- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химическая связь и строение молекул презентация
Содержание
- 1. Химическая связь и строение молекул
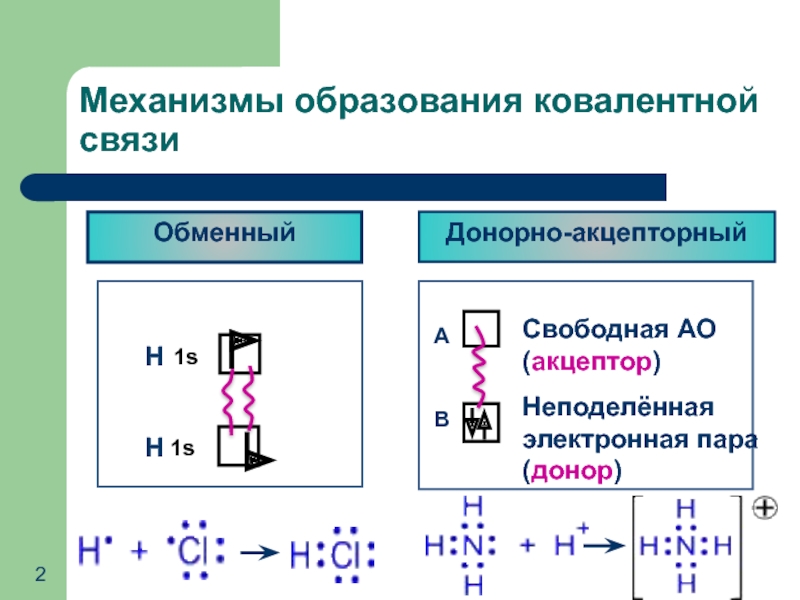
- 2. Механизмы образования ковалентной связи Обменный Донорно-акцепторный
- 3. Пример I: образование ковалентной связи в молекуле
- 4. Пример II: образование ковалентной связи в молекуле СО CO CΞO
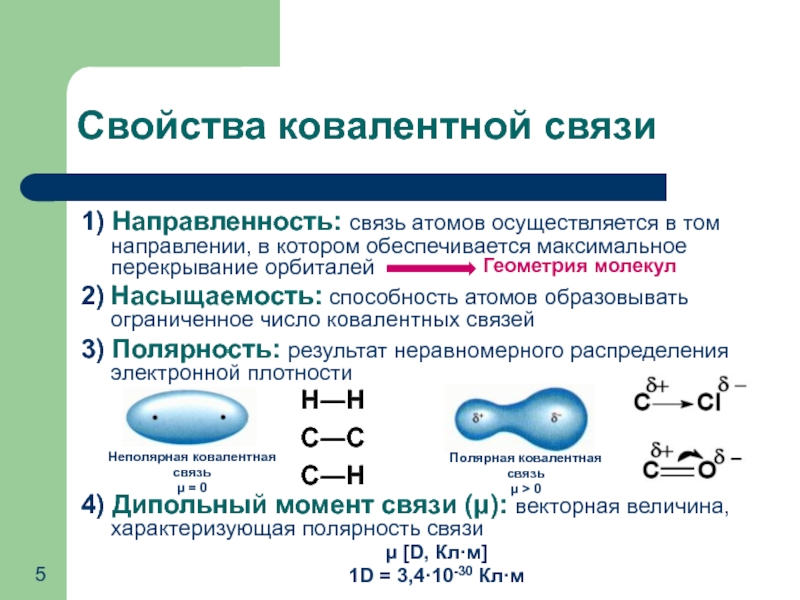
- 5. Свойства ковалентной связи 1) Направленность: связь атомов
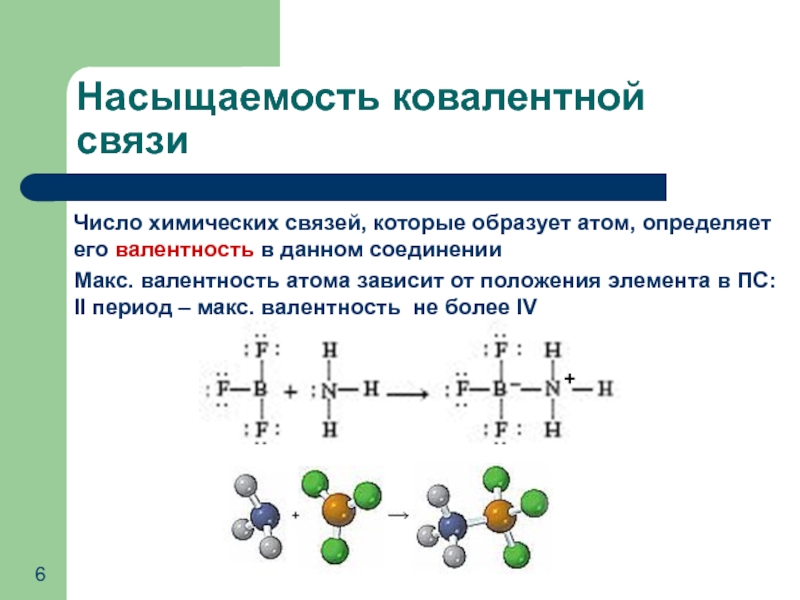
- 6. Число химических связей, которые образует атом, определяет
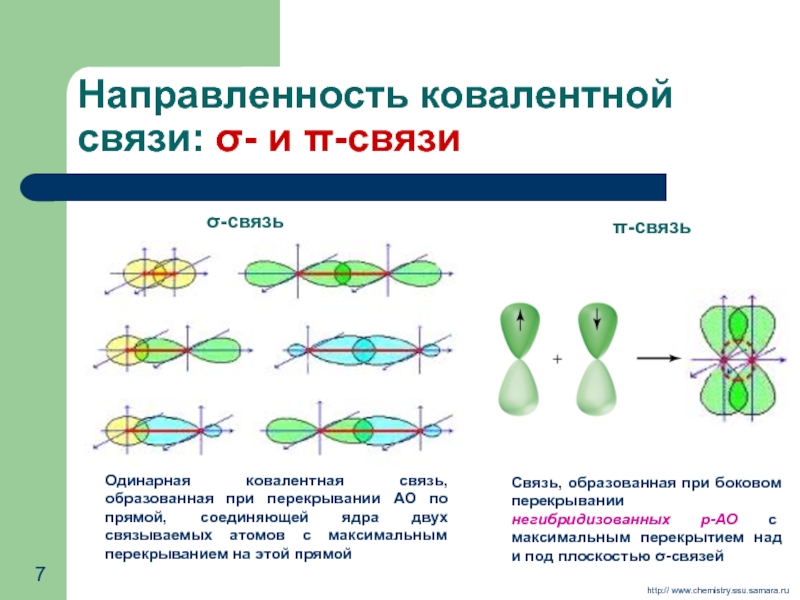
- 7. Направленность ковалентной связи: σ- и π-связи
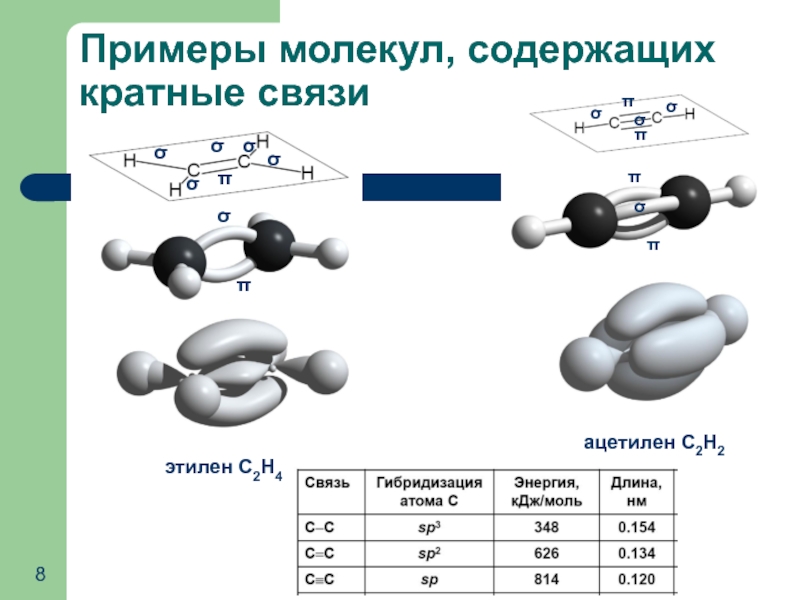
- 8. Примеры молекул, содержащих кратные связи
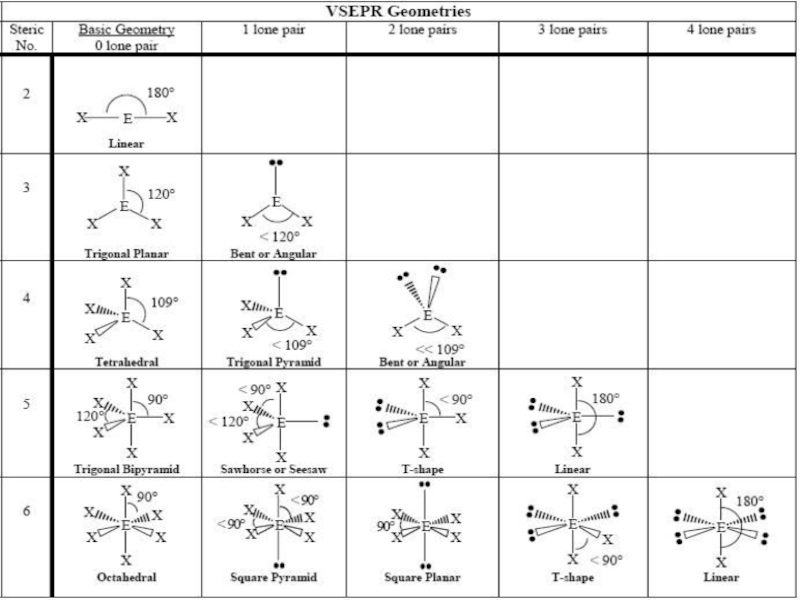
- 9. Геометрия молекул: Теория отталкивания электронных пар валентных
- 10. Некоторые правила для ОЭПВО Атомы связываются
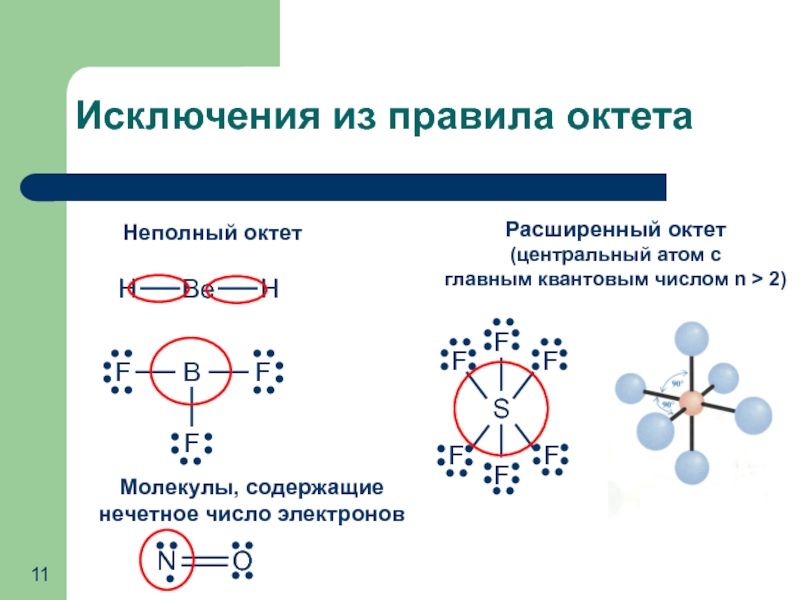
- 11. Исключения из правила октета Неполный октет Молекулы,
- 12. Примеры для молекул типа АВ2, АВ3, АВ6, АВ2Е: B
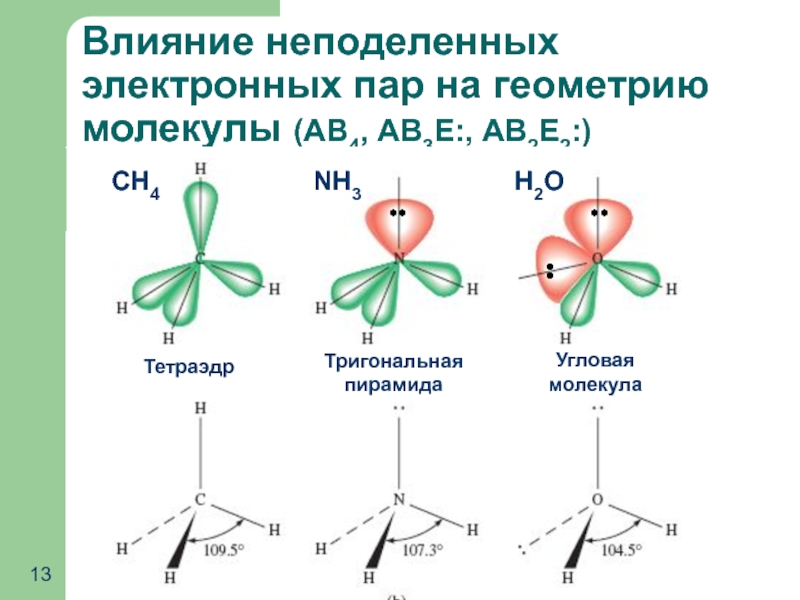
- 13. Влияние неподеленных электронных пар на геометрию молекулы (АВ4, АВ3Е:, АВ2Е2:) NH3 CH4 H2O
- 15. Теории химической связи Метод валентных связей
- 16. Основные положения теории гибридизации Гибридизуются орбитали атома,
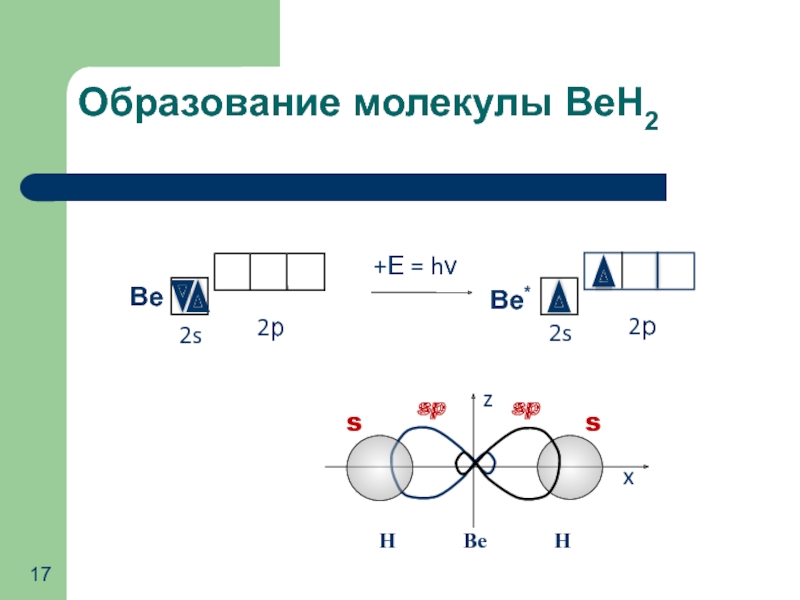
- 17. Образование молекулы ВеН2
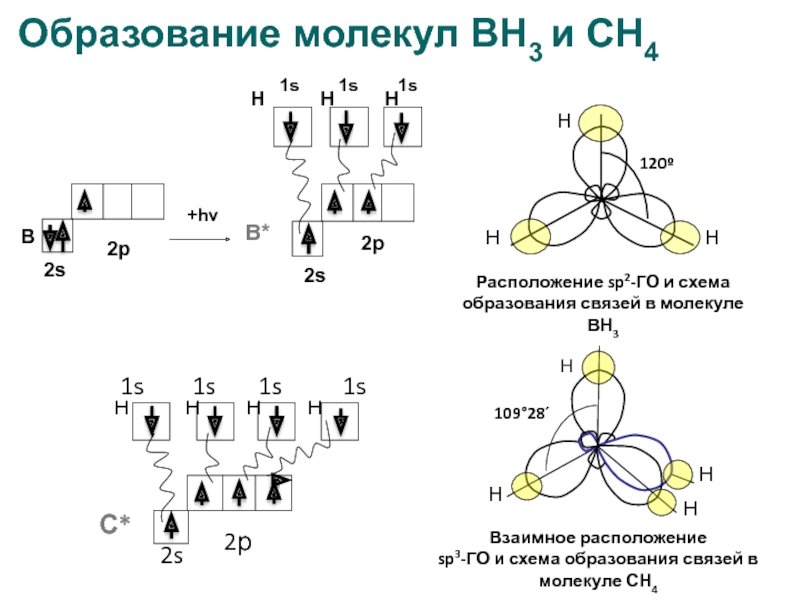
- 18. Образование молекул ВН3 и СН4
- 19. Дипольный момент связи Чем больше разница электроотрицательностей
- 20. Полярные и неполярные молекулы Все ли молекулы,
- 21. Полярность молекул с ковалентными связями: Влияние неподеленных
Слайд 3Пример I: образование ковалентной связи в молекуле N2
NΞN
Есвязи NΞN =
Есвязи N―N = 193 кДж/моль
Слайд 5Свойства ковалентной связи
1) Направленность: связь атомов осуществляется в том направлении, в
2) Насыщаемость: способность атомов образовывать ограниченное число ковалентных связей
3) Полярность: результат неравномерного распределения электронной плотности
4) Дипольный момент связи (μ): векторная величина, характеризующая полярность связи
μ [D, Кл·м]
1D = 3,4·10-30 Кл·м
С―С
С―Н
Н―Н
Геометрия молекул
Слайд 6Число химических связей, которые образует атом, определяет его валентность в данном
Макс. валентность атома зависит от положения элемента в ПС: II период – макс. валентность не более IV
Насыщаемость ковалентной связи
Слайд 7Направленность ковалентной связи: σ- и π-связи
Связь, образованная при боковом перекрывании
π-связь
http:// www.chemistry.ssu.samara.ru
Слайд 9Геометрия молекул: Теория отталкивания электронных пар валентных орбиталей (ОЭПВО)
Молекула принимает форму,
Конфигурация связей многовалентного атома обуславливается исключительно числом связывающих и несвязывающих пар в валентной оболочке центрального атома.
Ориентация облаков электронных пар валентных орбиталей определяется максимальным взаимным отталкиванием заполняющих их электронов.
Слайд 10Некоторые правила для ОЭПВО
Атомы связываются так, чтобы сформировать октет
Связывающие
Силы отталкивания уменьшаются в ряду:
С двойными и тройными связями обращаются также, как с одинарными
Слайд 11Исключения из правила октета
Неполный октет
Молекулы, содержащие нечетное число электронов
Расширенный октет
(центральный атом
главным квантовым числом n > 2)
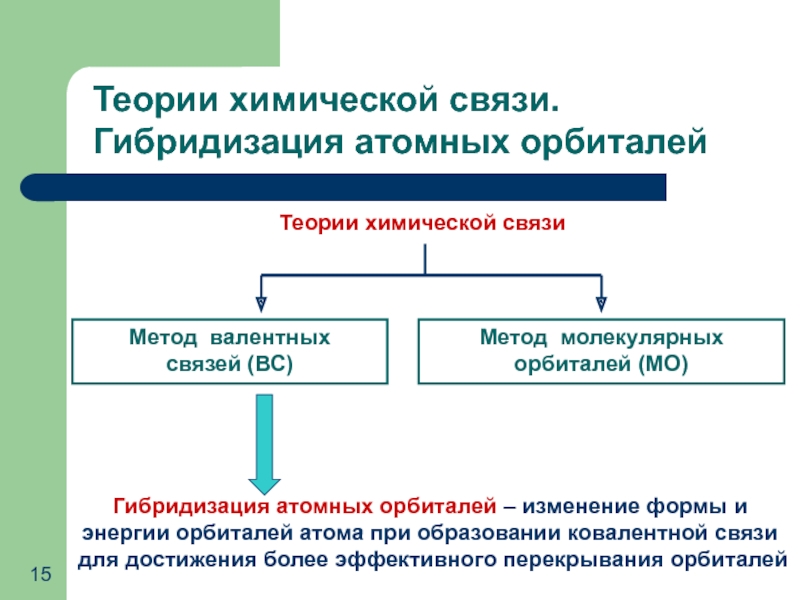
Слайд 15Теории химической связи
Метод валентных
связей (ВС)
Метод молекулярных
орбиталей (МО)
Теории химической связи.
Гибридизация атомных орбиталей – изменение формы и энергии орбиталей атома при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей
Слайд 16Основные положения теории гибридизации
Гибридизуются орбитали атома, реализующего связи с другими атомами
Гибридизуются
Число гибридных орбиталей равно суммарному числу исходных орбиталей
Гибридизация сопровождается изменением формы электронных облаков, поэтому хим. связи с участием гибр. орбиталей обладают большей прочностью, чем связи с “чистыми” АО
Гибридизация атомных орбиталей возможна лишь для атомов, образующих химические связи, но не для свободных атомов!
Слайд 19Дипольный момент связи
Чем больше разница электроотрицательностей элементов, тем полярнее связь
μ
диполь
1D = 3,4·10-30 Кл·м
Слайд 20Полярные и неполярные молекулы
Все ли молекулы, содержащие полярные связи полярны?
Линейная молекула
μ
Угловая молекула
μ = 1,79 D
Плоский треугольник
μ = 0 D
Тригональная пирамида
μ = 1,46 D
Молекулы с полярными связями
могут быть неполярными
Все зависит от геометрии молекулы
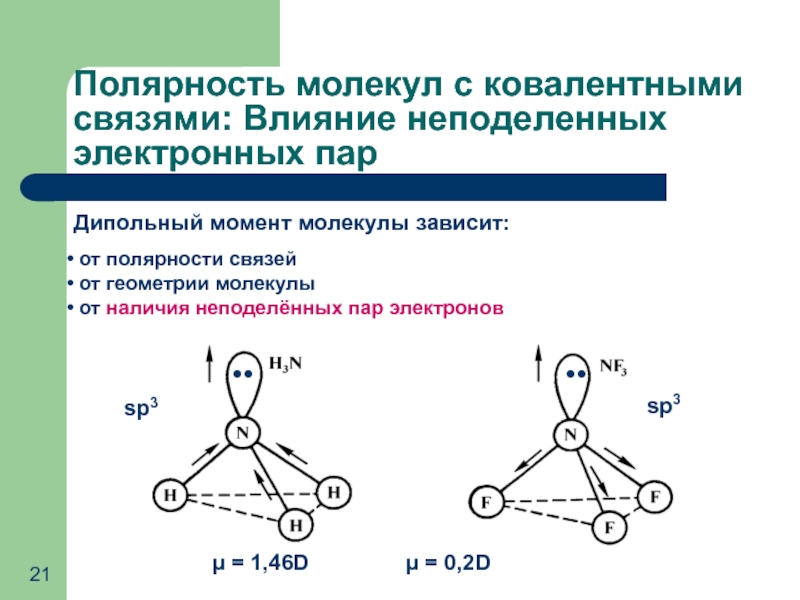
Слайд 21Полярность молекул с ковалентными связями: Влияние неподеленных электронных пар
Дипольный момент молекулы
от полярности связей
от геометрии молекулы
от наличия неподелённых пар электронов
●●
●●
sp3
sp3