- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химическая связь презентация
Содержание
- 1. Химическая связь
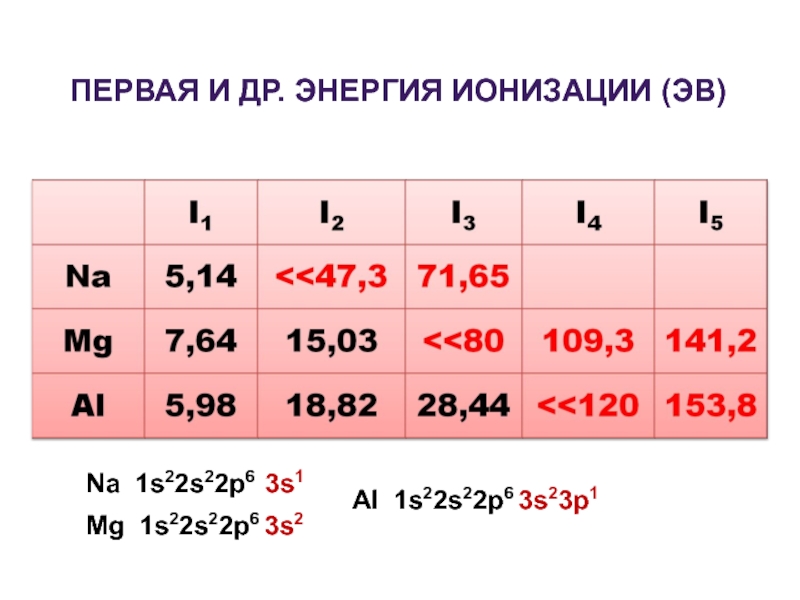
- 2. ПЕРВАЯ И ДР. ЭНЕРГИЯ ИОНИЗАЦИИ (ЭВ) Na 1s22s22p6 3s1 Mg 1s22s22p6 3s2 Al 1s22s22p6 3s23p1
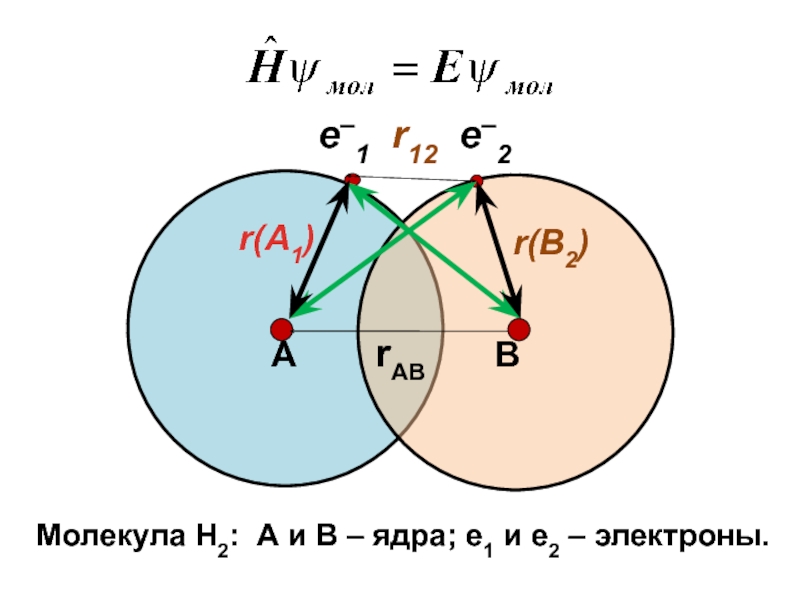
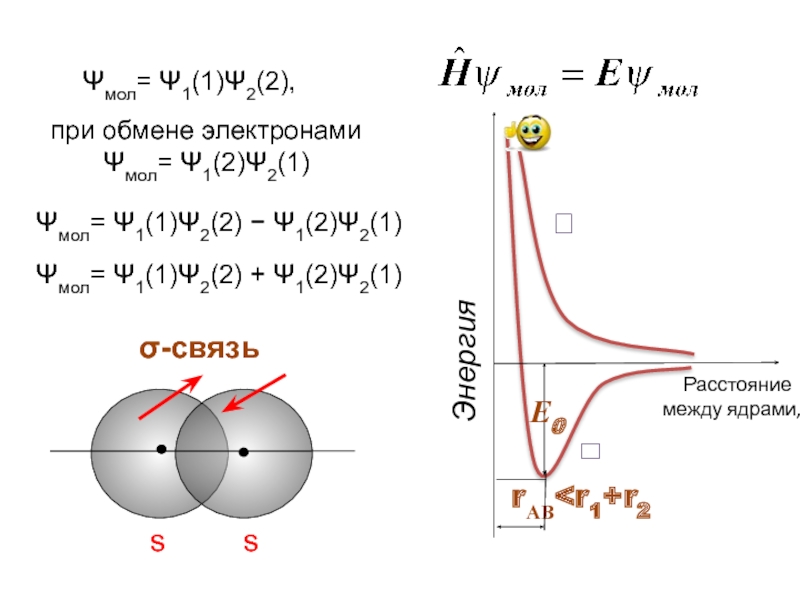
- 4. ⮀ ⮅ Ψмол= Ψ1(1)Ψ2(2),
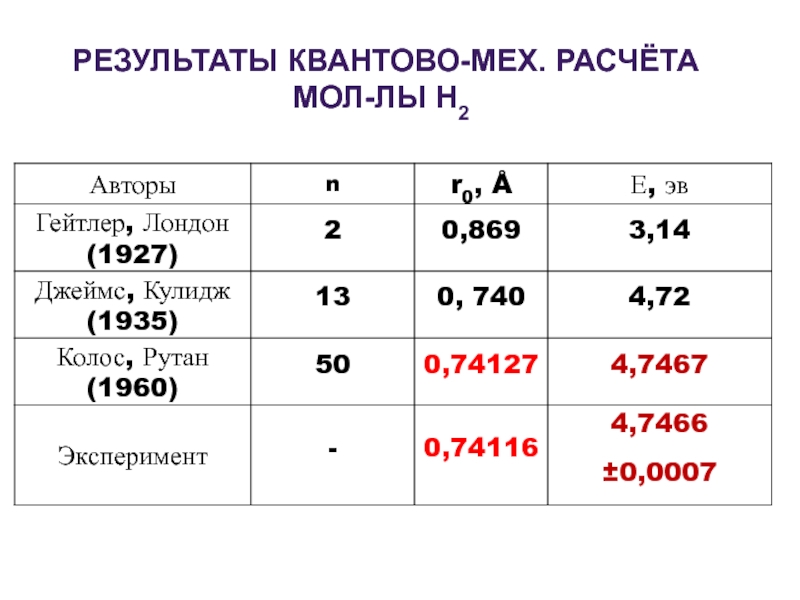
- 5. РЕЗУЛЬТАТЫ КВАНТОВО-МЕХ. РАСЧЁТА МОЛ-ЛЫ Н2
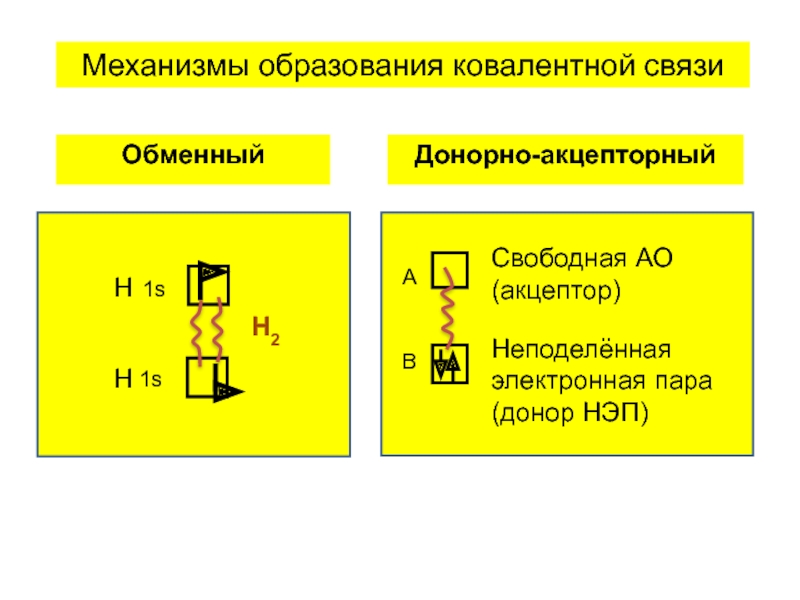
- 6. Свойства ковалентной связи а) насыщаемость б) направленность
- 7. Н Н Н2
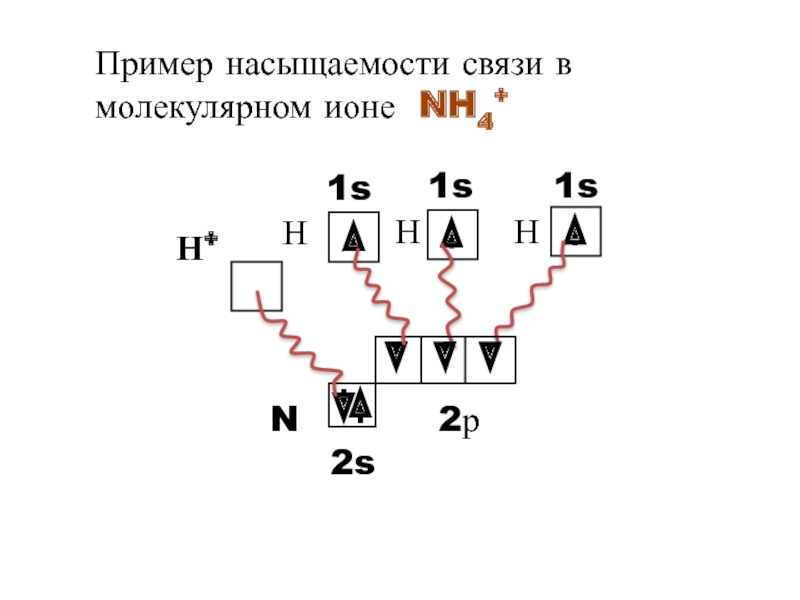
- 8. Пример насыщаемости связи в молекулярном ионе NH4+
- 9. s
- 10. А) Б)
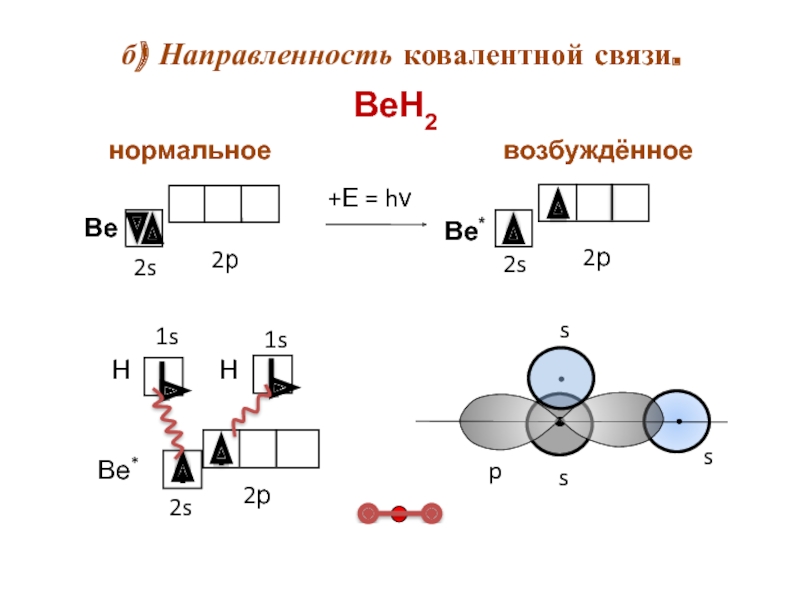
- 11. б) Направленность ковалентной связи. s ВеН2 возбуждённое нормальное
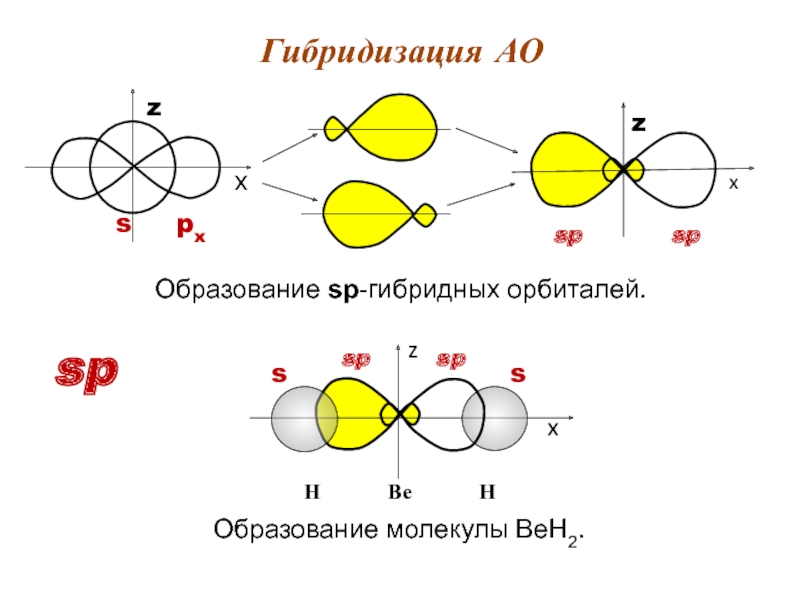
- 12. Образование sp-гибридных орбиталей. Гибридизация АО sp
- 13. Условия гибридизации АО. АО должны быть обязательно
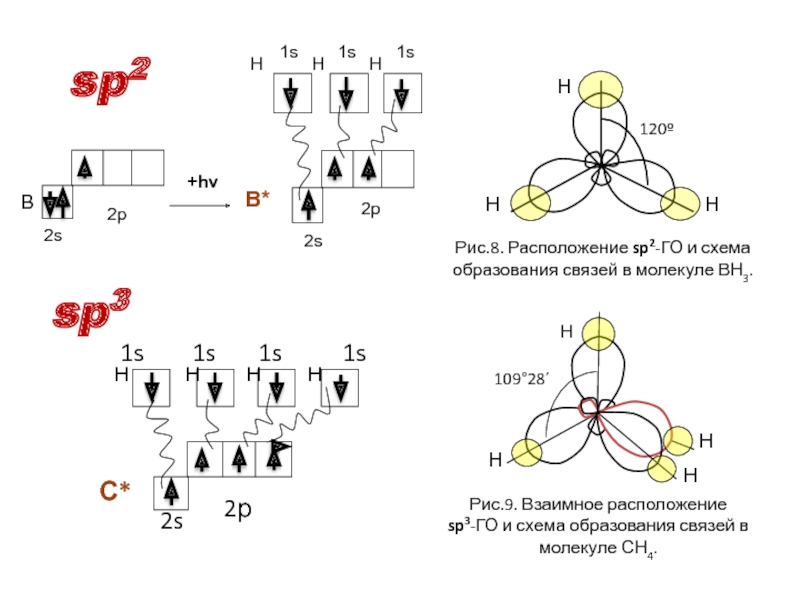
- 14. sp2 sp3
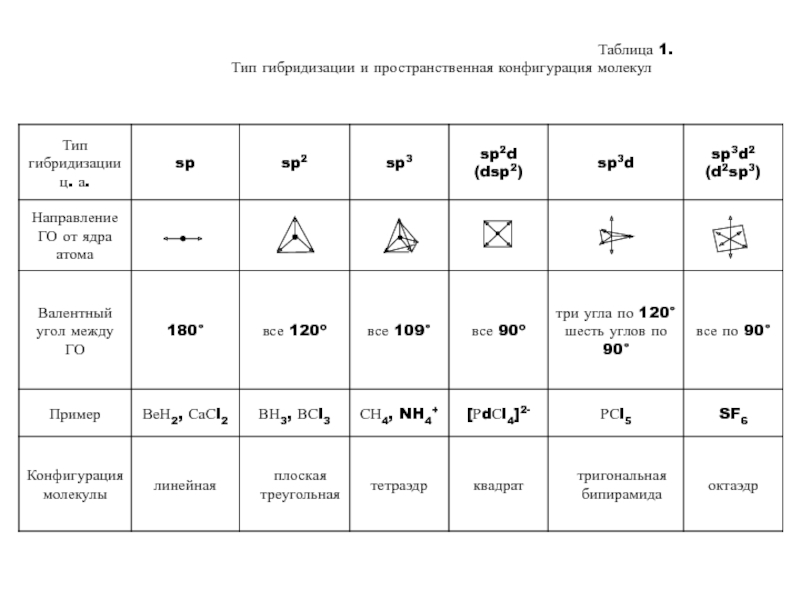
- 15. Таблица 1. Тип гибридизации и пространственная конфигурация молекул
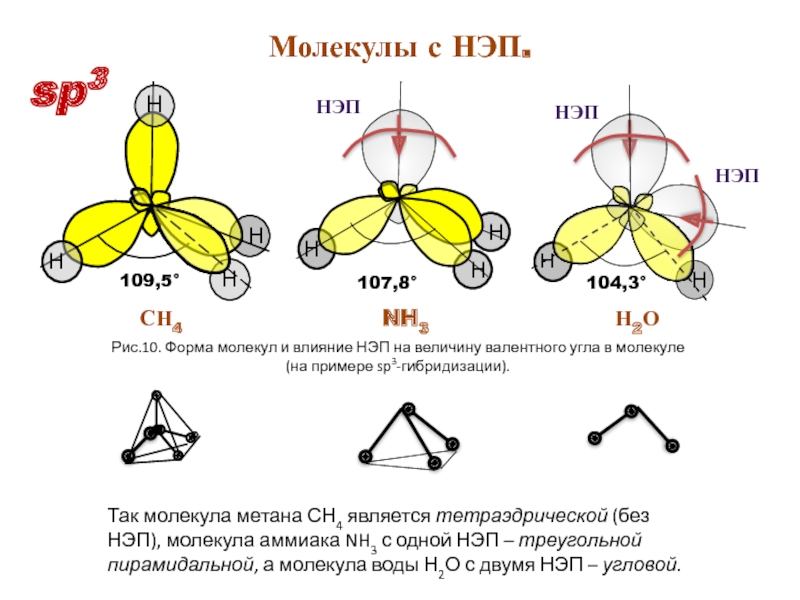
- 16. 109,5° Рис.10. Форма молекул и влияние
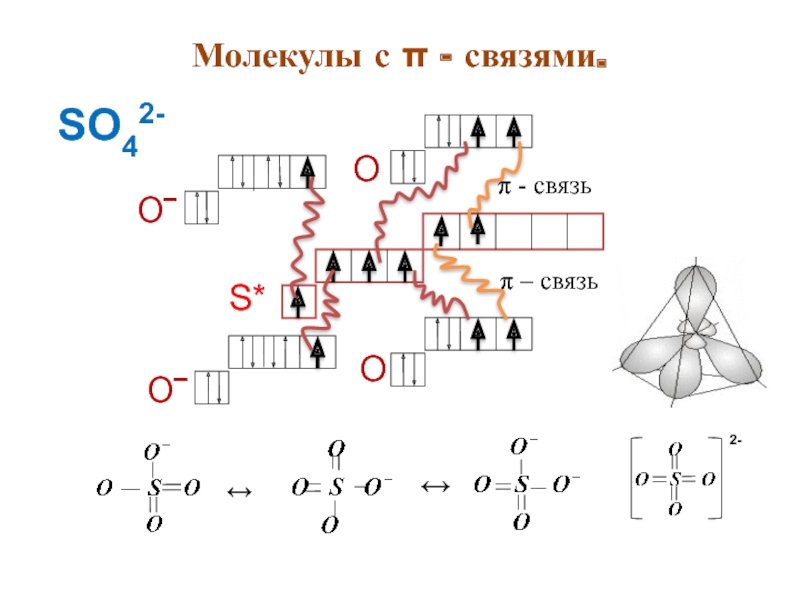
- 17. Молекулы с π - связями.
- 18. в) Поляризуемость ковалентной связи Ковалентная связь
- 19. Ионная связь. Свойства – неспецифичность
- 20. к.ч. = 6 к.ч. = 8
- 21. МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ (ММО) 1927-29 гг. Ф.
- 22. Имеются различные варианты ММО. Наиболее широкое использование
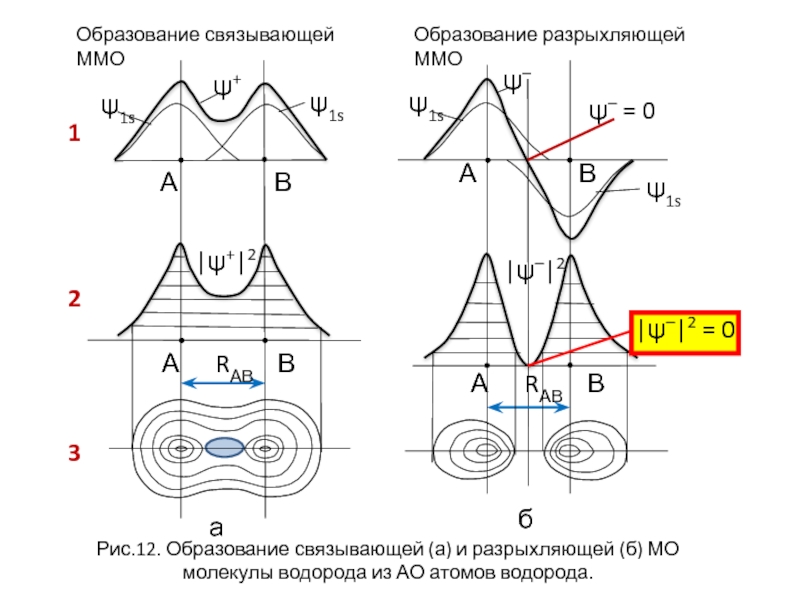
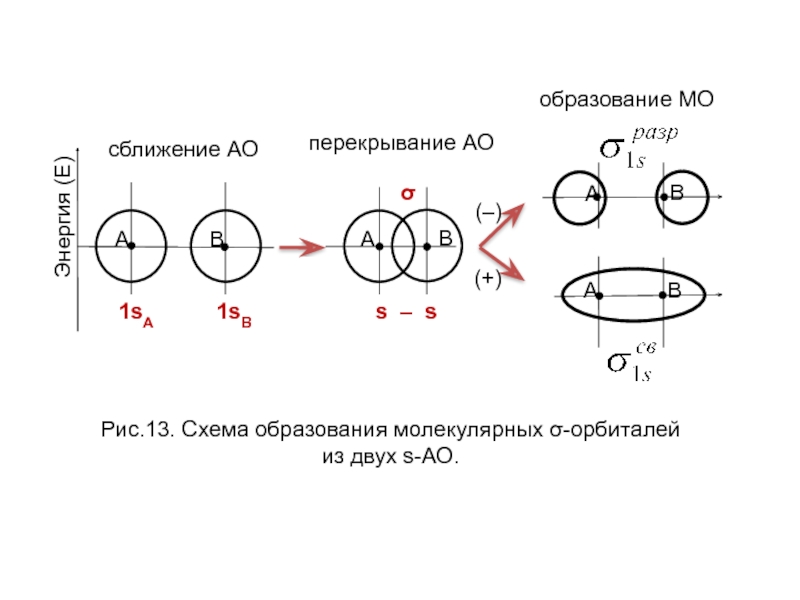
- 23. Образование связывающей ММО Образование разрыхляющей ММО
- 25. АО
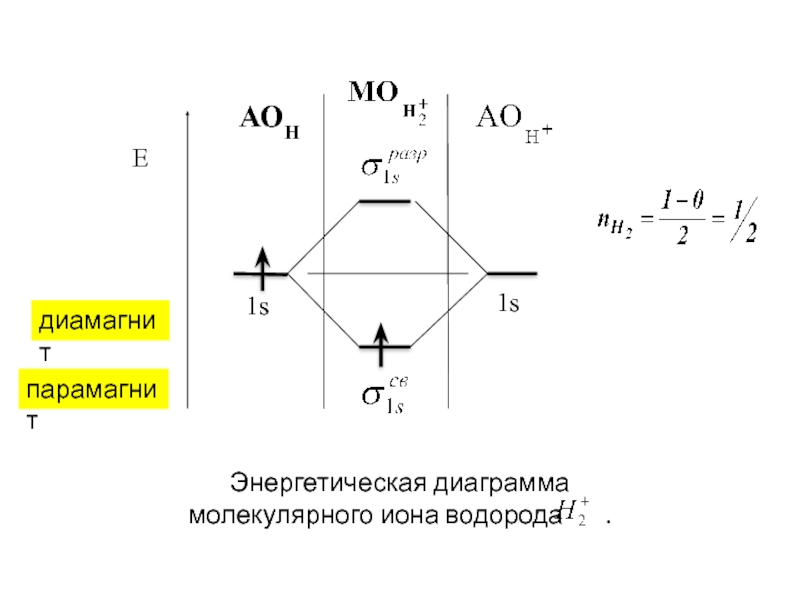
- 26. АОН диамагнит парамагнит
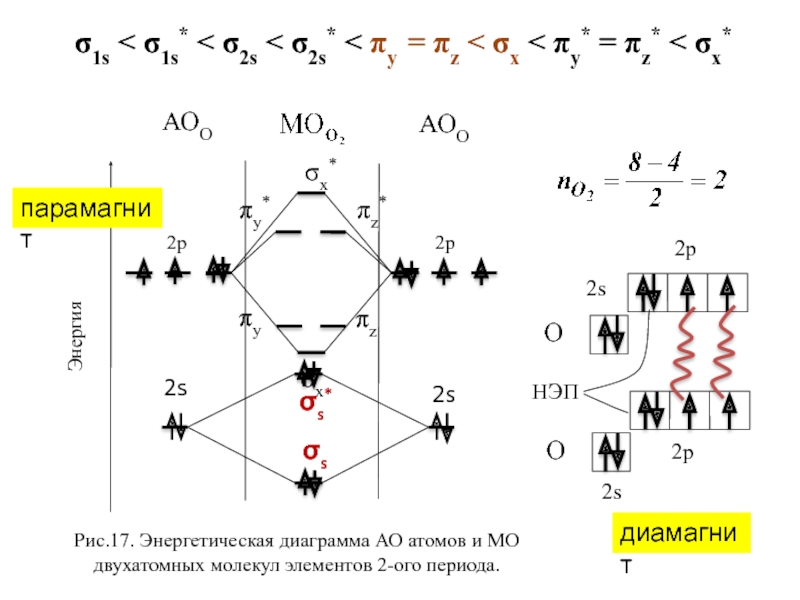
- 27. σx* σx πy πz πy*
- 28. σs σs* σx* σx πy πz
- 29. Метод МО при описании металлической связи. N
- 31. (а) ориентационное + ─
- 32. Водородная связь
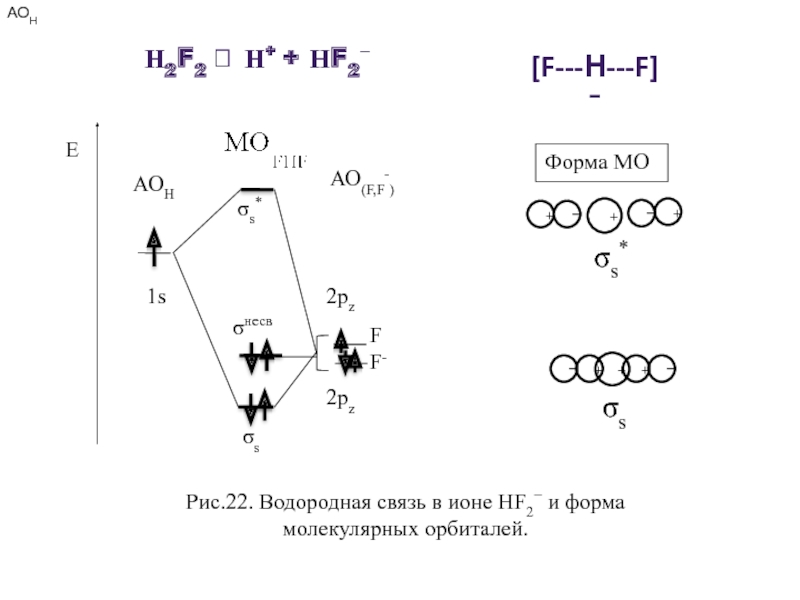
- 33. Рис.22. Водородная связь в ионе НF2−
- 34. 4KCN + Fe(CN)2 = 4KCN*Fe(CN)2 =
Слайд 4
⮀
⮅
Ψмол= Ψ1(1)Ψ2(2),
при обмене электронами
Ψмол= Ψ1(2)Ψ2(1)
Ψмол= Ψ1(1)Ψ2(2) − Ψ1(2)Ψ2(1)
Ψмол= Ψ1(1)Ψ2(2)
Слайд 6Свойства ковалентной связи
а) насыщаемость
б) направленность
в) поляризуемость
Типы ковалентной связи
сигма σ
пи
дельта δ
Слайд 7
Н
Н
Н2
1s
1s
Обменный
А
В
Свободная АО (акцептор)
Неподелённая электронная пара (донор НЭП)
Донорно-акцепторный
Механизмы образования ковалентной связи
Слайд 9
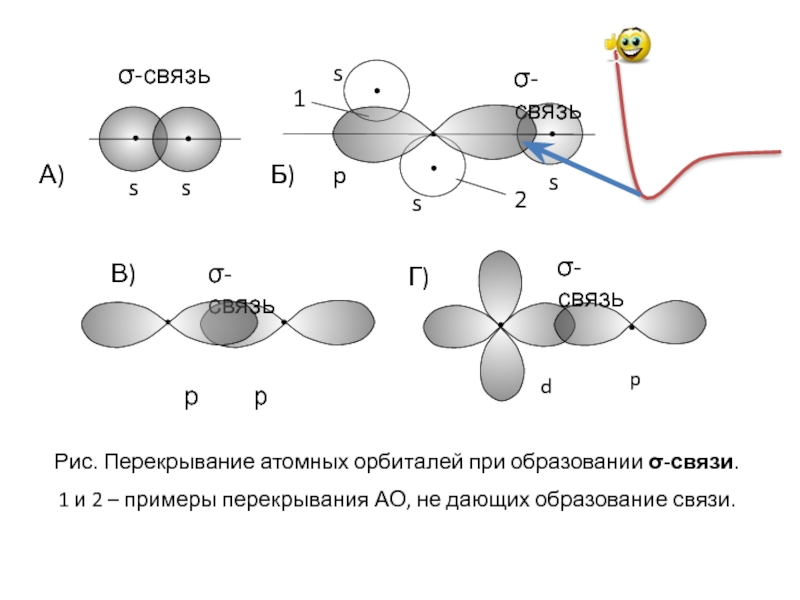
s s
σ-связь
s
s
s
p
σ-связь
1
2
А)
Б)
Рис. Перекрывание атомных орбиталей при образовании σ-связи.
1
р р
σ-связь
Г)
d
p
σ-связь
В)
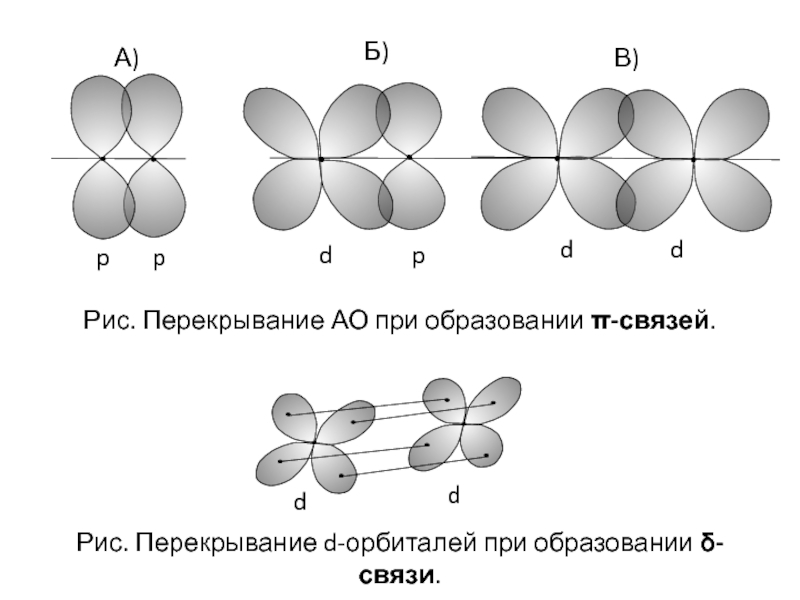
Слайд 10А)
Б)
d p
p
d d
В)
Рис. Перекрывание АО при образовании π-связей.
d
d
Рис. Перекрывание d-орбиталей при образовании δ-связи.
Слайд 13Условия гибридизации АО.
АО должны быть обязательно разного типа (s, p, и/или
n-АО = n-ГО (гибридных орбиталей).
Обозначение ГО: sp; sp2; sp3; sp2d; sp3d2 «эс-пэ-три-дэ-два».
ГО, имея одинаковую форму и энергию, располагаются в пространстве строго симметрично в стремлении к минимуму энергии с сохранением элементов симметрии исходного набора. Графическое изображение ГО:
В гибридизации принимают участие как электроны, образующие σ-связи, так и НЭП. ГО могут образовывать только сигма -связи.
π-связи в гибридизации не участвуют.
Слайд 16
109,5°
Рис.10. Форма молекул и влияние НЭП на величину валентного угла в
СН4 NH3 Н2О
Н
Н
104,3°
НЭП
НЭП
Молекулы с НЭП.
Так молекула метана СН4 является тетраэдрической (без НЭП), молекула аммиака NH3 с одной НЭП – треугольной пирамидальной, а молекула воды Н2О с двумя НЭП – угловой.
sp3
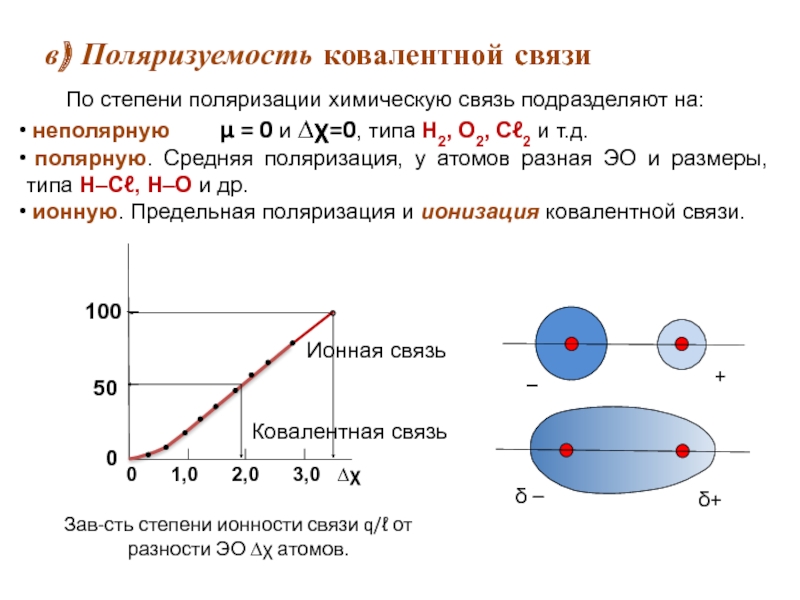
Слайд 18в) Поляризуемость ковалентной связи
Ковалентная связь
По степени поляризации химическую связь подразделяют
неполярную μ = 0 и ∆χ=0, типа Н2, О2, Сℓ2 и т.д.
полярную. Средняя поляризация, у атомов разная ЭО и размеры, типа Н–Сℓ, Н–О и др.
ионную. Предельная поляризация и ионизация ковалентной связи.
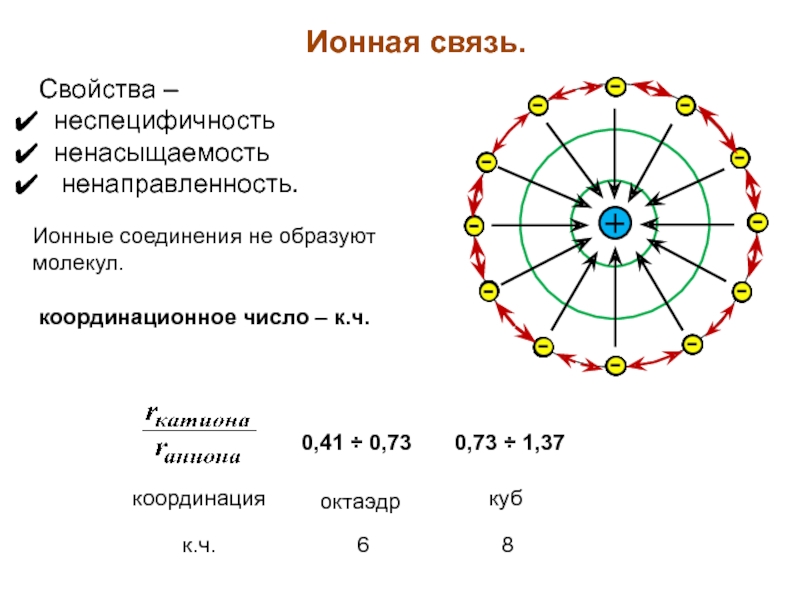
Слайд 19Ионная связь.
Свойства –
неспецифичность
ненасыщаемость
ненаправленность.
Ионные соединения
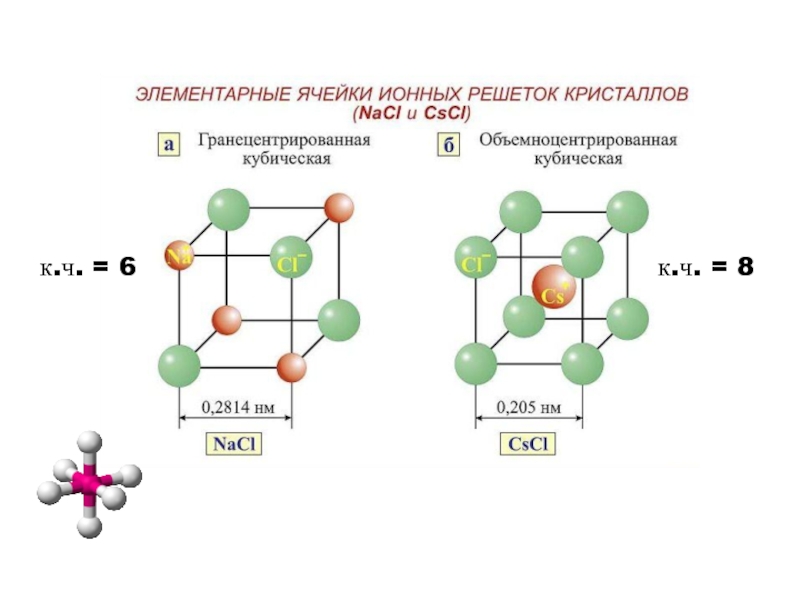
координационное число – к.ч.
Слайд 21МЕТОД МОЛЕКУЛЯРНЫХ ОРБИТАЛЕЙ (ММО)
1927-29 гг. Ф. Гунд, Р. Малликен, Р. Ленард-Джонс
Основные положения метода МО:
При образовании молекулы электроны переходят с АО на молекулярные орбитали МО, двигаясь в поле всех ядер.
Молекулярные орбитали являются многоцентровыми.
МО также как и АО характеризуются тремя квантовыми числами: главным n, побочным ℓ, магнитным mℓ; определяющими их энергию, число и ориентацию в пространстве.
Обозначают МО буквами греческого алфавита, сходными с латинскими буквами, принятыми для обозначения АО:
АО s p d f
МО σ π δ φ
Заполнение МО электронами подчиняется тем же принципам, что и АО: а) принцип минимума энергии;
б) принцип Паули;
в) правило Гунда.
Слайд 22Имеются различные варианты ММО. Наиболее широкое использование получил метод МО ЛКАО
Принцип линейной комбинации подразумевает конструирование МО путём сложения и вычитания волновых функций электронов исходных АО.
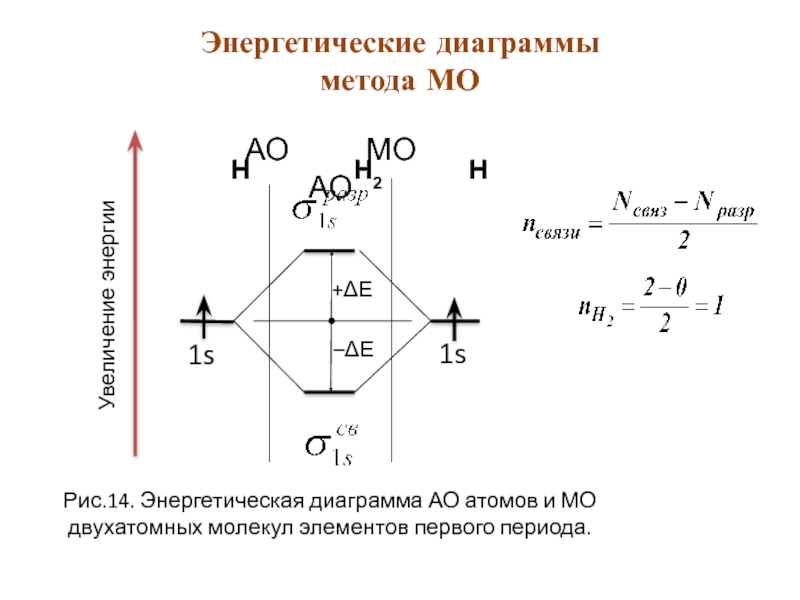
Линейная комбинация двух s-орбиталей (молекула Н2) даёт столько же молекулярных орбиталей МО в виде:
ψ+ = с1ψ1 + с2ψ2 и ψ– = с1ψ1 – с2ψ2,
ψ+ - связывающая МО – (волновая функция - при сложении исходных АО ).
ψ– - разрыхляющая МО – (волновая функция- при вычитании исходных АО).
Слайд 25
АО МО
1s
1s
Увеличение энергии
Рис.14. Энергетическая диаграмма АО атомов и МО двухатомных молекул элементов первого периода.
–ΔΕ
+ΔΕ
Н
Н
Н2
Энергетические диаграммы метода МО
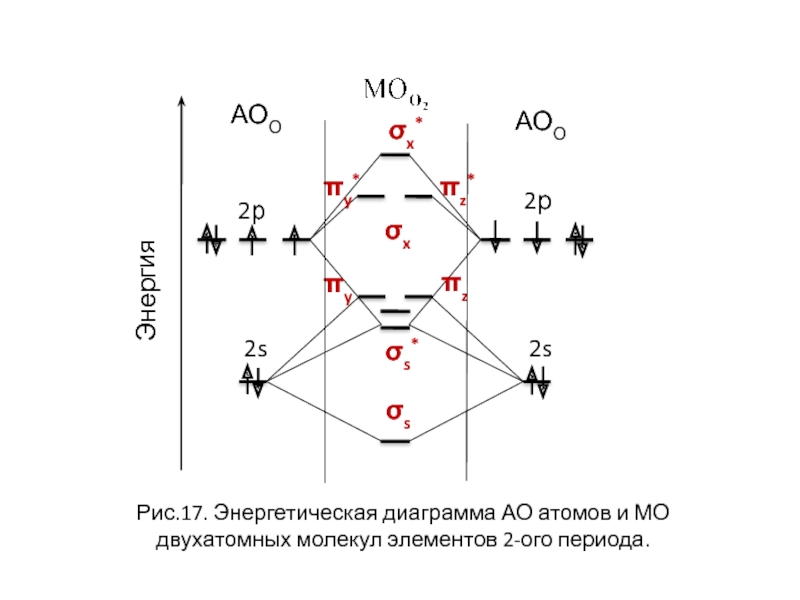
Слайд 27σx*
σx
πy
πz
πy* πz*
Рис.17. Энергетическая диаграмма АО
2р
Энергия
АОО
2р
АОО
σ1s < σ1s* < σ2s < σ2s* < πy = πz < σx < πy* = πz* < σx*
парамагнит
диамагнит
Слайд 28
σs
σs*
σx*
σx
πy
πz
πy* πz*
2р
2s
АОО
Рис.17. Энергетическая диаграмма АО
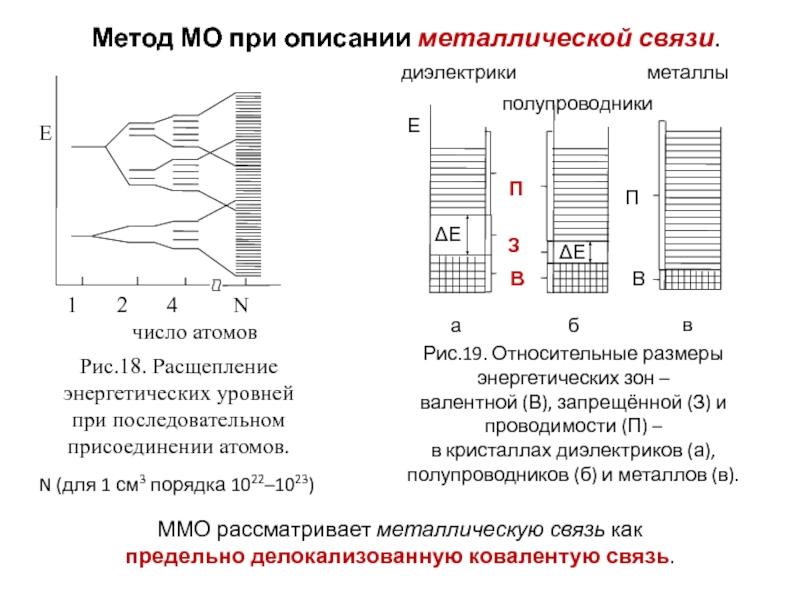
Слайд 29Метод МО при описании металлической связи.
N (для 1 см3 порядка 1022–1023)
ММО
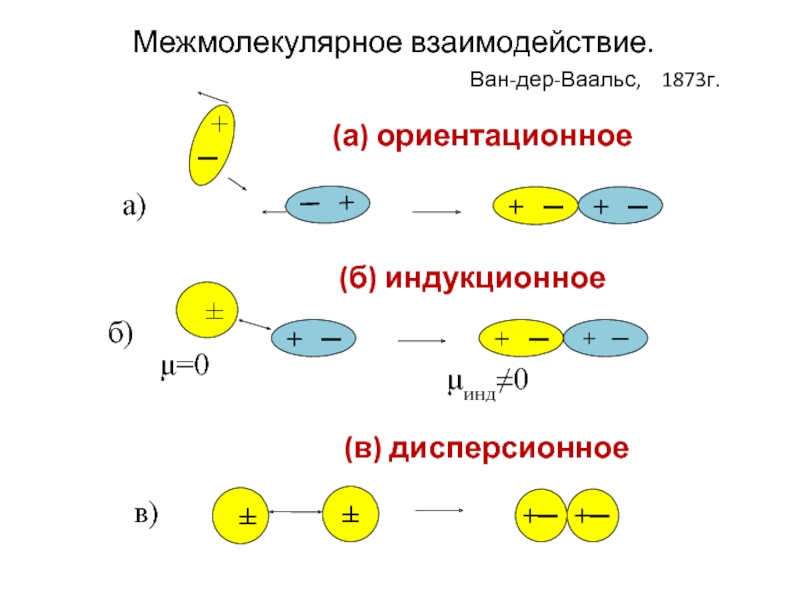
Слайд 31(а) ориентационное
+ ─
+ ─
+ ─
+ ─
+
+ ─
±
+
─
±
±
+─
+─
а)
б)
в)
μинд≠0
μ=0
(б) индукционное
(в) дисперсионное
Межмолекулярное взаимодействие.
Ван-дер-Ваальс, 1873г.
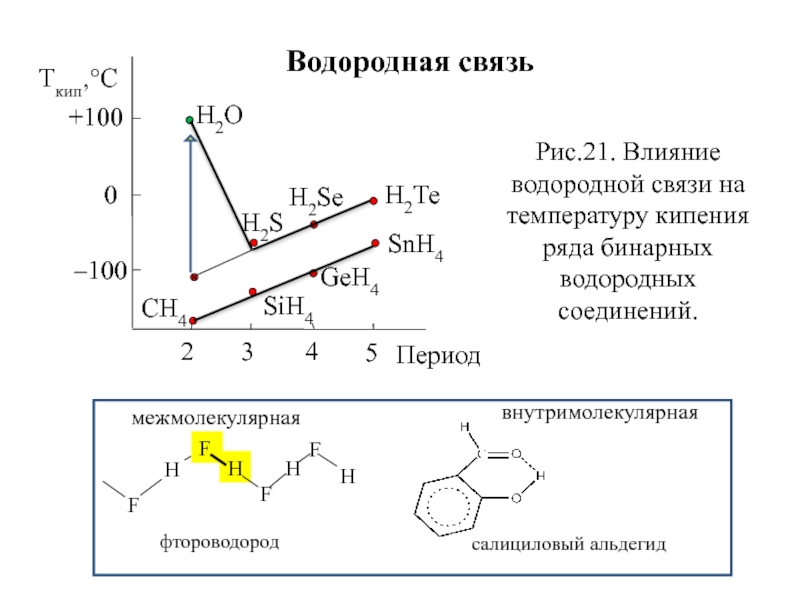
Слайд 32Водородная связь
Н2О
Н2Те
Н2Sе
Н2S
СН4
SiН4
GеН4
SnН4
Ткип,°C
+100
0
–100
2
3
4
5
Период
Рис.21. Влияние водородной связи на температуру кипения ряда бинарных водородных
F
Н
F
H
F
Н
F
Н
межмолекулярная
внутримолекулярная
фтороводород
салициловый альдегид
Слайд 33
Рис.22. Водородная связь в ионе НF2− и форма молекулярных орбиталей.
+
−
+
+
−
σs*
+
−
−
+
+
σs
Форма МО
АОН
Н2F2 ⮀ Н+ + НF2−
[F---Н---F]−
Слайд 344KCN + Fe(CN)2 = 4KCN*Fe(CN)2 = K4[Fe(CN)6]
“Дополнительные” химические связи в
Первые комплексные соединения были синтезированы в середине 19 века. Первая теория строения К.С. – координационная теория (А. Вернер, 1893 г).
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Все хим. в-ва подразделяют на простые и сложные.
Сложные в-ва: первого порядка NH3, H2O, KCN, Fe(CN)2
В-ва, у к-рых элементы проявляют “дополнительные” валентности, – комплексные.






![4KCN + Fe(CN)2 = 4KCN*Fe(CN)2 = K4[Fe(CN)6]“Дополнительные” химические связи в К.С. имеют ковалентный характер и](/img/tmb/4/310034/95eacbe12d32026fe603f62a63ec3051-800x.jpg)