- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химическая связь презентация
Содержание
- 1. Химическая связь
- 2. Химическая связь Ковалентная Ионная Металлическая Водородная
- 3. Ковалентная связь связь атомов посредством общих
- 4. Электроотрицательность – свойство атомов оттягивать к
- 5. Ковалентная связь Неполярная - в простых веществах,
- 6. Способы образования ковалентной связи 1. Обменный механизм:
- 7. Способы образования ковалентной связи 2. Донорно-акцепторный механизм
- 8. Способы образования ковалентной связи
- 9. Классификация ковалентных связей В зависимости от направления
- 10. σ-связь за счет перекрывания s-орбиталей атомов за
- 12. π – связь за счет перекрывания
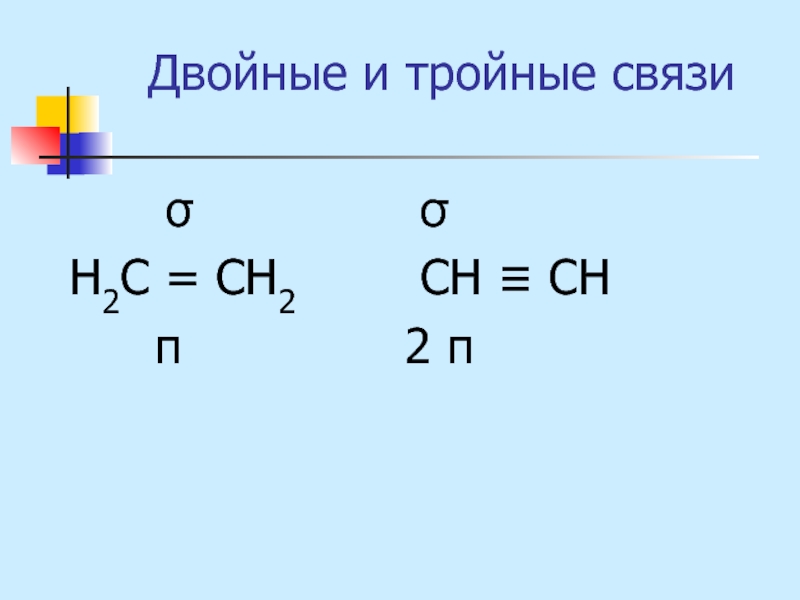
- 14. Двойные и тройные связи
- 15. Гибридизация атомных орбиталей смешивание s- и р-орбиталей атома
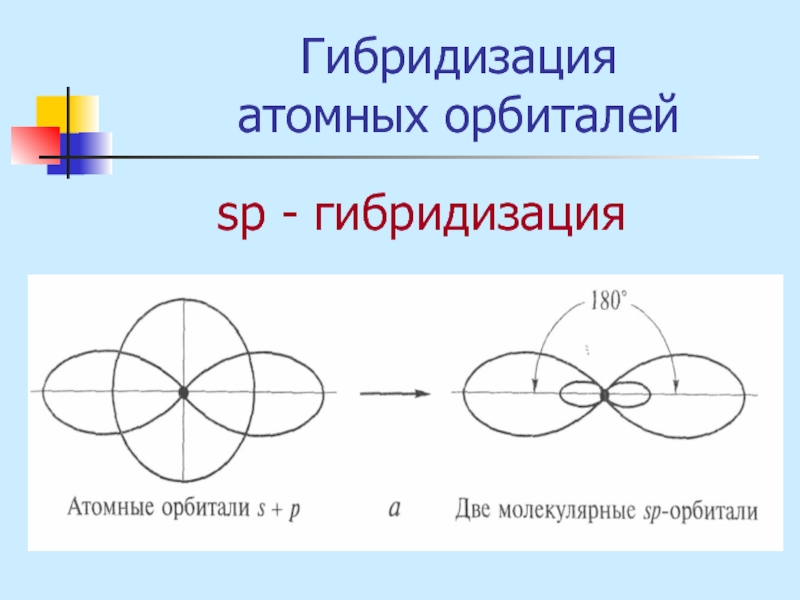
- 16. Гибридизация атомных орбиталей sр - гибридизация
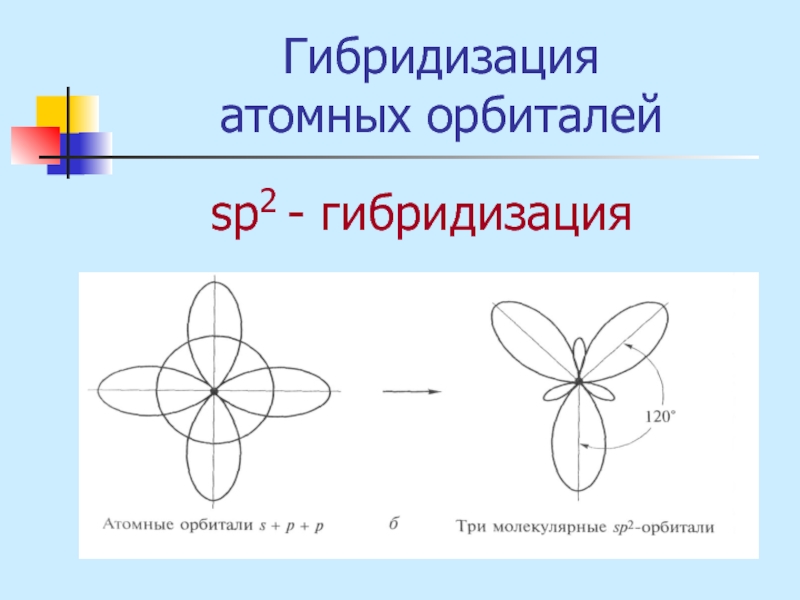
- 17. Гибридизация атомных орбиталей sр2 - гибридизация
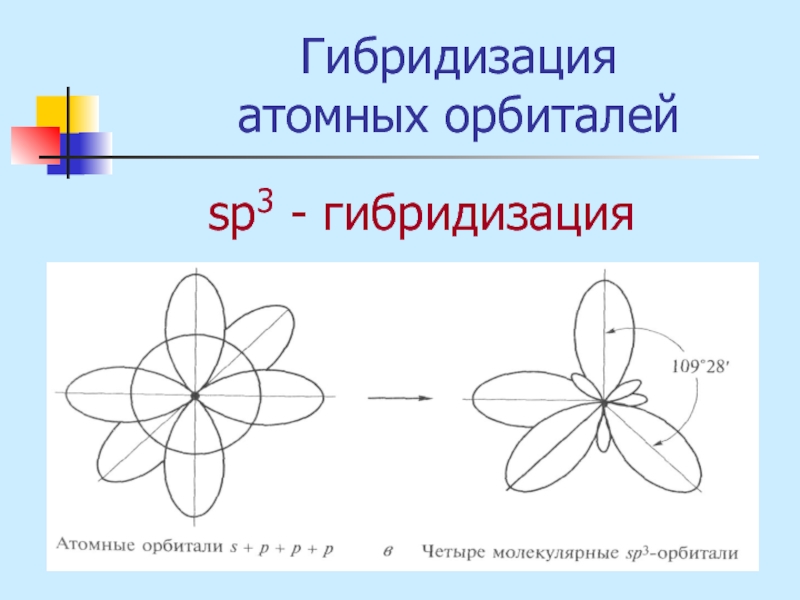
- 18. Гибридизация атомных орбиталей sр3 - гибридизация
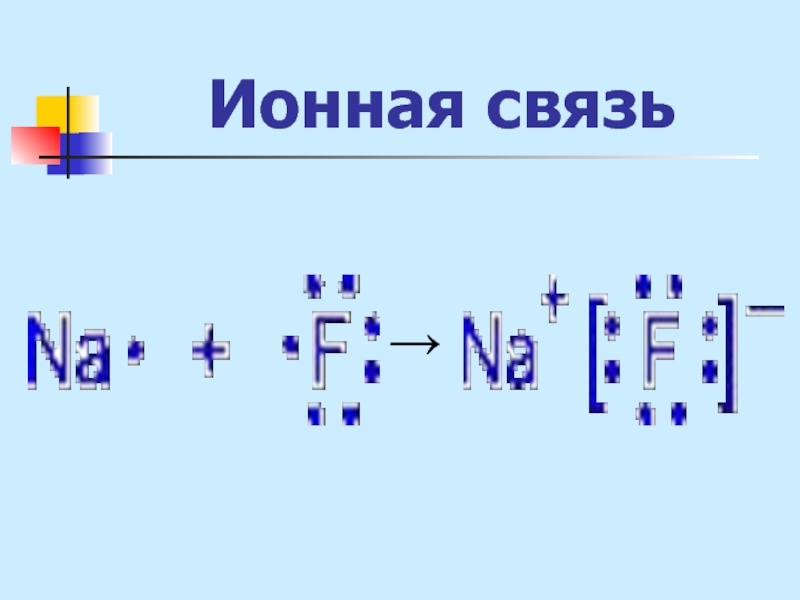
- 19. Ионная связь - связь между атомами за
- 20. Ионная связь Если разница электроотрицательностей атомов по
- 21. Ионная связь
- 22. Металлическая связь - связь, основанная
- 23. Схема образования простых веществ металлов атом
- 24. Схема образования простых веществ металлов - +
- 25. Схема образования простых веществ металлов - +
- 26. Схема образования простых веществ металлов - +
- 27. Схема образования простых веществ металлов Металлическая
- 28. неМе + неМе (простое вещество неметалл)
- 29. Водородная связь - связь между
- 30. ВЫ МОЛОДЦЫ!!! БЛАГОДАРЮ ЗА РАБОТУ
Слайд 1Химическая связь
– совокупность сил,
действующих между атомами
или группой атомов.
Причина ее
образования- электрические взаимодействия между е и ядрами.
Слайд 3Ковалентная связь
связь атомов посредством
общих электронных пар.
электронная формула водорода:
Н. + .Н
→ Н : Н
графическая формула хлороводорода:
Н – Cl
структурная формула воды:
О – Н
Н
графическая формула хлороводорода:
Н – Cl
структурная формула воды:
О – Н
Н
Слайд 4Электроотрицательность
– свойство атомов оттягивать к себе общие электронные пары, связывающие
их с другими атомами.
Ряд электроотрицательности:
Si As H P C Se I S Br Cl N O F
→
Ряд электроотрицательности:
Si As H P C Se I S Br Cl N O F
→
Слайд 5Ковалентная связь
Неполярная - в простых веществах, состоящих из одинаковых атомов (Н
: Н), е пара в равной степени принадлежит обоим атомам.
Полярная - е пара связывает два разных атома (Н :Cl), оттянута к атому с большей электроотрицательностью (молекула – диполь)
Полярная - е пара связывает два разных атома (Н :Cl), оттянута к атому с большей электроотрицательностью (молекула – диполь)
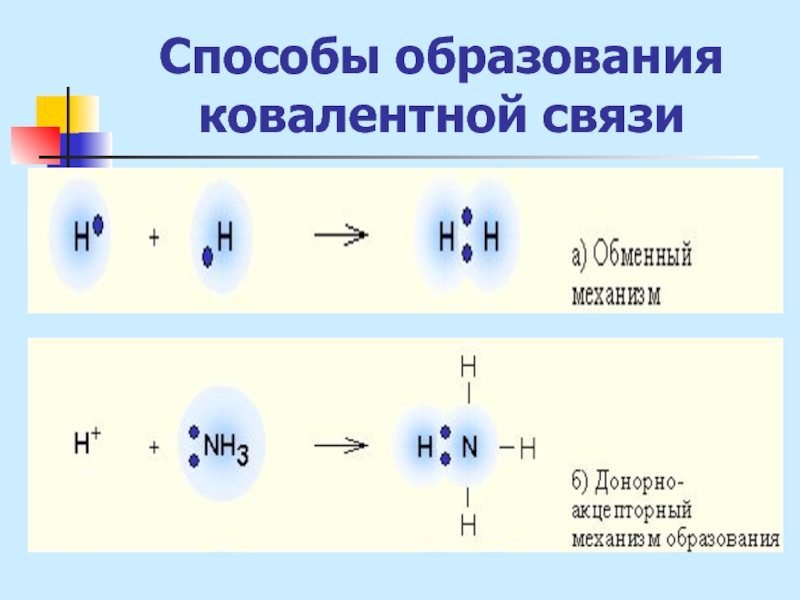
Слайд 6Способы образования ковалентной связи
1. Обменный механизм:
за счет неспаренных е невозбужденного атома
(Н2О, NН3)
за счет неспаренных е, получающихся в результате возбуждения атома (ВеХ2, ВХ3, СХ4).
за счет неспаренных е, получающихся в результате возбуждения атома (ВеХ2, ВХ3, СХ4).
Слайд 7Способы образования ковалентной связи
2. Донорно-акцепторный механизм
- при взаимодействии одного атома
с заполненной атомной орбиталью (донор) с другим атомом, имеющим свободную орбиталь (акцептор)
Слайд 9Классификация ковалентных связей
В зависимости от направления перекрывания атомных орбиталей различают σ-
и π-связи.
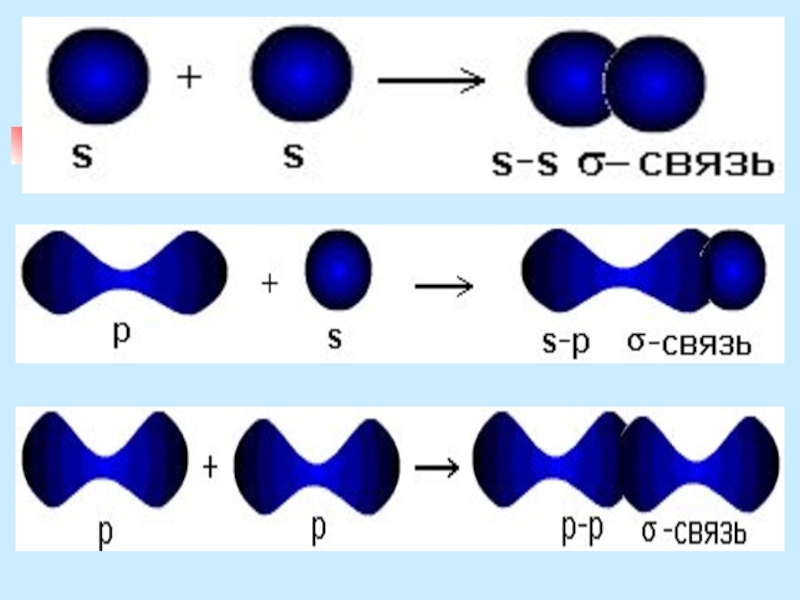
σ -связь - при перекрывании атомных орбиталей вдоль оси, соединяющей ядра атомов.
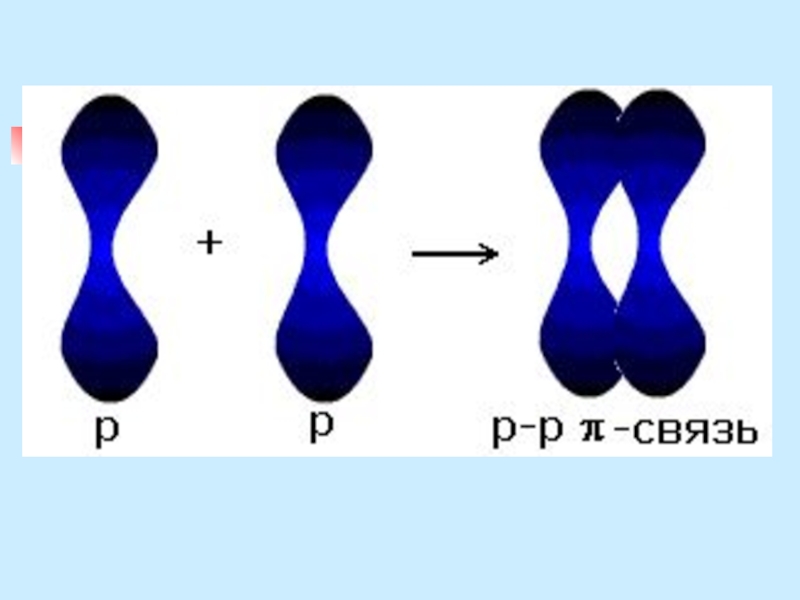
π -связь - при перекрывании атомных орбиталей по обе стороны оси, соединяющей ядра атомов.
σ -связь - при перекрывании атомных орбиталей вдоль оси, соединяющей ядра атомов.
π -связь - при перекрывании атомных орбиталей по обе стороны оси, соединяющей ядра атомов.
Слайд 10σ-связь
за счет перекрывания s-орбиталей атомов
за счет перекрывания s- и р-орбиталей
за счет
перекрывания р- и d-орбиталей
двух р-орбиталей, расположенных в параллельных плоскостях
двух d-орбиталей, расположенных в параллельных плоскостях
двух р-орбиталей, расположенных в параллельных плоскостях
двух d-орбиталей, расположенных в параллельных плоскостях
Слайд 12π – связь
за счет перекрывания двух р-орбиталей, расположенных перпендикулярно оси,
соединяющей ядра атомов
при перекрывании р- и d-орбиталей
при перекрывании d- и d-орбиталей
Образуются две области перекрывания
при перекрывании р- и d-орбиталей
при перекрывании d- и d-орбиталей
Образуются две области перекрывания
Слайд 19Ионная связь
- связь между атомами за счет электростатического притяжения ионов, образующихся
вследствие полного перехода е к одному из атомов.
Возникает при больших различиях в значениях электроотрицательностей атомов.
Галогениды щелочных металлов
(СsF, NаСl).
Возникает при больших различиях в значениях электроотрицательностей атомов.
Галогениды щелочных металлов
(СsF, NаСl).
Слайд 20Ионная связь
Если разница электроотрицательностей атомов по шкале Полинга превышает 2,0 ,
то между ними ионная связь.
Слайд 22Металлическая связь
- связь, основанная на обобществлении внешних е, принадлежащих
не двум, а практически всем атомам в кристалле.
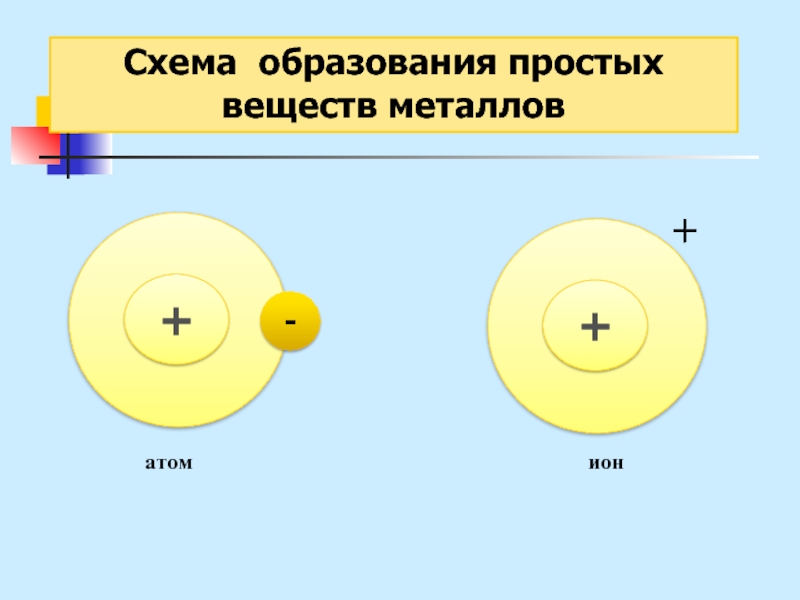
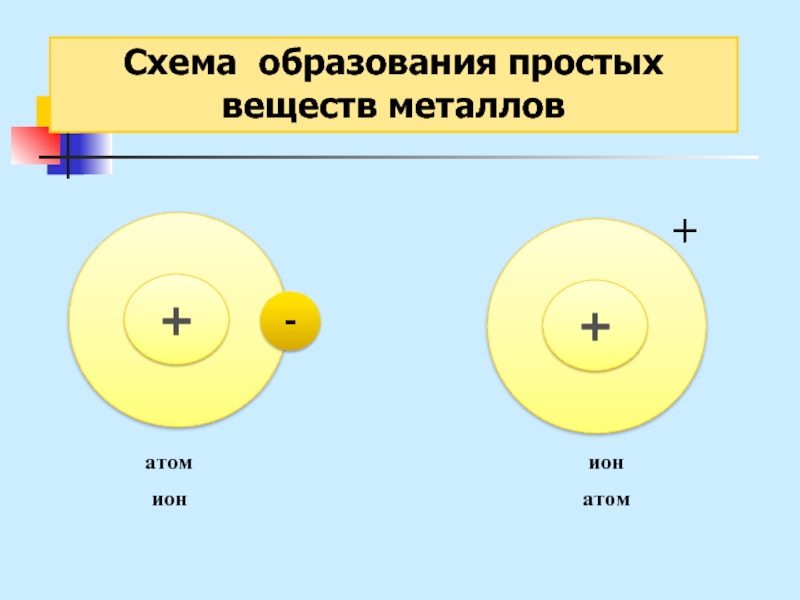
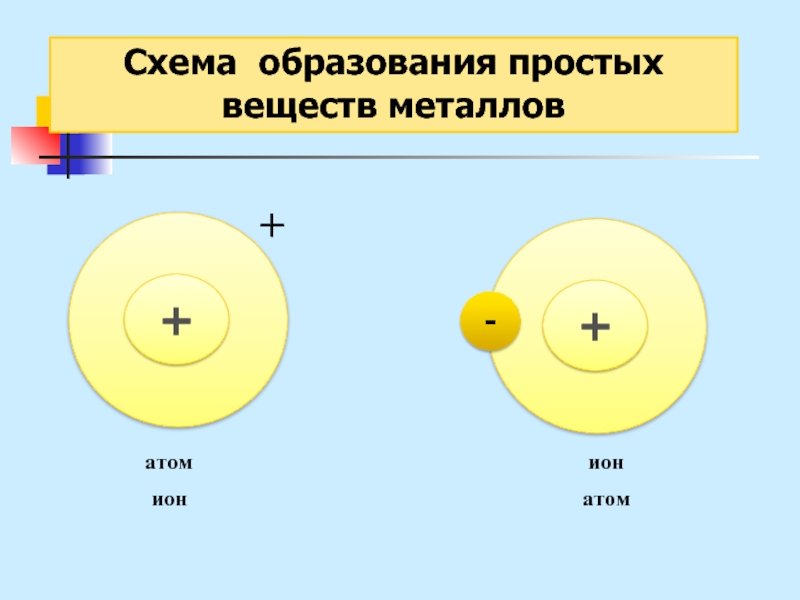
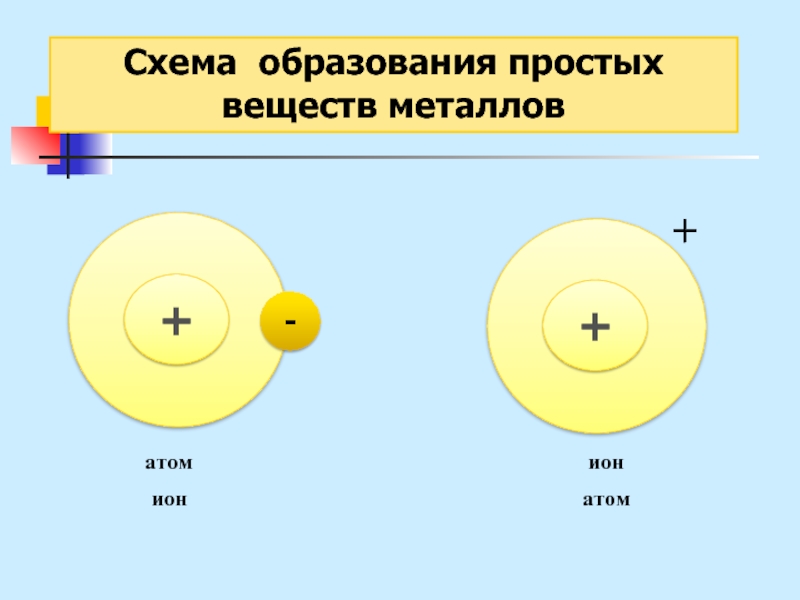
Слайд 27Схема образования
простых веществ металлов
Металлическая связь – это связь
в металлах
или сплавах, образуемая между атом-ионами посредством обобществленных электронов
Слайд 28 неМе + неМе (простое вещество неметалл)
Э.О. =
Э.О. – ковалентная неполярная связь
Ме + неМе ( сложное вещество)
Э.О. << Э.О. – ионная связь
неМе + неМе (сложное вещество)
Э.О. < Э.О. – ковалентная полярная связь
Ме (простое вещество металл) – металлическая химическая связь
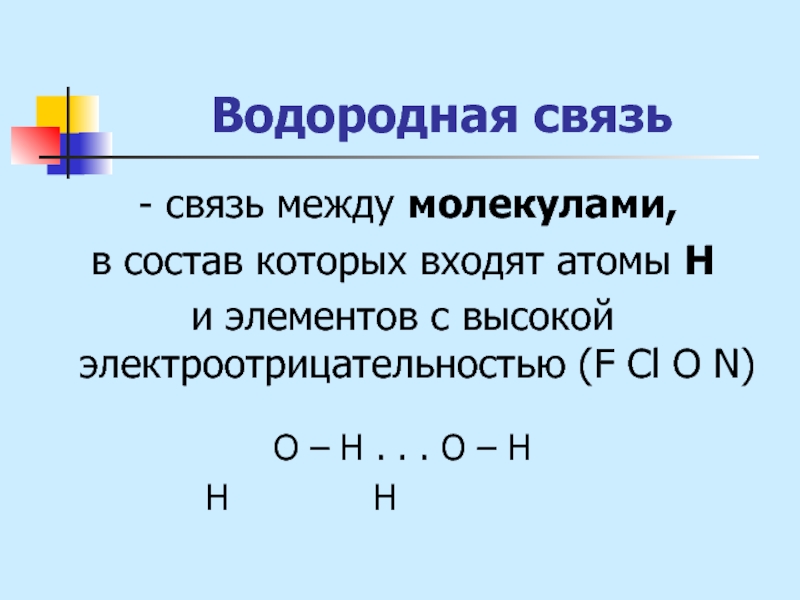
Слайд 29Водородная связь
- связь между молекулами,
в состав которых входят
атомы Н
и элементов с высокой электроотрицательностью (F Cl O N)
О – Н . . . О – Н
Н Н
и элементов с высокой электроотрицательностью (F Cl O N)
О – Н . . . О – Н
Н Н