- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химическая кинетика и катализ презентация
Содержание
- 1. Химическая кинетика и катализ
- 2. План лекции Химическая кинетика Скорость химических реакций
- 3. Условия протекания химических реакций Соприкосновение реагирующих веществ. Нагревание. Использование катализатора.
- 4. Сущность химических реакций Сущность химических реакций сводится
- 5. Изменение концентрации реагирующего вещества во времени
- 6. Для гомогенных реакций Под скоростью
- 7. Факторы, влияющие на скорость реакции Концентрация реагирующих
- 8. Концентрация реагирующих веществ Закон действующих масс (ЗДМ)
- 9. Cкорость и концентрация Чем больше концентрация реагирующих
- 10. Температура Правило Вант-Гоффа: при изменении
- 11. Физический смысл температурного коэффициента Если температурный
- 12. Скорость и температура При повышении температуры, увеличивается
- 13. Взаимодействие магния с водой Запишите уравнение реакции взаимодействия магния с водой. Mg+H2O=MgO+H2↑
- 14. Природа реагирующих веществ Металлы I и
- 15. Взаимодействие калия с водой
- 16. Взаимодействие кальция с водой
- 17. Природа реагирующих веществ Чем активнее вещество, тем скорость реакции с его участием больше.
- 18. Площадь соприкосновения реагирующих веществ Скорость гетерогенных реакций
- 19. Скорость гетерогенных реакций Чем больше поверхность соприкосновения веществ, тем выше скорость реакции.
- 20. Катализатор Катализаторами называются вещества, изменяющие скорость
- 21. Скорость и катализатор Катализатор увеличивает скорость химической реакции. С12Н22О11=12СО2+11Н2О t
- 22. Механизм каталитических реакций Для реакции: А +
- 23. Влияние катализатора на путь химической реакции 1.
Слайд 2План лекции
Химическая кинетика
Скорость химических реакций
Влияние концентрации на скорость химических реакций
Влияние температуры
на скорость химических реакций
Влияние природы реагирующих веществ
на скорость химических реакций
6. Влияние площади соприкосновения на скорость
гетерогенных реакций
7. Влияние катализатора на скорость и путь химических реакций
8. Катализаторы в химическом производстве
и в биологических объектах
Влияние природы реагирующих веществ
на скорость химических реакций
6. Влияние площади соприкосновения на скорость
гетерогенных реакций
7. Влияние катализатора на скорость и путь химических реакций
8. Катализаторы в химическом производстве
и в биологических объектах
Слайд 3Условия протекания химических реакций
Соприкосновение реагирующих веществ.
Нагревание.
Использование катализатора.
Слайд 4Сущность химических реакций
Сущность химических реакций сводится к разрыву связей в исходных
веществах и возникновению новых связей в продуктах реакции.
Общее число атомов каждого химического элемента до и после реакции остаётся постоянным.
Образование связей происходит с выделением энергии, а разрыв связей – с поглощением энергии.
Общее число атомов каждого химического элемента до и после реакции остаётся постоянным.
Образование связей происходит с выделением энергии, а разрыв связей – с поглощением энергии.
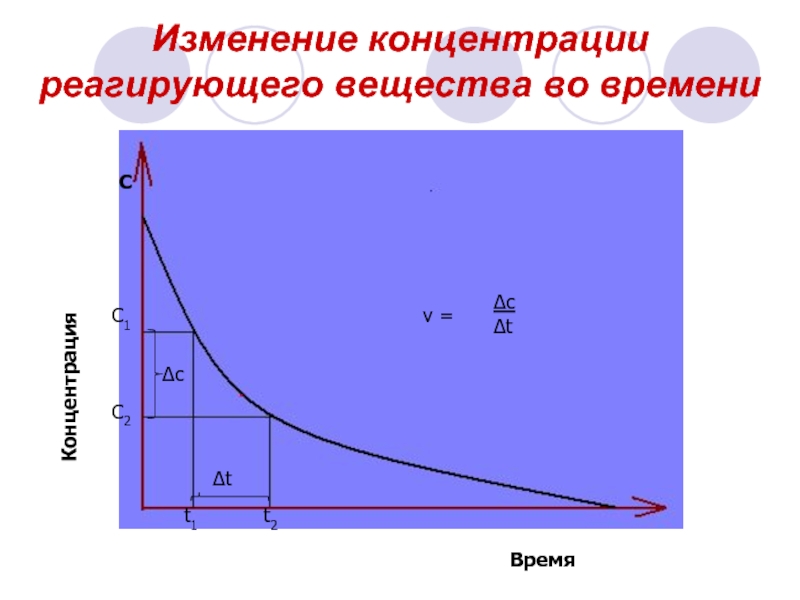
Слайд 5Изменение концентрации реагирующего вещества во времени
С
Концентрация
Время
С1
С2
t1
t2
∆c
∆t
v =
∆c
∆t
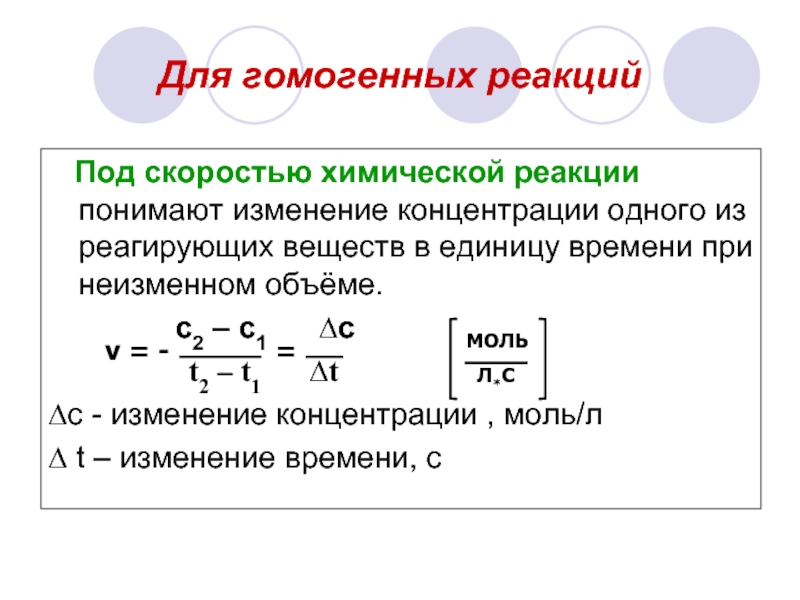
Слайд 6Для гомогенных реакций
Под скоростью химической реакции понимают изменение концентрации
одного из реагирующих веществ в единицу времени при неизменном объёме.
c2 – c1 ∆c
t2 – t1 ∆t
∆с - изменение концентрации , моль/л
∆ t – изменение времени, с
c2 – c1 ∆c
t2 – t1 ∆t
∆с - изменение концентрации , моль/л
∆ t – изменение времени, с
v = -
=
Слайд 7Факторы, влияющие на скорость реакции
Концентрация реагирующих веществ.
Температура.
Природа реагирующих веществ.
Площадь соприкосновения реагирующих
веществ.
Катализатор.
Катализатор.
Слайд 8Концентрация реагирующих веществ
Закон действующих масс (ЗДМ) : скорость химической реакции пропорциональна
произведению концентраций реагирующих веществ.
Для реакции: mА + nB = AmBn
ЗДМ: v = k٠САm٠CBn
k – константа скорости реакции:
k = v, при сА = св = 1 моль/л или
при сА ٠ св = 1 моль/л
k – зависит от природы реагирующих веществ и от t
Для реакции: mА + nB = AmBn
ЗДМ: v = k٠САm٠CBn
k – константа скорости реакции:
k = v, при сА = св = 1 моль/л или
при сА ٠ св = 1 моль/л
k – зависит от природы реагирующих веществ и от t
Слайд 9Cкорость и концентрация
Чем больше концентрация реагирующих веществ, тем чаще сталкиваются частицы
веществ, а значит скорость реакции увеличивается.
Слайд 10Температура
Правило Вант-Гоффа: при изменении температуры на каждые 100С скорость
большинства реакций изменяется в 2 – 4 раза.
t2 – t1
10
– температурный коэффициент, который показывает, во сколько раз изменяется скорость реакции при изменении t на 100С
t2 – t1
10
– температурный коэффициент, который показывает, во сколько раз изменяется скорость реакции при изменении t на 100С
v2 = v1٠
Слайд 11Физический смысл температурного коэффициента
Если температурный коэффициент равен 3, это значит, что
скорость реакции возрастает в 3 раза, при повышении температуры на 100С.
При увеличении температуры ещё на 100С, скорость реакции возрастёт в 32=9 раз.
При увеличении температуры ещё на 100С, скорость реакции возрастёт в 32=9 раз.
Слайд 12Скорость и температура
При повышении температуры, увеличивается скорость движения частиц, поэтому они
чаще сталкиваются, а значит скорость реакции возрастает.
Слайд 13Взаимодействие магния с водой
Запишите уравнение реакции взаимодействия магния с водой.
Mg+H2O=MgO+H2↑
Слайд 14Природа реагирующих веществ
Металлы I и II групп главных подгрупп взаимодействуют
с водой с образованием щёлочи и выделением водорода. Например:
2Na + 2H2O = 2NaOH + H2↑
2K + 2H2O = 2KOH + H2↑
Ca + 2H2O = Ca(OH)2 +H2↑
2Na + 2H2O = 2NaOH + H2↑
2K + 2H2O = 2KOH + H2↑
Ca + 2H2O = Ca(OH)2 +H2↑
Слайд 17Природа реагирующих веществ
Чем активнее вещество, тем скорость реакции с его участием
больше.
Слайд 18Площадь соприкосновения реагирующих веществ
Скорость гетерогенных реакций зависит от площади соприкосновения веществ.
Гетерогенные
реакции идут только на поверхности раздела реагирующих веществ.
Скорость гетерогенной реакции выражается формулой:
Скорость гетерогенной реакции выражается формулой:
[
]
Слайд 19Скорость гетерогенных реакций
Чем больше поверхность соприкосновения веществ, тем выше скорость реакции.
Слайд 20Катализатор
Катализаторами называются вещества, изменяющие скорость химических реакций.
Сам катализатор в реакциях
не расходуется и в конечные продукты не входит.
Химические реакции, протекающие при участии катализаторов, называют каталитическими.
Химические реакции, протекающие при участии катализаторов, называют каталитическими.
Слайд 21Скорость и катализатор
Катализатор увеличивает скорость химической реакции.
С12Н22О11=12СО2+11Н2О
t
Слайд 22Механизм каталитических реакций
Для реакции: А + В = АВ
Механизм:
Катализатор взаимодействует с
исходным веществом: А + К = АК
Промежуточное соединение взаимодействует с другим исходным веществом: АК + В = АВ + К
Суммарное уравнение: А + В = АВ
Промежуточное соединение взаимодействует с другим исходным веществом: АК + В = АВ + К
Суммарное уравнение: А + В = АВ