- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химическая кинетика презентация
Содержание
- 1. Химическая кинетика
- 2. Основные понятия Кинетика – наука о скоростях
- 3. Скорость химической реакции Под скоростью химической реакции
- 4. Скорость химической реакции На практике скорость химической
- 8. Классификация химических реакций а) Гомогенные- реакции в
- 9. ВЛИЯНИЕ КОНЦЕНТРАЦИЙ РЕАГИРУЮЩИХ ВЕЩЕСТВ НА СКОРОСТЬ РЕАКЦИЙ В
- 10. Классификация химических реакций
- 11. Простые химические реакции Простая или элементарная реакция
- 13. Мономолекулярная реакция – в элементарном акте участвует одна молекула (разложение)
- 14. Бимолекулярная реакция - в элементарном акте участвуют 2 молекулы (столкновение двух молекул)
- 15. Трехмолекулярная реакция в элементарном акте участвуют три молекулы, вероятность их столкновения мала
- 16. Сложные реакции Сложные реакции протекают в несколько
- 17. Последовательные реакции
- 18. Параллельные реакции
- 19. Цепные реакции
- 20. Закон действующих масс (Гульдберг и Вааге) Скорость химической реакции пропорциональна концентрации реагирующих веществ.
- 21. Где: СА, СВ – молярные концентрации реагентов
- 22. ПРИМЕР: по N2O первый порядок, по
- 23. Порядок реакции Если реакция сложная, то происходит
- 24. ПРИМЕР: Реакция образования воды, сложная цепная реакция:
- 25. ПРИМЕР: порядок по водороду - 0,4 порядок
- 26. Графическое определение порядка реакции в координатах (C;
- 27. Графическое определение порядка реакции а)
- 28. Влияние температуры на скорость химической реакции Чем
- 29. Влияние температуры на скорость химической реакции Осуществить
- 30. Влияние температуры на скорость химической реакции Правило
- 31. Температурный коэффициент γ – температурный коэффициент Вант-Гоффа,
- 32. Пример: Во сколько раз увеличится скорость химической
- 33. Решение:
- 34. Пример: При 100 ºС реакция идет за
- 35. Решение:
- 36. Теория активации Увеличение скорости реакции с повышением
- 37. Теория активации Во взаимодействие вступают только активные
- 38. Энергия активации Энергия, которую надо придать молекулам
- 39. Важно! Энергия активации характеристика реакции в целом,
- 40. Реакция начинается только между теми частицами, которые
- 41. Образование активированного комплекса А2 + В2 = 2АВ
- 42. Пример: Н2 + J2 = 2HJ
- 43. Образование активированного комплекса
- 44. Образование активированного комплекса В активированном комплексе происходит
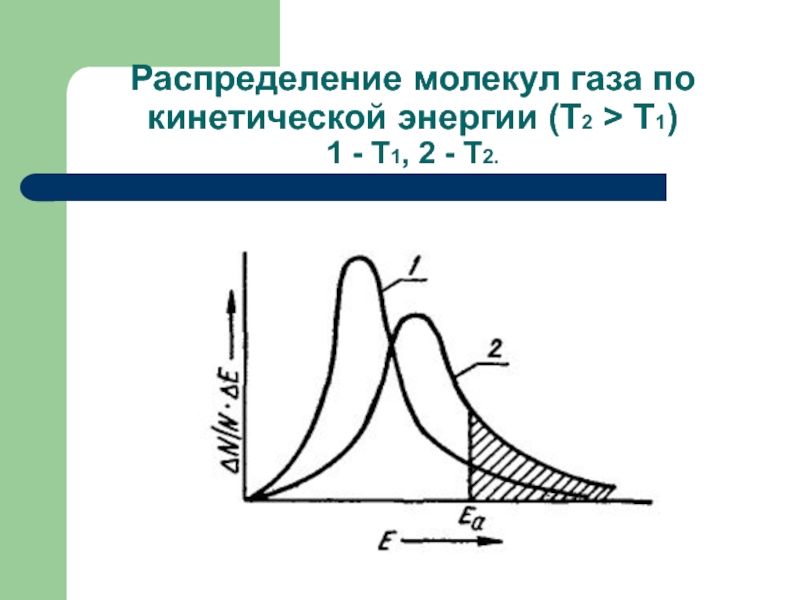
- 45. Распределение молекул газа по кинетической энергии (Т2
- 46. Уравнение Аррениуса К – константа скорости реакции,
- 47. Из уравнения Аррениуса видно, что поскольку
- 48. Графический метод определения энергии активации Строят
- 49. Скорость химической реакции в значительной мере
- 50. Пример: Энергия активации некоторой реакции при 500
- 51. Влияние давления на скорость химической реакции
- 52. ↑ давления → ↑ конц-ции газа
- 53. Пример: 2NOгаз + 2H2газ → N2 +
- 54. Решение: 2NOгаз + 2H2газ → N2 +
- 55. КАТАЛИЗ
- 56. Катализ - это один из наиболее распространенных в химической практике методов ускорения химических реакций
- 57. Катализаторы – это вещества, которые ускоряют химические
- 58. В присутствии катализатора возникают другие активированные
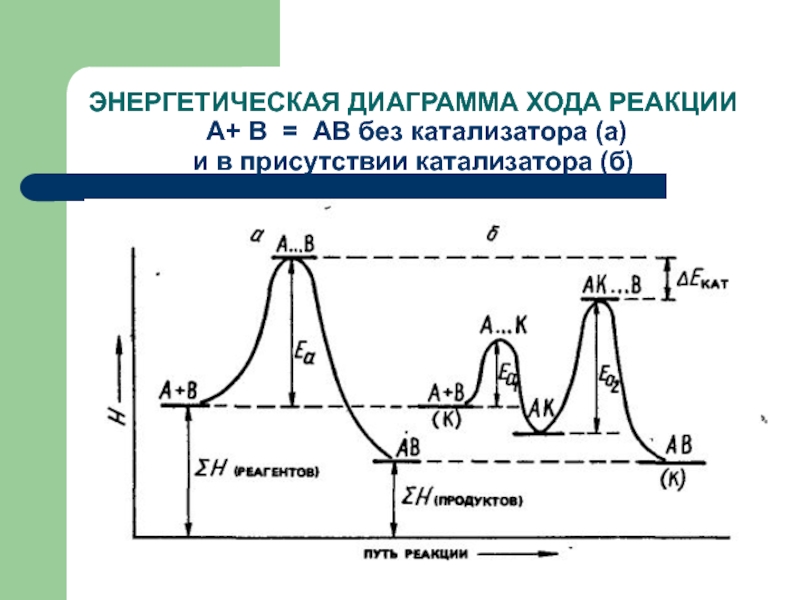
- 59. ЭНЕРГЕТИЧЕСКАЯ ДИАГРАММА ХОДА РЕАКЦИИ А+ В
- 60. Т. о., в присутствии катализаторов энергия
- 61. Пример Платина снижает значение Еа реакции
- 62. Пример Влияние катализатора на снижение энергии
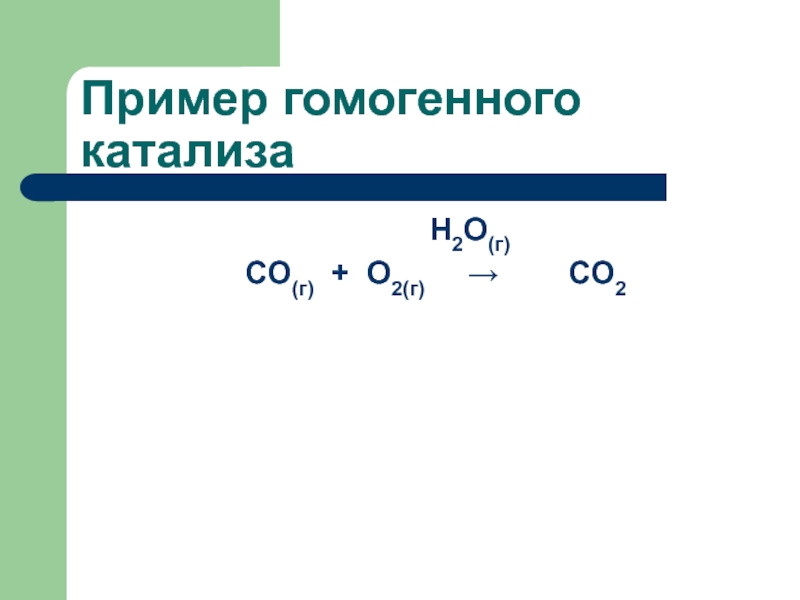
- 64. Пример гомогенного катализа
- 65. Пример гомогенного катализа H2O(г)
- 66. Пример гетерогенного катализа
- 67. Пример гетерогенного катализа
- 68. Эффективность гетерогенных катализаторов обычно намного больше
- 69. Сорбция - поглощение газа или жидкого вещества твердым веществом - сорбентом.
- 70. Различают: Адсорбция – поглощение поверхностью Абсорбция
- 71. Пример Энергия активации некоторой реакции в отсутствии
- 72. Выводы: 1. Скорость химической реакции зависит от
- 73. Химическое равновесие и константа равновесия
Слайд 2Основные понятия
Кинетика – наука о скоростях и механизмах процессов
Химическая кинетика изучает
скорости и механизмы химических реакций
Слайд 3Скорость химической реакции
Под скоростью химической реакции понимается число элементарных актов взаимодействия
реагентов в единицу времени (сек., мин., час) в единице объема (мл, литр, м3) для гомогенных реакций или на единице поверхности для гетерогенных реакций.
Слайд 4Скорость химической реакции
На практике скорость химической реакции выражается изменением концентрации реагентов
или продуктов в единицу времени.
Слайд 8Классификация химических реакций
а) Гомогенные- реакции в которых реагенты находятся в одном
агрегатном состоянии
б) Гетерогенные- реакции в которых реагенты находятся в различных агрегатных состояниях.
Слайд 11Простые химические реакции
Простая или элементарная реакция протекает в одну стадию, без
образования промежуточных веществ.
Простые реакции делятся на:
мономолекулярные
бимолекулярные
трехмолекулярные
Простые реакции делятся на:
мономолекулярные
бимолекулярные
трехмолекулярные
Слайд 14Бимолекулярная реакция
- в элементарном акте участвуют 2 молекулы (столкновение двух молекул)
Слайд 15Трехмолекулярная реакция
в элементарном акте участвуют три молекулы, вероятность их столкновения мала
Слайд 16Сложные реакции
Сложные реакции протекают в несколько стадий с образованием промежуточных продуктов.
Сложные реакции бывают:
последовательные
параллельные реакции
цепные реакции
последовательные
параллельные реакции
цепные реакции
Слайд 20Закон действующих масс
(Гульдберг и Вааге)
Скорость химической реакции пропорциональна концентрации реагирующих
веществ.
Слайд 21Где:
СА, СВ – молярные концентрации реагентов в любой момент времени моль/л,
k
– константа скорости химической реакции,
a, b – стехиометрические коэффициенты,
а – порядок реакции по веществу А,
b – порядок реакции по веществу В,
а + b –общий кинетический порядок реакции.
Общий порядок простой реакции совпадает с ее молекулярностью.
a, b – стехиометрические коэффициенты,
а – порядок реакции по веществу А,
b – порядок реакции по веществу В,
а + b –общий кинетический порядок реакции.
Общий порядок простой реакции совпадает с ее молекулярностью.
Слайд 22ПРИМЕР:
по N2O первый порядок,
по Н2 первый порядок, суммарный - второй.
Для простой реакции общий порядок равен сумме частных порядков.
Слайд 23Порядок реакции
Если реакция сложная, то происходит ряд промежуточных превращений и порядок
реакции равен порядку реакции лимитирующей стадии.
В сложных реакциях порядок реакции не совпадает с ее молекулярностью.
Молекулярность - это число одновременно сталкивающихся молекул.
В сложных реакциях порядок реакции не совпадает с ее молекулярностью.
Молекулярность - это число одновременно сталкивающихся молекул.
Слайд 24ПРИМЕР:
Реакция образования воды, сложная цепная реакция:
2Н2 + О2 = 2Н2О
Н2
+ О2 = ОН• + ОН•
ОН• + Н2 = Н2О + Н•
Н• + О2= ОН• + О•
О• + Н2 = ОН• + Н•
ОН• + Н2 = Н2О + Н•
Н• + О2= ОН• + О•
О• + Н2 = ОН• + Н•
Слайд 25ПРИМЕР:
порядок по водороду - 0,4
порядок по кислороду – 0,3
сумма равна
0,7
порядок реакции не совпадает со стехиометрическими коэффициентами.
Молекулярность равна трем.
порядок реакции не совпадает со стехиометрическими коэффициентами.
Молекулярность равна трем.
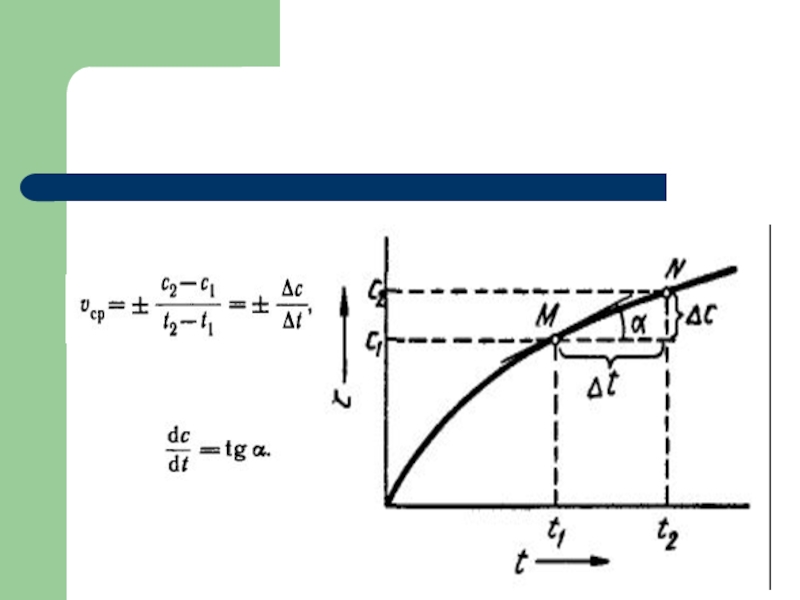
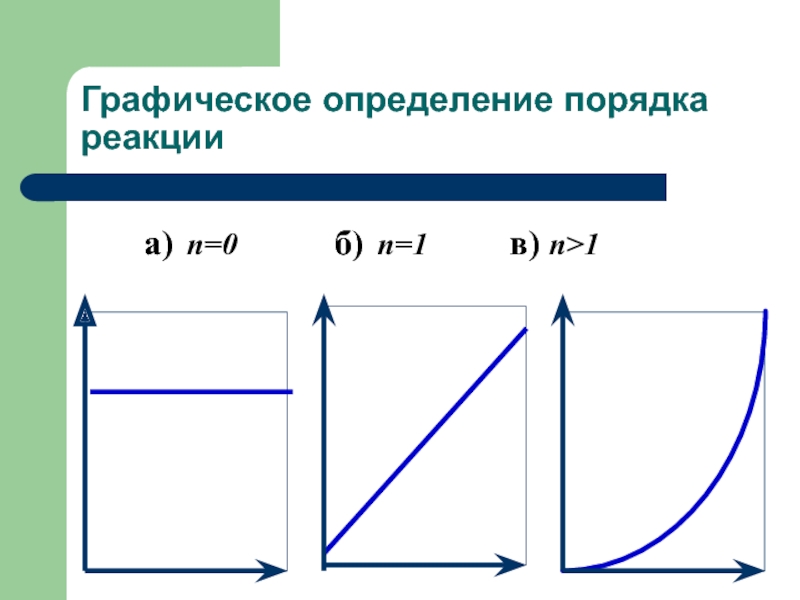
Слайд 26Графическое определение порядка реакции в координатах (C; t)
Если построить зависимость в
координатах концентрация от времени, то можно определить как порядок реакции, так и константу.
Слайд 28Влияние температуры на скорость химической реакции
Чем выше температура, тем больше скорость
химической реакции. Почему?
При повышении температуры увеличивается скорость движения молекул, возрастает число столкновений между ними и, соответственно этому доля активных молекул.
.
При повышении температуры увеличивается скорость движения молекул, возрастает число столкновений между ними и, соответственно этому доля активных молекул.
.
Слайд 29Влияние температуры на скорость химической реакции
Осуществить синтез воды
2Н2 + О2
= 2Н2О,
при t = 20оС - практически осуществить невозможно. Чтобы реакция прошла на 15% потребуется 54 миллиарда лет.
При t = 500оС - необходимо всего 50 минут.
При t = 700оС - реакция происходит мгновенно.
при t = 20оС - практически осуществить невозможно. Чтобы реакция прошла на 15% потребуется 54 миллиарда лет.
При t = 500оС - необходимо всего 50 минут.
При t = 700оС - реакция происходит мгновенно.
Слайд 30Влияние температуры на скорость химической реакции
Правило Вант-Гоффа:
При увеличении температуры на каждые
100 скорость химической реакции увеличивается в 2-4 раза.
Слайд 31Температурный коэффициент
γ – температурный коэффициент Вант-Гоффа, показывает во сколько раз возросла
скорость химической реакции.
Где Т2 > Т1
Слайд 32Пример:
Во сколько раз увеличится скорость химической реакции при повышении Т от
200 до 500 ºС, если температурный коэффициент γ= 2?
Слайд 34Пример:
При 100 ºС реакция идет за 16 минут , сколько времени
надо при 140 ºС, температурный коэффициент равен 2?
Слайд 36Теория активации
Увеличение скорости реакции с повышением температуры значительно больше, чем увеличение
скорости движения молекул.
Разъясняет действие другой причины увеличения скорости реакции с повышением температуры теория активации.
Разъясняет действие другой причины увеличения скорости реакции с повышением температуры теория активации.
Слайд 37Теория активации
Во взаимодействие вступают только активные молекулы, энергия которых превышает среднюю
энергию молекул данного вещества. Для активации остальных молекул им необходимо придать дополнительную энергию, что и может быть достигнуто повышением температуры.
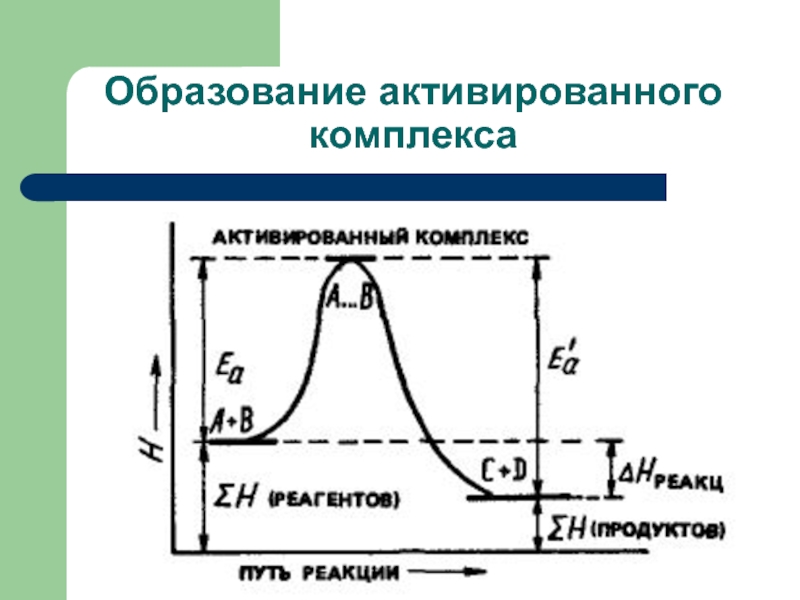
Слайд 38Энергия активации
Энергия, которую надо придать молекулам реагирующих веществ, для того, чтобы
сделать их активными, называется энергией активации Еа. Она зависит от природы реагирующих веществ и является характеристикой любой реакции и обычно выражается в кДж/моль.
Чем больше энергия активации, тем меньше активных молекул при данной температуре и тем медленнее идет реакция.
Чем больше энергия активации, тем меньше активных молекул при данной температуре и тем медленнее идет реакция.
Слайд 39Важно!
Энергия активации характеристика реакции в целом, а не для вещества.
Энергия
активации - это наименьшая энергия необходимая для того, чтобы молекула прореагировала.
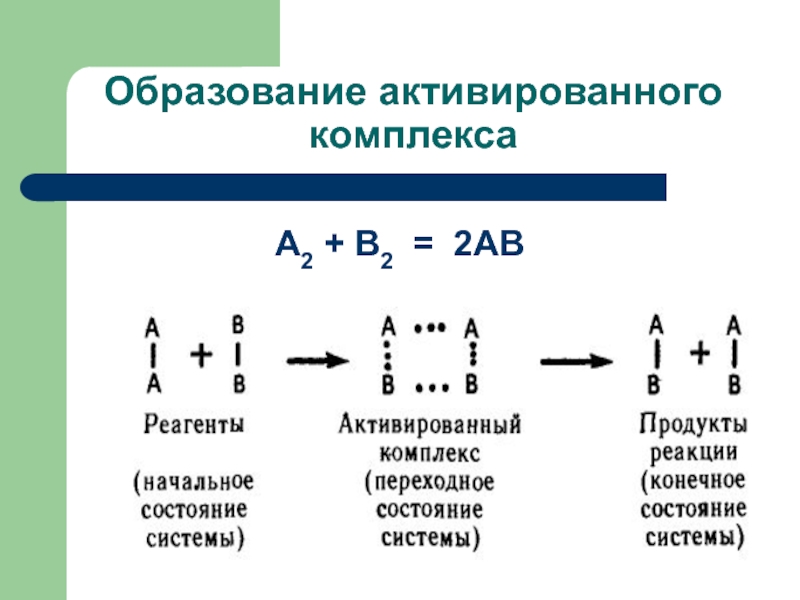
Слайд 40Реакция начинается только между теми частицами, которые обладают повышенной энергией. Такие
частицы при столкновении сначала образуют активированный комплекс - промежуточное соединение, существующее в течение очень короткого времени. Затем активированный комплекс разрушается с образованием продуктов реакции. Образование активированного комплекса более энергетически выгодно, чем предварительный полный распад молекул, вступающих в реакцию.
Слайд 42Пример:
Н2 + J2 = 2HJ
Электронные облака не дают взаимодействовать
молекулам, избыточная энергия нужна для разрыва связей и атомы взаимодействуют:
1. Н2 → 2H E=434 кДж/моль - атомизация
2. J2 → 2J E=100 кДж/моль
3. Н + J → НJ
E= 530 ÷ 550 кДж/моль - теоретическая, а экспериментальная энергия активации – 198 кДж/моль. Почему такая разница? Как идет этот процесс?
Атомизация на самом деле не идет. Молекулы образуют промежуточные активированные комплексы
Н2 + J2 → H2……J2 → 2HJ
Для обратимых реакций активированный комплекс одинаков для прямой и обратной реакции.
1. Н2 → 2H E=434 кДж/моль - атомизация
2. J2 → 2J E=100 кДж/моль
3. Н + J → НJ
E= 530 ÷ 550 кДж/моль - теоретическая, а экспериментальная энергия активации – 198 кДж/моль. Почему такая разница? Как идет этот процесс?
Атомизация на самом деле не идет. Молекулы образуют промежуточные активированные комплексы
Н2 + J2 → H2……J2 → 2HJ
Для обратимых реакций активированный комплекс одинаков для прямой и обратной реакции.
Слайд 44Образование активированного комплекса
В активированном комплексе происходит перераспределение электронной плотности между атомами:
связи А-В начинают образовываться одновременно с разрывом связей А-А и В-В.
Активированный комплекс существует очень короткое время (порядка 10-13сек).
Активированный комплекс существует очень короткое время (порядка 10-13сек).
Слайд 46Уравнение Аррениуса
К – константа скорости реакции,
е – основание натурального логарифма,
Т
– температура, в К,
R – молярная газовая постоянная 8,31 Дж/моль*К
Еа – энергия активации, Дж/моль,
А – предэкспоненциальный множитель, показывает общее число столкновений.
R – молярная газовая постоянная 8,31 Дж/моль*К
Еа – энергия активации, Дж/моль,
А – предэкспоненциальный множитель, показывает общее число столкновений.
Слайд 47
Из уравнения Аррениуса видно, что поскольку Т входит в показатель степени,
скорость химической реакции очень чувствительна к изменению температуры. Например, при повышении температуры на 100оС скорость реакци
H2(г) + I2(г) = 2HI (г)
возрастает примерно в 1000 раз.
H2(г) + I2(г) = 2HI (г)
возрастает примерно в 1000 раз.
Слайд 48Графический метод определения энергии активации
Строят график в аррениусовских координатах (ln
k – 1/T)
ln k = ln A – Eа/RT
и из графика находят k и Еа
ln k = ln A – Eа/RT
и из графика находят k и Еа
Слайд 49
Скорость химической реакции в значительной мере зависит от энергии активации. Для
подавляющего большинства реакций она лежит в пределах от 50 до 250 кДж/моль. Реакции для которых Еа >150 кДж/моль при комнатной температуре практически не протекают.
Слайд 50Пример:
Энергия активации некоторой реакции при 500 К равна 80 кДж/моль. Определить
долю активных молекул.
Решение:
Решение:
Слайд 51Влияние давления на скорость химической реакции
Если в реакции участвуют газообразные
вещества, то повышение давления равносильно сжатию газа, т.е. увеличению его концентрации.
При увеличении концентрации газообразного компонента скорость реакции в соответствии с законом действующих масс возрастает.
При понижении давления газ расширяется, и его концентрация в системе падает, это вызывает уменьшение скорости реакции.
При увеличении концентрации газообразного компонента скорость реакции в соответствии с законом действующих масс возрастает.
При понижении давления газ расширяется, и его концентрация в системе падает, это вызывает уменьшение скорости реакции.
Слайд 53Пример:
2NOгаз + 2H2газ → N2 + 2H2O
Как изменится скорость химической реакции
при увеличении давления в 2 раза?
Как изменится скорость химической реакции при уменьшении давления в 3 раза?
Как изменится скорость химической реакции при уменьшении давления в 3 раза?
Слайд 54Решение:
2NOгаз + 2H2газ → N2 + 2H2O
1) V1 = k ·
РNO2 · РH22
V2 = k · (2РNO)2 · (2РH2)2 = 16 · k · РNO2 · РH22
V2 / V1 = 16 .
Ответ: скорость реакции возрастёт в 16 раз.
2) V1 = k · РNO2 · РH22
V2 = k · (1/3 РNO)2 · (1/3 РH2)2 = 1/81 · k · РNO2 · РH22
V2 / V1 = 1/81.
Ответ: скорость реакции уменьшится в 81 раз.
V2 = k · (2РNO)2 · (2РH2)2 = 16 · k · РNO2 · РH22
V2 / V1 = 16 .
Ответ: скорость реакции возрастёт в 16 раз.
2) V1 = k · РNO2 · РH22
V2 = k · (1/3 РNO)2 · (1/3 РH2)2 = 1/81 · k · РNO2 · РH22
V2 / V1 = 1/81.
Ответ: скорость реакции уменьшится в 81 раз.
Слайд 56Катализ
- это один из наиболее распространенных в химической практике методов ускорения
химических реакций
Слайд 57Катализаторы
– это вещества, которые ускоряют химические реакции за счет участия в
образовании промежуточных соединений, в состав продуктов они не входят и, следовательно, в реакции не расходуются.
Слайд 58
В присутствии катализатора возникают другие активированные комплексы.
Для их образования требуется
меньше энергии, чем для образования активированных комплексов возникающих без катализатора.
Слайд 59ЭНЕРГЕТИЧЕСКАЯ ДИАГРАММА ХОДА РЕАКЦИИ А+ В = АВ без катализатора (а)
и в присутствии катализатора (б)
Слайд 60
Т. о., в присутствии катализаторов энергия активации реакции понижается.
Уменьшение энергии
активации приводит к увеличению скорости реакции.
Слайд 61Пример
Платина снижает значение Еа реакции
Н2 + J2 = 2HJ
от
Еа =198 кДж/моль до
Еа =109кДж/молью
Еа =109кДж/молью
Слайд 62Пример
Влияние катализатора на снижение энергии активации процесса Еа можно показать
на следующих данных для реакции распада иодида водорода
2 HJ = H2 + J2 Еа , кДж/моль
без катализатора 168
катализатор Au 105
катализатор Pt 59
2 HJ = H2 + J2 Еа , кДж/моль
без катализатора 168
катализатор Au 105
катализатор Pt 59
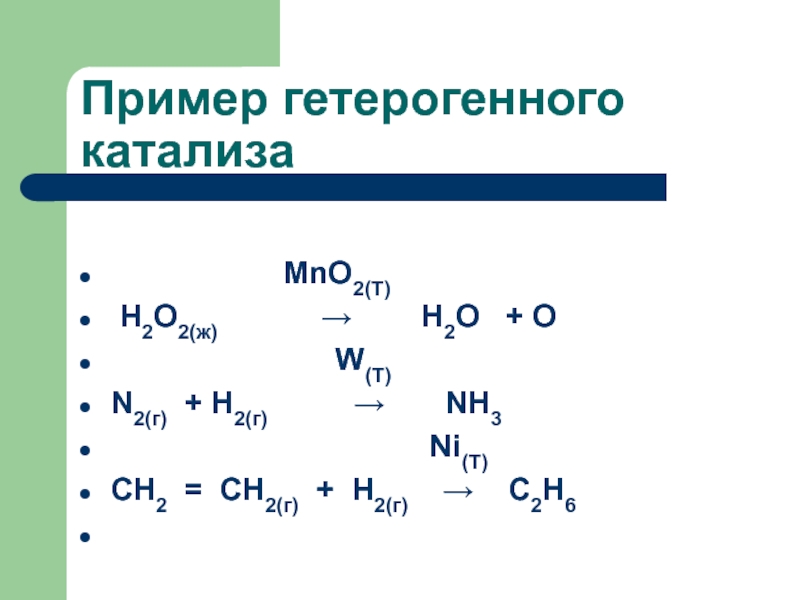
Слайд 67Пример гетерогенного катализа
MnO2(T)
Н2О2(ж) → Н2О + О
W(T)
N2(г) + H2(г) → NH3
Ni(T)
CH2 = CH2(г) + Н2(г) → C2H6
Н2О2(ж) → Н2О + О
W(T)
N2(г) + H2(г) → NH3
Ni(T)
CH2 = CH2(г) + Н2(г) → C2H6
Слайд 68
Эффективность гетерогенных катализаторов обычно намного больше чем гомогенных.
Скорость реакций в
случае гомогенного катализатора зависит от его концентрации, а в случае гетерогенного - от его удельной поверхности: чем она больше, тем больше скорость. Потому что каталитическая реакция идет на поверхности катализатора и включает в себя стадии адсорбции молекул реагентов на поверхности.
Слайд 70
Различают:
Адсорбция – поглощение поверхностью
Абсорбция – поглощение всем объемом, поглощение газа жидкостью,
или твердым веществом.
На процессе сорбции основано создание противогаза с активированным углем.
На процессе сорбции основано создание противогаза с активированным углем.
Слайд 71Пример
Энергия активации некоторой реакции в отсутствии катализатора равна 75,24 кДж/моль, а
с катализатором – 50,14 кДж/моль. Во сколько раз увеличится скорость реакции
в присутствии катализатора;
без катализатора.
в присутствии катализатора;
без катализатора.
Слайд 72Выводы:
1. Скорость химической реакции зависит от температуры, концентрации реагирующих веществ, их
природы и наличия катализатора.
2. Зависимость скорости реакции от концентрации реагирующих веществ представляется законом действующих масс, концентрация твердых веществ не записывается.
3. Зависимость скорости химической реакции от температуры выражается правилом Вант-Гоффа и уравнением Аррениуса.
3.
2. Зависимость скорости реакции от концентрации реагирующих веществ представляется законом действующих масс, концентрация твердых веществ не записывается.
3. Зависимость скорости химической реакции от температуры выражается правилом Вант-Гоффа и уравнением Аррениуса.
3.