- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Хімічні властивості алкенів і алкінів презентация
Содержание
- 1. Хімічні властивості алкенів і алкінів
- 2. Самостійна робота Варіант І Напишіть рівняння реакцій,
- 3. Варіант ІІ Напишіть рівняння реакцій, з допомогою
- 4. Запитання Наведіть загальні формули гомологічних рядів алканів,
- 5. Одержання й горіння етилену та ацетилену Демонстрація
- 6. Демонстрація 10. Одержання й горіння ацетилену 1)
- 7. Хімічні властивості алкенів і алкінів
- 8. Демонстрація 12. Реакції ненасичених вуглеводнів з розчинами
- 9. Якщо атоми Карбону, які утворюють кратний зв’язок,
- 11. Додаткові способи одержання А. Алкенів
- 12. Б. Ацетилену 1. Крекінг метану: 2CH4
- 13. Тренувальні вправи Запишіть рівняння реакцій, що характеризують
- 14. Поясніть, яка властивість ацетилену використовується під час
- 15. У результаті згоряння вуглеводню масою 6,5 г
- 16. Запитання 1) Назвіть загальні хімічні властивості вуглеводнів.
- 17. Домашнє завдання Опрацювати матеріал параграфа, відповісти
Слайд 2Самостійна робота
Варіант І
Напишіть рівняння реакцій, з допомогою яких можна здійснити такі
Обчисліть, який об’єм кисню (н. у.) знадобиться для спалювання 8,8 г пропану.
Слайд 3Варіант ІІ
Напишіть рівняння реакцій, з допомогою яких можна здійснити такі перетворення:
Обчисліть, який об’єм водню (н. у.) виділиться в результаті дегідрування 7,8 г бутану.
Слайд 4Запитання
Наведіть загальні формули гомологічних рядів алканів, алкенів, алкінів.
Назвіть види гібридизації в
Якими видами хімічного зв’язку утворені молекули етану, етену, етину?
Порівняйте види ізомерії в алканів, алкенів, алкінів на прикладі бутану, бутену, бутину.
Які вуглеводні (алкени, алкіни, алкани) частіше трапляються в природі? У вигляді яких сполук?
Слайд 5Одержання й горіння етилену та ацетилену
Демонстрація 9. Одержання й горіння етилену
1)
C2H5OH(H 2SO4(конц.)) t°→ C2H4 + H2O
2) Горіння етилену.
Слайд 6Демонстрація 10. Одержання й горіння ацетилену
1) Одержання ацетилену з кальцій карбіду:
CaC2
2) Горіння ацетилену.
Слайд 8Демонстрація 12. Реакції ненасичених вуглеводнів з розчинами кислот, лугів, калій перманганату
1) Взаємодія етилену з бромною водою й калій перманганатом.
CH2 = CH2 + Br2 → CH2Br − CH2Br
Висновок: ненасичені вуглеводні знебарвлюють розчини калій перманганату і бромну воду.
! Реакція з бромною водою (Br2) — якісна реакція на наявність кратного зв’язку!
Слайд 9 Якщо атоми Карбону, які утворюють кратний зв’язок, з’єднані з різною кількістю
CH2 = CH − CH3 + HCl → CH3 − CHCl − CH3
CH ≡ C − CH3 + HCl → CH2 = CCl − CH3
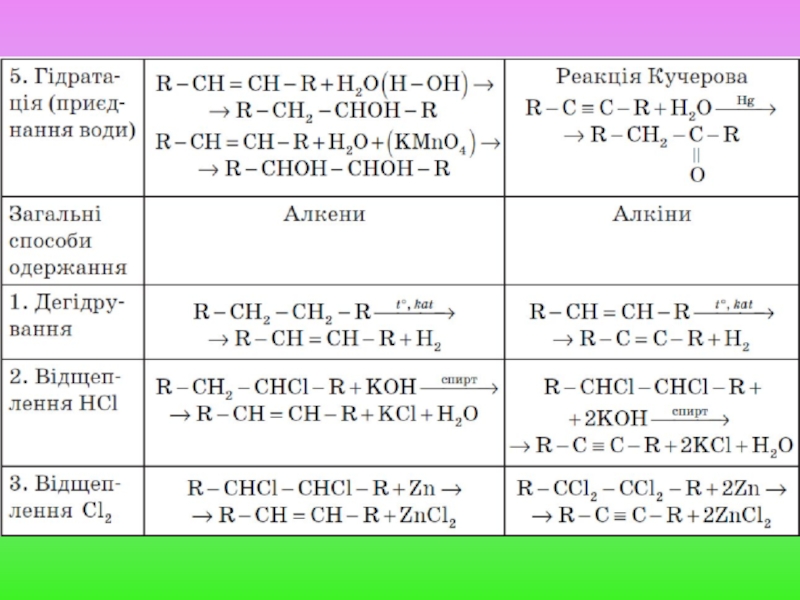
Слайд 11Додаткові способи одержання
А. Алкенів
1. Гідрування алкінів:
R − C = C
2. Дегідратація спиртів (відщеплення води):
Слайд 12Б. Ацетилену
1. Крекінг метану:
2CH4 t°→ C2H2 + 3H2
2. Карбідний метод:
CaC2
Одержання карбіду:
CaCO3 t°→ CaO + CO2
CaO + 3C t°→ CaC2 + CO
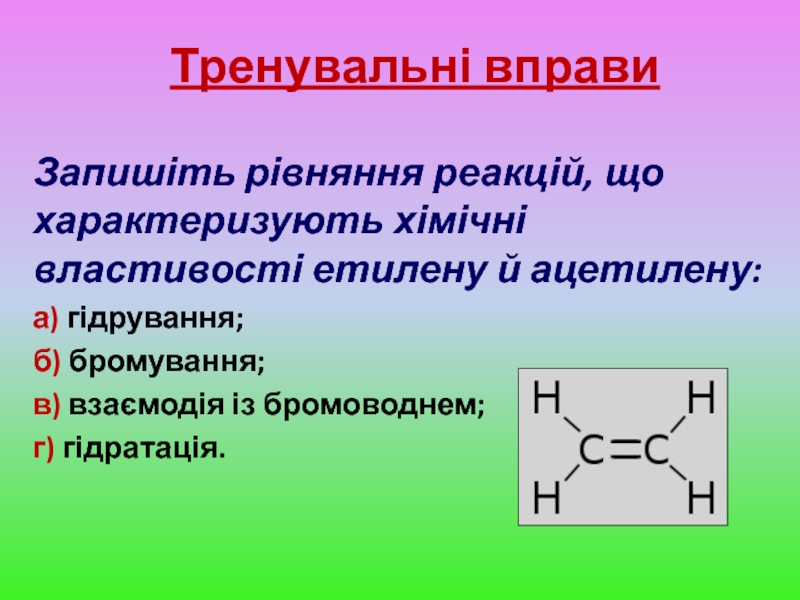
Слайд 13Тренувальні вправи
Запишіть рівняння реакцій, що характеризують хімічні властивості етилену й ацетилену:
а)
б) бромування;
в) взаємодія із бромоводнем;
г) гідратація.