- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Гидролиз солей презентация
Содержание
- 1. Гидролиз солей
- 2. Содержание Общие понятия Количественные характеристики гидролиза солей
- 3. обменное взаимодействие
- 4. Типы гидролиза солей Модуль 2.
- 5. по аниону:
- 6. Константа гидролиза
- 7. Константа гидролиза
- 8. Степень гидролиза соли -
- 9. Взаимосвязь степени и константы
- 10. Влияние природы соли
- 11. Смещение равновесия гидролиза Гидролиз по
- 12. Ионное уравнение гидролиза СH3COO−
- 13. соль образована сильным основанием
- 14. Гидролиз соли К2СО3 K2CO3 = 2K+
- 15. По первой ступени:
- 16. Гидролиз соли Cd(NO3)2 Cd(NO3)2 = Cd2+
- 17. Гидролиз соли CH3COONH4 Модуль 2.
- 18. Гидролиз солей слабых кислот и слабых
- 19. Необратимый совместный гидролиз - с участием катионов
- 20. Заключение Гидролиз соли ‑ процесс обменного взаимодействия
- 21. Рекомендуемая литература Никольский А.Б., Суворов А.В. Химия.
Слайд 1ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Лекция 10
ГИДРОЛИЗ СОЛЕЙ
Слайд 2Содержание
Общие понятия
Количественные характеристики гидролиза солей
Константа гидролиза
Степень гидролиза
Расчет степени гидролиза и рН
Примеры гидролиза солей
Гидролиз солей слабых кислот и сильных оснований
Гидролиз солей слабых оснований и сильных кислот
Гидролиз солей слабых оснований и слабых кислот
Необратимый гидролиз
Модуль 2. Лекция 10. Гидролиз солей
Слайд 3
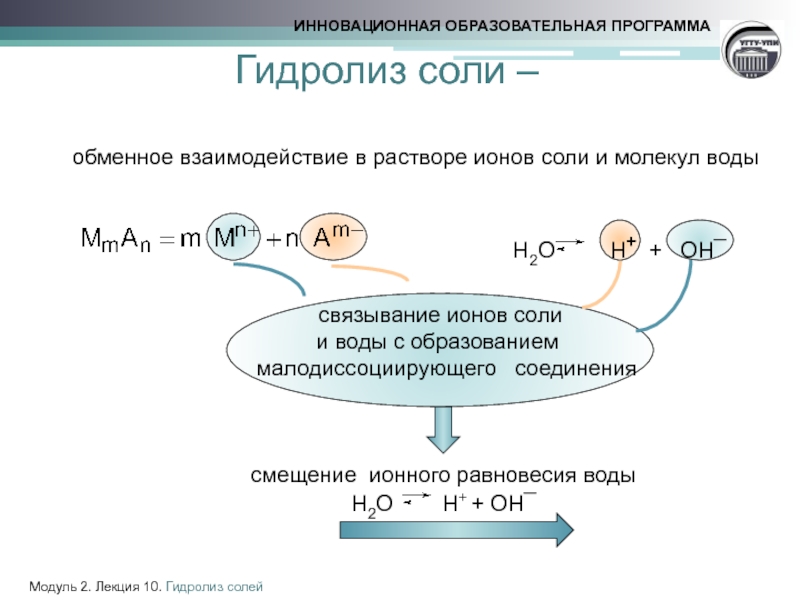
обменное взаимодействие в растворе ионов соли и молекул воды
Н2О Н+ + ОН¯
связывание ионов соли
и воды с образованием
малодиссоциирующего соединения
смещение ионного равновесия воды
Н2О Н+ + ОН¯
Гидролиз соли –
Модуль 2. Лекция 10. Гидролиз солей
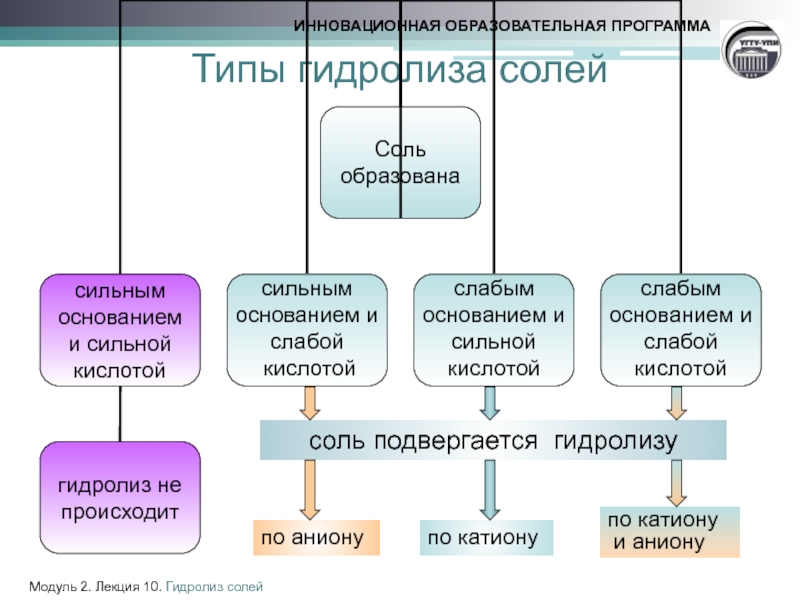
Слайд 4Типы гидролиза солей
Модуль 2. Лекция 10. Гидролиз солей
соль подвергается гидролизу
по
по катиону
по катиону
и аниону
Слайд 5
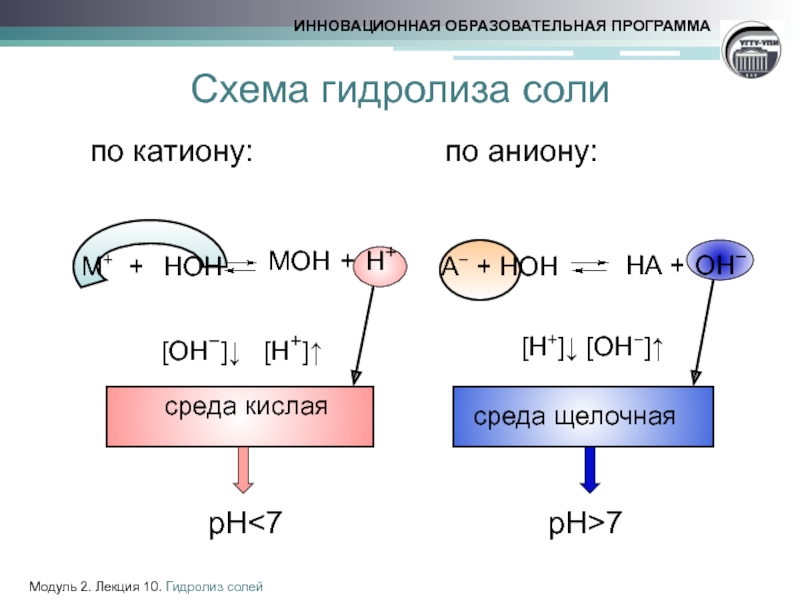
по аниону:
HА + OH−
cреда щелочная
по катиону:
MOH + H+
среда кислая
Схема гидролиза соли
Модуль 2. Лекция 10. Гидролиз солей
М+ + НОН
А− + НОН
[ОН−]↓ [H+]↑
[H+]↓ [ОН−]↑
pH<7
pH>7
Слайд 6
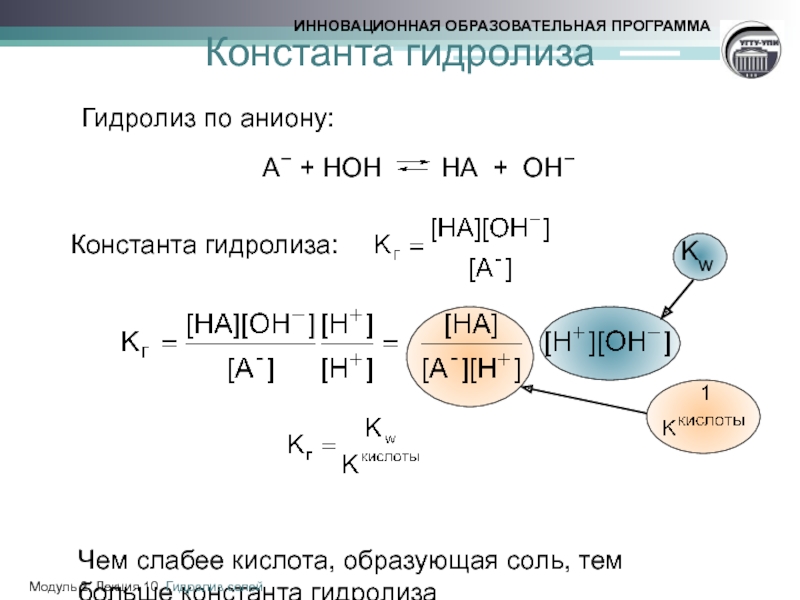
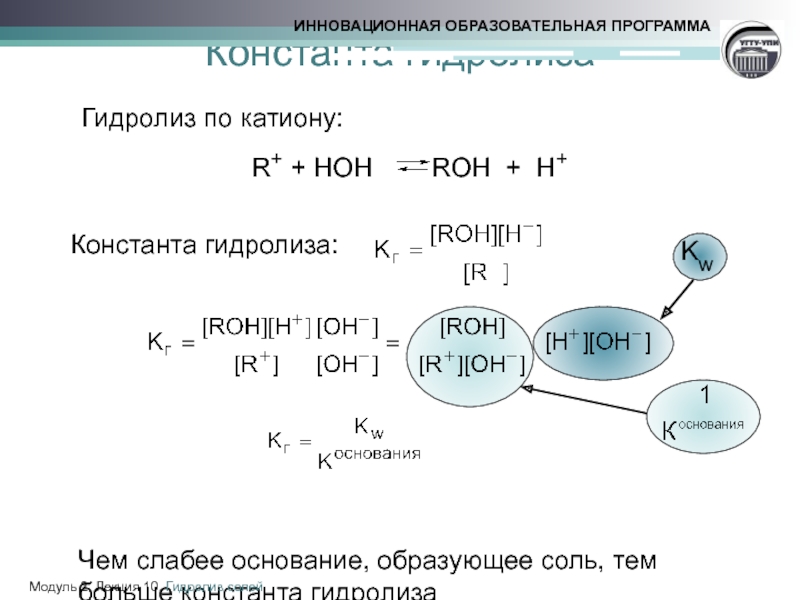
Константа гидролиза
Гидролиз по аниону:
А− + НОН
Константа гидролиза:
Чем слабее кислота, образующая соль, тем
больше константа гидролиза
Модуль 2. Лекция 10. Гидролиз солей
Kw
Слайд 7
Константа гидролиза
Гидролиз по катиону:
R+ + НОН
Константа гидролиза:
Чем слабее основание, образующее соль, тем
больше константа гидролиза
Модуль 2. Лекция 10. Гидролиз солей
Kw
Слайд 8Степень гидролиза соли -
отношение количества вещества (соли), подвергшегося
Размерность – доли ед., %
При комнатной температуре степень гидролиза соли обычно
невелика:
Модуль 2. Лекция 10. Гидролиз солей
Слайд 9
Взаимосвязь степени и константы гидролиза
Соль гидролизуется по аниону: А−
С – исходная концентрация аниона в растворе соли, моль/л
hС – концентрация анионов, подвергшихся гидролизу, моль/л
– равновесная концентрация
анионов соли
– равновесные концентрации
продуктов гидролиза
Если
Модуль 2. Лекция 10. Гидролиз солей
Слайд 10
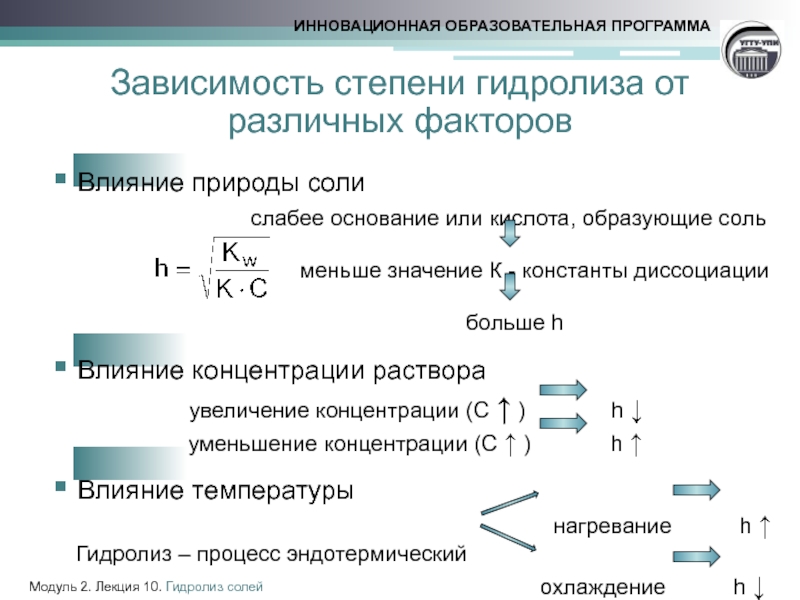
Влияние природы соли
меньше значение К - константы диссоциации
больше h
Влияние концентрации раствора
увеличение концентрации (С ↑ ) h ↓
уменьшение концентрации (С ↑ ) h ↑
Влияние температуры
нагревание h ↑
Гидролиз – процесс эндотермический
охлаждение h ↓
Зависимость степени гидролиза от различных факторов
Модуль 2. Лекция 10. Гидролиз солей
Слайд 11
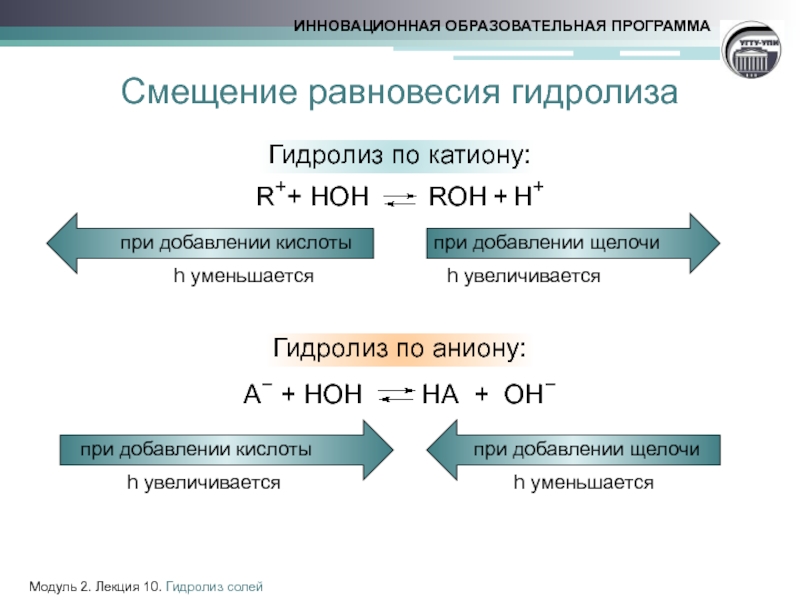
Смещение равновесия гидролиза
Гидролиз по катиону:
R++ HOH
Гидролиз по аниону:
А− + НОН НА + ОН−
Модуль 2. Лекция 10. Гидролиз солей
при добавлении кислоты
при добавлении щелочи
h увеличивается
h уменьшается
при добавлении кислоты
при добавлении щелочи
h уменьшается
h увеличивается
Слайд 12
Ионное уравнение гидролиза
СH3COO− + HOH СH3COOH +
Степень гидролиза
Концентрация ионов Н+ и рН
Модуль 2. Лекция 10. Гидролиз солей
Расчет степени гидролиза CH3COONa в 0,1М растворе и pH раствора
Слайд 13
соль образована сильным основанием и слабой одноосновной кислотой, гидролиз
NaNO2 = Na+ + NO2−
NO2− + HOH HNO2 + OH−
NaNO2 + H2O HNO2 + NaOH
Среда щелочная, рН>7
Константа гидролиза
Кг <<1 равновесие смещено в направлении
обратной реакции
Гидролиз соли NaNO2
Модуль 2. Лекция 10. Гидролиз солей
Слайд 14
Гидролиз соли К2СО3
K2CO3 = 2K+ + CO32−
Соль образована
Уравнения гидролиза по I ступени:
CO32− + HOH HCO3− + OH−
K2CO3 + H2O KHCO3 + KOH
Уравнения гидролиза по II ступени:
HCO3− + HOH H2CO3 + OH−
KHCO3 + HOH H2CO3 + KOH
Среда щелочная, рН>7
Модуль 2. Лекция 10. Гидролиз солей
Слайд 15
По первой ступени:
По второй ступени:
Расчет констант гидролиза К2СО3
Модуль 2. Лекция
гидролиз протекает преимущественно по I ступени
Слайд 16
Гидролиз соли Cd(NO3)2
Cd(NO3)2 = Cd2+ + 2NO3−
Соль образована
кислотой. Гидролиз идет по катиону
Уравнение гидролиза по I ступени:
Cd2+ + HOH CdOH+ + H+
Cd(NO3)2 + H2O CdOHNO3 + HNO3
Уравнение гидролиза по II ступени:
CdOH+ + HOH Cd(OH)2 + H+
CdOHNO3 + H2O Cd(OH)2 + HNO3
Среда кислая, pH<7
Гидролиз идет преимущественно по I ступени
Модуль 2. Лекция 10. Гидролиз солей
Слайд 17
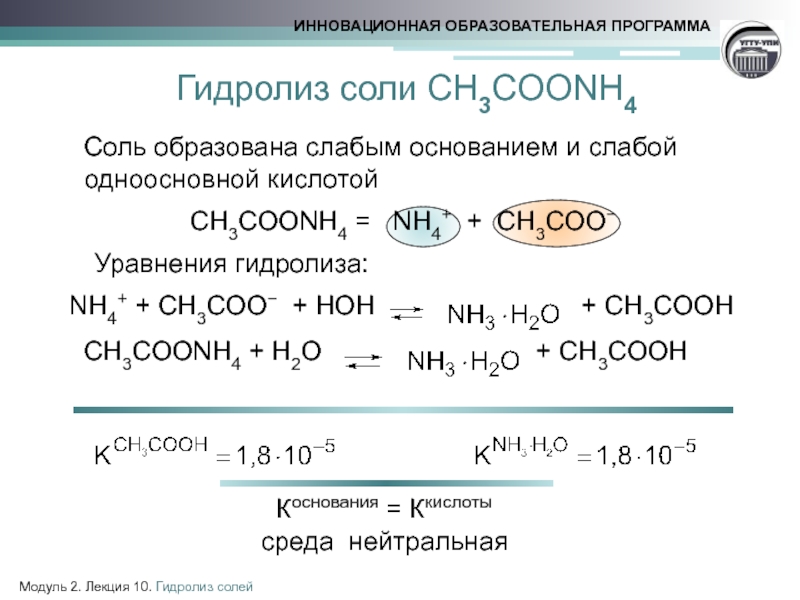
Гидролиз соли CH3COONH4
Модуль 2. Лекция 10. Гидролиз солей
Соль образована
CH3COONH4 = NH4+ + CH3COO−
Уравнения гидролиза:
NH4+ + CH3COO− + HOH + CH3COOH
CH3COONH4 + H2O + CH3COOH
Коснования = Ккислоты
среда нейтральная
Слайд 18Гидролиз солей слабых кислот и
слабых оснований
Модуль 2. Лекция 10. Гидролиз
Соли слабого основания и слабой многоосновной кислоты в растворе полностью гидролизованы
(NH4)2S + H2O NH4HS +
NH4HS + HOH + H2S
Соли слабых одноосновных кислот и слабых оснований при гидролизе образуют осадки основных солей:
Al(CH3COO)3 + HOH Al(OH)(CH3COO)2↓ + CH3COOH
Al(OH)(CH3COO)2 + HOH Al(OH)2CH3COO↓ + CH3COOH
Гидролиз некоторых солей, образованных летучими или малорастворимыми слабыми кислотами и слабыми основаниями протекает необратимо:
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
Такие соли в водных растворах не существуют
Слайд 19Необратимый совместный гидролиз
- с участием катионов Al3+, Fe3+, Cr3+, NH4+ и
проходит с образованием слабого основания и кислоты
2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3↓ + 3H2S↑+ 6NaCl
2Al3+ + 3S2− + 6H2O = 2Al(OH)3 + 3H2S
2NH4Cl + Na2SiO3 + (H2O) = 2NH3↑ + H2SiO3↓ + 2NaCl
2NH4+ + SiO32− + (H2O) = 2NH3 + H2SiO3
- солей слабых оснований типа M(OH)2 и солей угольной кислоты проходит с образованием основных солей и угольной кислоты
2CuSO4 + 2Na2CO3 + H2O = (CuOH)2CO3↓ + CO2↑ + 2Na2SO4
2Cu2+ + 2CO32− + H2O = (CuOH)2CO3 + CO2
Модуль 2. Лекция 10. Гидролиз солей
Слайд 20Заключение
Гидролиз соли ‑ процесс обменного взаимодействия ионов соли с молекулами воды
Гидролизу
слабыми кислотами и сильными основаниями
слабыми основаниями и сильными кислотами
слабыми кислотами и слабыми основаниями
Количественные характеристики гидролиза солей ‑ константа гидролиза и степень гидролиза
Чем слабее основание или кислота, образующие соль, тем больше степень гидролиза соли
Степень гидролиза увеличивается при повышении температуры и разбавлении раствора
Гидролиз солей, образованных многоосновными слабыми кислотами (летучими или малорастворимыми) и слабыми основаниями, протекает необратимо
Модуль 2. Лекция 10. Гидролиз солей
Слайд 21Рекомендуемая литература
Никольский А.Б., Суворов А.В. Химия. - СПб: Химиздат, 2001
Степин Б.Д.,
Карапетьянц М.Х. Общая и неорганическая химия. - М.: Химия, 2000
Угай Я.А. Общая и неорганическая химия. - М.: Высш. шк., 2007
Неорганическая химия. В 3 т. Т. 1: Физико-химические основы неорганической химии. Под ред. Ю. Д. Третьякова. - М.: Академия, 2004
Гаршин А.П. Неорганическая химия в схемах, рисунках, таблицах, формулах, химических реакциях. - СПб.: Лань, 2000
Модуль 2. Лекция 10. Гидролиз солей