- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Гидролиз солей презентация
Содержание
- 2. Гидролиз солей «Три пути ведут к
- 3. СОДЕРЖАНИЕ Определение Типы солей,участвующих в гидролизе Алгоритм
- 4. ГИДРОЛИЗ процесс разложения соли водой
- 5. Новые понятия Гидролиз – реакция обмена
- 6. Соль образована сильным основанием и сильной
- 7. ALCL3 AL3+ + 3CL- AL(OH)3 (слабое
- 8. О Б Р А Т И Т
- 9. Гидролизу НЕ подвергаются катионы сильных оснований
- 10. Гидролизу подвергаются катионы слабого основания, например:
- 11. Классификация солей Задание1. Разделите предложенные формулы солей
- 12. Алгоритм составления уравнений гидролиза Проверить растворимость
- 13. П Р И М Е Р Ы
- 14. CuCL2 Cu(OH)2-слабое основание HCL(сильная кислота)
- 15. Соли, образованные слабым основанием и сильной кислотой
- 16. 2Na++ S2- NaOH(сильное основание)
- 17. Соли, образованные сильным основанием и слабой кислотой
- 18. KCL HCL (сильная кислота) KOH (сильное
- 19. Соли, образованные сильным основанием и сильной кислотой
- 20. AL2S3 +6H2O=2AL(OH)3 +3H2S AL2S3 H2S (слабая
- 21. Соли, образованные слабым основанием и слабой
- 22. стирка мытье посуды умывание с мылом Роль
- 23. Для умывания, стирки, мытья посуды нужны синтетические
- 24. А ТЕПЕРЬ ВОПРОСЫ….
- 25. Нейтральную среду имеет водный раствор: 1)нитрита натрия
- 26. В водном растворе какой соли фенолфталеин окрашен
- 27. Одинаковую реакцию среды имеют растворы карбоната натрия
- 28. ФОРМУЛА СОЛИ А) NaNO3 Б)
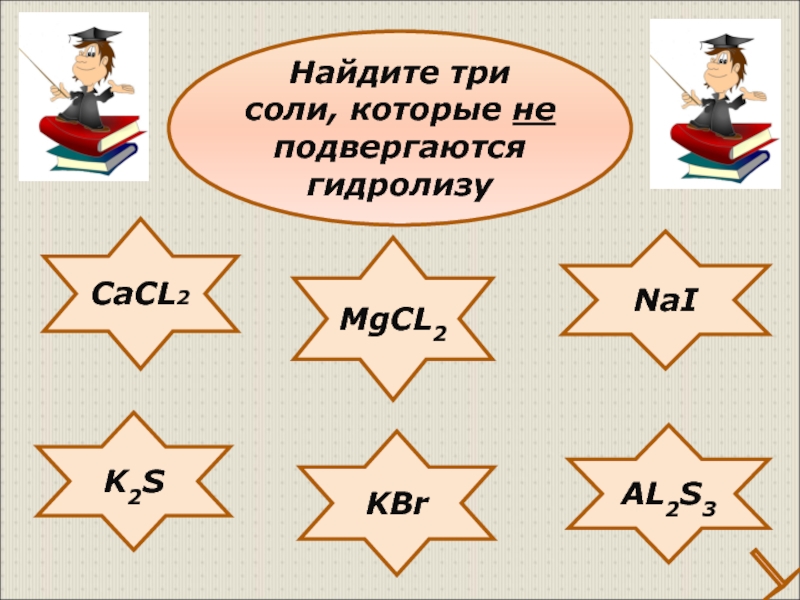
- 29. CaCL2 NaI K2S KBr AL2S3 MgCL2 Найдите три соли, которые не подвергаются гидролизу
- 30. Гидролиз нитрата алюминия идет по катиону Гидролиз
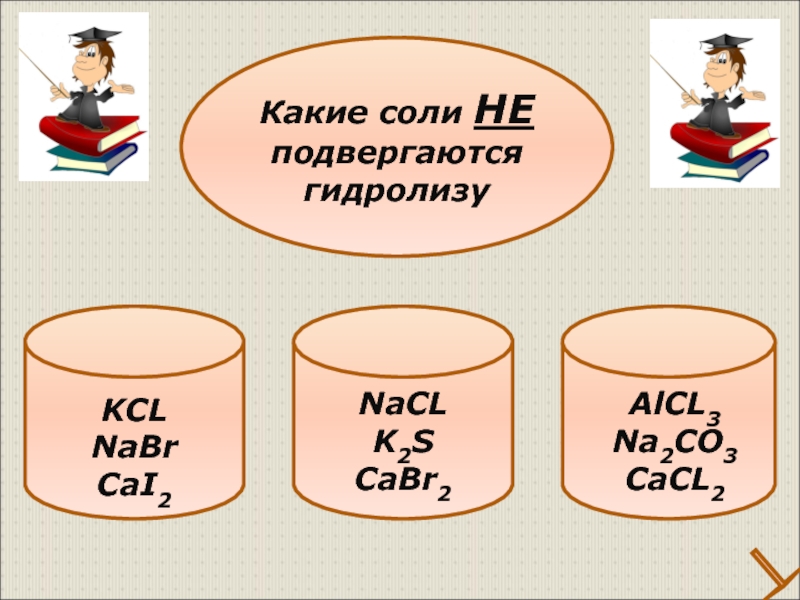
- 31. KCL NaBr
- 32. Какая соль подвергается гидролизу по
- 33. В Ы В О Д: Э Т
- 34. Домашнее задание § 1.12 Упр 7 стр 47
- 35. СПАСИБО ЗА УРОК!!!
Слайд 2Гидролиз
солей
«Три пути ведут к знанию: путь размышления – это путь
путь опыта – это путь самый горький»
Конфуций
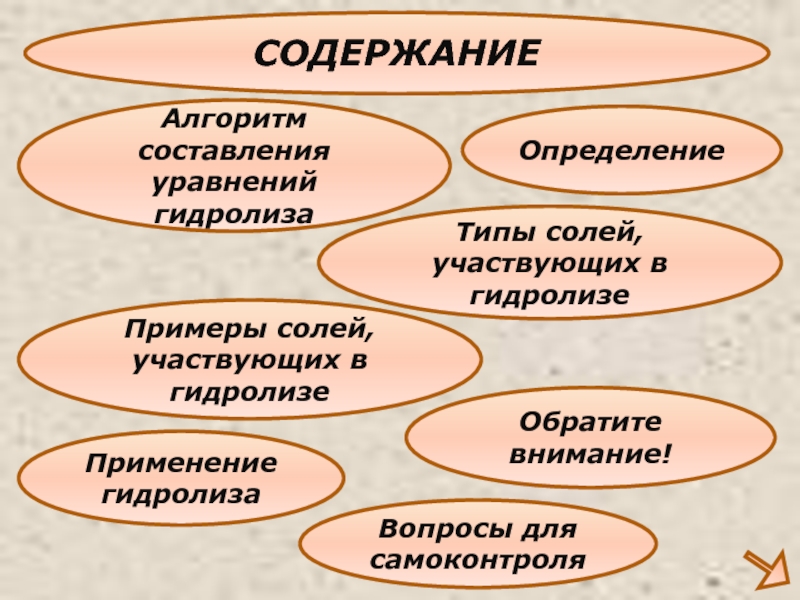
Слайд 3СОДЕРЖАНИЕ
Определение
Типы солей,участвующих в гидролизе
Алгоритм составления уравнений гидролиза
Применение гидролиза
Примеры солей,участвующих в гидролизе
Вопросы
Обратите внимание!
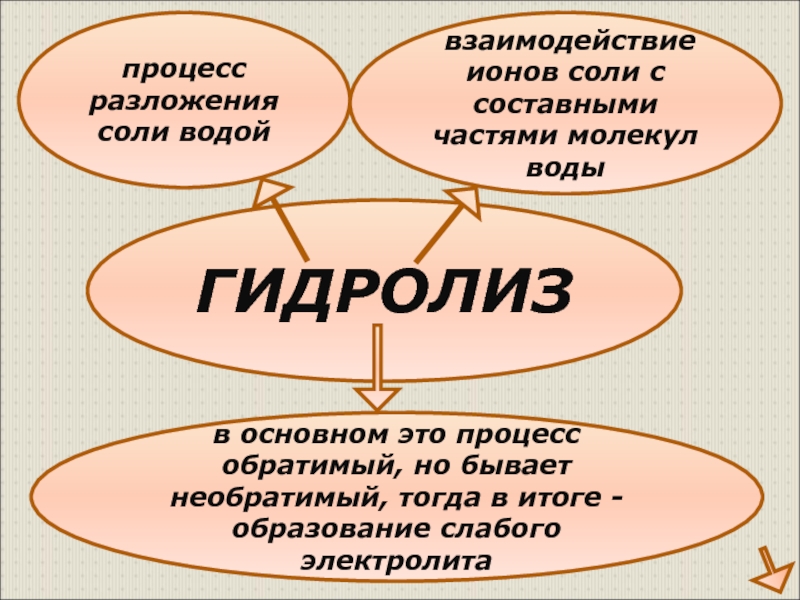
Слайд 4ГИДРОЛИЗ
процесс разложения соли водой
взаимодействие ионов соли с составными частями молекул
в основном это процесс обратимый, но бывает необратимый, тогда в итоге - образование слабого электролита
Слайд 5
Новые понятия
Гидролиз – реакция обмена между растворимыми солями и водой
Сильные основания
Слабые основания – нерастворимые основания, слабые электролиты (Cu(OH)2, Al(OH)3 и другие)
Сильные кислоты – кислоты, являющиеся сильными электролитами (H2SO4, HCl, HNO3, HBr, HI, HClO4 и другие)
Слабые кислота – кислоты, являющиеся слабыми электролитами (H2CO3, H2SO3, H2S, H2SiO3, H3PO4 и др)
Слайд 6Соль образована
сильным основанием и сильной кислотой
Соль образована
сильным основанием и
Соль образована
слабым основанием и сильной кислотой
Соль образована
слабым основанием и слабой кислотой
Классификация солей
участвующих в гидролизе:
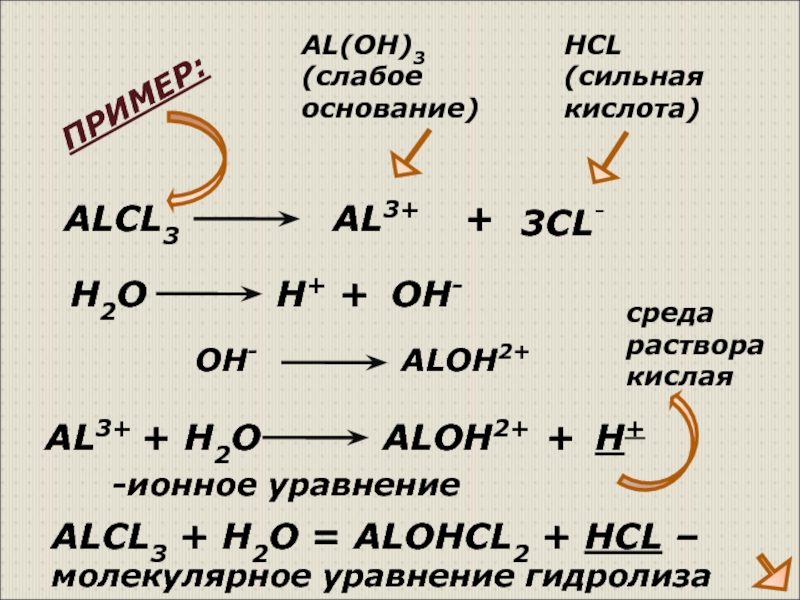
Слайд 7ALCL3
AL3+
+
3CL-
AL(OH)3
(слабое основание)
HCL
(сильная кислота)
AL3+ + H2O
H+ OH-
ALOH2+
H+
+
ALCL3 + H2O = ALOHCL2 + HCL – молекулярное уравнение гидролиза
ПРИМЕР:
среда
раствора
кислая
H2O
+
OH-
ALOH2+
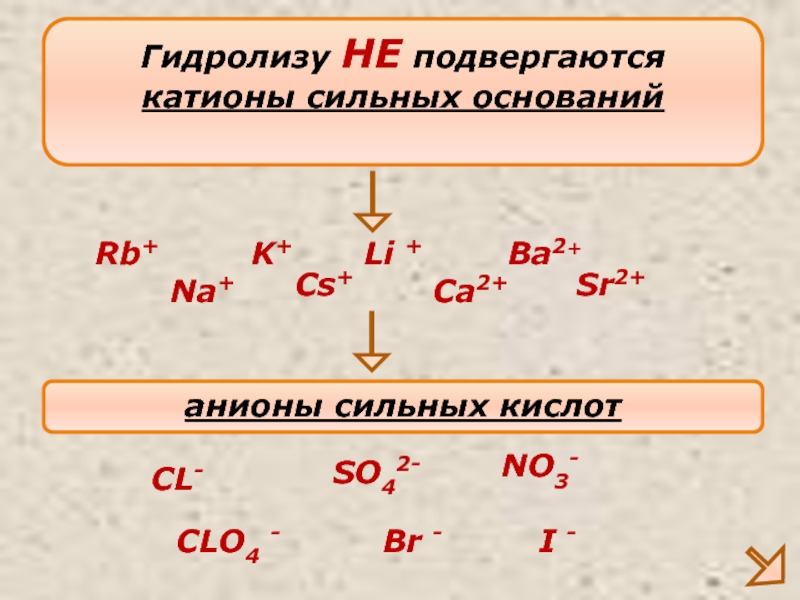
Слайд 9Гидролизу НЕ подвергаются
катионы сильных оснований
Na+
K+
Ca2+
анионы сильных кислот
CL-
SO42-
NO3-
Ba2+
Li +
Sr2+
Rb+
Cs+
CLO4 -
Br -
I -
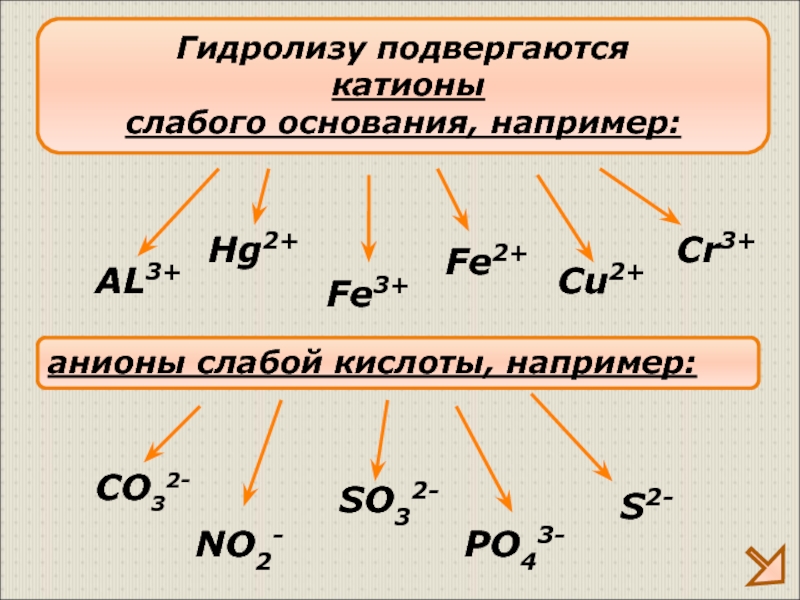
Слайд 10Гидролизу подвергаются
катионы
слабого основания, например:
AL3+
Fe3+
Cu2+
анионы слабой кислоты, например:
CO32-
SO32-
S2-
NO2-
PO43-
Cr3+
Fe2+
Hg2+
Слайд 11Классификация солей
Задание1.
Разделите предложенные формулы солей на четыре типа, объясните свой выбор:
BaCl2,
Слайд 12Алгоритм составления
уравнений гидролиза
Проверить растворимость соли.
Определить состав соли, т.е. указать, каким
Записать диссоциацию соли и подчеркнуть ион слабого электролита
Записать уравнение взаимодействия иона слабого электролита с водой
Определить среду раствора соли
Записать молекулярное уравнение
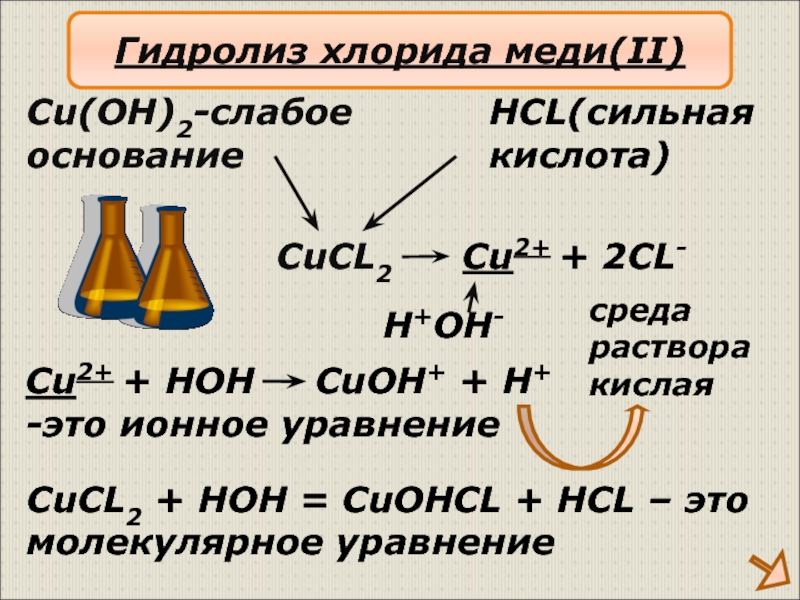
Слайд 14CuCL2
Cu(OH)2-слабое
основание
HCL(сильная
кислота)
Cu2+ + 2CL-
H+OH-
Cu2+ + HOH CuOH+
-это ионное уравнение
CuCL2 + HOH = CuOHCL + HCL – это
молекулярное уравнение
Гидролиз хлорида меди(II)
среда
раствора
кислая
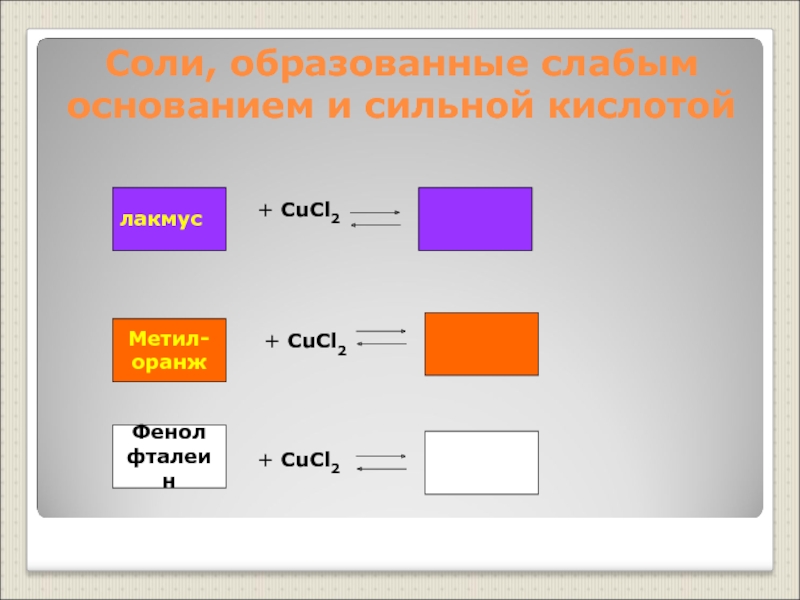
Слайд 15Соли, образованные слабым основанием и сильной кислотой
Фенол
фталеин
+ CuCl2
+ CuCl2
+ CuCl2
лакмус
Метил-
оранж
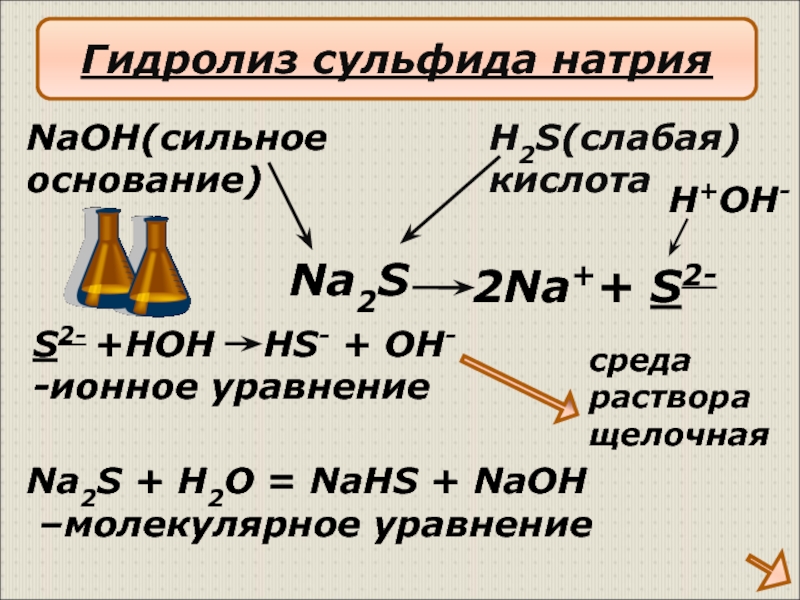
Слайд 16 2Na++ S2-
NaOH(сильное
основание)
H2S(слабая)
кислота
S2- +HOH HS- + OH-
-ионное
Na2S + H2O = NaHS + NaOH
–молекулярное уравнение
Na2S
H+OH-
среда
раствора
щелочная
Гидролиз сульфида натрия
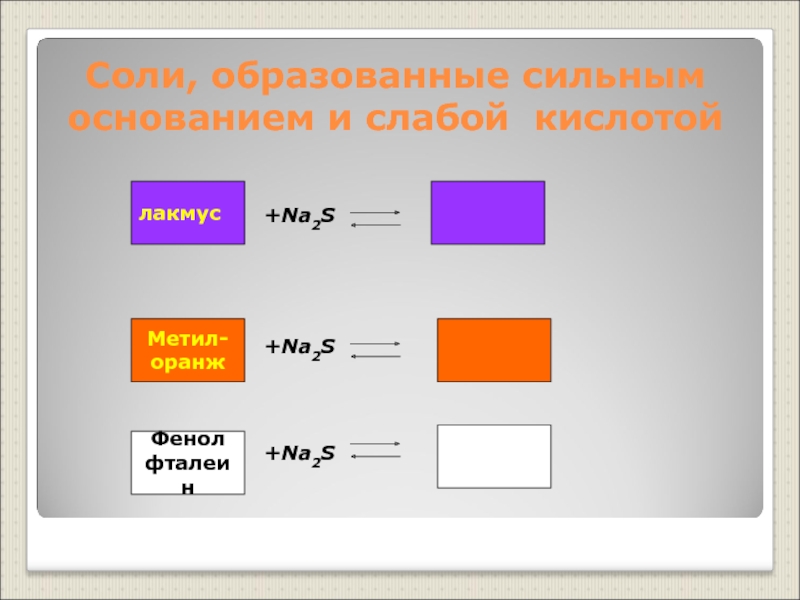
Слайд 17Соли, образованные сильным основанием и слабой кислотой
+Na2S
+Na2S
+Na2S
лакмус
Метил-
оранж
Фенол
фталеин
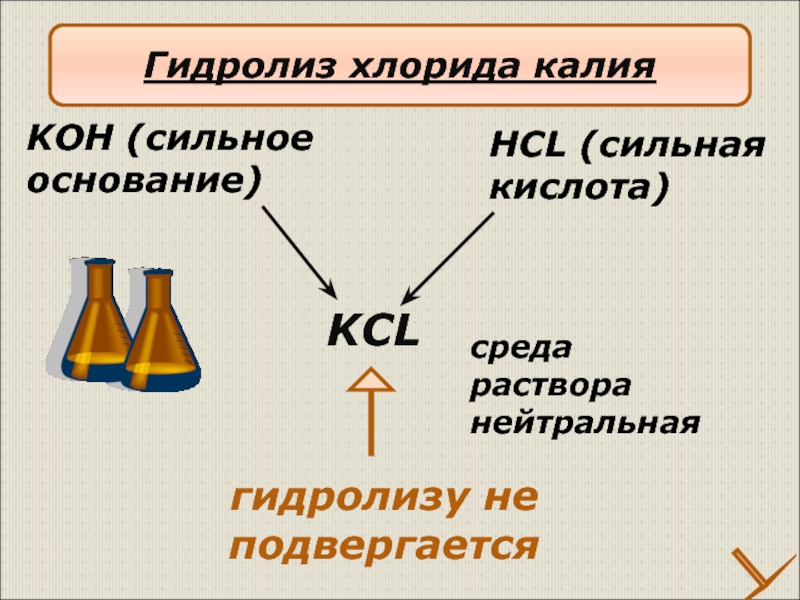
Слайд 18KCL
HCL (сильная
кислота)
KOH (сильное
основание)
гидролизу не подвергается
среда
раствора
нейтральная
Гидролиз хлорида калия
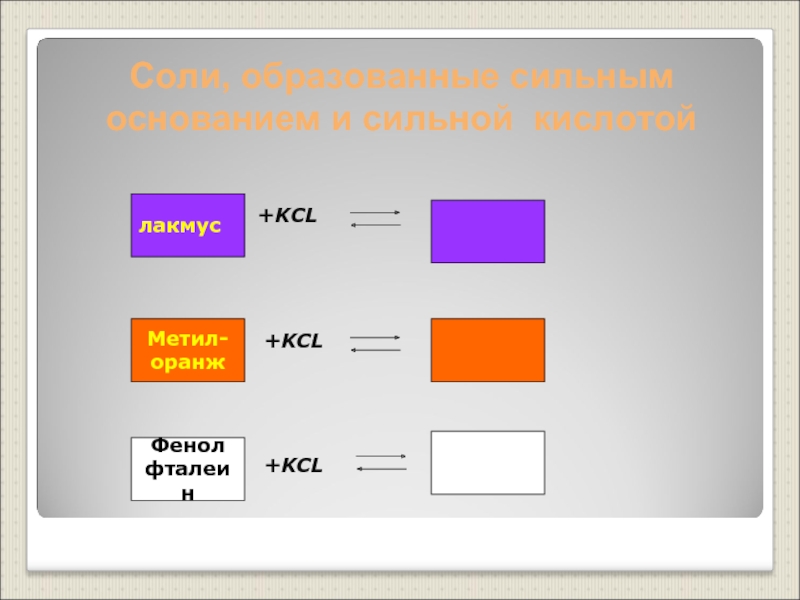
Слайд 19Соли, образованные сильным основанием и сильной кислотой
+KCL
+KCL
+KCL
лакмус
Метил-
оранж
Фенол
фталеин
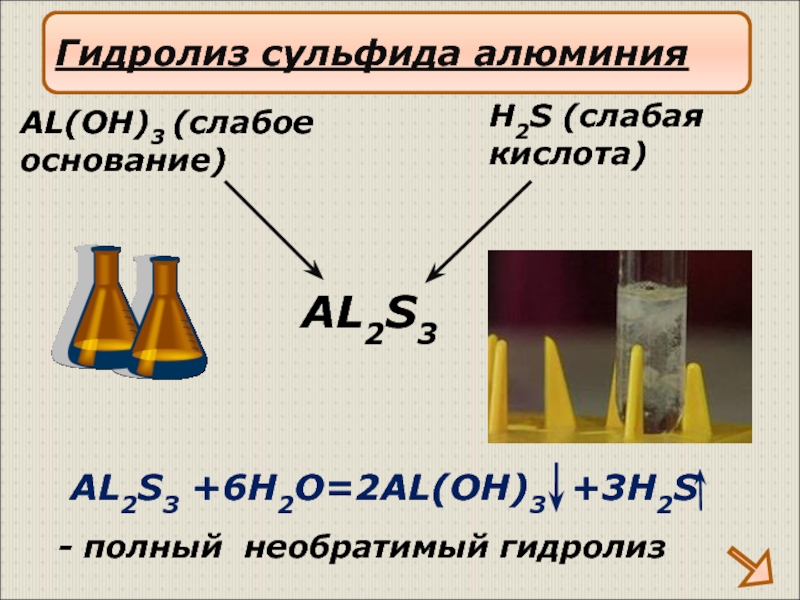
Слайд 20AL2S3 +6H2O=2AL(OH)3 +3H2S
AL2S3
H2S (слабая
кислота)
AL(OH)3 (слабое
основание)
Гидролиз сульфида алюминия
- полный необратимый гидролиз
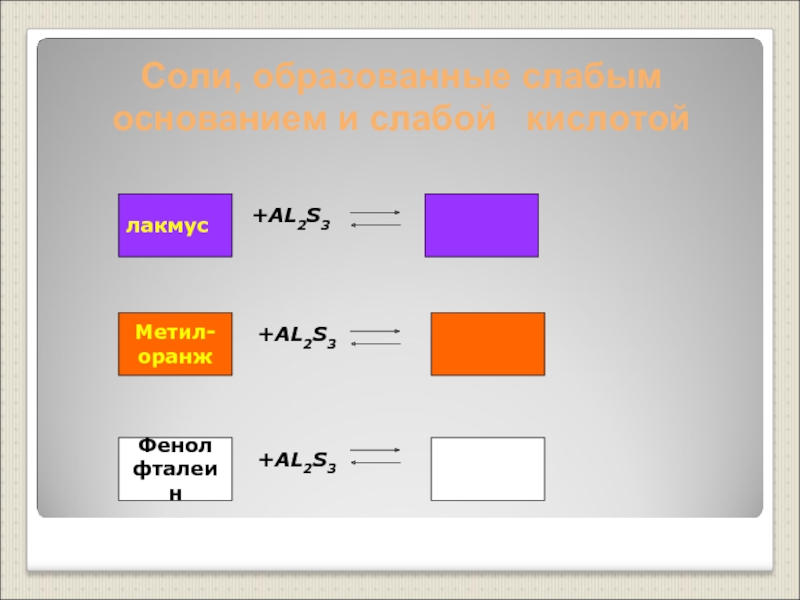
Слайд 21Соли, образованные слабым основанием и слабой кислотой
+AL2S3
+AL2S3
+AL2S3
лакмус
Метил-
оранж
Фенол
фталеин
Слайд 23Для умывания, стирки, мытья посуды нужны синтетические моющие средства, в основе
При их попадании в воду идет гидролиз с созданием щелочной среды (ОН-), в которой и удаляется грязь.
Загрязнения представляют собой смесь твердых частиц (пыли, сажи, соли, жировых, а также потовых пленок, прилипших к поверхности тканей и других предметов).
Чтобы удалить загрязнения необходимо:
отделить загрязнение от очищаемой поверхности;
перевести грязевые частицы в моющий раствор;
удержать их в моющем растворе и устранить возможность повторного осаждения на очищаемую поверхность.
Слайд 25Нейтральную среду имеет водный раствор:
1)нитрита натрия
2)силиката калия
3)хлорида железа (II)
4)нитрата калия
Найди верный
Слайд 26 В водном растворе какой соли фенолфталеин окрашен в малиновый цвет?
1)CaCl2
2)KNO3
3)FeSO4
4)Na2CO3
Найди верный
Слайд 27Одинаковую реакцию среды имеют растворы карбоната натрия и
1) нитрата натрия
2)
3) сульфата калия
4) хлорида алюминия
Найди верный ответ
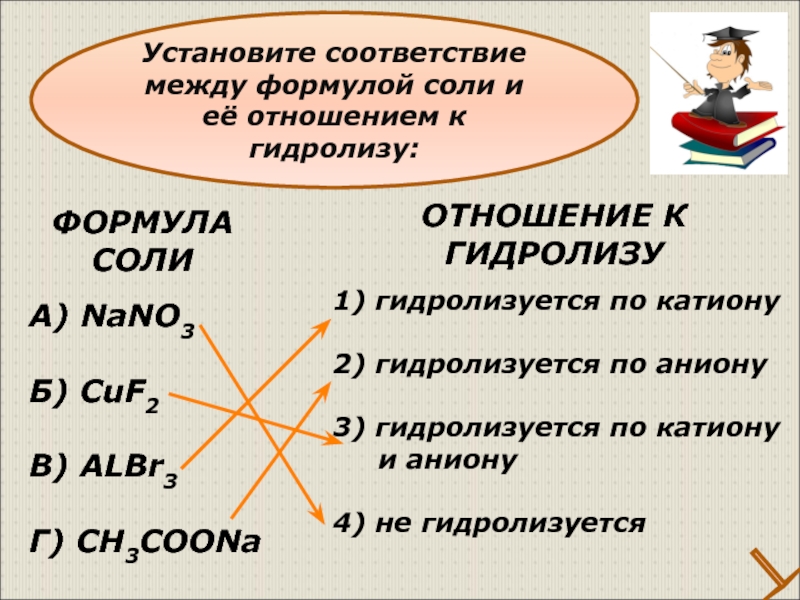
Слайд 28ФОРМУЛА
СОЛИ
А) NaNO3
Б) CuF2
В) ALBr3
Г) CH3COONa
1) гидролизуется по катиону
2) гидролизуется по
3) гидролизуется по катиону
и аниону
4) не гидролизуется
ОТНОШЕНИЕ К
ГИДРОЛИЗУ
Установите соответствие между формулой соли и её отношением к гидролизу:
Слайд 30Гидролиз нитрата алюминия идет по катиону
Гидролиз сульфата бария идет по аниону
Гидролиз
Оксиды подвергаются гидролизу
Хлорид бария не подвергается гидролизу
В растворе сульфата меди(ll) кислая среда
да
нет
да
нет
да
да
Выберите истинные и ложные утверждения
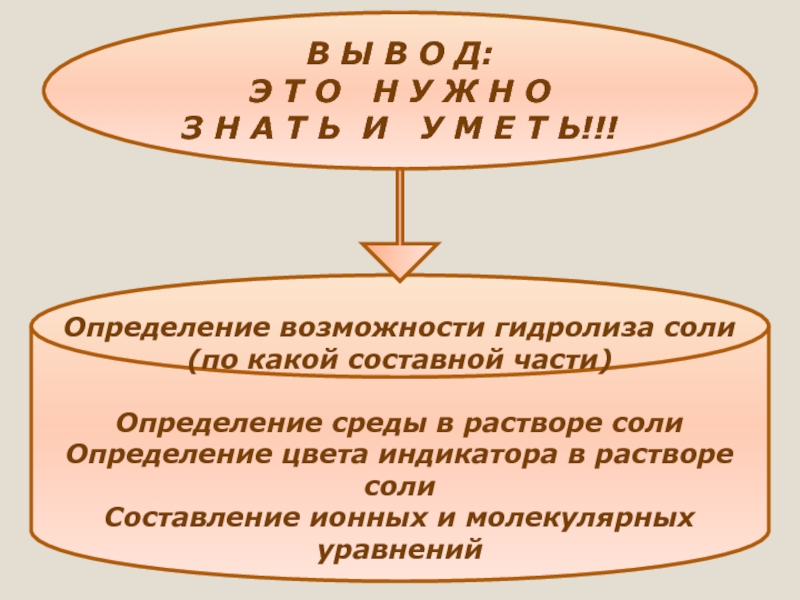
Слайд 33В Ы В О Д:
Э Т О Н У Ж
З Н А Т Ь И У М Е Т Ь!!!
Определение возможности гидролиза соли (по какой составной части)
Определение среды в растворе соли
Определение цвета индикатора в растворе соли
Составление ионных и молекулярных уравнений