- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Гидроксиды. Основания: способы получения презентация
Содержание
- 1. Гидроксиды. Основания: способы получения
- 2. Цель урока: Углубить знания о важнейших классах веществ неорганической химии
- 3. Формулы только оксидов приведены в ряду: H2SO3,
- 4. Не характеризует свойство основных оксидов: CaO +
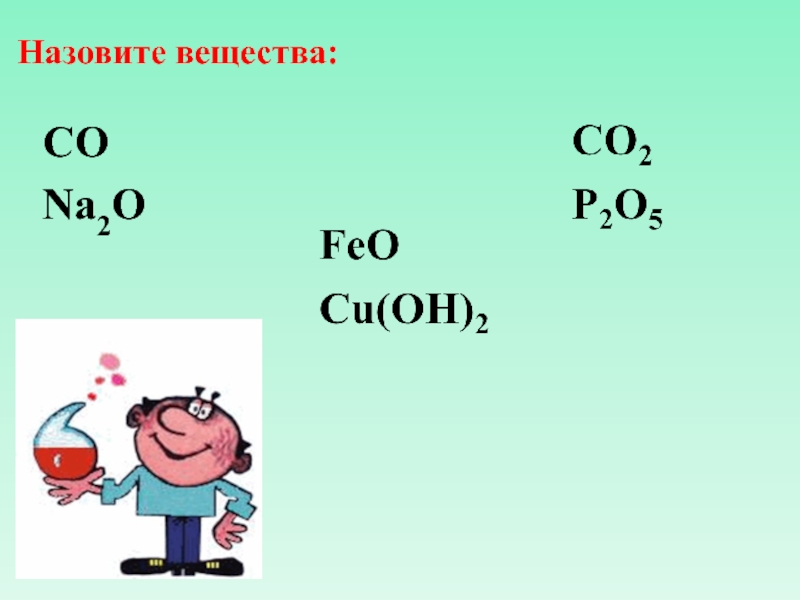
- 5. Назовите вещества: CO Na2O
- 6. Гидроксиды. Основания: способы получения.
- 7. Гидроксиды. Основания: способы получения Что надо узнать: Состав и названия Классификация Способы получения
- 8. K2O + H2O → 2KOH
- 9. K2O + H2O → 2KOH Гидроксиды –
- 10. Гидроксиды. Основания: способы получения.
- 11. Основания - это гидроксиды металлов IА и IIА (кроме
- 12. Работа с учебником: Стр 137 «Классификация гидроксидов»
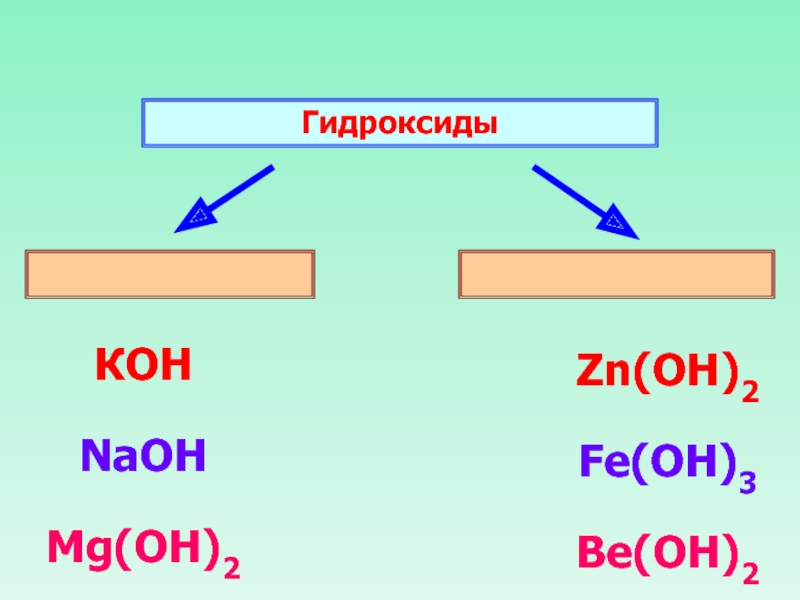
- 14. Гидроксиды КОН NaOH Mg(OH)2 Zn(ОН)2 Fe(OH)3 Be(OH)2
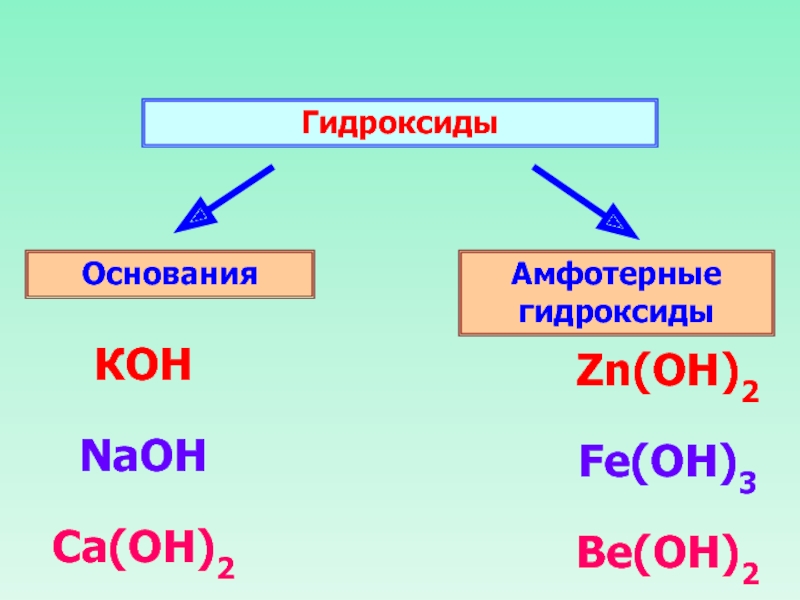
- 15. Гидроксиды Основания Амфотерные гидроксиды КОН
- 16. Основания Растворимые в воде
- 17. NaOH – гидроксид натрия, едкий натр, каустическая сода
- 18. Получение оснований Щелочи 2Na +
- 19. Нерастворимые в воде основания Косвенный
- 20. Гидроксиды. Основания: способы получения Что надо узнать: Состав и названия Классификация Способы получения
- 21. Домашнее задание: §41 По задачнику
- 23. Химические свойства оснований Щелочи изменяют окраску индикаторов
- 24. Фенолфталеиновый в щелочах малиновый
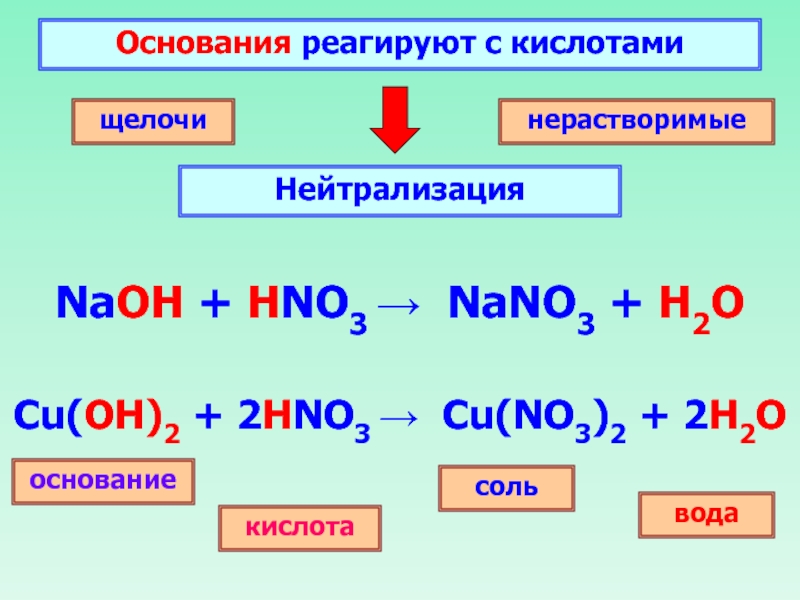
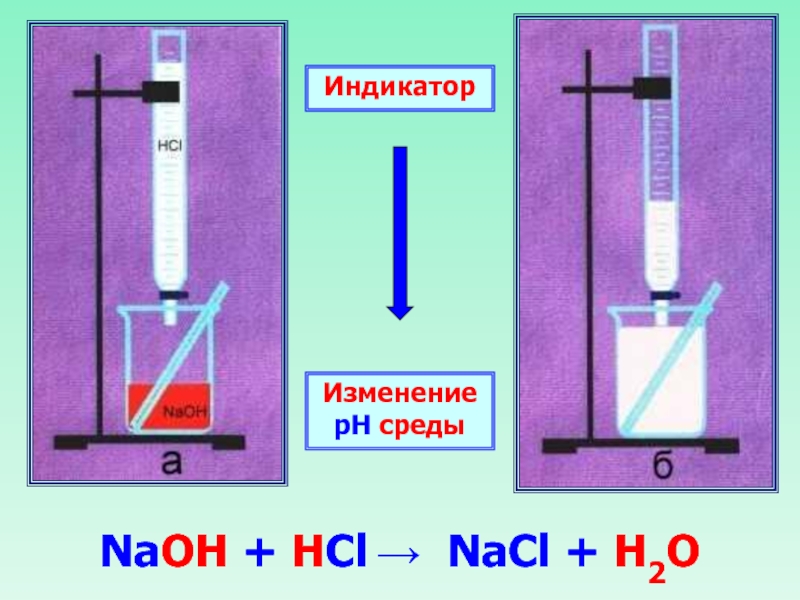
- 25. Основания реагируют с кислотами Нейтрализация щелочи нерастворимые основание соль кислота вода
- 27. Индикатор Изменение рН среды
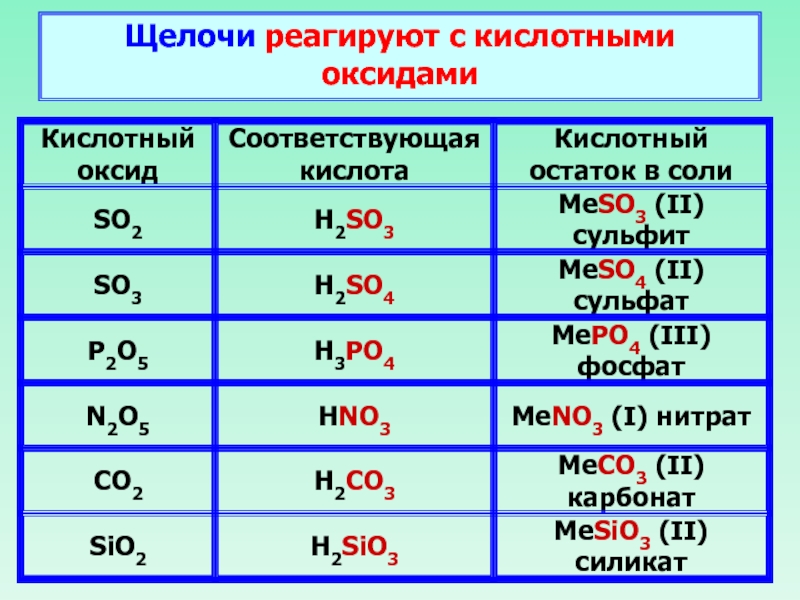
- 28. Щелочи реагируют с кислотными оксидами
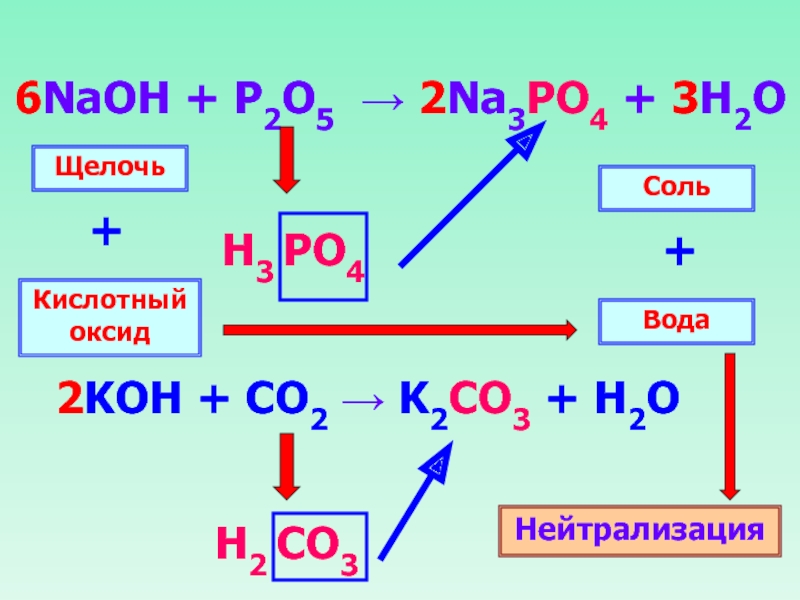
- 29. 6NaOH + P2O5 → 2Na3PO4 + 3H2O
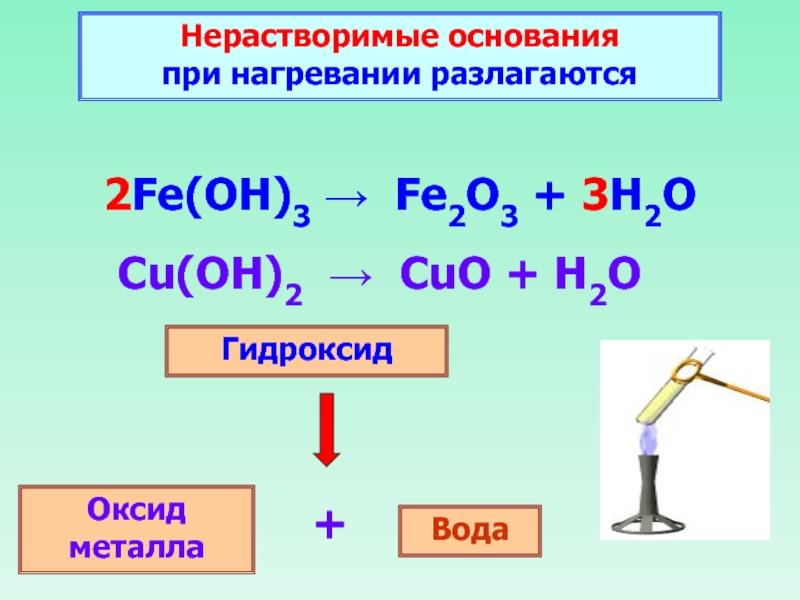
- 30. Нерастворимые основания
- 31. Cu(OH)2 –t°→ CuO + H2O ––
- 33. Определение оснований Ме(ОН)n КОН Ca(ОН)2
- 34. Сильные и слабые основания
Слайд 3Формулы только оксидов приведены в ряду:
H2SO3, BeO, CuCl2
Na2CO3, Na2O, Cl2O7
CO2, Li2O,
KOH, K2O, BaO
Слайд 4Не характеризует свойство основных оксидов:
CaO + H2O → Ca(OH)2
SO3 + Na2O
K2O + 2HCl → 2KCl + H2O
Zn(OH)2 → ZnO + H2O
Слайд 7
Гидроксиды. Основания: способы получения
Что надо узнать:
Состав и названия
Классификация
Способы получения
Слайд 9K2O + H2O → 2KOH
Гидроксиды – это сложные вещества в состав
!!! Число гидроксогрупп в формуле гидроксида соответствует валентности металла
Слайд 11Основания - это гидроксиды металлов IА и IIА (кроме Be), а также металлов
Например: NaOH, LiOH, Mg(OH)2, Ca(OH)2, Cr(OH)2, Mn(OH)2.
Слайд 12Работа с учебником:
Стр 137 «Классификация гидроксидов»
Стр 139 «Физические свойства оснований»
?
? Физические свойства оснований?
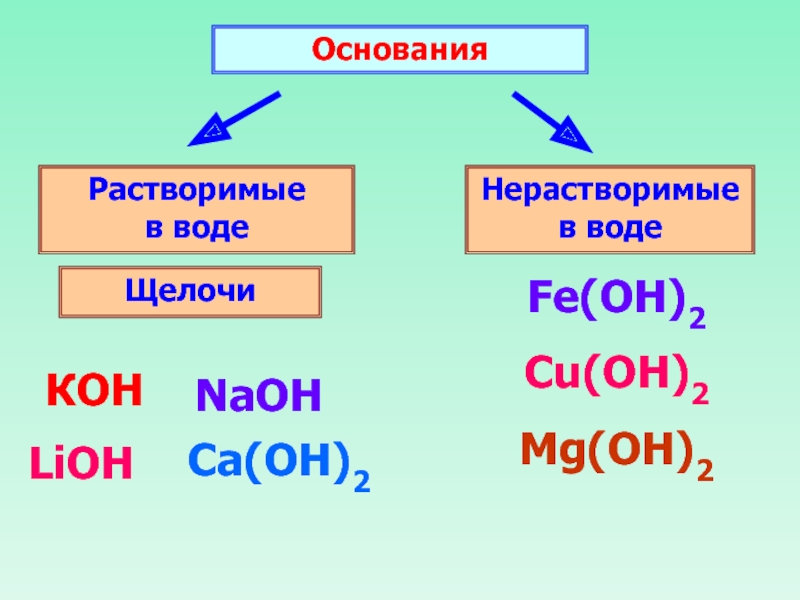
Слайд 16Основания
Растворимые в воде
Нерастворимые в воде
Щелочи
КОН
NaOH
Ca(ОН)2
LiOH
Fe(OH)2
Cu(OH)2
Mg(ОН)2
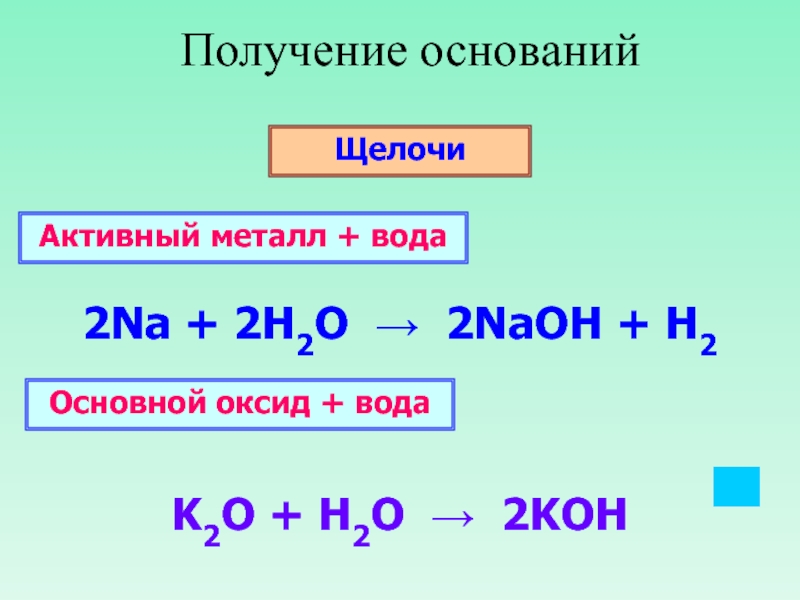
Слайд 18Получение оснований
Щелочи
2Na + 2H2O → 2NaOH + H2
K2O + H2O
Активный металл + вода
Основной оксид + вода
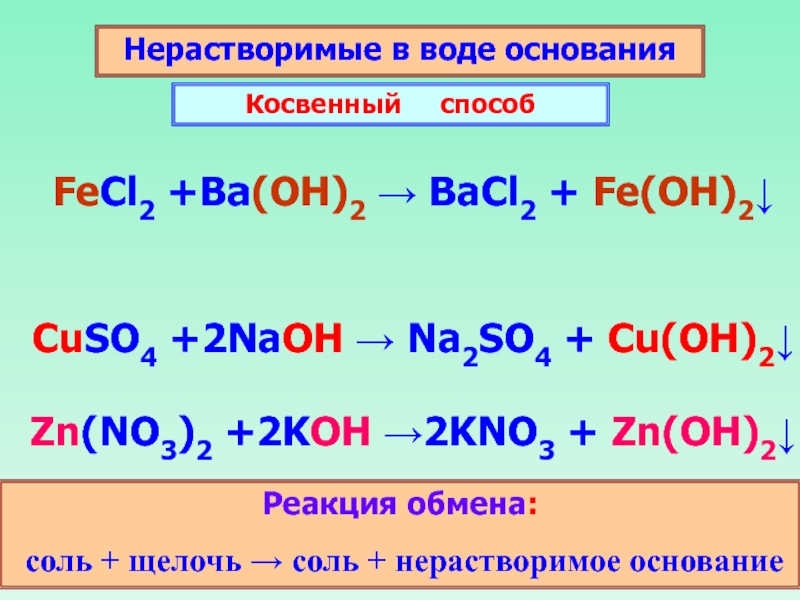
Слайд 19Нерастворимые в воде основания
Косвенный способ
CuSO4 +2NaOH → Na2SO4 +
Zn(NO3)2 +2KOH →2KNO3 + Zn(OH)2↓
FeCl2 +Ba(OH)2 → BaCl2 + Fe(OH)2↓
Реакция обмена:
соль + щелочь → соль + нерастворимое основание
Слайд 20
Гидроксиды. Основания: способы получения
Что надо узнать:
Состав и названия
Классификация
Способы получения
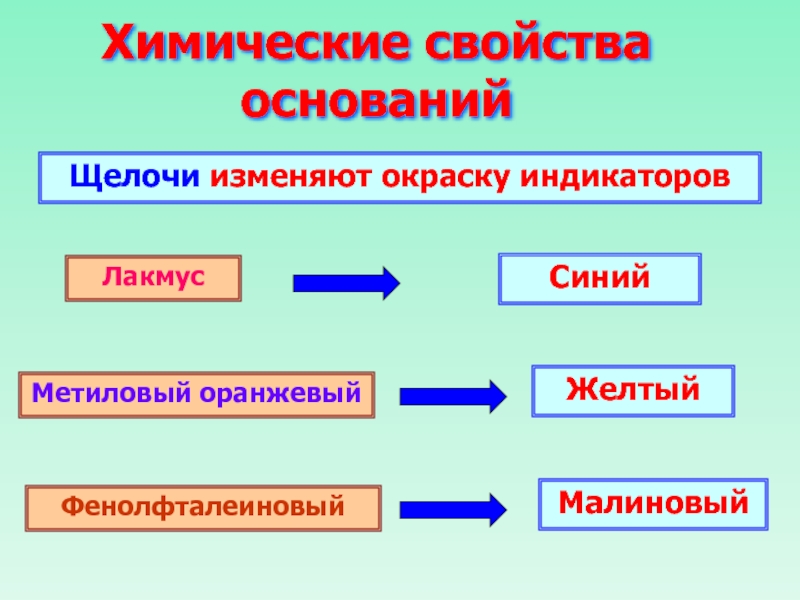
Слайд 23Химические свойства оснований
Щелочи изменяют окраску индикаторов
Лакмус
Метиловый оранжевый
Фенолфталеиновый
Синий
Желтый
Малиновый
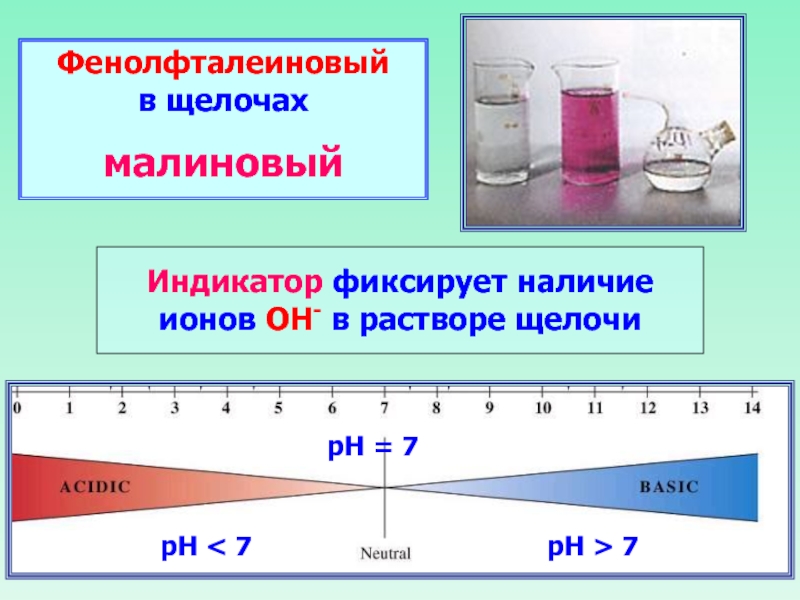
Слайд 24Фенолфталеиновый в щелочах
малиновый
Индикатор фиксирует наличие ионов ОН- в
рН < 7
рН = 7
рН > 7
Слайд 30Нерастворимые основания
2Fe(OH)3 → Fe2O3 + 3H2O
Гидроксид
Оксид металла
Вода
+
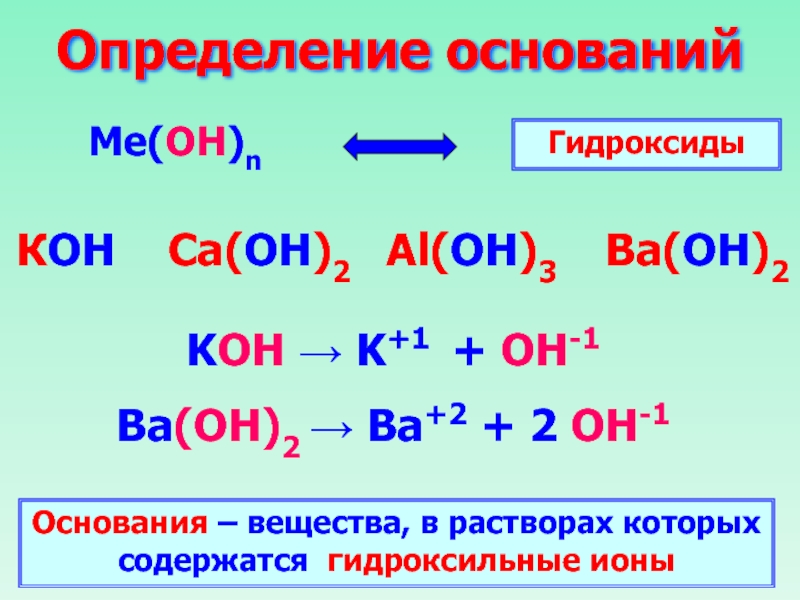
Слайд 33Определение оснований
Ме(ОН)n
КОН Ca(ОН)2 Al(ОН)3 Ba(ОН)2
Гидроксиды
KOH →
Ba(ОН)2 → Ba+2 + 2 OH-1
Основания – вещества, в растворах которых содержатся гидроксильные ионы