- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Галогены. Положение галогенов в ПСХЭ презентация
Содержание
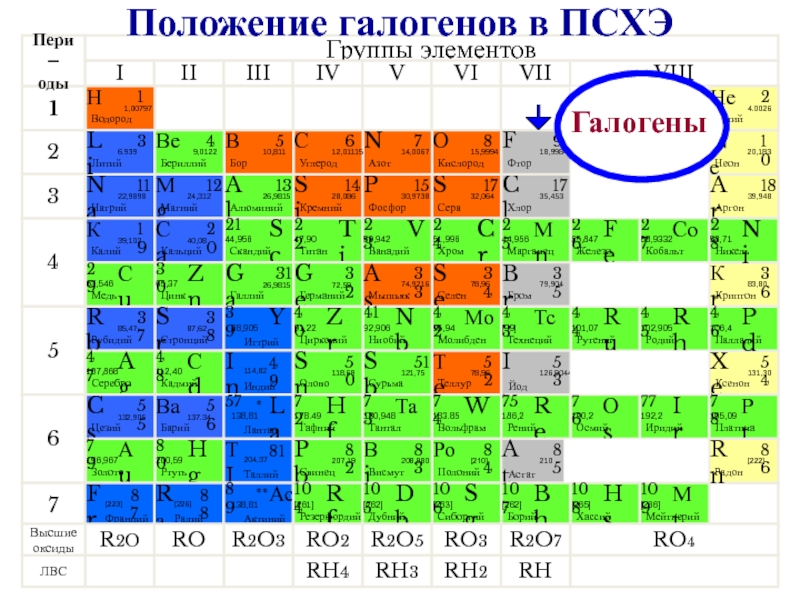
- 2. Галогены Положение галогенов в ПСХЭ
- 3. К элементам VII группы, главной подгруппы относятся
- 4. В свободном виде не встречаются
- 5. Галит NaCl
- 7. Нахождение галогенов в природе Апатит 3Ca(PO4 ) 2*CaF2
- 8. AgI (йодаргирит)- примесь к другим минералам
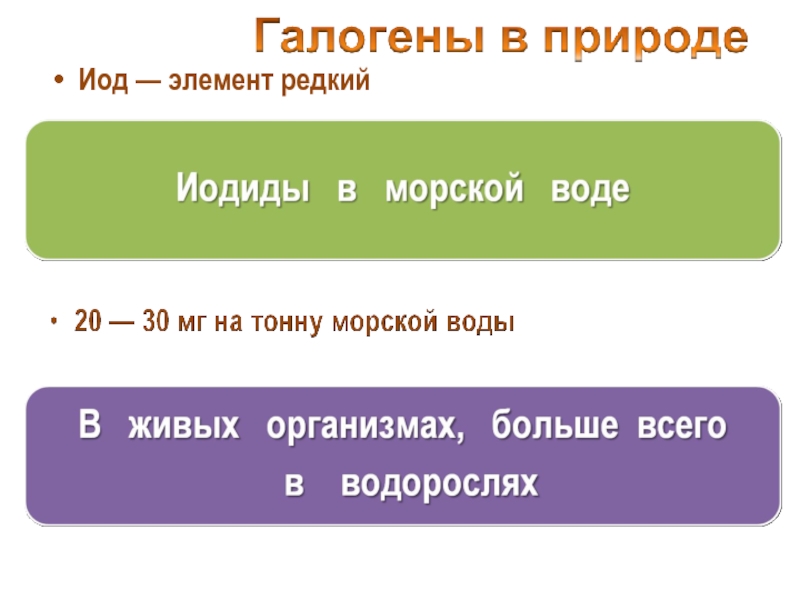
- 9. Иод — элемент редкий
- 10. 5 кг на тонну высушенной морской капусты (ламинарии)
- 13. Галогены
- 14. Название "фтор" (от греческого phthoros - разрушение,
- 15. Хлор был открыт шведским химиком Карлом Шееле
- 16. от греч. bromos – зловоние единственный неметалл,
- 17. от греч. iodes—имеющий фиалковый цвет в парообразное
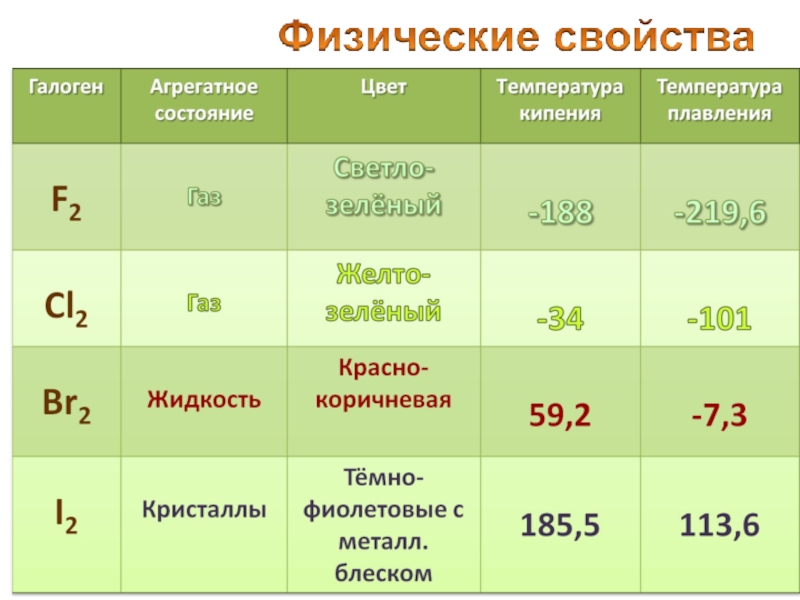
- 18. Превращение в пары, минуя жидкое состояние
- 19. Молекулы галогенов состоят из двух атомов. Связь – ковалентная неполярная
- 20. Галогены – типичные окислители Hal2 +
- 21. Сравнение окислительных свойств ←е- ←е- ←е- ←е- ←е-
- 22. Восстановительные свойства ионов Ионы галогенов являются
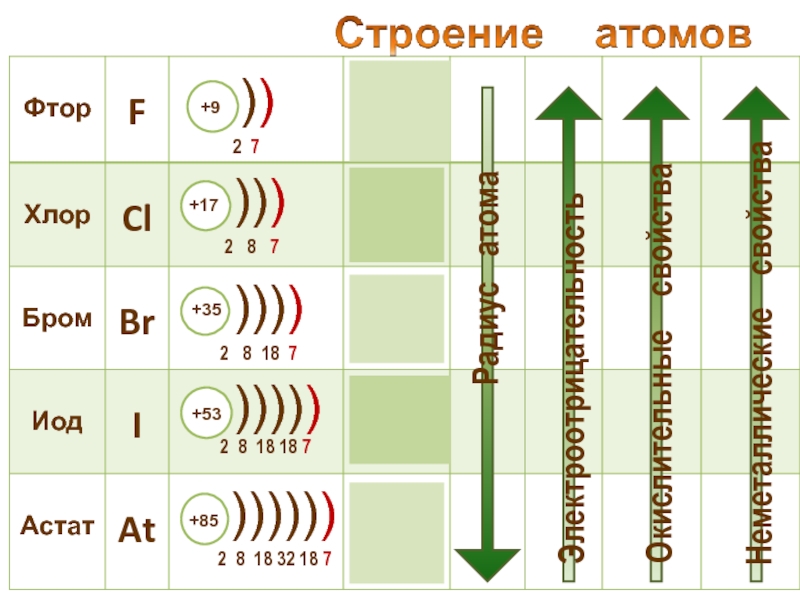
- 24. Строение - свойства Внешняя электронная
- 25. Строение - свойства Внешняя электронная
- 26. 1. Взаимодействие с металлами
- 27. 3. Взаимодействие с водой
- 28. В промышленности: электролиз расплава или раствора
- 29. Определение галогенид-ионов Определить в какой пробирке находится раствор хлорида, бромида, иодида, фторида ?
- 30. AgNO3 AgCl AgBr AgI AgF Уравнения реакций:
- 31. Хлор хвалился: «Нет мне равных! Галоген я
- 32. производство соляной кислоты
- 33. - 5 % спиртовой раствор йода
Слайд 3К элементам VII группы, главной подгруппы относятся
Общее название - галогены (греч. «солеобразующие») - большинство их соединений с металлами представляют собой типичные соли (KCl, NaCl и т.д.).
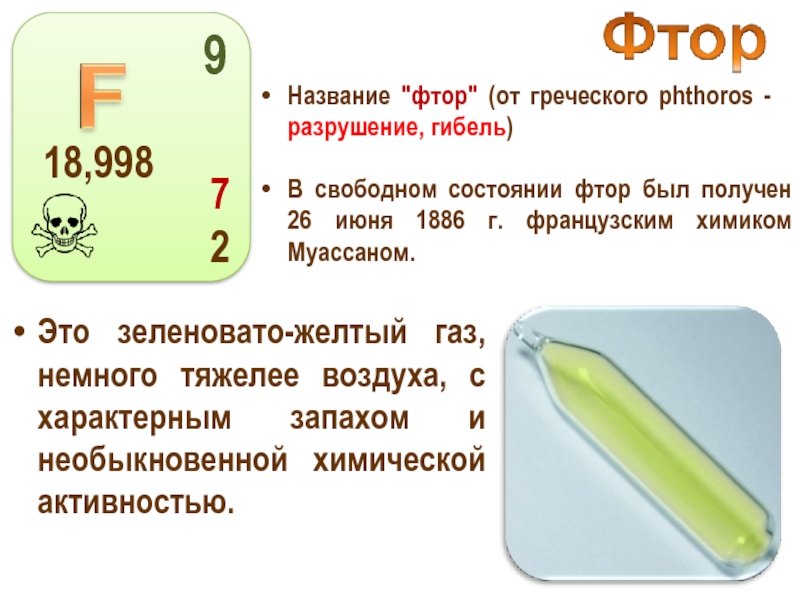
Слайд 14Название "фтор" (от греческого phthoros - разрушение, гибель)
Это зеленовато-желтый газ, немного
В свободном состоянии фтор был получен 26 июня 1886 г. французским химиком Муассаном.
Слайд 15Хлор был открыт шведским химиком Карлом Шееле в 1774 г.
Газ
в 2,5 раза тяжелее воздуха
в 1810 году сэр Гемфри Дэви назвал газ "хлорином"(Chlorine), от греческого "зелёный".
Этот термин используется в английском языке,
а в других языках закрепилось название "хлор".
Слайд 16от греч. bromos – зловоние
единственный неметалл, жидкий при комнатной температуре
79Вr (50,56%)
пары брома имеют желто-бурый цвет
при температуре –7,25° C бром затвердевает, превращаясь в красно-коричневые игольчатые кристаллы со слабым металлическим блеском
тяжелая красно-бурая жидкость с неприятным запахом
Слайд 17от греч. iodes—имеющий фиалковый цвет
в парообразное состояние переходит при комнатной t°,
пары -фиолетового цвета
Иод был открыт в 1811 г. Куртуа в золе морских водорослей, а с 1815 г. Гей-Люссак стал рассматривать его как химический элемент
Известны 37 изотопов иода с массовыми числами
от 108 до 144.
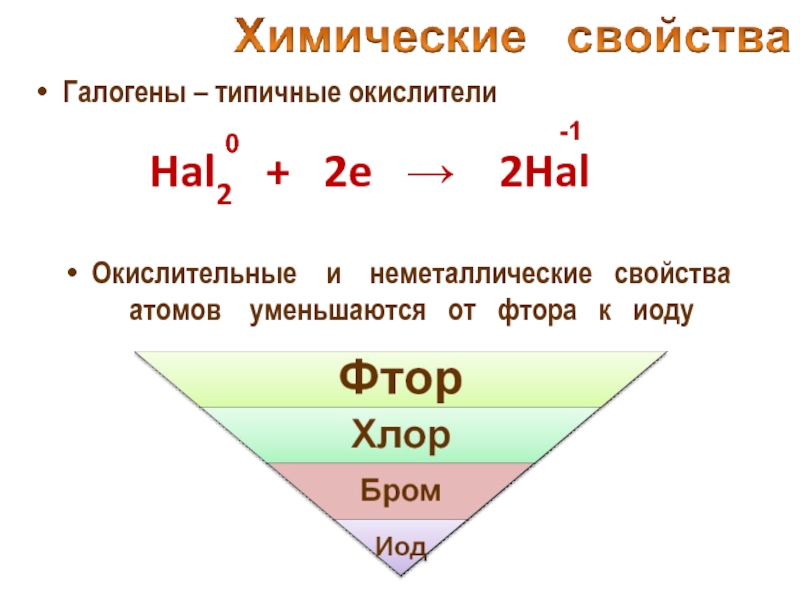
Слайд 20Галогены – типичные окислители
Hal2 + 2e →
-1
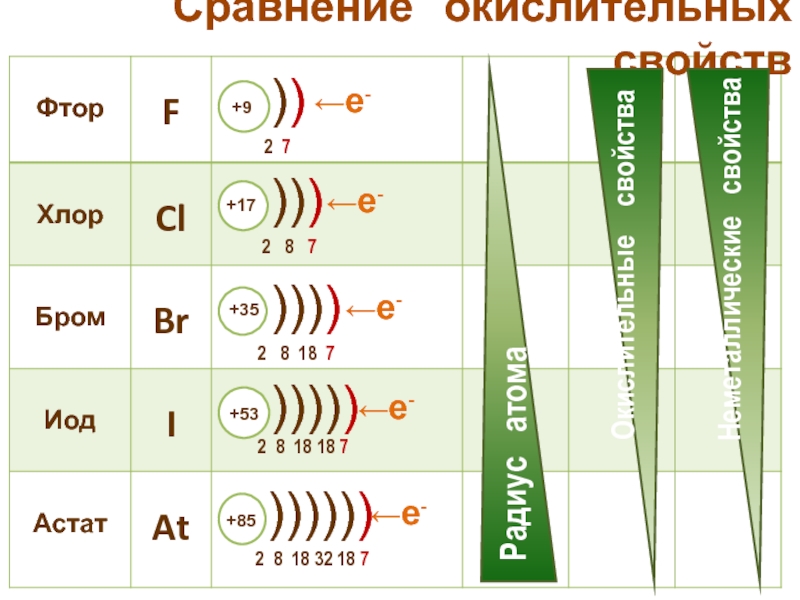
Окислительные и неметаллические свойства атомов уменьшаются от фтора к иоду
0
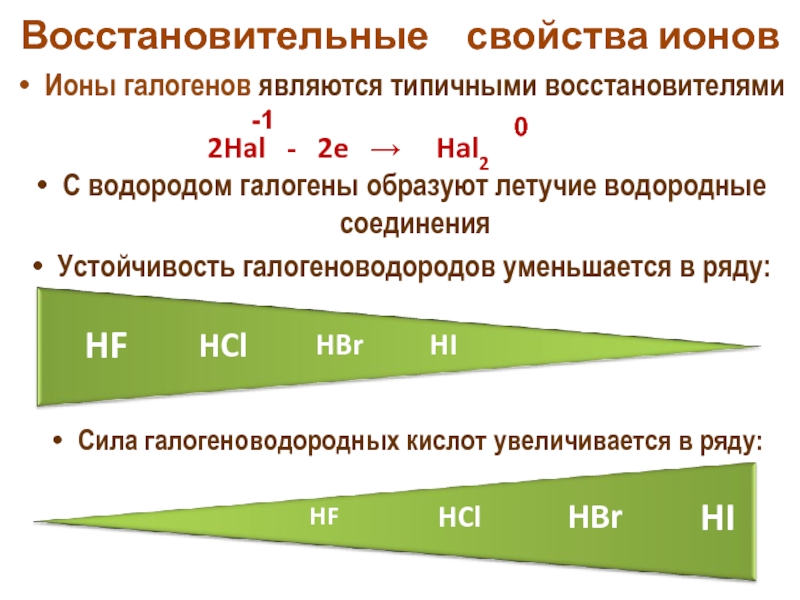
Слайд 22Восстановительные свойства ионов
Ионы галогенов являются типичными восстановителями
С водородом галогены образуют
Устойчивость галогеноводородов уменьшается в ряду:
Cила галогеноводородных кислот увеличивается в ряду:
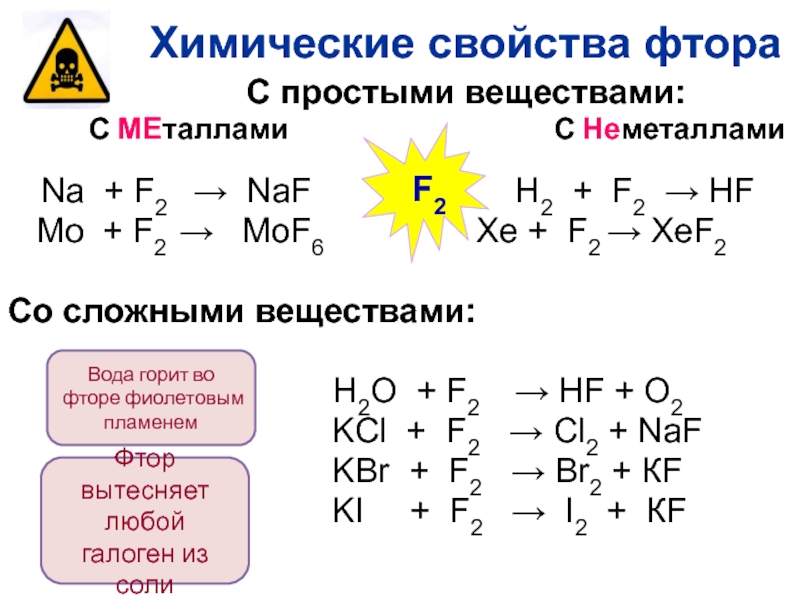
Слайд 23
С МЕталлами С Неметаллами
Na + F2 → NaF H2 + F2 → HF
Mo + F2 → MoF6 Xe + F2 → XeF2
Со сложными веществами:
H2O + F2 → HF + O2
KCl + F2 → Cl2 + NaF
KBr + F2 → Br2 + КF
KI + F2 → I2 + КF
Химические свойства фтора
Фтор вытесняет любой галоген из соли
Вода горит во фторе фиолетовым пламенем
F2
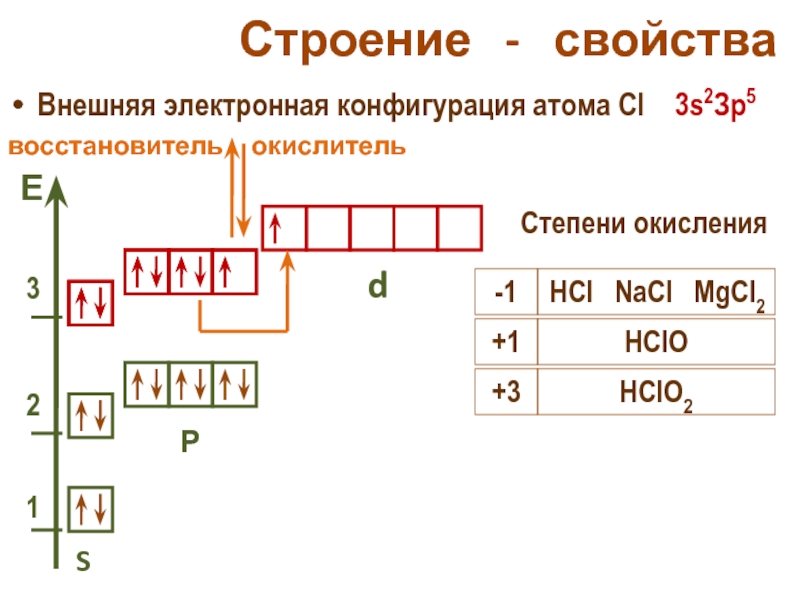
Слайд 24Строение - свойства
Внешняя электронная конфигурация атома Cl 3s2Зр5
S
Р
d
окислитель
-1
HCl NaCl MgCl2
+1
HClO
+3
HClO2
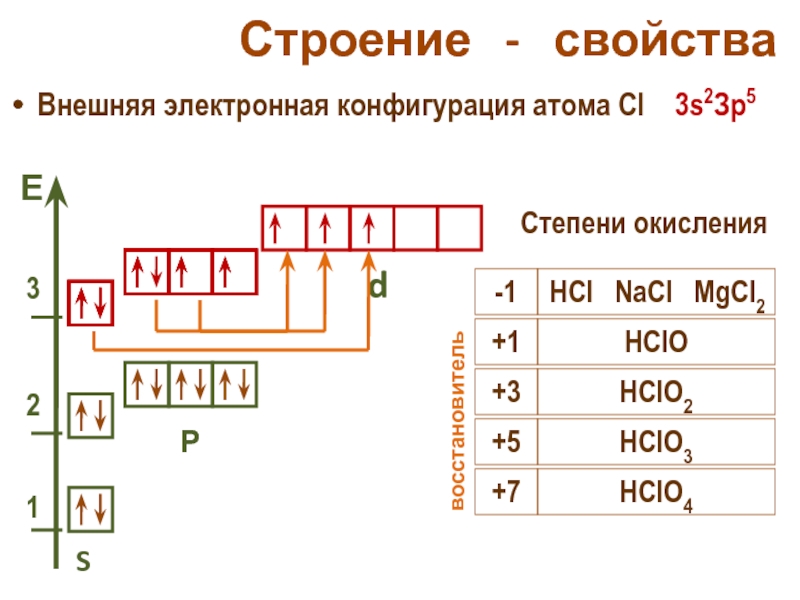
Слайд 25Строение - свойства
Внешняя электронная конфигурация атома Cl 3s2Зр5
S
Р
d
-1
HCl NaCl MgCl2
+1
HClO
восстановитель
+3
HClO2
+5
HClO3
+7
HClO4
Слайд 261. Взаимодействие с металлами
Хлор непосредственно реагирует почти со
2. Взаимодействие с неметаллами
C неметаллами (кроме углерода, азота, кислорода и инертных газов), образует соответствующие хлориды.
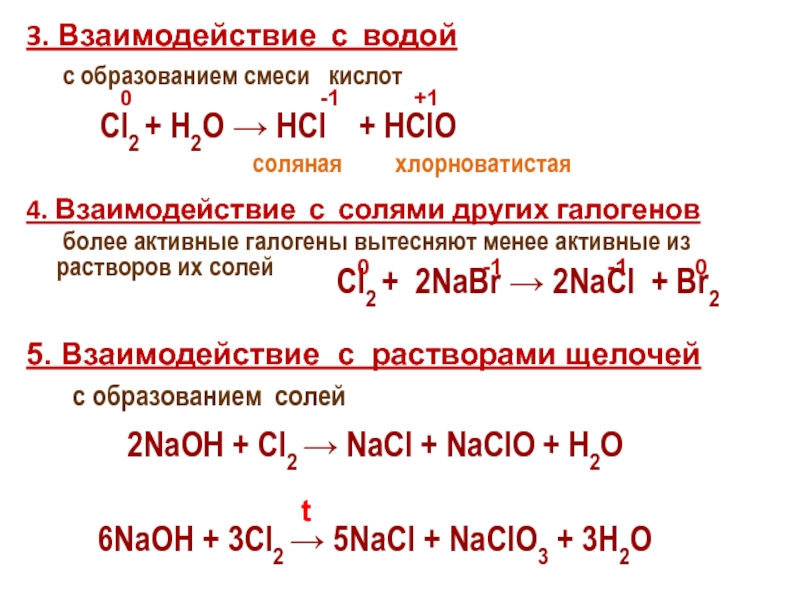
Слайд 273. Взаимодействие с водой
с образованием смеси кислот
4.
более активные галогены вытесняют менее активные из растворов их солей
5. Взаимодействие с растворами щелочей
с образованием солей
2NaOH + Cl2 → NaCl + NaClO + H2O
Слайд 28В промышленности: электролиз расплава или раствора хлорида натрия
В лаборатории:
4 HСl
2NaCl → 2Na + Cl2
HСl + MnO2 → MnCl2 + Cl2 ↑+ H2O
16 HСl + 2KMnO4 → 2KСl + 2MnCl2 + 5Cl2 ↑+ 8H2O
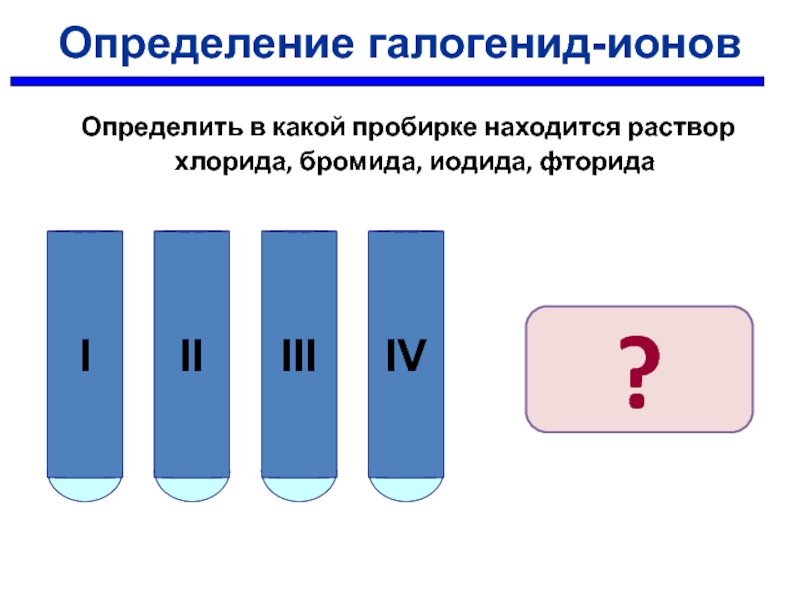
Слайд 29Определение галогенид-ионов
Определить в какой пробирке находится раствор хлорида, бромида, иодида,
?
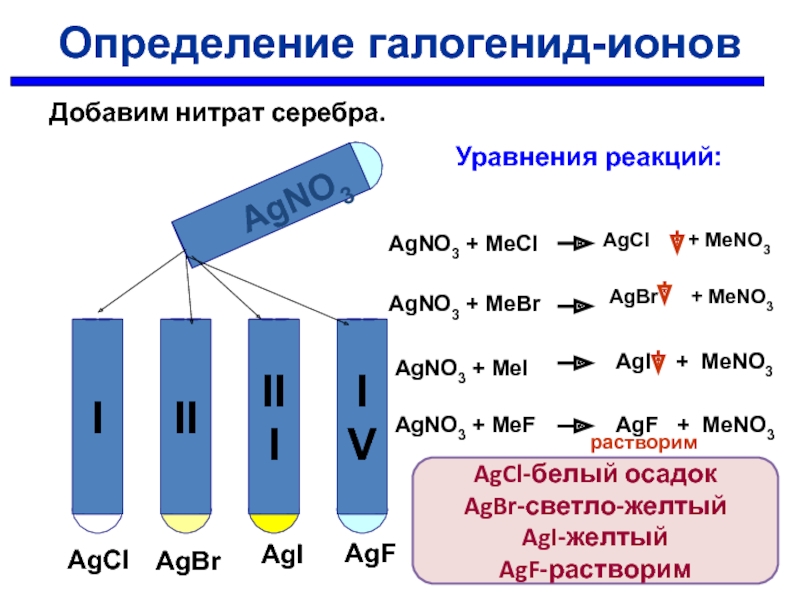
Слайд 30AgNO3
AgCl
AgBr
AgI
AgF
Уравнения реакций:
AgNO3 + MeCl
AgNO3 + MeBr
AgNO3 + MeI
AgNO3 + MeF
растворим
AgCl
Добавим нитрат серебра.
AgBr + MeNO3
AgI + MeNO3
AgF + MeNO3
Определение галогенид-ионов
AgCl-белый осадок
AgBr-светло-желтый
AgI-желтый
AgF-растворим
Слайд 31Хлор хвалился: «Нет мне равных!
Галоген я - самый главный.
Зря болтать я
Всё на свете отбелю!»
Йод красой своей гордился,
Твердым был, но испарился.
Фиолетовый как ночь,
Далеко умчался прочь.
Бром разлился океаном,
Хоть зловонным. Но румяным.
Бил себя он грозно в грудь:
«Я ведь бром! Не кто-нибудь!..»
Фтор молчал и думал:
«Эх!.. Ведь приду – окислю всех…»
Химические свойства галогенов
Слайд 33
- 5 % спиртовой раствор йода используется для
- В рентгенологических и томографических исследованиях применяются йодсодержащие контрастные препараты
- Галоге́нная ла́мпа — лампа накаливания, в баллон которой добавлены пары галогенов (брома или йода)
- Лазерный термоядерный синтез - иодорганические соединения применяются для производства сверхмощных газовых лазеров на возбужденных атомах
В технике
В медицине