- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Галогенопроизводные углеводородов презентация
Содержание
- 1. Галогенопроизводные углеводородов
- 2. 2. От природы углеводородного остатка R:
- 3. 3. По характеру С в sp3-гибридном состоянии,
- 4. Номенклатура Радикально-функциональные названия: строятся путем прибавления названия
- 6. Изомерия Изомерия обусловлена изомерией углеродного скелета и
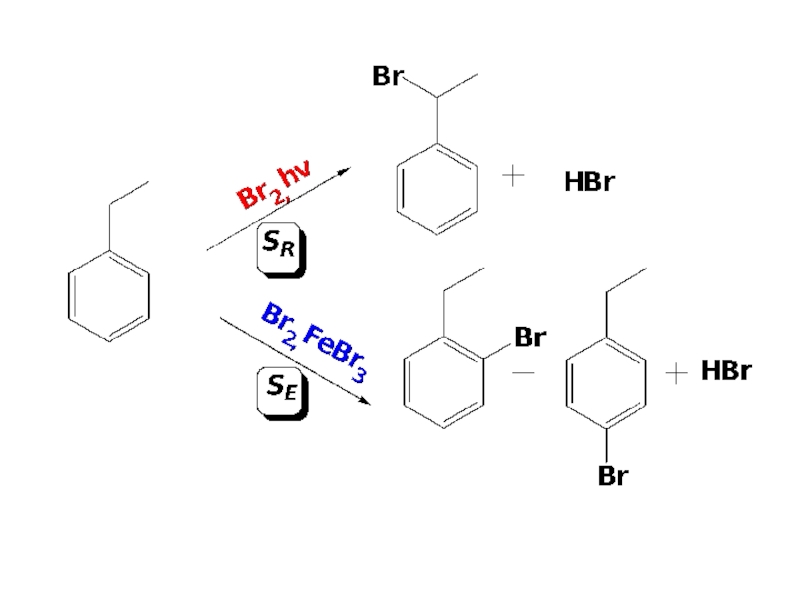
- 7. МЕТОДЫ ПОЛУЧЕНИЯ 1. Прямое галогенирование углеводородов
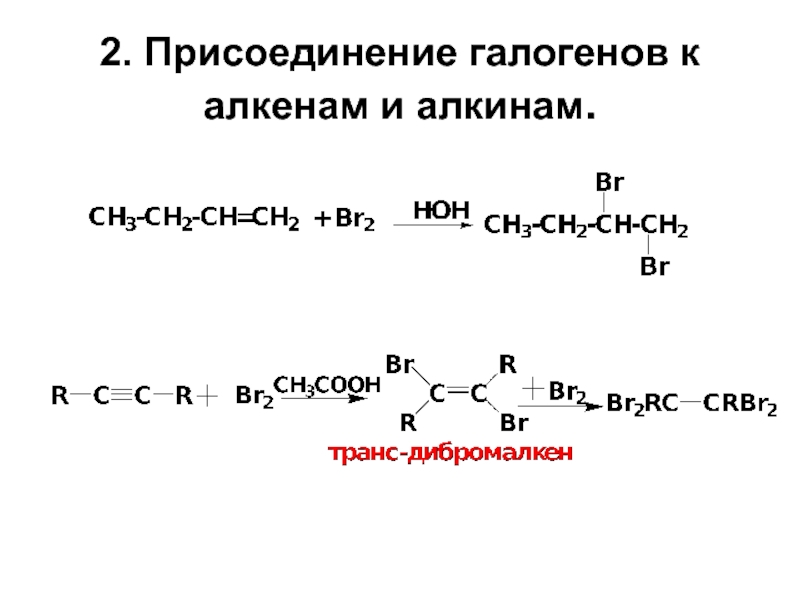
- 9. 2. Присоединение галогенов к алкенам и алкинам.
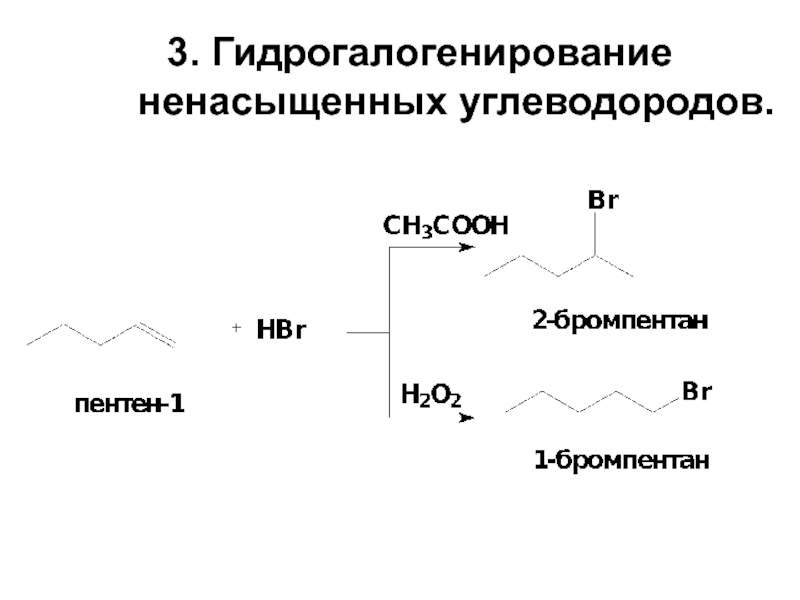
- 10. 3. Гидрогалогенирование ненасыщенных углеводородов.
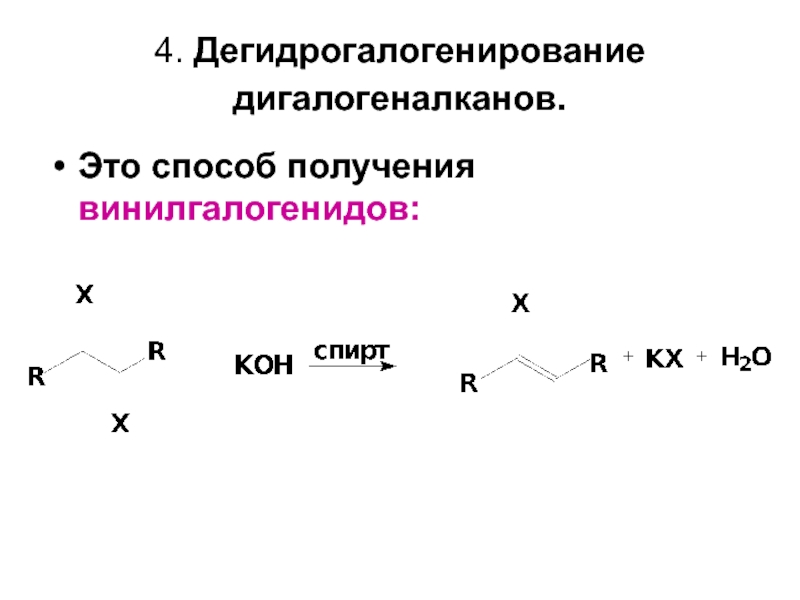
- 11. 4. Дегидрогалогенирование дигалогеналканов. Это способ получения винилгалогенидов:
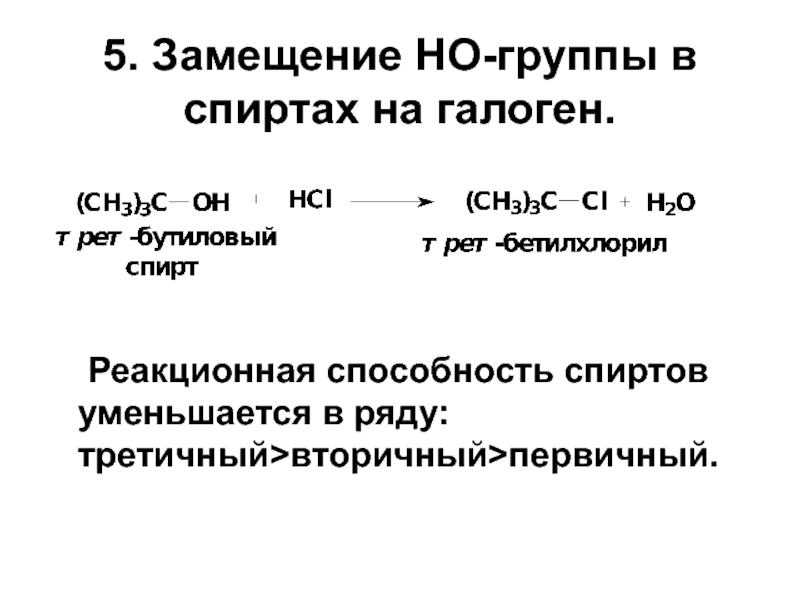
- 12. 5. Замещение HO-группы в спиртах на галоген. Реакционная способность спиртов уменьшается в ряду: третичный>вторичный>первичный.
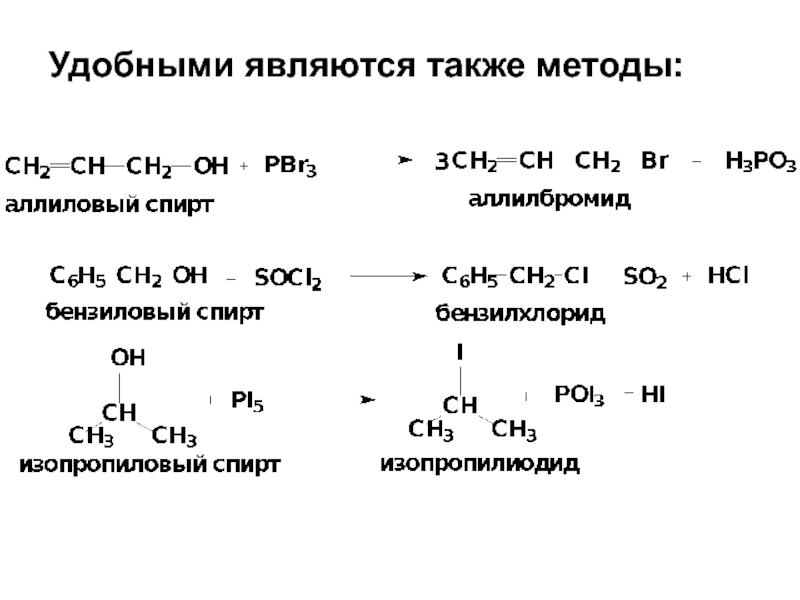
- 13. Удобными являются также методы:
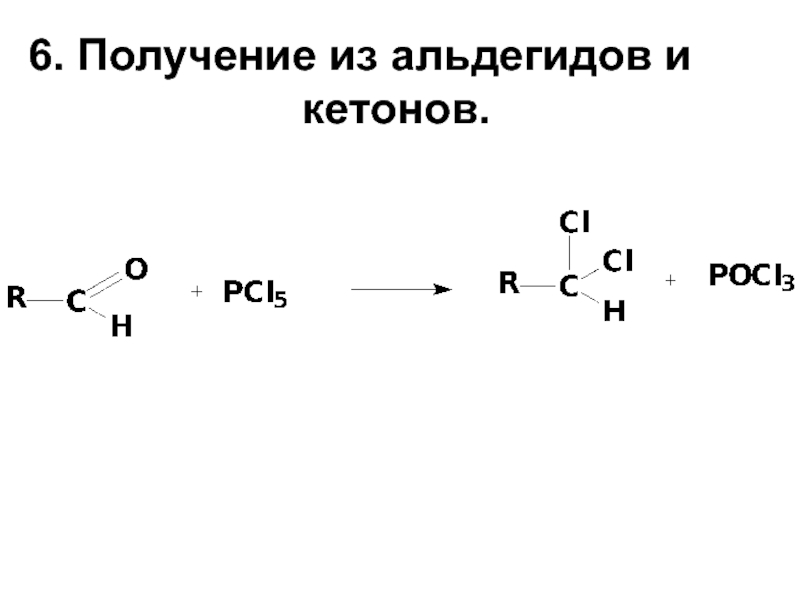
- 14. 6. Получение из альдегидов и кетонов.
- 15. 7. Получение иодпроизводных реакцией Финкельштейна
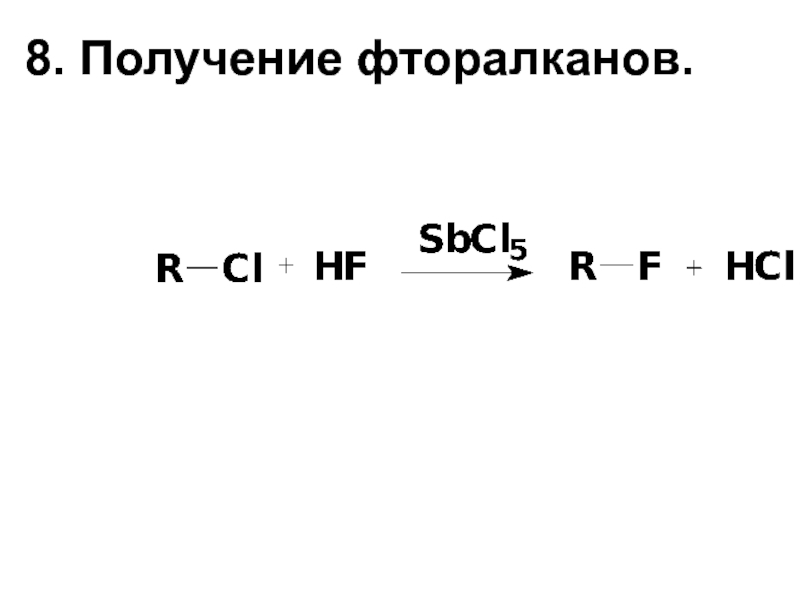
- 16. 8. Получение фторалканов.
- 17. ФИЗИЧЕСКИЕ СВОЙСТВА Физические свойства галогеналканов зависят от
- 18. Полифторалканы заметно отличаются по свойствам от других
- 19. Галогеноуглеводороды – полярные соединения, но они почти
- 20. ХИМИЧЕСКИЕ СВОЙСТВА
- 21. Электрофильный центр (α-атом углерода) возникает вследствие поляризации
- 22. 1. Реакции нуклеофилов–наиболее распространенные превращения галогеналканов.
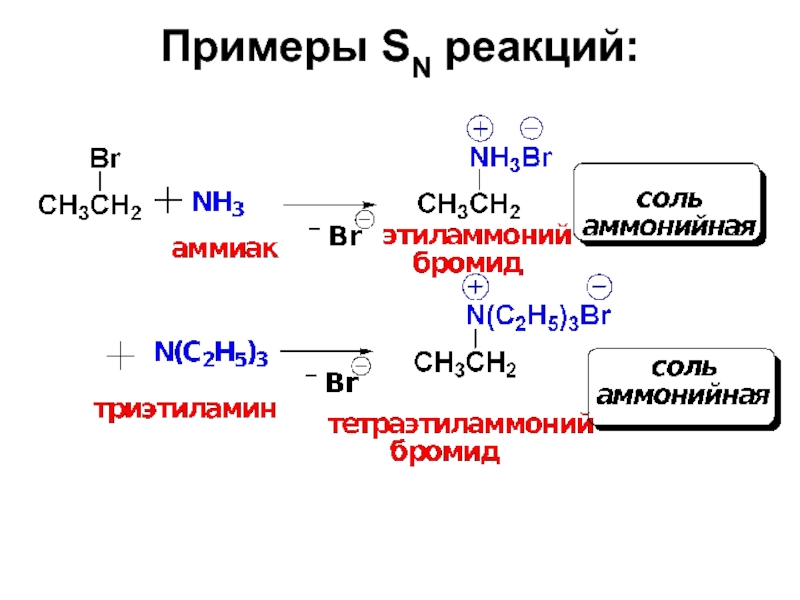
- 23. Примеры SN реакций:
- 24. Примеры SN реакций:
- 25. Примеры SN реакций:
- 26. Примеры SN реакций:
- 27. Эти реакции идут по типу нуклеофильного замещения
- 28. Нуклеофильные реагенты - это частицы (атомы или
- 29. Нуклеофилы – отрицательно заряженные ионы:
- 30. Нуклеофилы – нейтральные молекулы:
- 31. Реакции нуклеофильного замещения идут по одной из
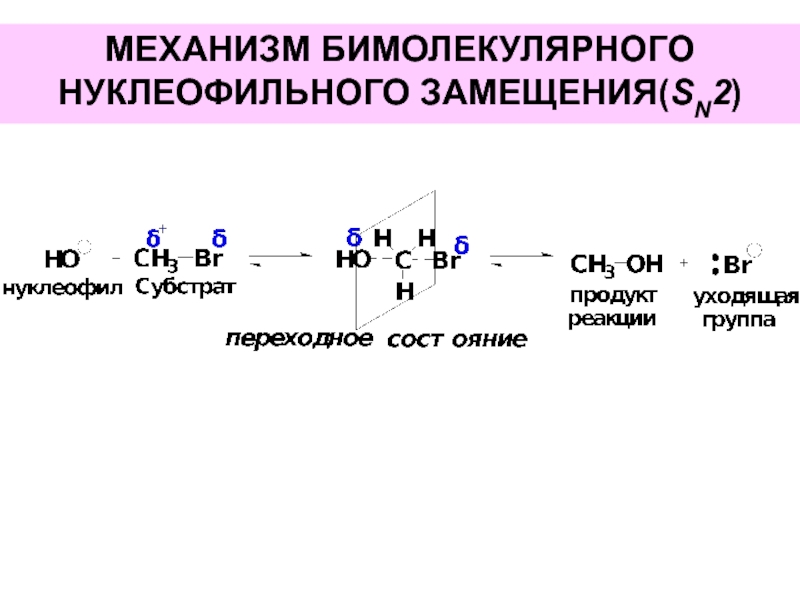
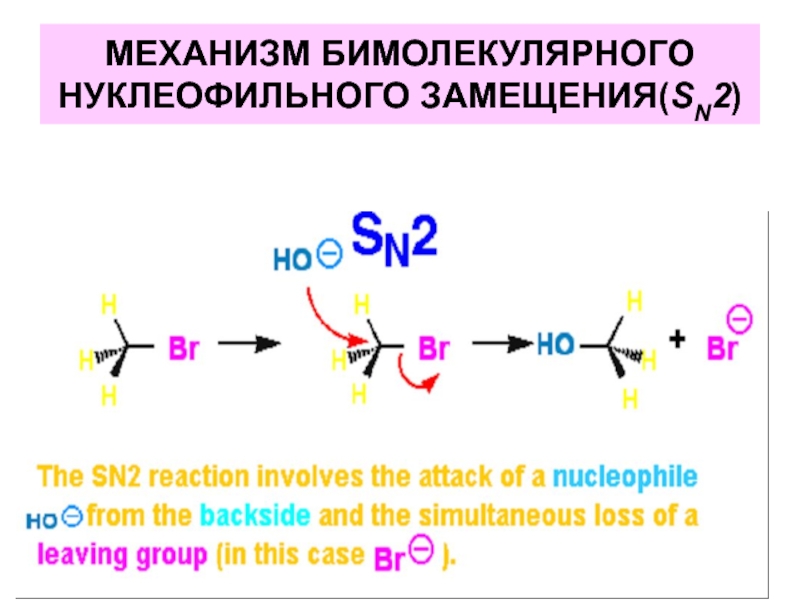
- 32. МЕХАНИЗМ БИМОЛЕКУЛЯРНОГО НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ(SN2)
- 33. МЕХАНИЗМ БИМОЛЕКУЛЯРНОГО НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ(SN2)
- 34. Кинетика реакции: V=k[субстрат] [реагент]
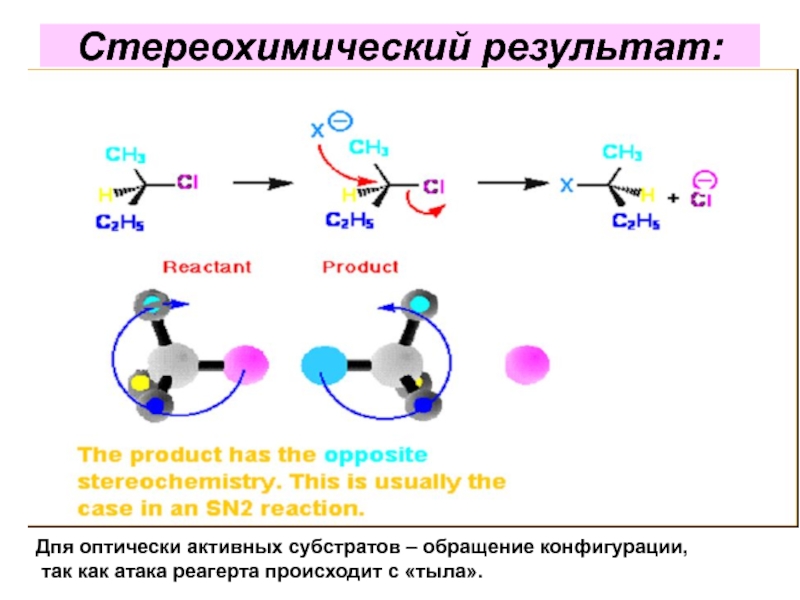
- 35. Стереохимический результат: Дпя оптически активных субстратов
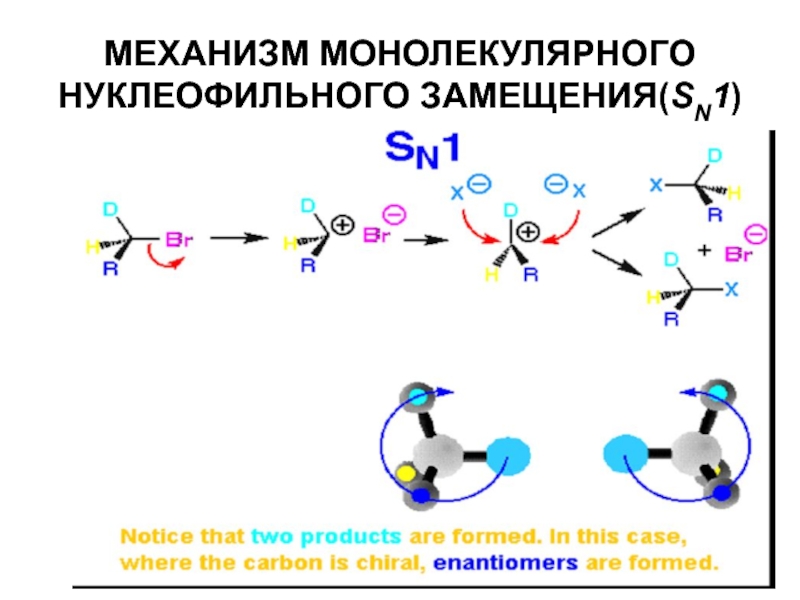
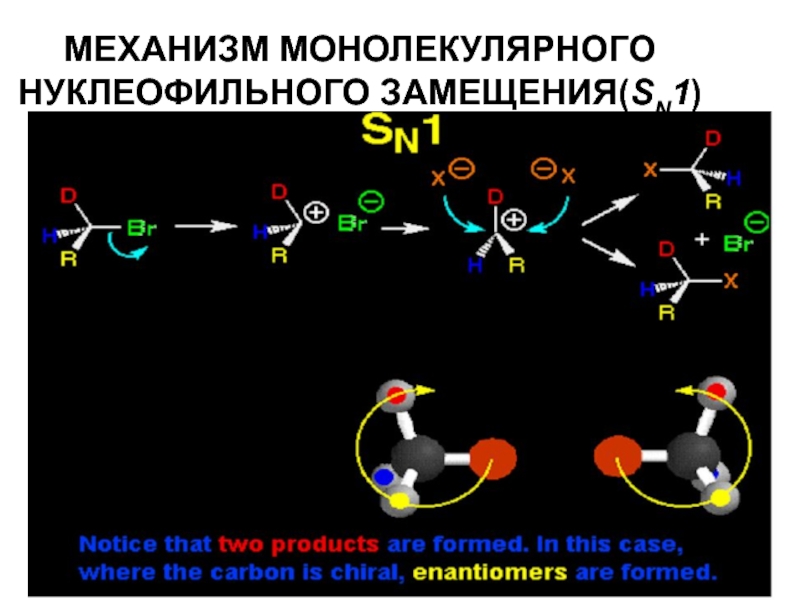
- 36. МЕХАНИЗМ МОНОЛЕКУЛЯРНОГО НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ(SN1)
- 37. МЕХАНИЗМ МОНОЛЕКУЛЯРНОГО НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ(SN1)
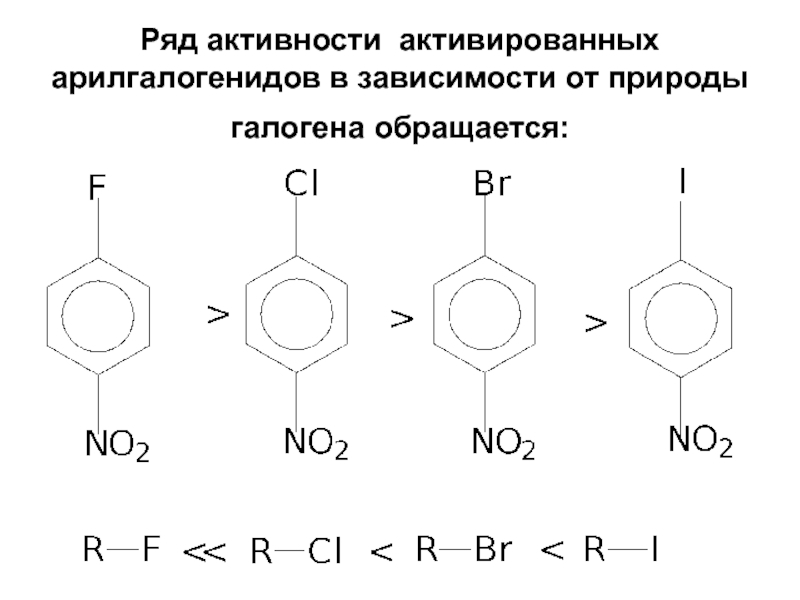
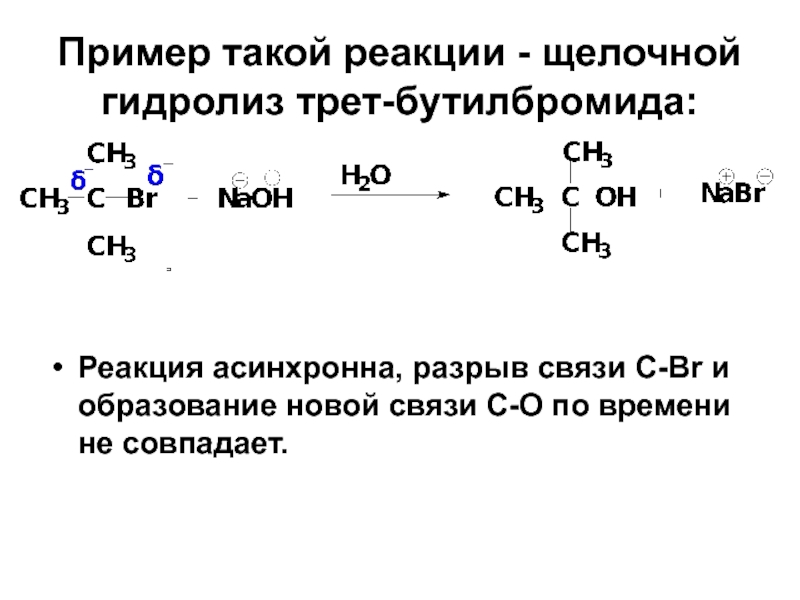
- 38. Пример такой реакции - щелочной гидролиз трет-бутилбромида:
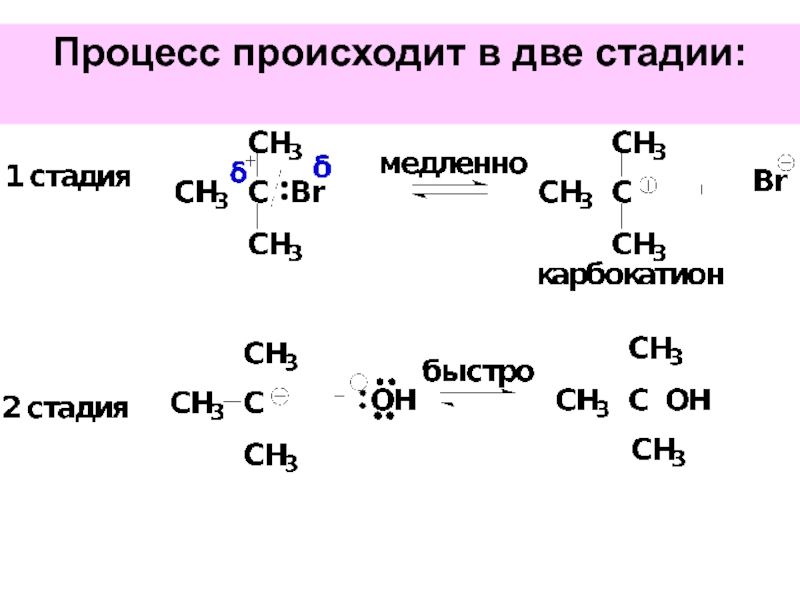
- 39. Процесс происходит в две стадии:
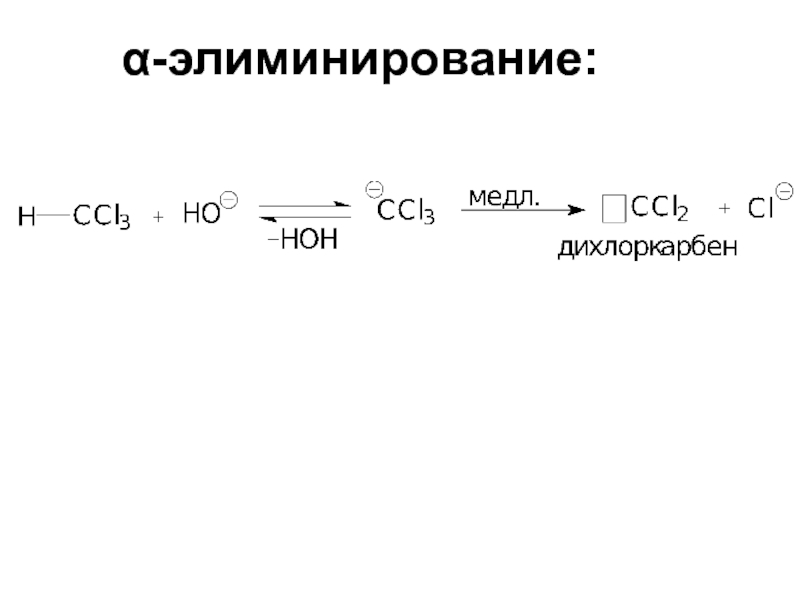
- 40. Кинетика реакции: V=k[субстрат] Концентрация нуклеофила на скорость реакции не влияет.
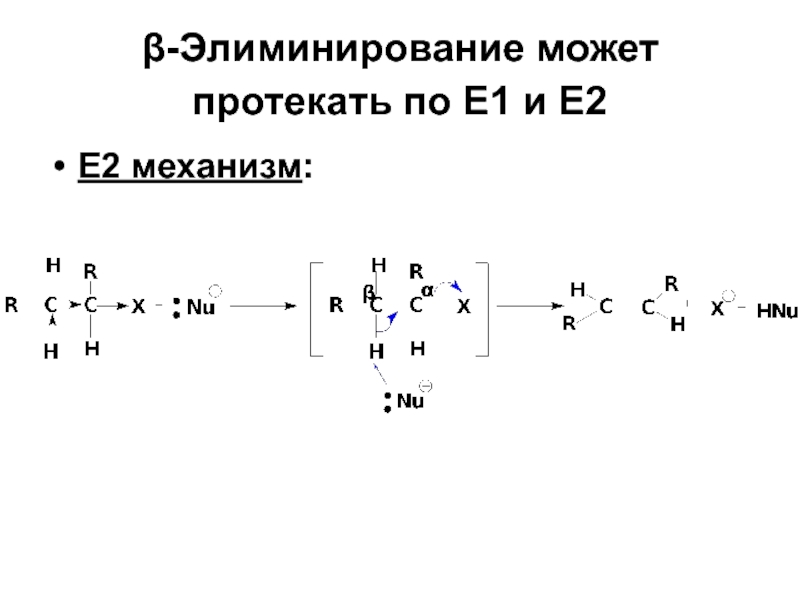
- 41. Стереохимический результат: При участии в реакции оптически
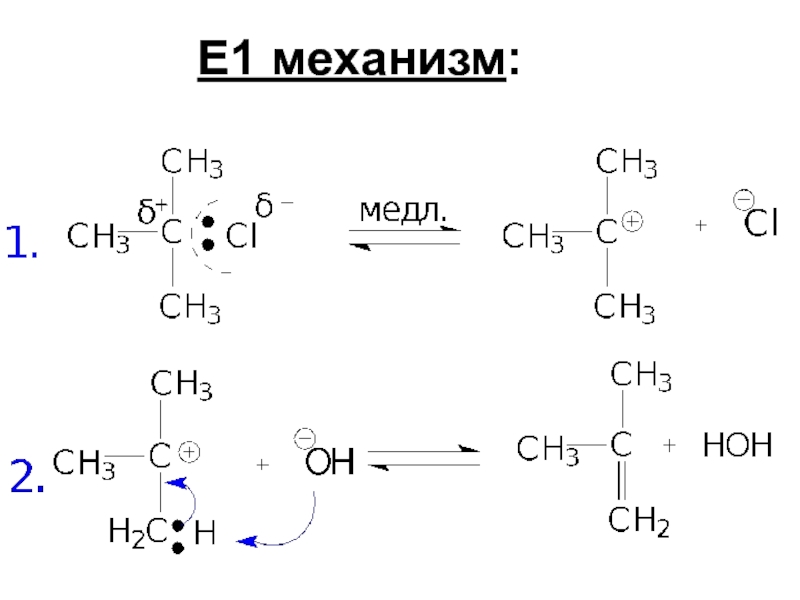
- 42. Факторы,влияющие на ход нуклеофильного замещения 1. Строение
- 43. Строение субстрата. Природа углеводородного радикала, связанного с
- 44. а) Соединения с нормальной реакционной способностью (нормальной
- 45. Соединения с нормальной реакционной способностью – галогенопроизводные
- 46. Соединения с пониженной реакционной способностью – галогенопроизводные
- 47. Вследствие +М эффекта связь С-Hal в этих
- 48. Соединения с повышенной реакционной способностью –
- 49. Для этих соединений SN реакции протекают быстрее
- 50. Природа R влияет и на предпочтительность реализации
- 51. В случае SN2 реакции определяющим является стерический
- 52. SN1 Реакции могут протекать для тех субстратов,
- 53. Таким образом, третичные субстраты обычно вступают
- 54. Влияние природы уходящей группы (нуклеофуга) Хорошие уходящие
- 55. Влияние природы растворителя. Роль полярного растворителя:
- 56. По сольватирующей способности растворители делят на протонные
- 57. Эти растворители за счёт неподелённых электронных пар
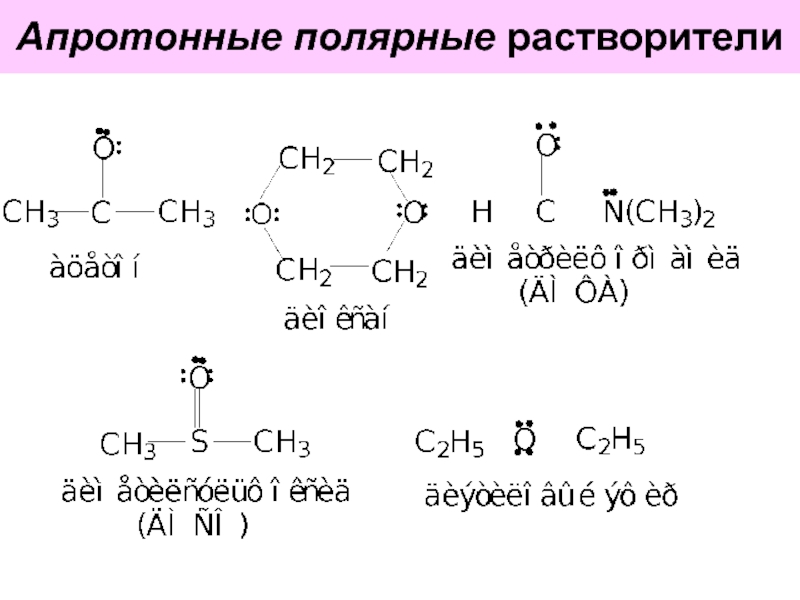
- 58. Апротонные полярные растворители
- 59. Апротонные полярные растворители за счёт неподелённых
- 60. Таким образом, характер растворителя оказывает существенное влияние
- 61. Влияние нуклеофильности реагента. Активность нуклеофила сказывается на
- 62. а) Между основностью реагента и его нуклеофильностью
- 63. б) Нуклеофильность определяется ещё и поляризуемостью.
- 64. в) На нуклеофильность слабополяризуемых ионов значительное влияние
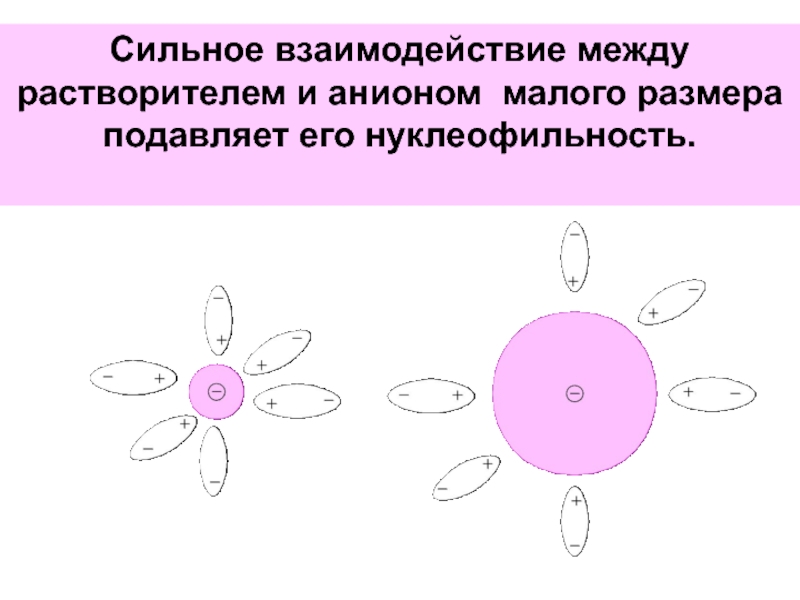
- 65. Сильное взаимодействие между растворителем и анионом малого размера подавляет его нуклеофильность.
- 66. Реагенты по возрастанию их нуклеофильности в SN2-реакциях в протонных растворителях можно расположить таким образом:
- 67. Апротонный растворитель не способен сольватировать анионы за
- 68. Порядок нуклеофильности в апротонном растворителе диметилформамиде (ДМФА)
- 69. Особенность реакций нуклеофильного замещения с амбидентными нуклеофилами
- 71. Правило Корнблюма: В SN2-реакциях атакующим атомом амбидентного
- 72. Аллильная перегруппировка. Реализуется при нуклеофильном замещении в
- 73. НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ В АРИЛГАЛОГЕНИДАХ Активированные и неактивированные
- 74. Подвижность галогена можно увеличить введением в о-
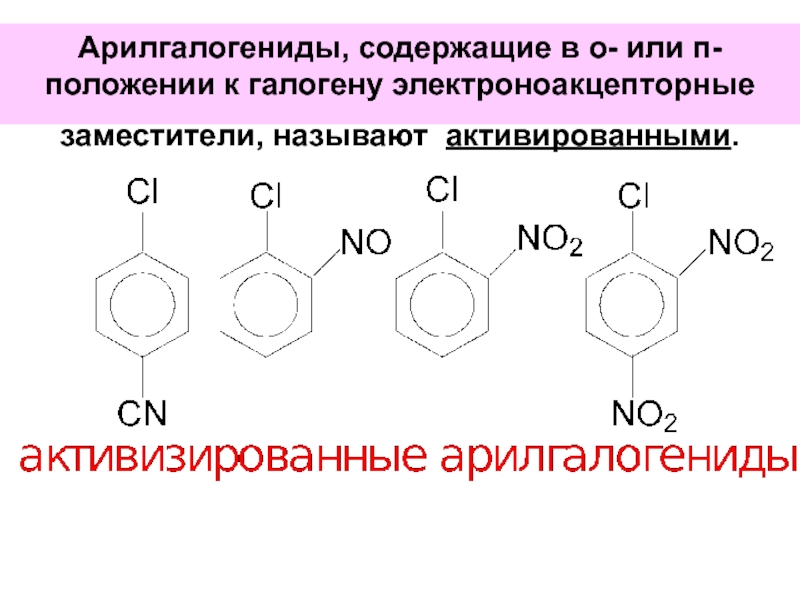
- 75. Арилгалогениды, содержащие в о- или п-положении к галогену электроноакцепторные заместители, называют активированными.
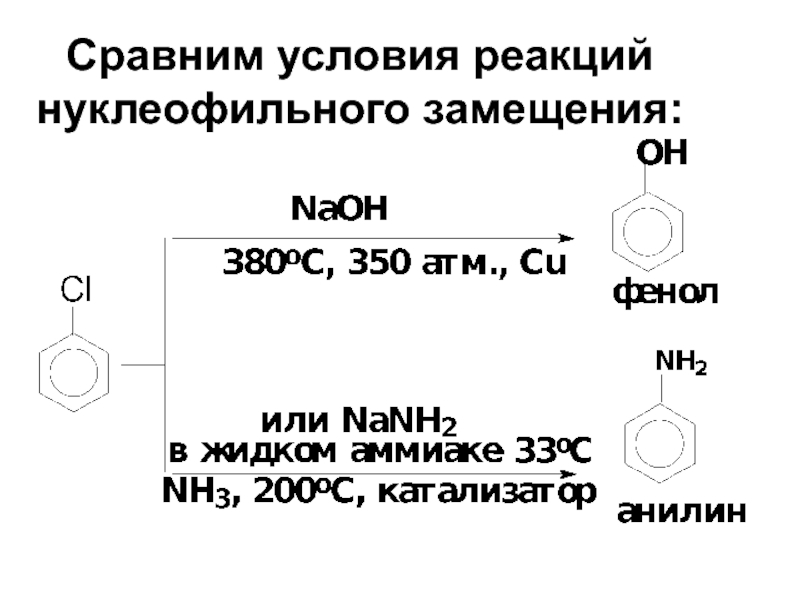
- 76. Сравним условия реакций нуклеофильного замещения:
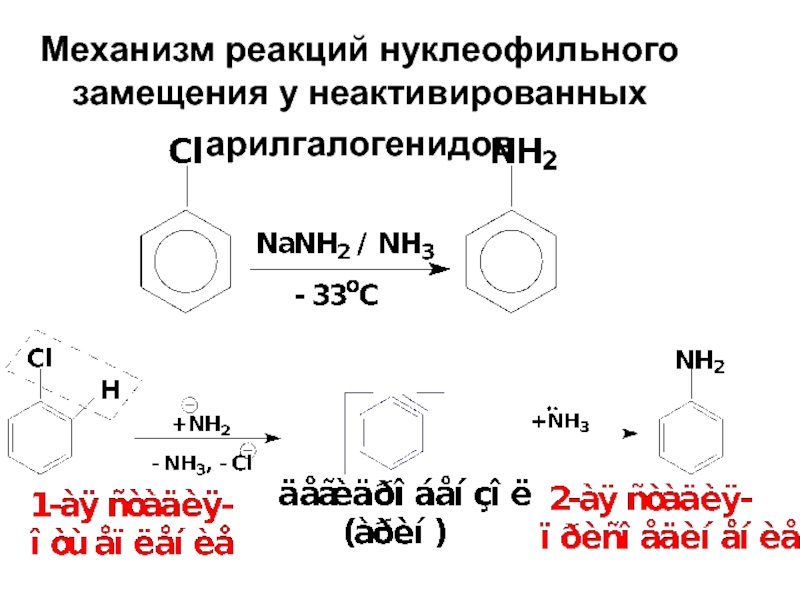
- 78. Механизм реакций нуклеофильного замещения у неактивированных арилгалогенидов
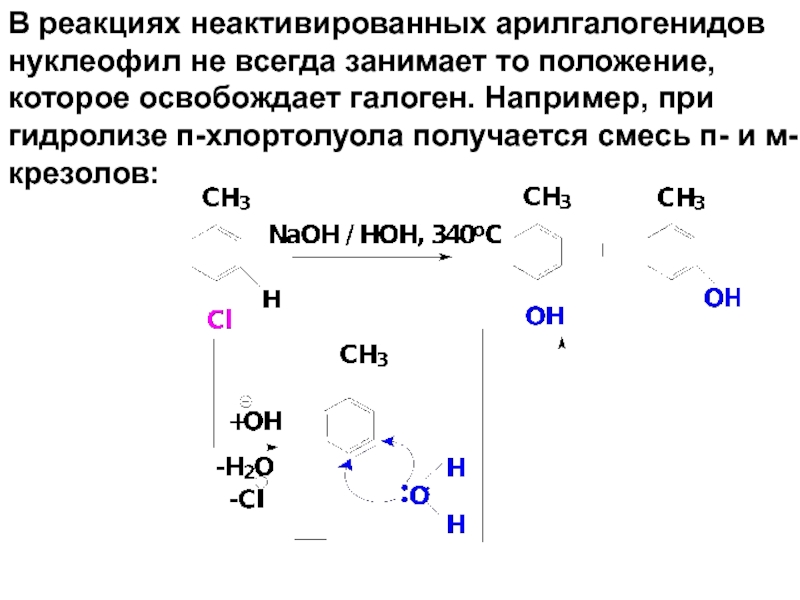
- 79. В реакциях неактивированных арилгалогенидов нуклеофил не всегда
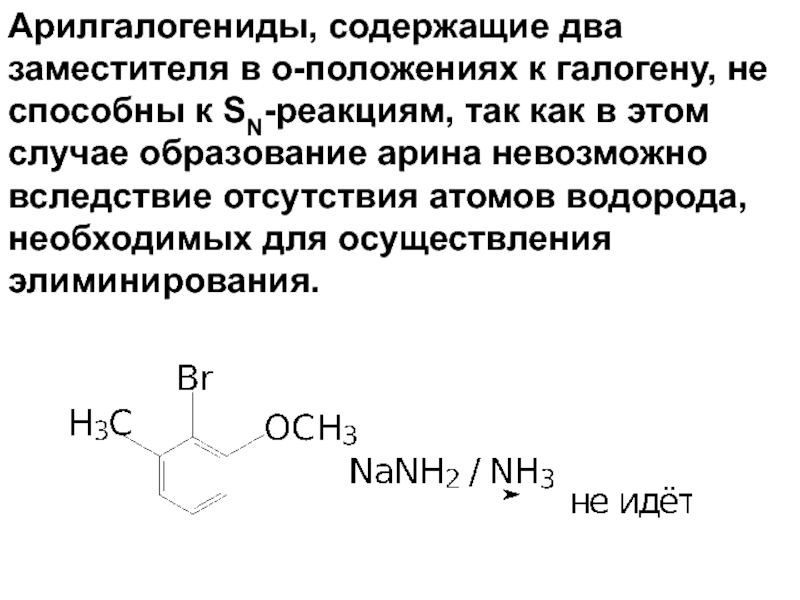
- 80. Арилгалогениды, содержащие два заместителя в о-положениях к
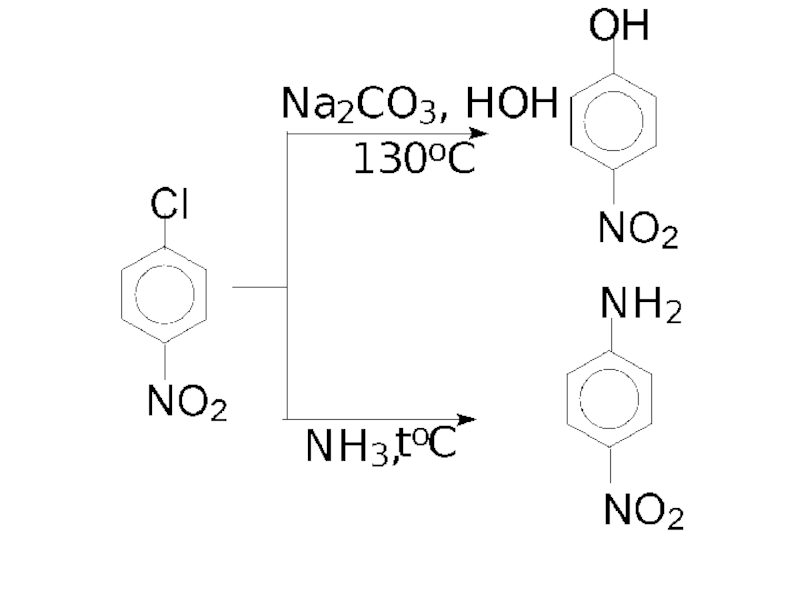
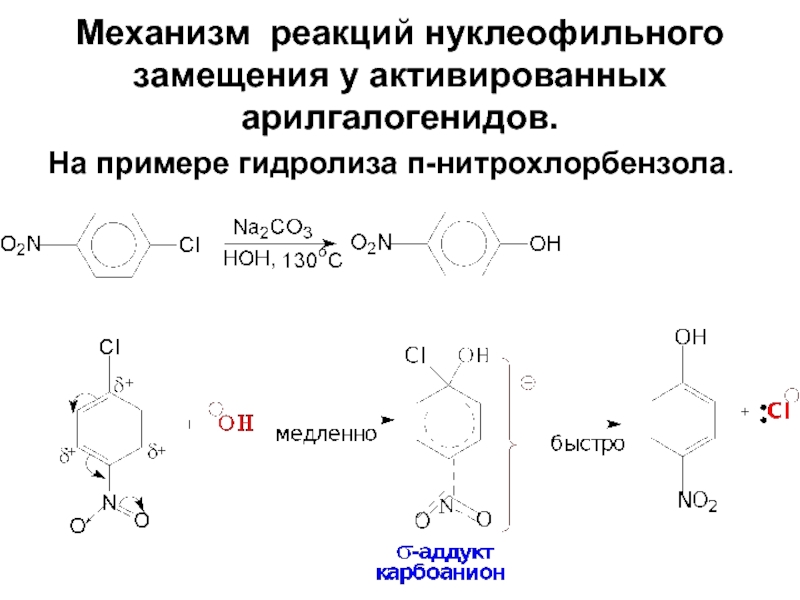
- 81. Механизм реакций нуклеофильного замещения у активированных арилгалогенидов. На примере гидролиза п-нитрохлорбензола.
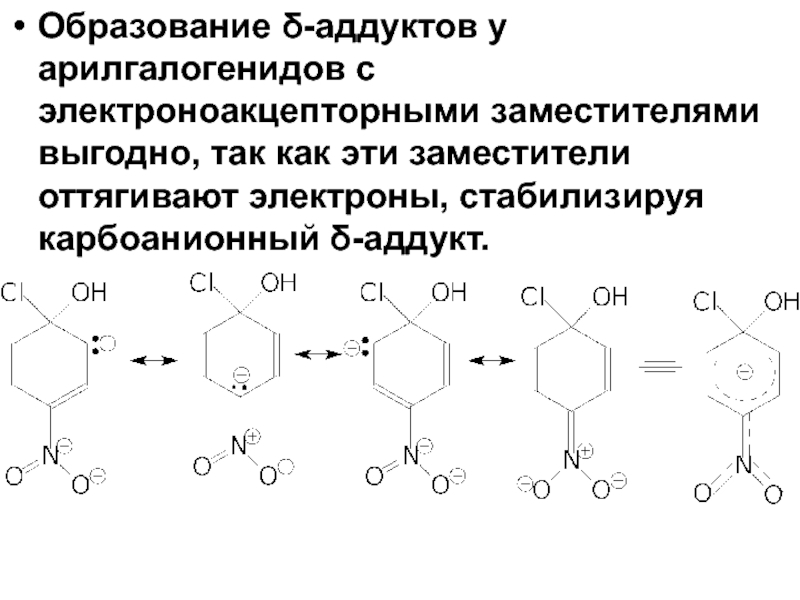
- 82. Образование δ-аддуктов у арилгалогенидов с электроноакцепторными заместителями
- 83. Т.к. в lim-стадии участвуют два вещества реакция
- 84. Ряд активности активированных арилгалогенидов в зависимости от природы галогена обращается:
- 85. 2. РЕАКЦИИ ЭЛИМИНИРОВАНИЯ Нуклеофильные реагенты
- 86. α-элиминирование:
- 87. β-Элиминирование может протекать по Е1 и Е2 Е2 механизм:
- 88. Е1 механизм:
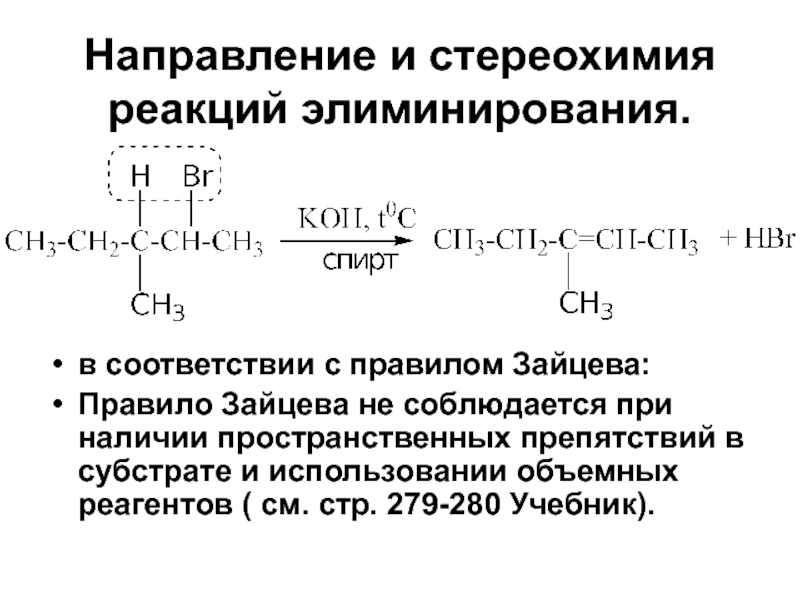
- 89. Направление и стереохимия реакций элиминирования. в соответствии
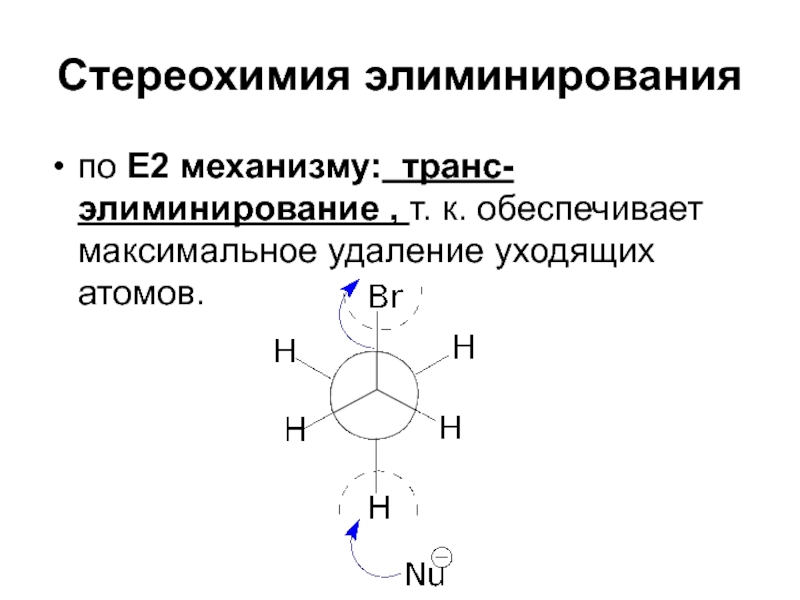
- 90. Стереохимия элиминирования по Е2 механизму: транс-элиминирование
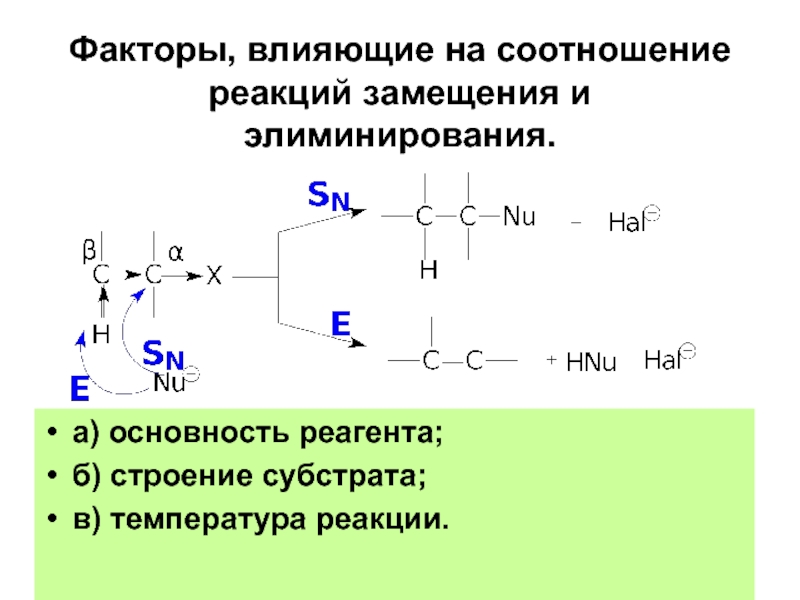
- 91. Факторы, влияющие на соотношение реакций замещения и
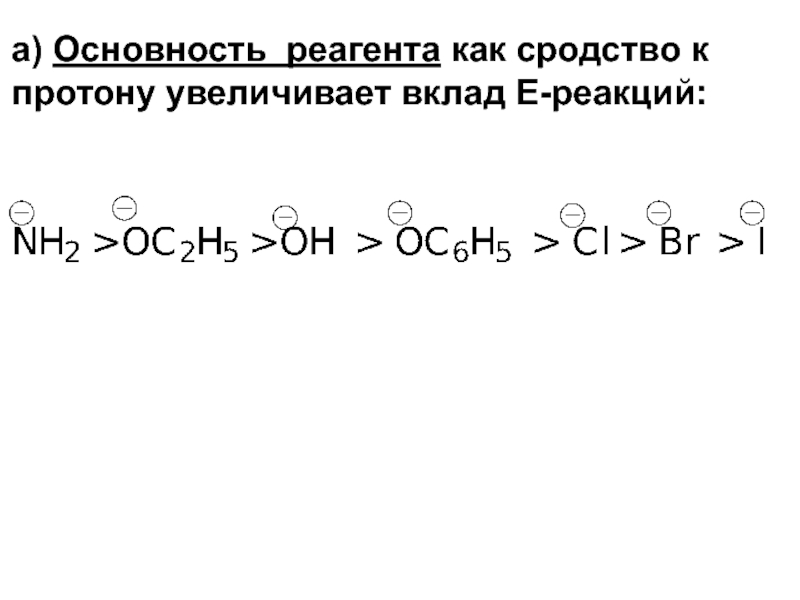
- 92. а) Основность реагента как сродство к протону увеличивает вклад Е-реакций:
- 93. б) строение субстрата В зависимости от природ
- 94. в) температура реакции. Повышение температуры увеличивает вклад Е-реакций.
- 95. 3.РЕАКЦИИ ГАЛОГЕНПРОИЗВОДНЫХ С МЕТАЛЛАМИ Алкил- и
- 96. Li образует ковалентную связь с угдеродом,
- 97. При переходе от R-Ha1 к Li -
- 98. Mg-органические галогениды –реактивы Гриньяра ( 1912 г.
- 99. Реакции магнийорганических соединений. В реактивах Гриньяра
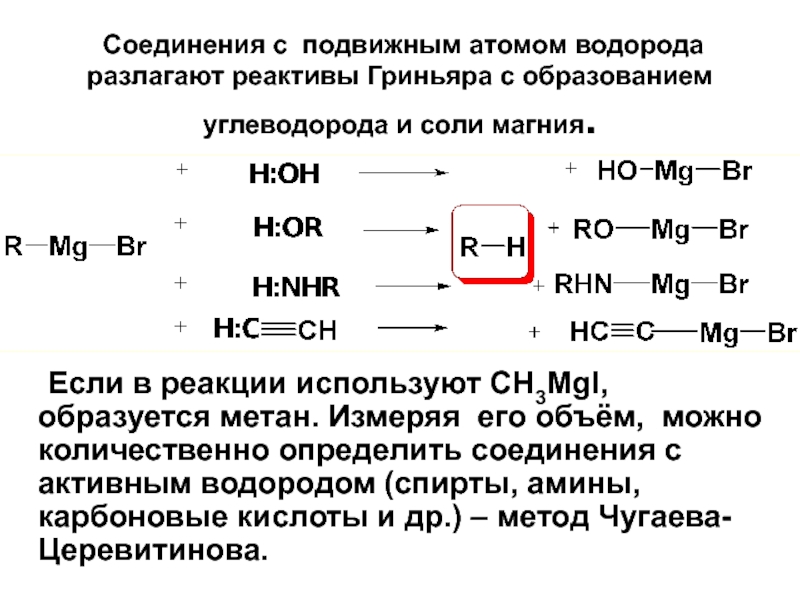
- 100. Соединения с подвижным атомом водорода разлагают
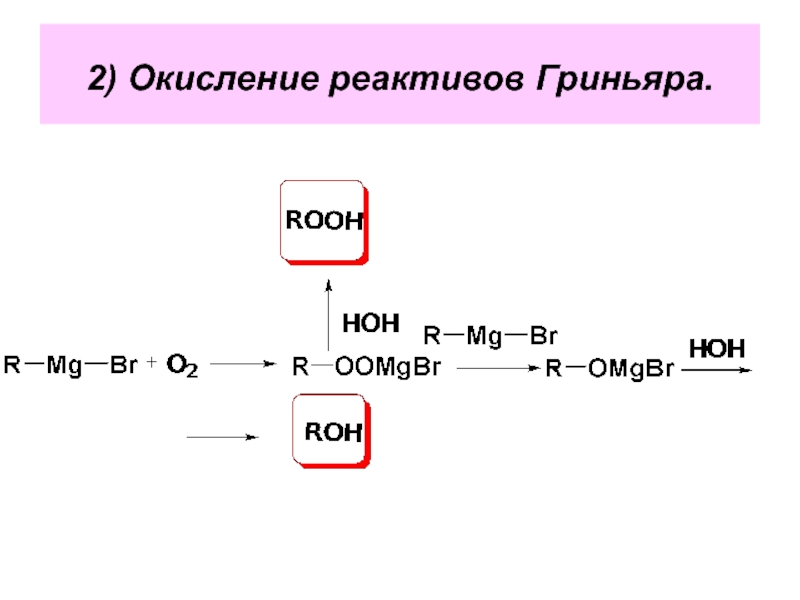
- 101. 2) Окисление реактивов Гриньяра.
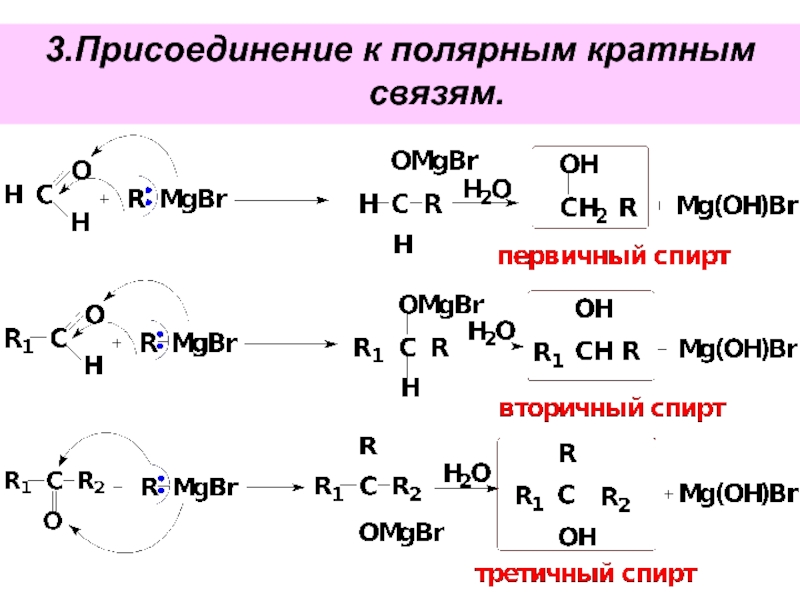
- 102. 3.Присоединение к полярным кратным связям.
Слайд 1ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ УГЛЕВОДОРОДОВ
Галогенопроизводные углеводородов
Классификация
1. От природы галогена:
Различают фтористые, хлористые, бромистые, иодистые
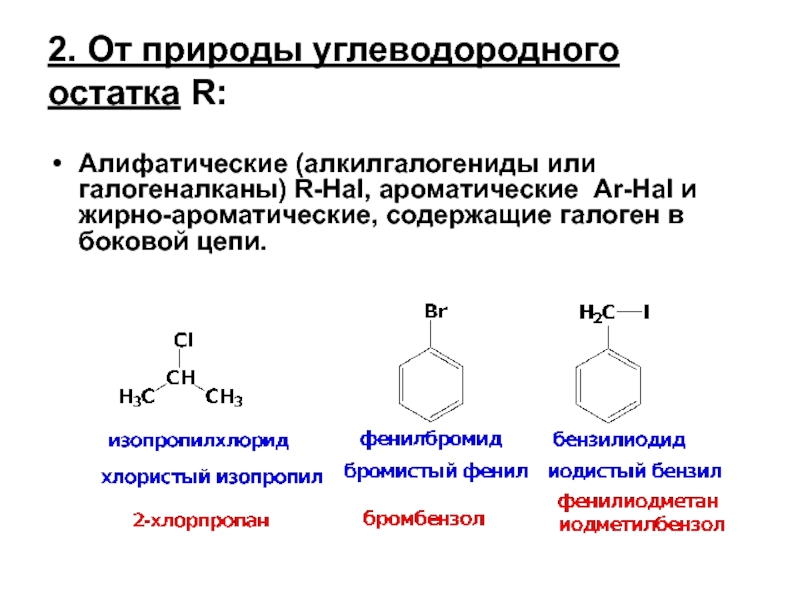
Слайд 22. От природы углеводородного остатка R:
Алифатические (алкилгалогениды или галогеналканы) R-Hal, ароматические
Слайд 33. По характеру С в sp3-гибридном состоянии, с которым связан галоген:
Первичные
вторичные (R)2СН- Hal,
третичные (R)3С- Hal.
Слайд 4Номенклатура
Радикально-функциональные названия: строятся путем прибавления названия галогена в форме прилагательного перед
По ИЮПАК галогены перечисляются в префиксной части названия .
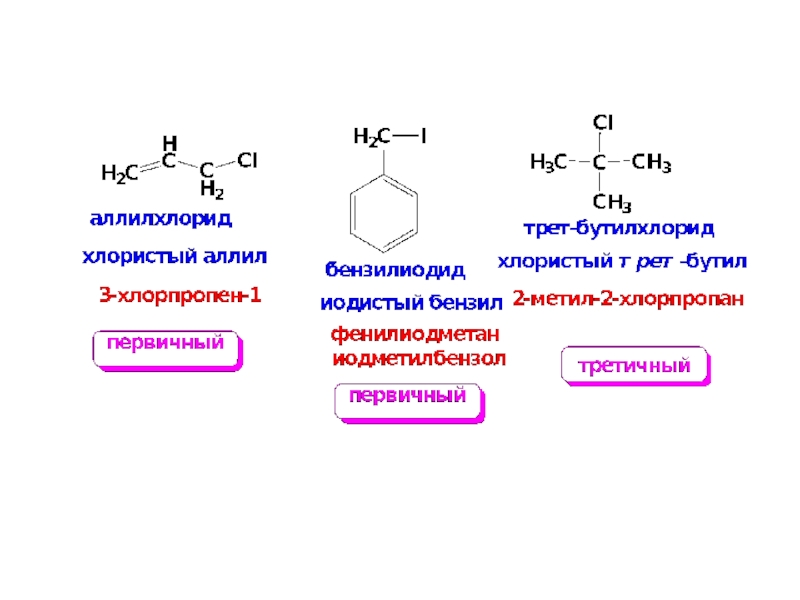
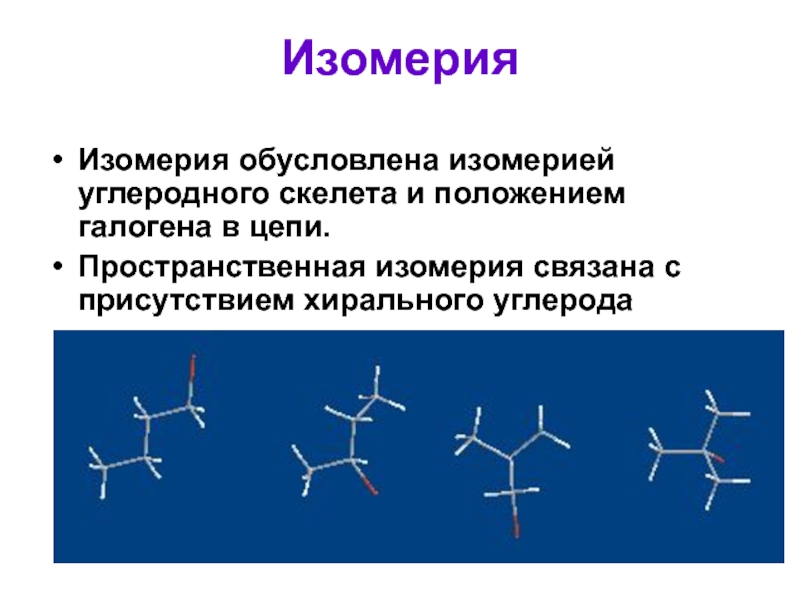
Слайд 6Изомерия
Изомерия обусловлена изомерией углеродного скелета и положением галогена в цепи.
Пространственная изомерия
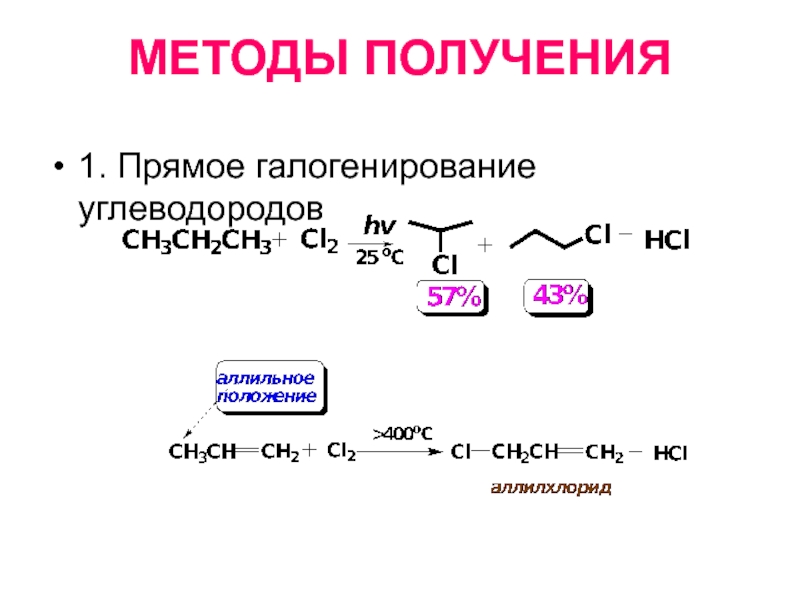
Слайд 125. Замещение HO-группы в спиртах на галоген.
Реакционная способность спиртов уменьшается в
Слайд 17ФИЗИЧЕСКИЕ СВОЙСТВА
Физические свойства галогеналканов зависят от природы и числа атомов галогена
Т. кип. галогеналканов с одинаковым R повышаются с увеличением атомной массы галогена в ряду F
Слайд 18Полифторалканы заметно отличаются по свойствам от других галогеналканов.
Переход от одного галогена
С увеличением атомного радиуса галогена увеличивается показатель преломления. I-производные имеют наиболее высокие показатели преломления.
Слайд 19Галогеноуглеводороды – полярные соединения, но они почти нерастворимы в воде ,
Таблица физических характеристик связей С-Hal представлена на стр.254, учебник.
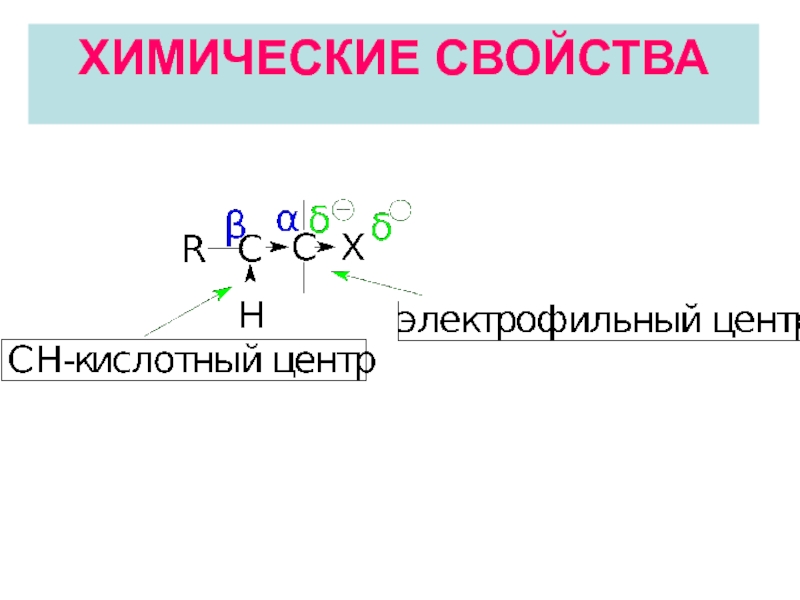
Слайд 21Электрофильный центр (α-атом углерода) возникает вследствие поляризации связи С-Нal и может
Если в реакционной среде имеется сильное основание, то реакция идет по СН-кислотному центру. Результатом такой реакции является элиминирование (отщепление ) атомов водорода и галогена от соседних атомов углерода.
Галогенопроизводные могут реагировать с металлами, в результате чего получаются металлоорганические соединения RMX
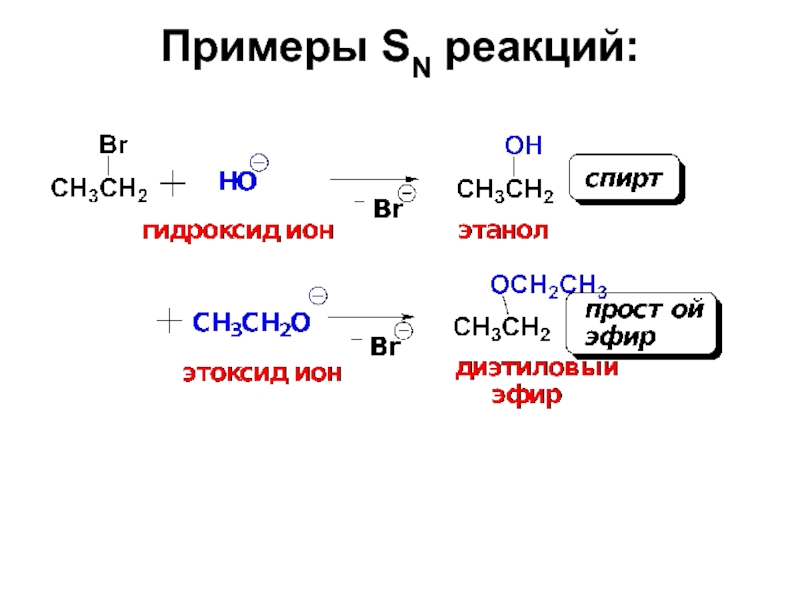
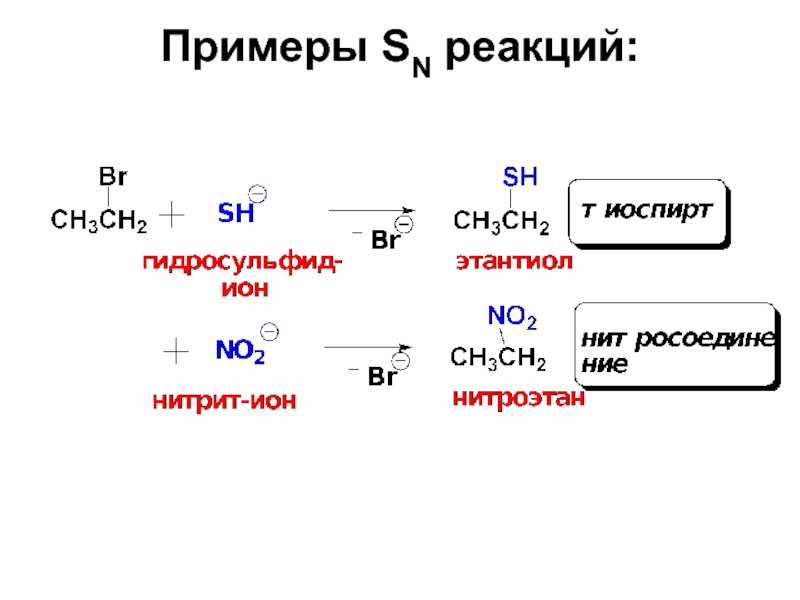
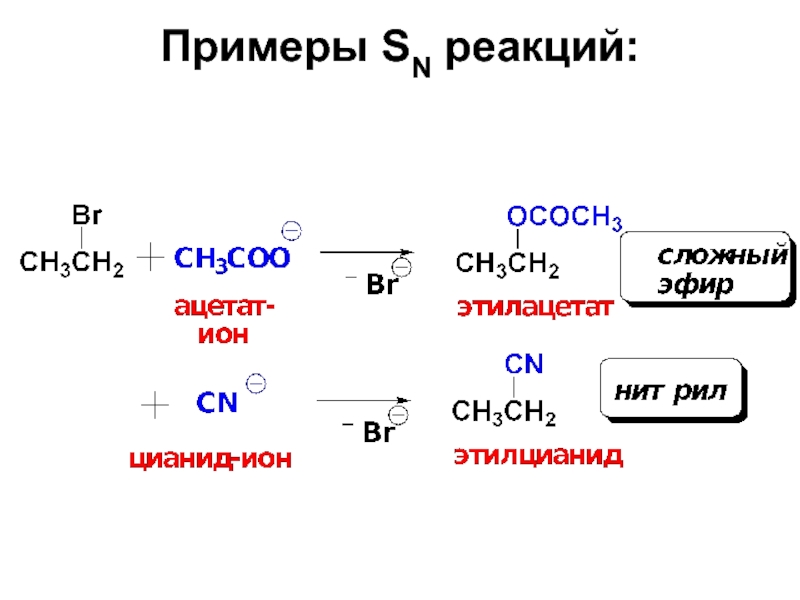
Слайд 221. Реакции нуклеофилов–наиболее распространенные превращения галогеналканов.
Именно эти реакции позволяют вводить
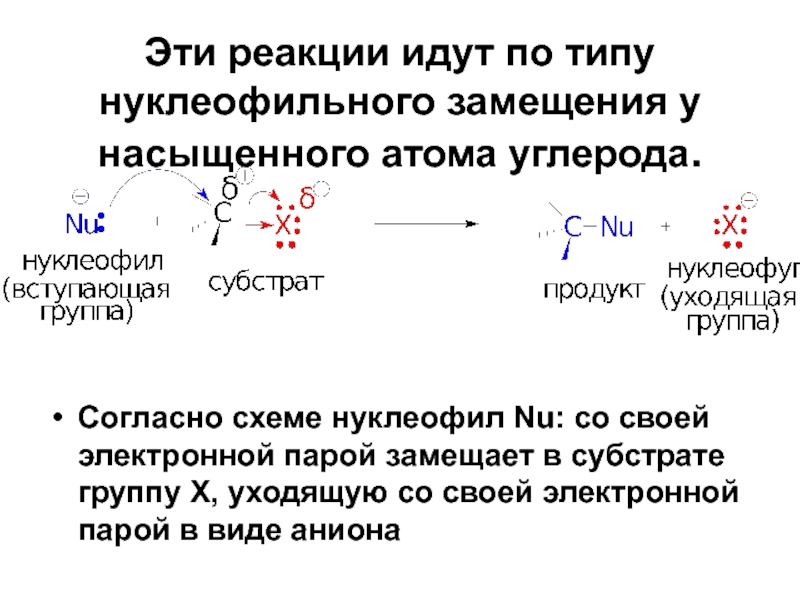
Слайд 27Эти реакции идут по типу нуклеофильного замещения у насыщенного атома углерода.
Согласно схеме нуклеофил Nu: со своей электронной парой замещает в субстрате группу Х, уходящую со своей электронной парой в виде аниона
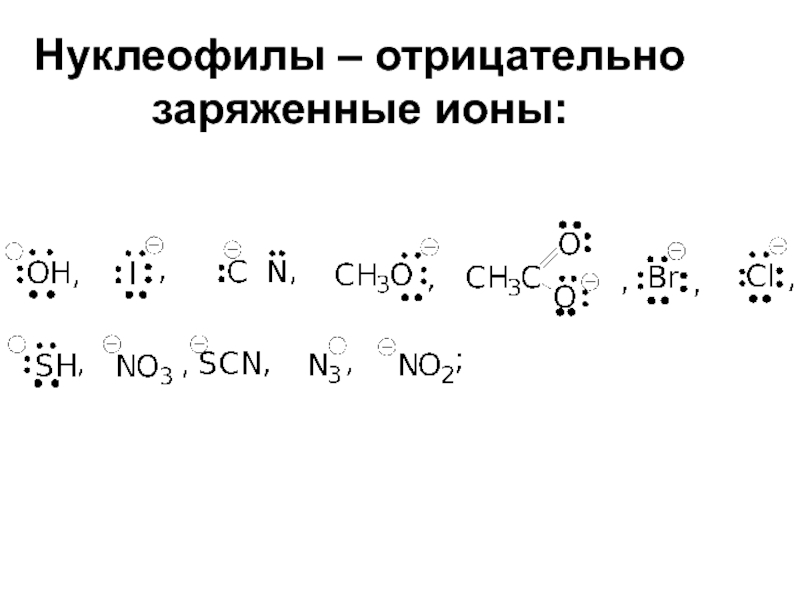
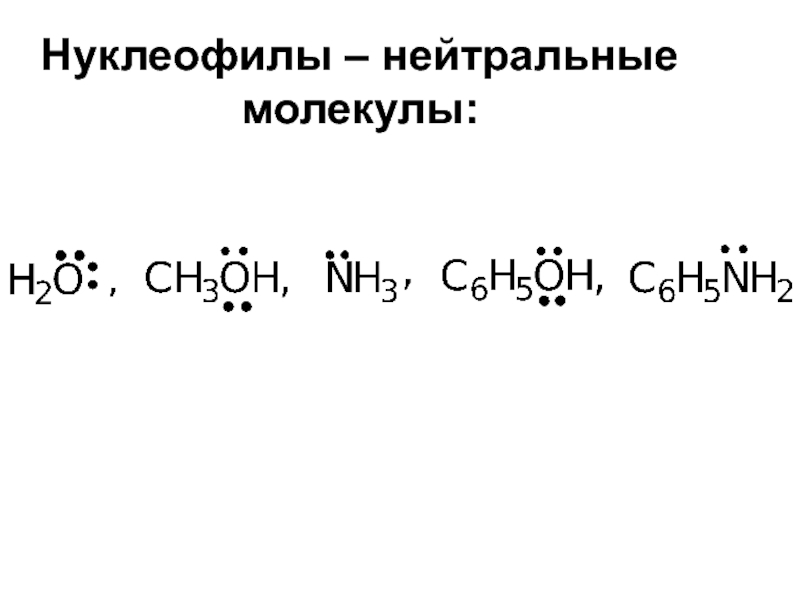
Слайд 28Нуклеофильные реагенты - это частицы (атомы или молекулы) доноры электронной пары
Нуклеофилы подразделяют по признаку наличия или отсутствия отрицательного заряда
Слайд 31Реакции нуклеофильного замещения идут по одной из следующих схем:
бимолекулярное нуклеофильное замещение
мономолекулярное нуклеофильное замещение (SN1).
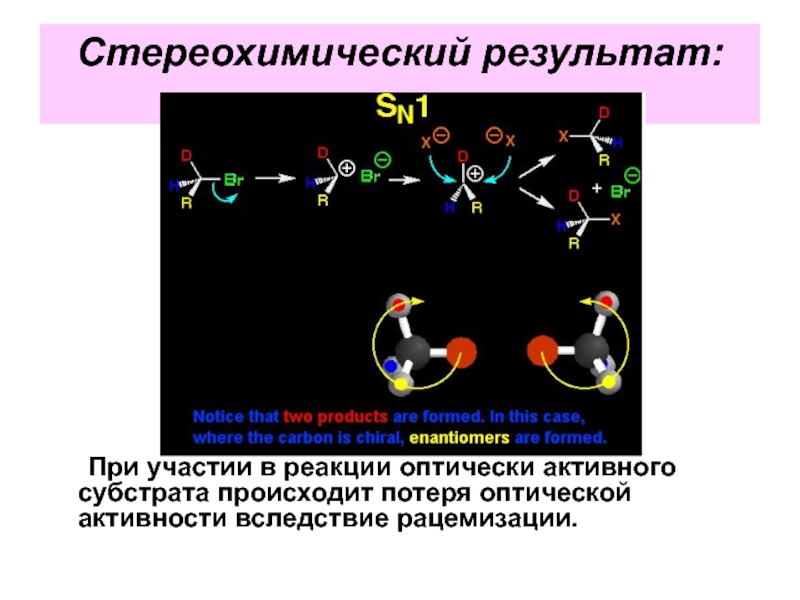
Слайд 35Стереохимический результат:
Дпя оптически активных субстратов – обращение конфигурации,
так как атака
Слайд 38Пример такой реакции - щелочной гидролиз трет-бутилбромида:
Реакция асинхронна, разрыв связи С-Br
Слайд 41Стереохимический результат:
При участии в реакции оптически активного субстрата происходит потеря оптической
Слайд 42Факторы,влияющие на ход нуклеофильного замещения
1. Строение субстрата.
2. Природа уходящей группы.
3. Природа
4. Нуклеофильность реагента
Слайд 43Строение субстрата.
Природа углеводородного радикала, связанного с галогеном, играет важную роль.
С точки
Слайд 44а) Соединения с нормальной реакционной способностью (нормальной подвижностью галогена в SN
б) Соединения с пониженной реакционной способностью (пониженной подвижностью галогена в SN реакциях);
а) Соединения с повышенной реакционной способностью (повышенной подвижностью галогена в SN реакциях).
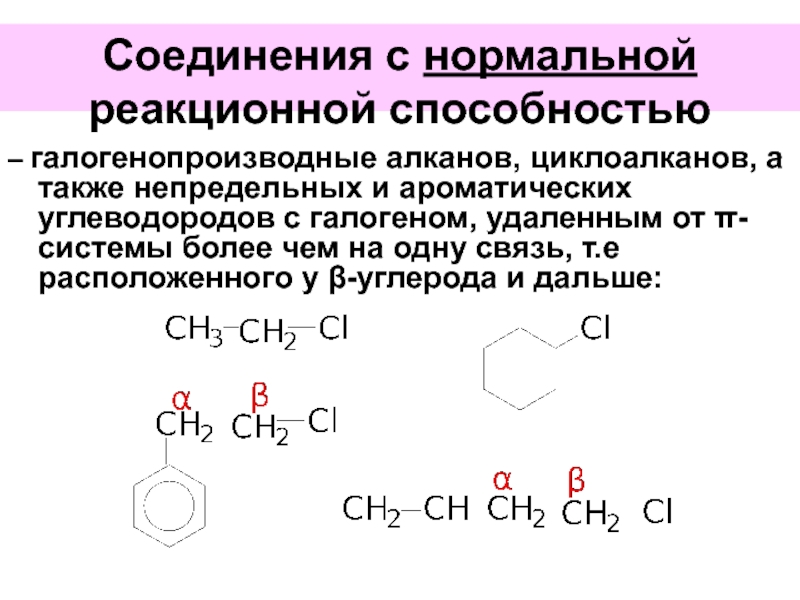
Слайд 45Соединения с нормальной реакционной способностью
– галогенопроизводные алканов, циклоалканов, а также непредельных
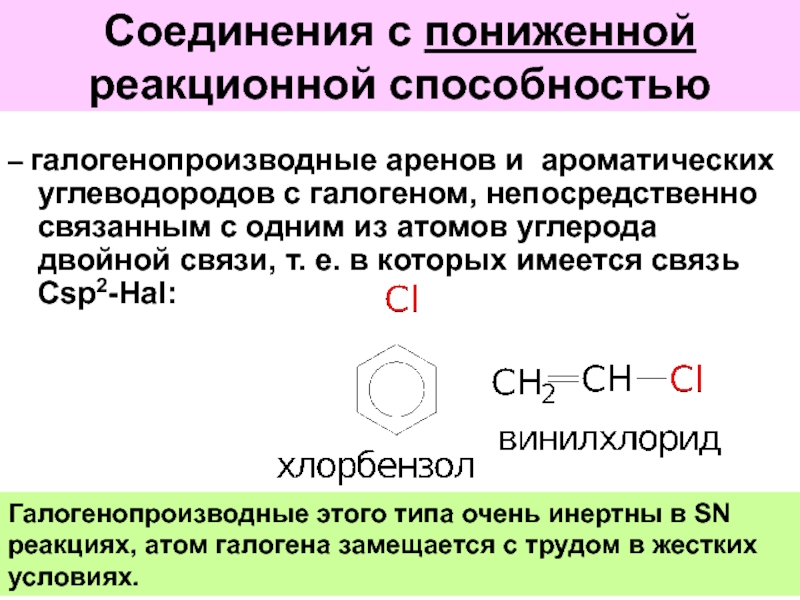
Слайд 46Соединения с пониженной реакционной способностью
– галогенопроизводные аренов и ароматических углеводородов с
Галогенопроизводные этого типа очень инертны в SN реакциях, атом галогена замещается с трудом в жестких условиях.
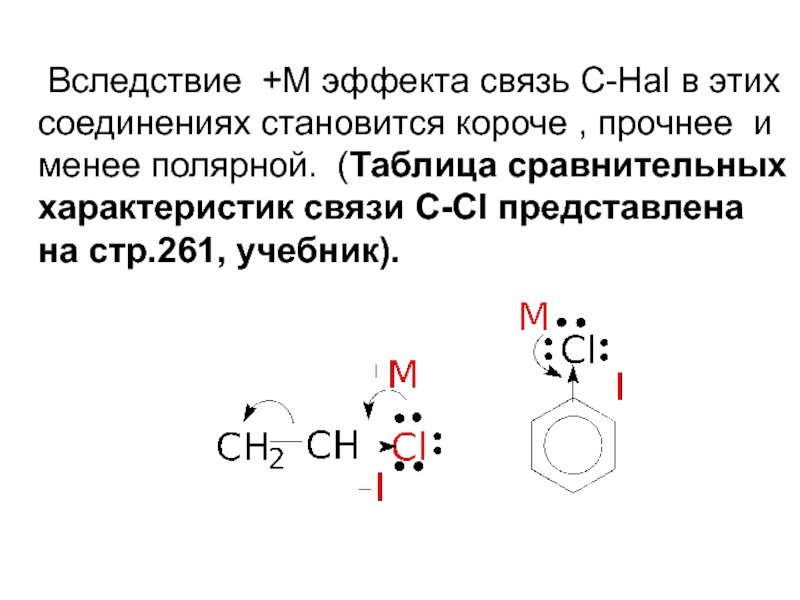
Слайд 47 Вследствие +М эффекта связь С-Hal в этих соединениях становится короче ,
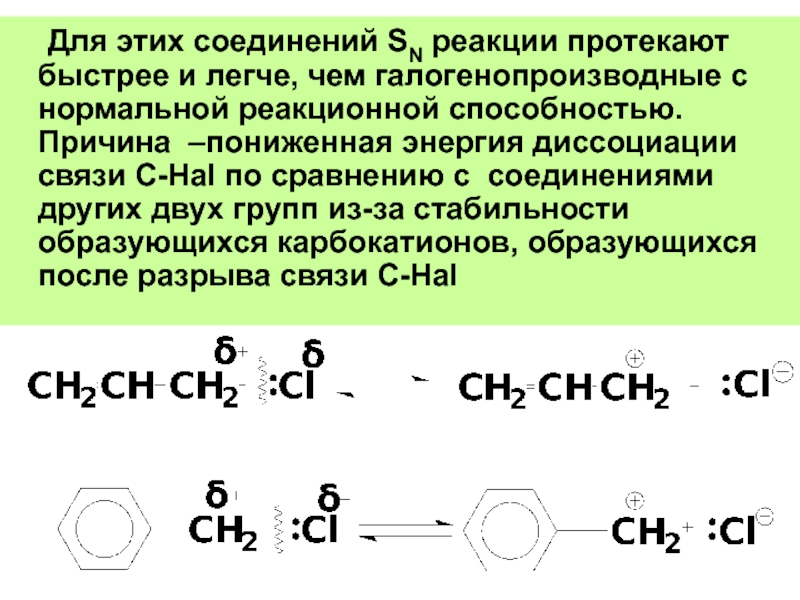
Слайд 48Соединения с повышенной реакционной способностью
– галогенопроизводные углеводородов с галогеном, связанным
Слайд 49 Для этих соединений SN реакции протекают быстрее и легче, чем галогенопроизводные
Слайд 50Природа R влияет и на предпочтительность реализации замещения по (SN1) или
Склонность субстрата вступать в (SN1) или (SN2) реакции зависит от пространственного строения заместителя и от энергии диссоциации связи С-Hal.
Слайд 51В случае SN2 реакции определяющим является стерический фактор: большие по объему
Слайд 52SN1 Реакции могут протекать для тех субстратов, у которых связь С-Hal
Слайд 53Таким образом, третичные субстраты обычно
вступают в SN1, а первичные –
Субстраты вторичные, а также бензильного
и аллильного типа могут реагировать по SN1
или SN2 –механизмам в зависимости от
природы растворителя.
Слайд 54Влияние природы уходящей группы (нуклеофуга)
Хорошие уходящие группы бедны энергией, т.е. являются
Плохие уходящие группы богаты энергией; в них невелика или отсутствует степень делокализации отрицательного заряда.
В ряду алкилгалогенидов реакционная способность в реакциях нуклеофильного замещения изменяется следующим образом:
SN2-механизм
Слайд 55Влияние природы растворителя.
Роль полярного растворителя:
1) принимает участие в ионизации
2) стабилизирует образующиеся ионы за счёт их сольватации;
3) стабилизирует переходное состояние.
Слайд 56По сольватирующей способности растворители делят на протонные и апротонные.
К протонным относятся
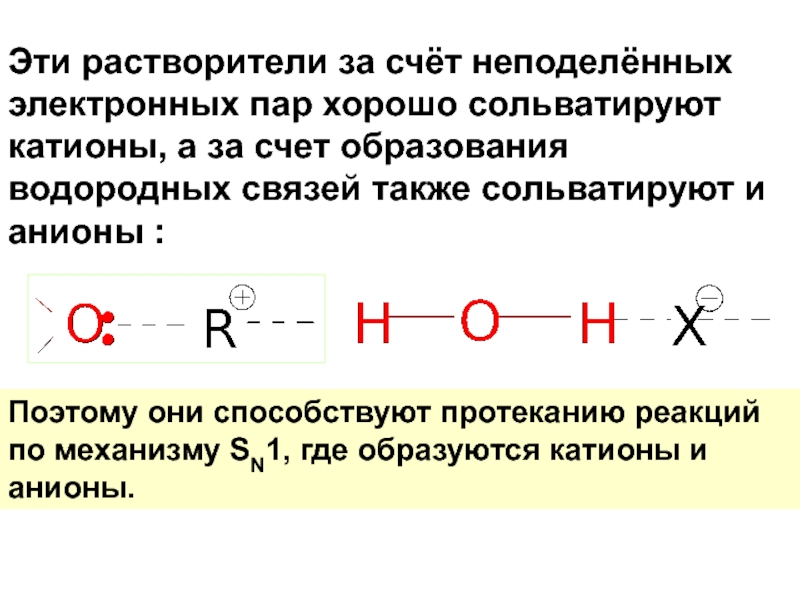
Слайд 57Эти растворители за счёт неподелённых электронных пар хорошо сольватируют катионы, а
Поэтому они способствуют протеканию реакций по механизму SN1, где образуются катионы и анионы.
Слайд 59 Апротонные полярные растворители за счёт неподелённых электронных пар гетероатомов хорошо
Слайд 60Таким образом, характер растворителя оказывает существенное влияние на скорость реакций и
Слайд 61Влияние нуклеофильности реагента.
Активность нуклеофила сказывается на скорости реакций типа SN2, поскольку
Нуклеофильность зависит от:
а) основности реагента,
б) поляризуемости реагента,
в) природы растворителя.
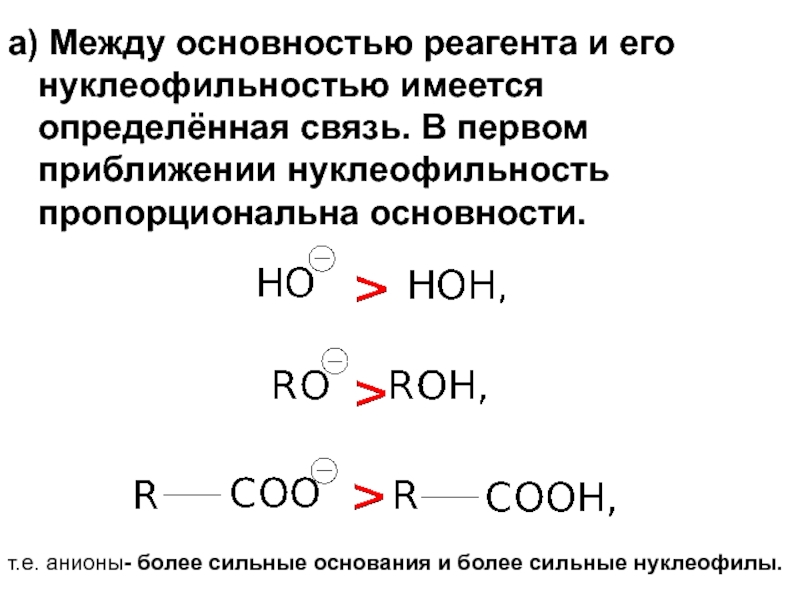
Слайд 62а) Между основностью реагента и его нуклеофильностью имеется определённая связь. В
т.е. анионы- более сильные основания и более сильные нуклеофилы.
Слайд 63
б) Нуклеофильность определяется ещё и поляризуемостью. Чем больше размер атома, тем
Легкополяризуемые реагенты
обладают высокой нуклеофильностью в растворителях различного типа.
Слайд 64в) На нуклеофильность слабополяризуемых ионов значительное влияние оказывает природа растворителя.
В
Слайд 65Сильное взаимодействие между растворителем и анионом малого размера подавляет его нуклеофильность.
Слайд 66Реагенты по возрастанию их нуклеофильности в SN2-реакциях в протонных растворителях можно
Слайд 67Апротонный растворитель не способен сольватировать анионы за счёт образования водородных связей
Слайд 68Порядок нуклеофильности в апротонном растворителе диметилформамиде (ДМФА) становится следующим:
Таблица сравнения SN1-
на стр. 268, Учебник.
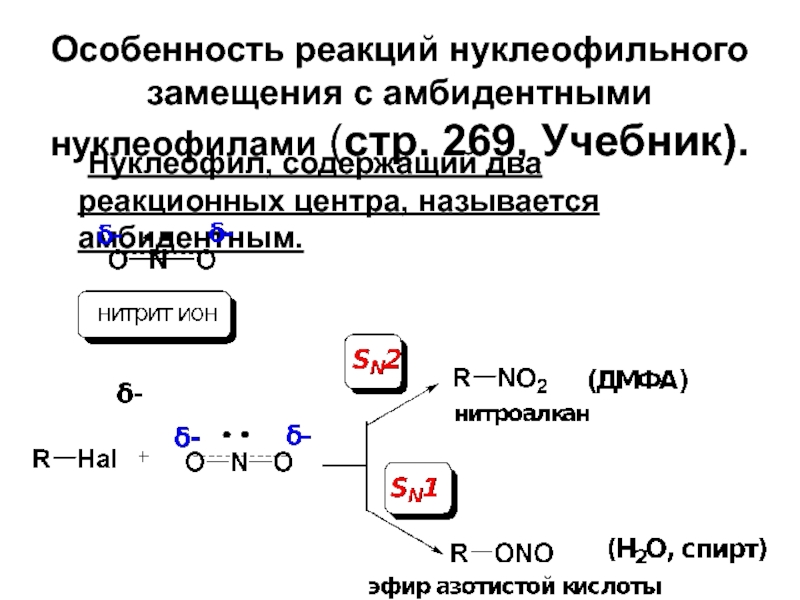
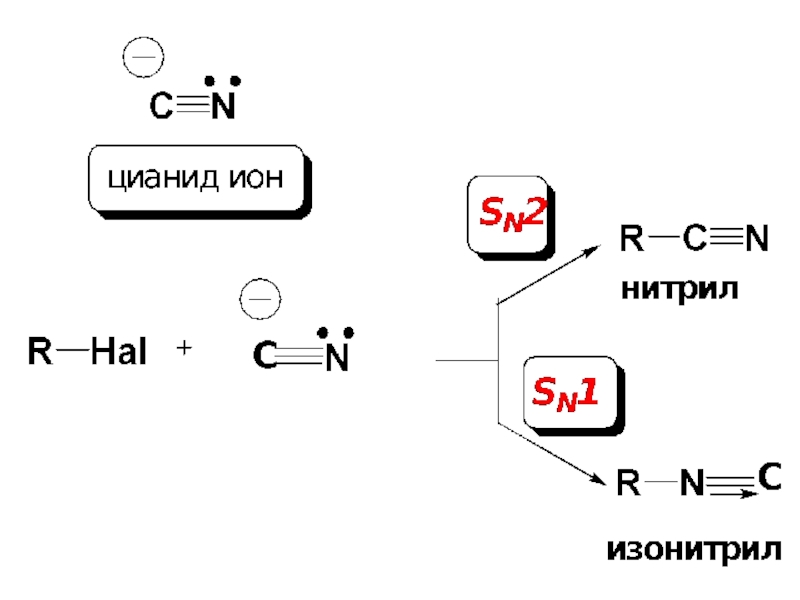
Слайд 69Особенность реакций нуклеофильного замещения с амбидентными нуклеофилами (стр. 269, Учебник).
Нуклеофил, содержащий
Слайд 71Правило Корнблюма:
В SN2-реакциях атакующим атомом амбидентного нуклеофила будет более нуклеофильный атом,
Слайд 72Аллильная перегруппировка.
Реализуется при нуклеофильном замещении в аллильных соединениях.
В SN2-реакциях – продукт
а в В SN1-реакциях – смесь обычного продукта замещения
и продукта аллильной перегруппировки.
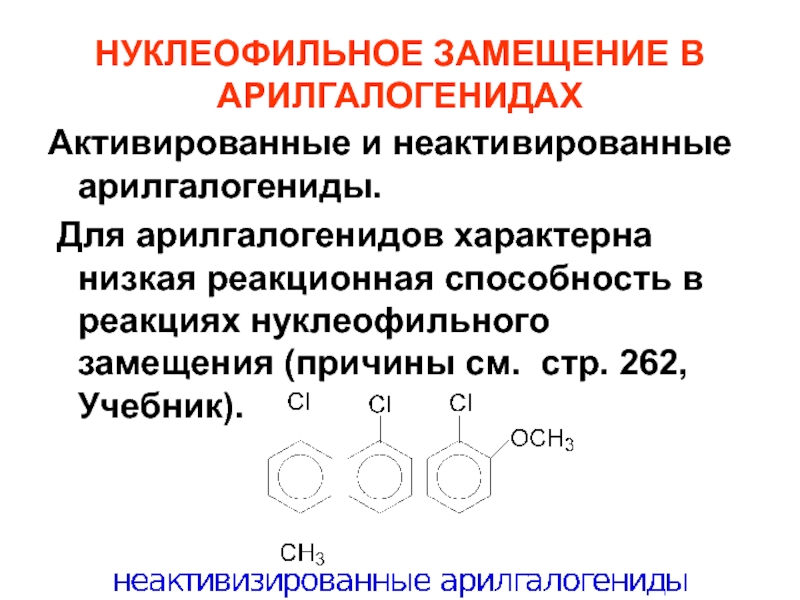
Слайд 73НУКЛЕОФИЛЬНОЕ ЗАМЕЩЕНИЕ В АРИЛГАЛОГЕНИДАХ
Активированные и неактивированные арилгалогениды.
Для арилгалогенидов характерна низкая
Слайд 74Подвижность галогена можно увеличить введением в о- или п-положение сильных электроноакцепторных
1) уменьшают электронную плотность бензольного кольца, особенно в –о и п- положениях, вследствие чего у реакционного центра , связанного с галогеном увеличивается дефицит электронов и облегчается нуклеофильная атака.
2) принимая участие в делокализации отрицательного заряда, электроноакцепторные группы стабилизируют образующийся в лимитирующей стадии σ-аддукт, имеющий характер аниона.
Слайд 75Арилгалогениды, содержащие в о- или п-положении к галогену электроноакцепторные заместители, называют
Слайд 79В реакциях неактивированных арилгалогенидов нуклеофил не всегда занимает то положение, которое
Слайд 80Арилгалогениды, содержащие два заместителя в о-положениях к галогену, не способны к
Слайд 81Механизм реакций нуклеофильного замещения у активированных арилгалогенидов.
На примере гидролиза п-нитрохлорбензола.
Слайд 82Образование δ-аддуктов у арилгалогенидов с электроноакцепторными заместителями выгодно, так как эти
Слайд 83Т.к. в lim-стадии участвуют два вещества реакция по своему типу относится
Сравнение реакций SN2аром и SN2 у насыщенного атома углерода приведено на стр. 276 Учебника.
Слайд 852. РЕАКЦИИ ЭЛИМИНИРОВАНИЯ
Нуклеофильные реагенты являются также основаниями, способными отщеплять протон,
1,2- или β-элиминирование:
Слайд 89Направление и стереохимия реакций элиминирования.
в соответствии с правилом Зайцева:
Правило Зайцева
Слайд 90Стереохимия элиминирования
по Е2 механизму: транс-элиминирование , т. к. обеспечивает максимальное
Слайд 91Факторы, влияющие на соотношение реакций замещения и элиминирования.
а) основность реагента;
б) строение
в) температура реакции.
Слайд 93б) строение субстрата
В зависимости от природ Hal при одинаковом R скорость
Элиминирование более характерно для третичных и менее для первичных алкилгалогенидов.
Слайд 953.РЕАКЦИИ ГАЛОГЕНПРОИЗВОДНЫХ С МЕТАЛЛАМИ
Алкил- и арилгалогениды реагируют с металлами с
Образование литийалкилов:
Литийарилы менее реакционноспособны, чем литийалкилы
Слайд 96 Li образует ковалентную связь с угдеродом, в то время как
Слайд 97 При переходе от R-Ha1 к Li - и Na-органическим соединениям происходит
Поэтому Li -алкилы и Na-алкилы – сильнейшие С-основания и С-нуклеофилы.
Слайд 98Mg-органические галогениды –реактивы Гриньяра ( 1912 г. Нобелевская премия).
Роль диэтилового
1) эфир растворяет RMgX, удаляя его с поверхности металла, что способствует протеканию реакции до конца. Растворение происходит за счёт сольватации эфиром .
2) Диэтиловый эфир имеет низкую Т.кип. (34,8оС) и «подушка» паров над раствором защищает RMgX от окисления О2 воздуха.
Чаще для получения реактивов Гриньяра используются R-Br, так как R-Cl реагируют вяло, R-I дают малые выходы. Н- Алкилгалогениды дают лучшие выходы, чем втор-, а втор- лучшие, чем трет-алкилгалогениды.
Слайд 99Реакции магнийорганических соединений.
В реактивах Гриньяра связь достаточно полярна, что определяет
1). Взаимодействие с соединениями, имеющими подвижный атом водорода.
Слайд 100 Соединения с подвижным атомом водорода разлагают реактивы Гриньяра с образованием
Если в реакции используют CH3MgI, образуется метан. Измеряя его объём, можно количественно определить соединения с активным водородом (спирты, амины, карбоновые кислоты и др.) – метод Чугаева-Церевитинова.











![Кинетика реакции: V=k[субстрат] [реагент]](/img/tmb/2/144960/208990524bd4d81ac472f04cb7895d36-800x.jpg)
![Кинетика реакции: V=k[субстрат] Концентрация нуклеофила на скорость реакции не влияет.](/img/tmb/2/144960/c89b0a09c0793346f0cfe5a76e2a2e4b-800x.jpg)