- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Фосфор. Открытие фосфора презентация
Содержание
- 1. Фосфор. Открытие фосфора
- 2. Открытие фосфора Гамбургский алхимик Хеннинг Бранд
- 3. Алхимик Х.Бранд, пытаясь отыскать «философский камень», получил удивительное вещество. Оказалось, что это был фосфор .
- 4. Фосфор – простое вещество. 1.Химическая формула –
- 5. Апати́т (от др.-греч. ἀπατάω «обманываю») — минерал класса
- 6. Белый фосфор
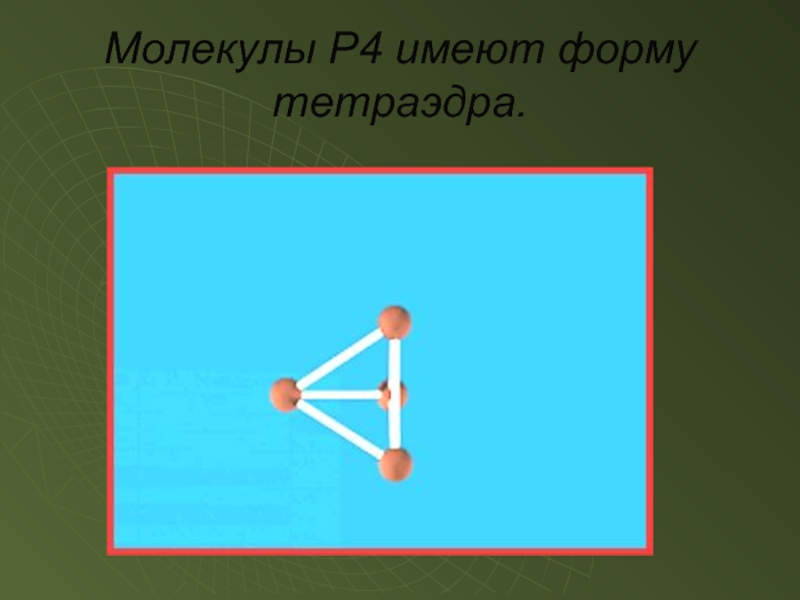
- 7. Молекулы P4 имеют форму тетраэдра.
- 8. Желтый фосфор
- 9. Красный фосфор
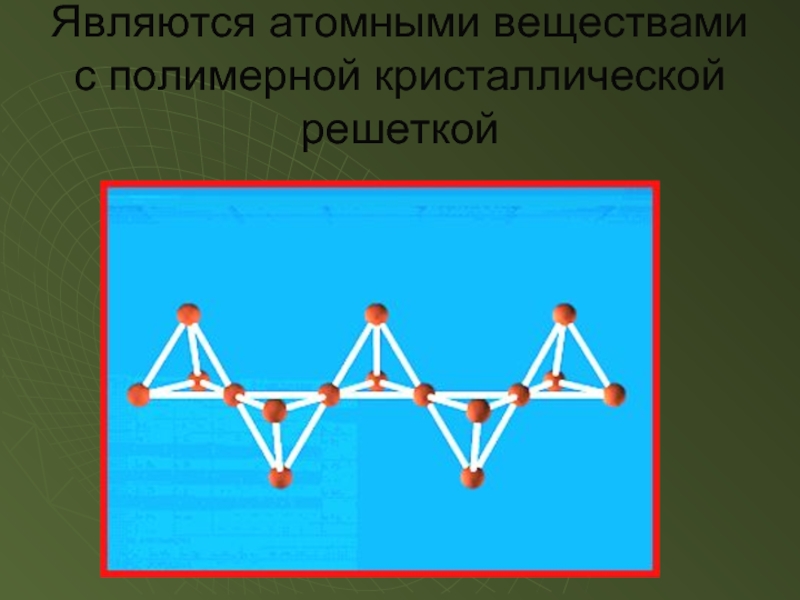
- 10. Являются атомными веществами с полимерной кристаллической решеткой
- 11. Черный фосфор
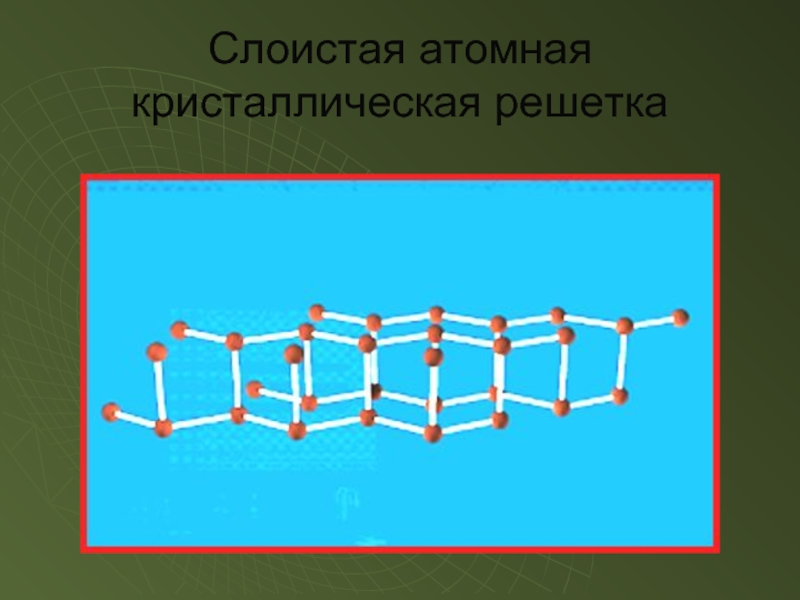
- 12. Слоистая атомная кристаллическая решетка
- 13. Металлический фосфор
- 14. Химические свойства Взаимодействие с простыми веществами Фосфор
- 15. ПРИМЕНЕНИЕ ФОСФОРА Р удобрения ядохимикаты Производство
- 16. Войска США использовали фосфорные Бомбы в Ираке, 2004 г.
- 17. Р ОРГАНИЗМЫ МИНЕРАЛЫ ФОСФОЛИПИДЫ, ФЕРМЕНТЫ,
- 18. Физиологическое действие белого фосфора Результат применения
Слайд 2Открытие фосфора
Гамбургский алхимик
Хеннинг Бранд
1669 год
«Фосфор» -
от греческого «светоносный»
Слайд 3Алхимик Х.Бранд, пытаясь отыскать «философский камень», получил удивительное вещество. Оказалось, что это
был фосфор
.
.
Слайд 4Фосфор – простое вещество.
1.Химическая формула – Р.
2.Mr(Р) =31
3. М (Р) =
31г/моль
4. Физические свойства.
Фосфор образует несколько аллотропных модификаций:
Химические свойства.
а) Фосфор – окислитель
1) Взаимодействие с металлами:
2P + 3Ca = Ca3P2 (фосфид кальция)
б) Фосфор – восстановитель
1) Горение
4Р + 5О2 =2Р2О5
2) Взаимодействие с галогенами (при нагревании)
2Р + 5CI2 = 2PCI5 (при избытке галогена)
2Р + 3CI2 = 2PCI3 (при избытке фосфора)
3) Взаимодействие с серой
2P + 5S = P2S5
2P + 3S = P2S3
С водородом фосфор непосредственно не реагирует. Газообразный фосфин РН3 получают косвенным путем, например:
Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3
4. Физические свойства.
Фосфор образует несколько аллотропных модификаций:
Химические свойства.
а) Фосфор – окислитель
1) Взаимодействие с металлами:
2P + 3Ca = Ca3P2 (фосфид кальция)
б) Фосфор – восстановитель
1) Горение
4Р + 5О2 =2Р2О5
2) Взаимодействие с галогенами (при нагревании)
2Р + 5CI2 = 2PCI5 (при избытке галогена)
2Р + 3CI2 = 2PCI3 (при избытке фосфора)
3) Взаимодействие с серой
2P + 5S = P2S5
2P + 3S = P2S3
С водородом фосфор непосредственно не реагирует. Газообразный фосфин РН3 получают косвенным путем, например:
Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3
Слайд 5Апати́т (от др.-греч. ἀπατάω «обманываю») — минерал класса фосфатов, как правило, бледно-зеленоватого,
голубого, желто-зеленого или розового цвета со стеклянным блеском.
Слайд 14Химические свойства
Взаимодействие с простыми веществами
Фосфор легко окисляется кислородом
Взаимодействует со многими простыми
веществами — галогенами, серой, некоторыми металлами.
с металлами — окислитель, образует фосфиды
фосфиды разлагаются водой и кислотами с образованием фосфина
с неметаллами — восстановитель
Не взаимодействует с водородом.
Взаимодействие с водой
Взаимодействует с водяным паром при температуре выше 500 градусов по Цельсию, протекает реакция диспропорционирования с образованием фосфина и фосфорной кислоты:
Взаимодействие со щелочами
В холодных концентрированных растворах щелочей также медленно протекает реакция диспропорционирования:
Восстановительные свойства
Сильные окислители превращают фосфор в фосфорную кислоту
Реакция окисления фосфора происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль
с металлами — окислитель, образует фосфиды
фосфиды разлагаются водой и кислотами с образованием фосфина
с неметаллами — восстановитель
Не взаимодействует с водородом.
Взаимодействие с водой
Взаимодействует с водяным паром при температуре выше 500 градусов по Цельсию, протекает реакция диспропорционирования с образованием фосфина и фосфорной кислоты:
Взаимодействие со щелочами
В холодных концентрированных растворах щелочей также медленно протекает реакция диспропорционирования:
Восстановительные свойства
Сильные окислители превращают фосфор в фосфорную кислоту
Реакция окисления фосфора происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль
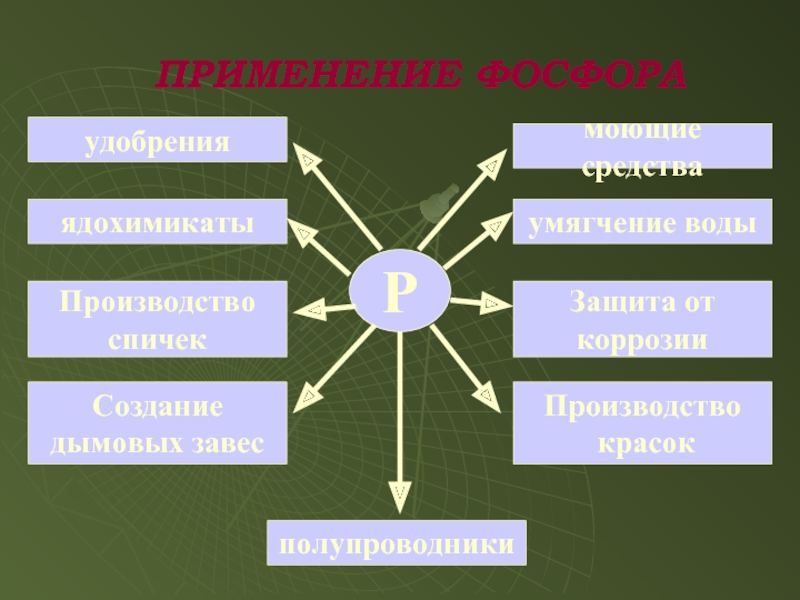
Слайд 15ПРИМЕНЕНИЕ ФОСФОРА
Р
удобрения
ядохимикаты
Производство
спичек
Создание
дымовых завес
полупроводники
Производство
красок
Защита от
коррозии
умягчение воды
моющие средства
Слайд 17
Р
ОРГАНИЗМЫ
МИНЕРАЛЫ
ФОСФОЛИПИДЫ,
ФЕРМЕНТЫ,
ФОСФАТ КАЛЬЦИЯ
ЭФИРЫ
ОРТОФОСФОРНОЙ
КИСЛОТЫ
В ЗУБАХ И КОСТЯХ
ФОСФОРИТ
БИРЮЗА
АПАТИТ
НАХОЖДЕНИЕ В ПРИРОДЕ
АПАТИТ
Слайд 18Физиологическое действие
белого фосфора
Результат применения чрезмерного количества фосфора
Появление лягушек с
уродствами -результат применения фосфорных удобрений, которые смываются в реки и пруды
Фосфорный некроз – поражение челюстей