- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Физико-химический процесс элелктролиз. (11 класс) презентация
Содержание
- 3. Элелктролиз Это физико-химический процесс, протекающий в растворе
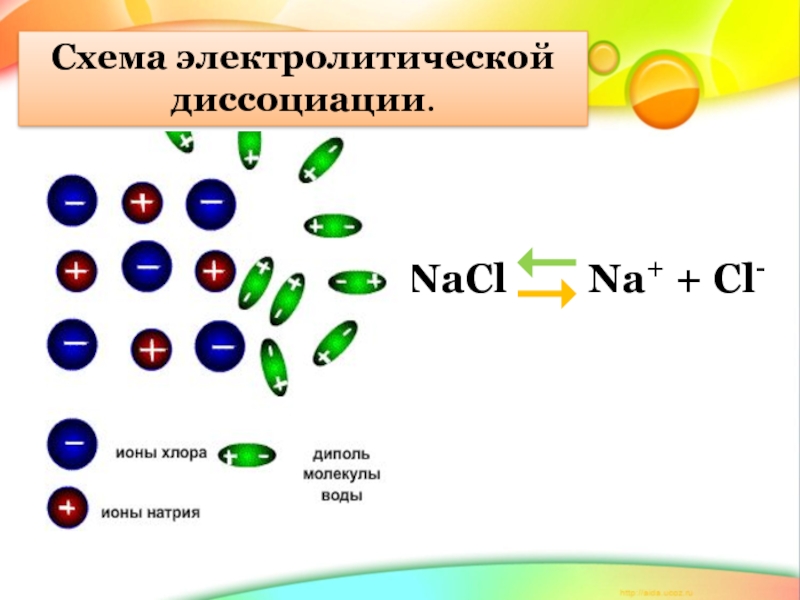
- 4. NaCl Na+ + Cl- Схема электролитической диссоциации.
- 5. Na Cl Na+ Cl-
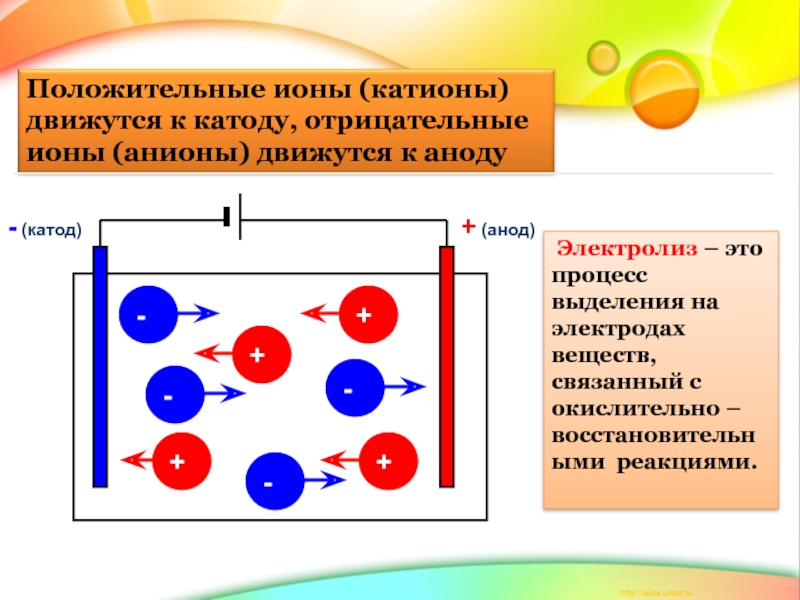
- 6. + (анод) - (катод)
- 7. Электрохимический ряд напряжений металлов Li→Rb→K→Ba→Sr→Ca→Na→Mg→Al→Mn→Zn→Cr→Fe→Cd→Co→Ni→Sn→Pb→H→Sb→Bi→Cu→Hg→Ag→Pd→Pt→Au
- 8. Исследовал электролиз и открыл его законы
- 9. Второй закон электролиза При одинаковом количестве
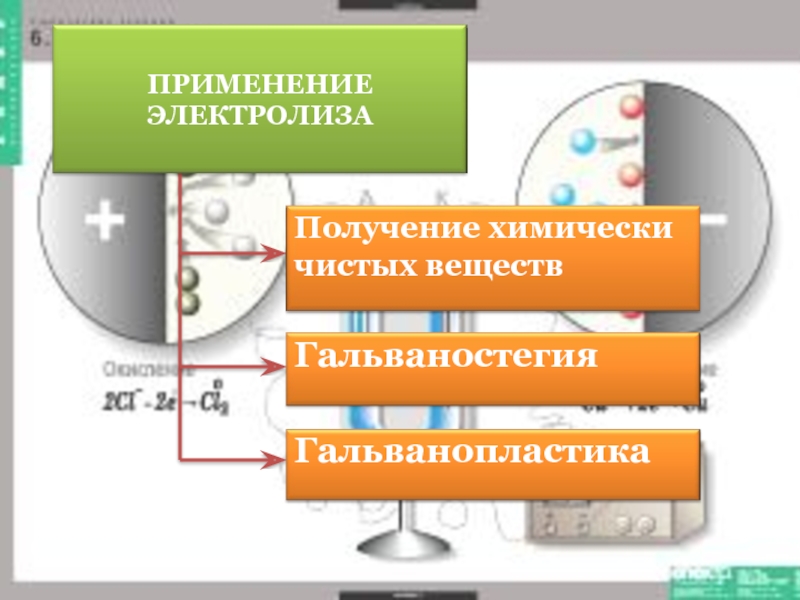
- 12. Гальваностегия это процесс, который позволяет
- 13. Покрытие предметов слоем благородного металла
- 16. это получение электролитическим способом более
- 17. Изготовление медалей, монет.
- 18. Произведения искусства: Барельефы для: Исаакиевского собора
- 19. Петропавловского собора
- 20. Эрмитажа
- 21. Зимнего дворца
- 22. Большого театра
- 23. Медные клише для типографии
- 24. Пресс-формы из пластмассы, резины, металла
- 25. Пресс-формы из пластмассы, резины, металла
- 26. Будьте здоровы!
Слайд 3Элелктролиз
Это физико-химический процесс, протекающий в растворе или расплаве электролита, при пропускании
Слайд 5
Na Cl
Na+
Cl-
Электролитическая диссоциация поваренной соли
NaCl → Na+ + Cl-
Диссоциация других
CuSO4 → Cu 2+ + SO42-
HCl → H + + Cl-
H2SO4 → H+ + H+ + SO42-
CaCl2 → Ca 2+ + Cl- + Cl-
При диссоциации ионы металлов и водорода всегда заряжены положительно, а ионы кислотных радикалов и группы ОН - отрицательно
Слайд 6
+ (анод)
- (катод)
+
+
+
-
-
-
+
-
Электролиз – это процесс выделения на электродах веществ,
Слайд 7Электрохимический ряд напряжений металлов
Li→Rb→K→Ba→Sr→Ca→Na→Mg→Al→Mn→Zn→Cr→Fe→Cd→Co→Ni→Sn→Pb→H→Sb→Bi→Cu→Hg→Ag→Pd→Pt→Au
Слайд 8 Исследовал электролиз и открыл его законы английский физик Майкл Фарадей
Майкл Фарадей (1791 – 1867) Открыл явление электромагнитной индукции, законы электролиза, ввел представления об электрическом и магнитном поле
Первый закон электролиза
Масса вещества, выделившегося на электродах при электролизе, прямо пропорциональна величине заряда, прошедшего через электролит
k – электрохимический эквивалент вещества
(равен массе вещества, выделившегося при прохождении через электролит заряда 1 Кл)
Слайд 9Второй закон электролиза
При одинаковом количестве электричества (электрическом заряде, прошедшем через
M – масса выделившегося вещества k – электрохимический эквивалент М – молярная масса вещества z – валентность вещества
Заряд, необходимый для выделения 1 моля вещества, одинаков для всех электролитов. Он называется числом Фарадея F
Электрохимический эквивалент и число Фарадея связаны соотношением
Слайд 12Гальваностегия
это процесс, который позволяет покрыть изделие слоем (плёнкой) благородного
Слайд 16 это получение электролитическим способом более толстых отложений (до нескольких
ГАЛЬВАНОПЛАСТИКА
Копия барельефа, полученная методом гальванопластики