- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Ферменттер. Ферментативті катализдің механизмі. Ферменттердің жіктелуі презентация
Содержание
- 1. Ферменттер. Ферментативті катализдің механизмі. Ферменттердің жіктелуі
- 2. Дәріс жоспары: Ферменттер, жалпы қасиеттері. Ферментативті катализдің
- 3. Фермент Ферменттер – арнайылығы бар нәруыздар, жасушаларда
- 4. Ферменттердің жалпы қасиеттері: 1. құрылысының күрделілігі (ферменттер
- 5. Ферменттің нәруыздан айырмашылығы активті орталығының болуында, активті
- 6. Активті орталықта функциясы жағынан ерекшеленетін 2 аймақ
- 7. Активті орталық (АО)
- 8. Ферменттер Біркомпонентті жай нәруыз – фермент-протеин
- 9. Ферменттердің әсер ету механизмі 3 сатыдан тұрады:
- 10. ІІ. Фермент-реакция өнімі комплексінің түзілуі Ферменттің
- 11. ІІІ. Фермент-реакция өнімі комплексінің ыдырауы, бос ферменттің
- 12. Ферменттердің әсер ету механизмі
- 13. Ферменттердің номенклатурасы мен жіктелуі. Қазіргі уақытта
- 14. 1961 жылдан бері әрбір фермент 4 санды
- 15. Ферменттердің жіктелуі Барлық белгілі ферменттер катализдейтін реакция
- 16. Энзимдердің 6 класы бөлінген →
- 17. Гидролазалар класы Гидролазалар – судың
- 18. Маңызды топтары Гидролазалар Эстеразалар
- 19. Лиазалар класы Лиазалар –
- 20. Лиазалар екі негізгі тобы Декарбоксилазалар
- 21. 1 тобы. Декарбоксилазалар Кетоқышқылдарының декарбоксилазалары Амин
- 22. Кетоқышқылдарының декарбоксилазалары мультиферменттік
- 24. 2. α–кетоглутаратдекарбоксилаза (α-КГДК). α-кетоглутаратдегидрогеназды мультиферменттік комплекстің
- 25. АҚ–ның декарбоксилазалары екікомпонентті, Ко – пиридоксальфосфат (В6
- 26. Триптофанның декарбоксилденуі нәтижесінде серотонин түзіледі: Триптофан
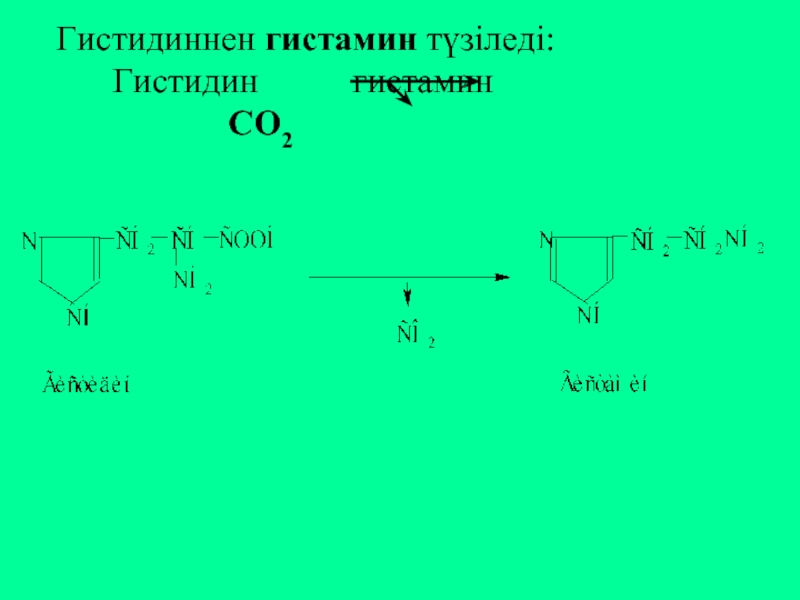
- 27. Гистидиннен гистамин түзіледі: Гистидин гистамин
- 28. Глутамин қышқылынан γ-аминомай қышқылы (ГАМҚ) түзіледі: Глутамин қышқылы γ-аминомай қышқылы СО2
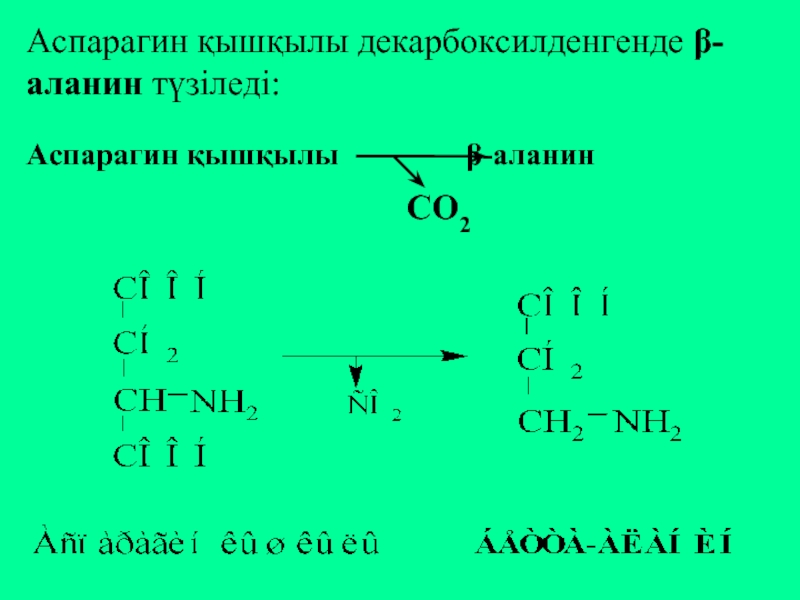
- 29. Аспарагин қышқылы декарбоксилденгенде β-аланин түзіледі: Аспарагин қышқылы β-аланин СО2
- 30. 2 тобы. Карбангидраза. Екікомпонентті, Ко-ң құрамында
- 31. Трансферазалар – атом немесе атом топтарын
- 32. Аминотрансферазалар амин қышқылдарындағы амин тобын кето қышқылдарына
- 33. Аминотрансферазалар катализдейтін реакцияларды қайта аминдену (трансаминдену) деп
- 34. АЛТ және АСТ органдық арнайылығы бар ферменттер.
- 35. Оксидоредуктазалар – организмдегі тотығу-тотықсыздану реакцияларын катализдейтін ферменттер
- 36. Оксидоредуктазалар Дегидрогеназалар (аэробты, анааэробты)
- 37. ДГ субстраттан сутегін, гидрид ионын (Н-), электрондарды
- 38. ДГ-ң саны 150-ден асады. Негізгі өкілдері:
- 39. Пиридин ферменттері (ПФ) ПФ – екі компонентті
- 40. ПФ коферменттерінің құрамы: НАДФ -ң
- 42. ПФ тотыққан және тотықсызданған формада болады. ПФ
- 43. Никотинамид субстратты тотықтырады, өзі тотықсызданады, яғни субстраттан
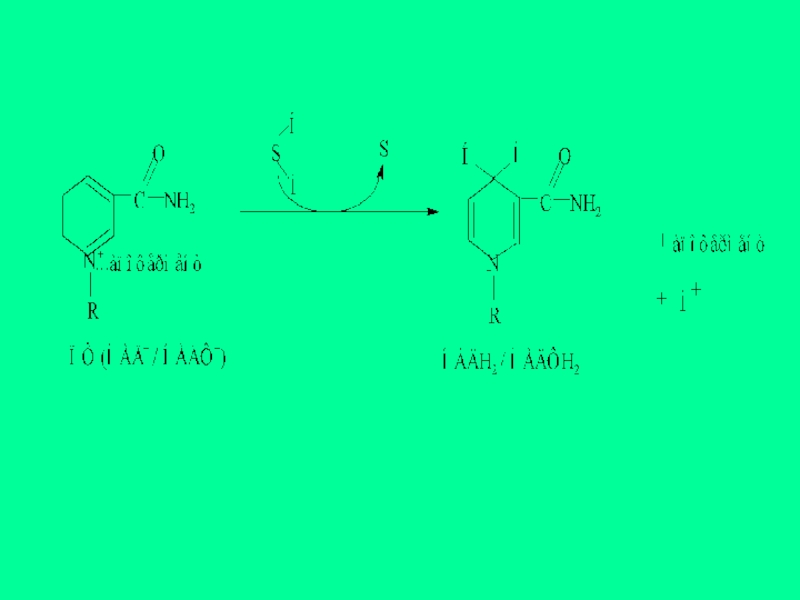
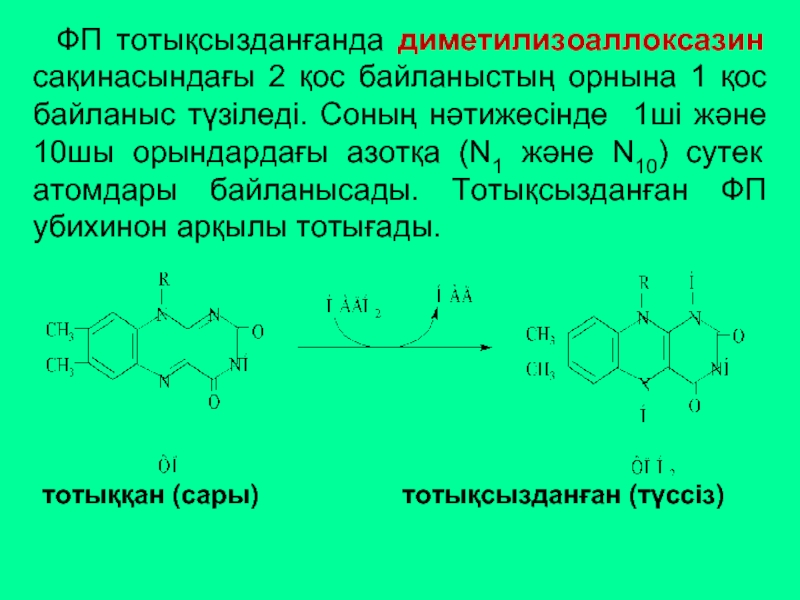
- 45. ФП – екікомпонентті, Ко – флавинмононуклеотид
- 47. ФП тотыққан күйінде сары түс береді, сондықтан
- 48. ФП тотықсызданғанда диметилизоаллоксазин сақинасындағы 2 қос
- 49. Кейбір ФП оттегімен тікелей әрекеттесіп, сутегінің асқын
- 50. Цитохромдар Цитохромдар деп жасушада және микроорганизмдерде кездесетін,
- 51. Цитохромдар (Цх) – екікомпонентті, Ко –
- 52. Каталаза мен пероксидазалар 2Н2О2 →2Н2О + О2
- 53. Оксигеназалар – оттегін қосып алушы ферменттер. Цитоплазмада,
- 54. стероидтар, ксенобиотиктер және басқа да циклді қосылыстардың
- 55. Оксигеназалар RH + O2 + HAДФН +
- 56. ӘДЕБИЕТТЕР: Қазақ тілінде: 1.Северин Е.С. (қазақ
- 57. ӘДЕБИЕТТЕР: Орыс тілінде: Северин Е,С. «Биохимия»,
- 58. НАЗАРЛАРЫҢЫЗҒА РАХМЕТ!
Слайд 1№ 2 дәріс
ФЕРМЕНТТЕР.
Ферментативті катализдің механизмі. Ферменттердің жіктелуі. Гидролазалар, лиазалар,
Слайд 2Дәріс жоспары:
Ферменттер, жалпы қасиеттері.
Ферментативті катализдің механизмі.
Ферменттердің номенклатурасы және жіктелуі.
Гидролазалар.
Лиазалар.
Трансферазалар.
Оксидоредуктазалар.
Слайд 3Фермент
Ферменттер – арнайылығы бар нәруыздар, жасушаларда түзіліп, химиялық үрдістерді тездетуге қабілетті
«Фермент» термині «fermentum» - ашытқы латын сөзінен шыққан. Ағылшын тіліндегі әдебиеттерде «энзим» сөзі пайдаланылады, грек тілінінен «en zyme» – ашытқыда деген мағына береді.
Слайд 4Ферменттердің жалпы қасиеттері:
1. құрылысының күрделілігі (ферменттер химиялық табиғаты нәруыз болғандықтан, нәруыздарға
2. әсер ету қуаттылығы жоғары;
3.жоғары арнайылығы;
4. ағзада жайлы жағдайда әсер етеді ( tо 37-45о, қысым 1 атм.);
5. активтілігін реттеуге болатын заттар (фермент пен субстрат концентрациясы, орта рН-ы, температура, эффекторлар).
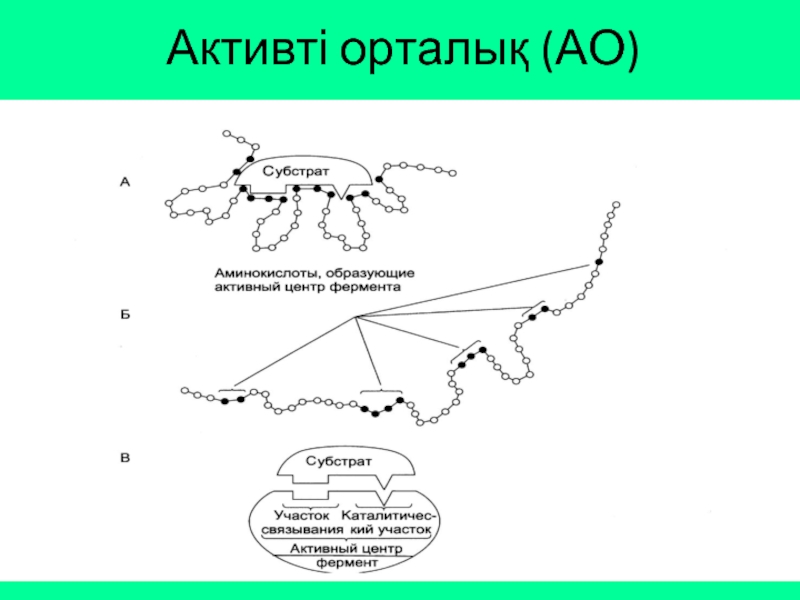
Слайд 5Ферменттің нәруыздан айырмашылығы активті орталығының болуында, активті орталығы арқылы фермент өз
Активті орталық – ферменттердің беткі жағына орналасқан амин қышқылдарының функционалды топтарының белгілі бір шектелген кеңістікке шоғырлануы.
Субстрат – фермент әсер ететін зат.
Құрылысының күрделілігі
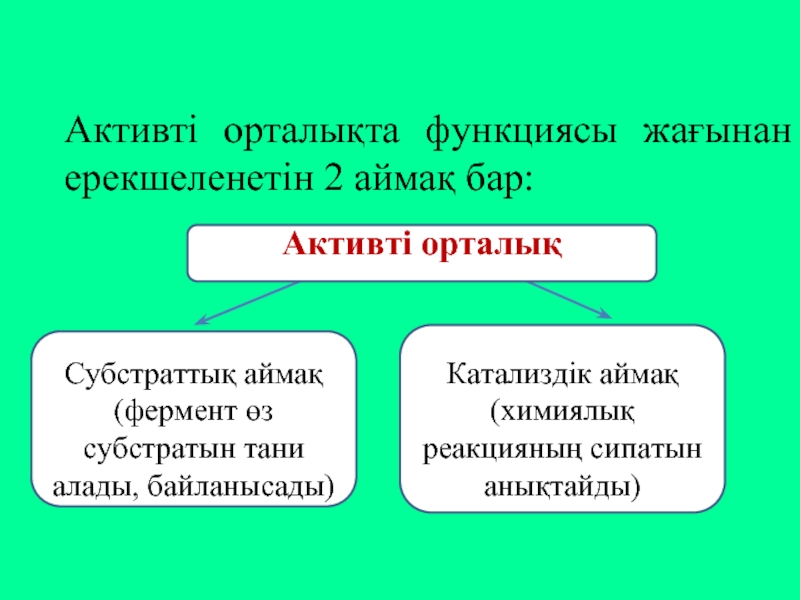
Слайд 6Активті орталықта функциясы жағынан ерекшеленетін 2 аймақ бар:
Активті орталық
Субстраттық
Катализдік аймақ (химиялық реакцияның сипатын анықтайды)
Слайд 8Ферменттер
Біркомпонентті
жай нәруыз – фермент-протеин
Мысалы: пепсин, трипсин , α-амилаза.
Екікомпонентті –
Апофермент (жай нәруыз) және простетикалық топтан, яғни коферменттен тұрады
Слайд 9Ферменттердің әсер ету механизмі
3 сатыдан тұрады:
І. Фермент-субстрат комплексінің түзілуі.
Субстрат ферменттің
Слайд 10
ІІ. Фермент-реакция өнімі комплексінің түзілуі
Ферменттің активті орталығындағы активті топтар субстраттағы байланыстарды
Слайд 11ІІІ. Фермент-реакция өнімі комплексінің ыдырауы, бос ферменттің бөлінуі.
ІІІ сатысы баяу жүреді,
Слайд 12
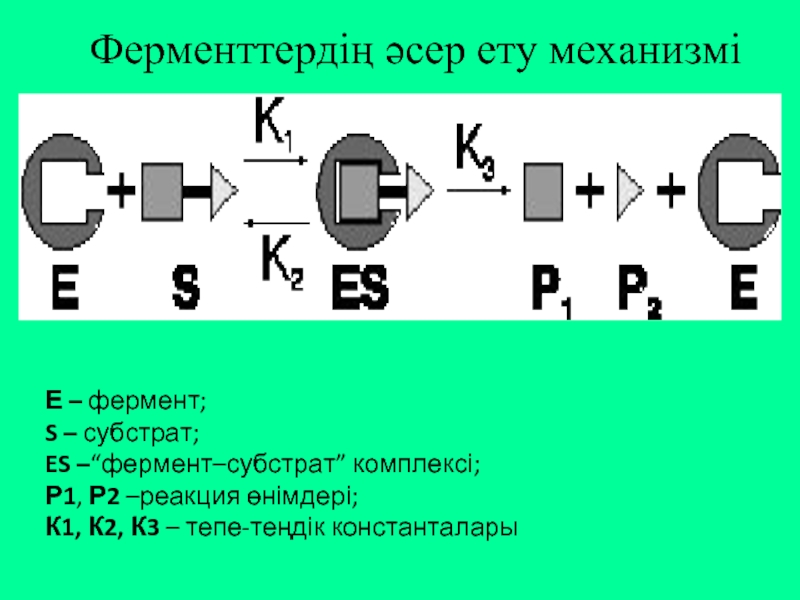
Ферменттердің әсер ету механизмі
Е – фермент;
S – субстрат;
ES –“фермент–субстрат”
Р1, Р2 –реакция өнімдері;
К1, К2, К3 – тепе-теңдік константалары
Слайд 13Ферменттердің номенклатурасы мен жіктелуі.
Қазіргі уақытта барлық ферменттер класқа жіктеледі. Әр
Ферменттің аталуы субстраттың атына немесе катализдейтін реакция атына “аза” деген жалғау қосылып оқылады. Кейбір ферменттердің тривиальды аттары сақталған.
Слайд 141961 жылдан бері әрбір фермент 4 санды шифр бойынша белгіленеді:
Мысалы: ұйқы
"3" класты - гидролазалар класын,
"1" топты - эстеразалар тобын (күрделі эфирлік байланысты үзеді),
"1" топшаны – карбоэстеразалар топшасын (карбон қышқылынан түзілген күрделі эфирлік байланысты үзеді),
"3" –ферменттің осы топшадағы реттік санын көрсетеді.
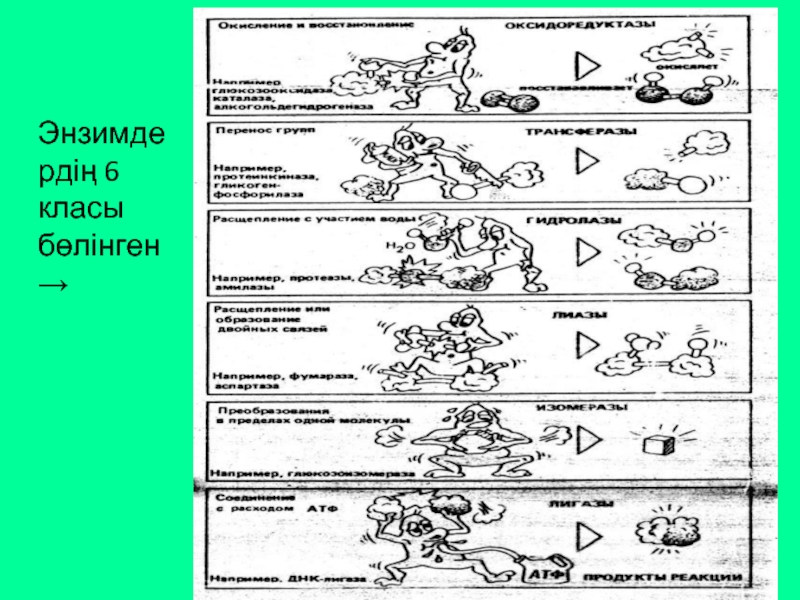
Слайд 15Ферменттердің жіктелуі
Барлық белгілі ферменттер катализдейтін реакция түріне байланысты 6 класқа бөлінеді:
Оксидоредуктазалар
Трансферазалар
Гидролазалар
Лиазалар
Изомеразалар
Лигазалар (синтетазалар)
Слайд 17
Гидролазалар класы
Гидролазалар – судың қатысуымен күрделі заттардың мономерлерге дейін ыдырауын
Гидролазалар (карбоксипептидазадан басқасы) – біркомпонентті ферменттер,
жасушаларда, ас қорыту сөлдерінде кездеседі.
Гидролазалар 9 топқа бөлінеді, 3 тобын қарастырамыз:
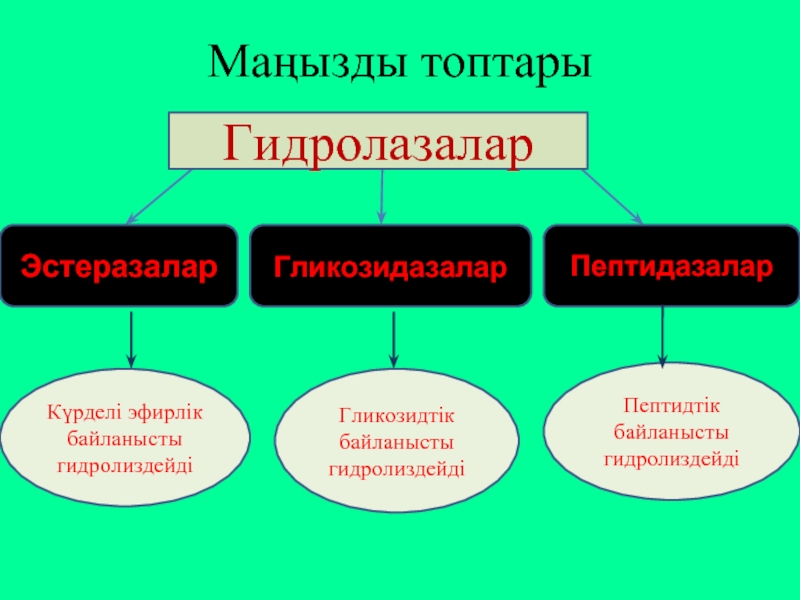
Слайд 18Маңызды топтары
Гидролазалар
Эстеразалар
Гликозидазалар
Пептидазалар
Күрделі эфирлік байланысты гидролиздейді
Гликозидтік
Пептидтік байланысты гидролиздейді
Слайд 19Лиазалар класы
Лиазалар – судың қатысуынсыз субстраттан белгілі бір
Лиазалар – екікомпонентті, жасушалық ферменттер (240≈ өкілі бар).
Слайд 20
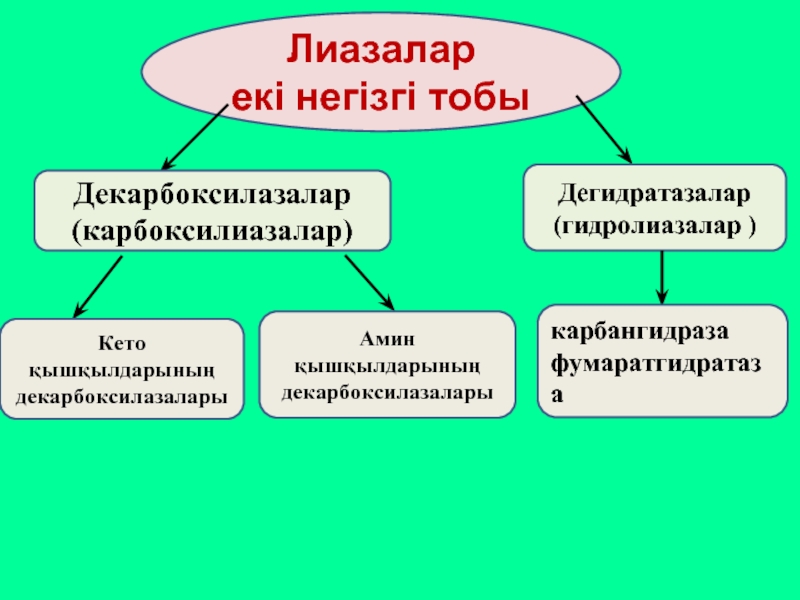
Лиазалар
екі негізгі тобы
Декарбоксилазалар (карбоксилиазалар)
Дегидратазалар
(гидролиазалар )
Кето қышқылдарының декарбоксилазалары
Амин қышқылдарының декарбоксилазалары
карбангидраза
фумаратгидратаза
Слайд 211 тобы. Декарбоксилазалар
Кетоқышқылдарының декарбоксилазалары
Амин қышқылдарының декарбоксилазалары
Екікомпонентті,
Ко – тиаминдифосфат
(В1
Екікомпонентті,
Ко – пиридоксальфосфат
(В6 вит. + Н3РО4)
Декарбоксилазалар
СООН тобын СО2 түрінде бөліп алу реакция ларын катализдейді.
Слайд 22 Кетоқышқылдарының декарбоксилазалары мультиферменттік комплекстің құрамына кіреді, тотығудан
Өкілдері:
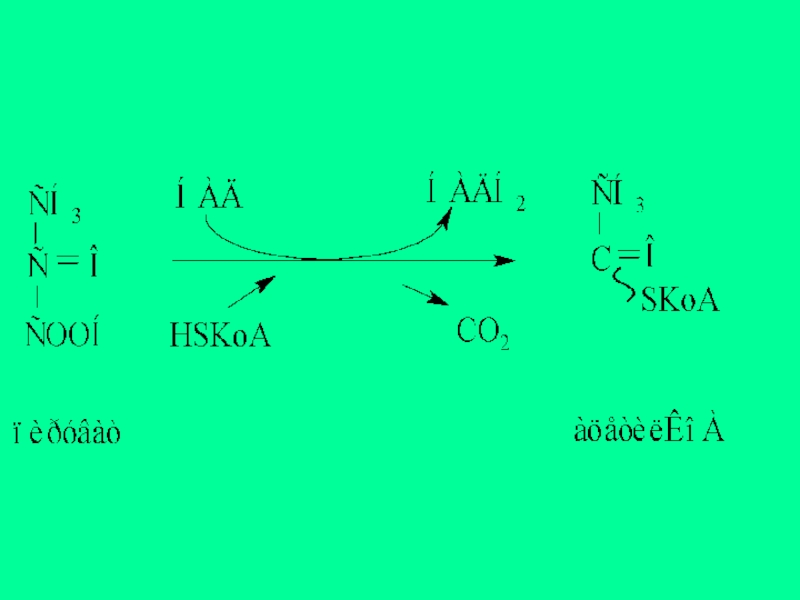
1.пируватдекарбоксилаза (ПДК) пируватдегидрогеназды мультиферменттік комплекстің құрамына кіріп, ПЖҚ-ның тотығудан декарбоксилдену реакциясын катализдейді:
Слайд 242. α–кетоглутаратдекарбоксилаза (α-КГДК).
α-кетоглутаратдегидрогеназды мультиферменттік комплекстің (α-КГДГ м/ф к) құрамында α-КГ-ң
Слайд 25АҚ–ның декарбоксилазалары екікомпонентті, Ко – пиридоксальфосфат (В6 вит. + Н3РО4).
Бұл ферменттер
бактериялар
инфекциялық аурулар мен шіру үдерісінде маңызы зор;
АҚ-ның аралық алмасуына қатысады.
АҚ-ның декарбоксилдену реакцияларын (қайтымсыз) катализдейді, реакция өнімі –биогенді аминдер (серотонин, гистамин, ГАМҚ).
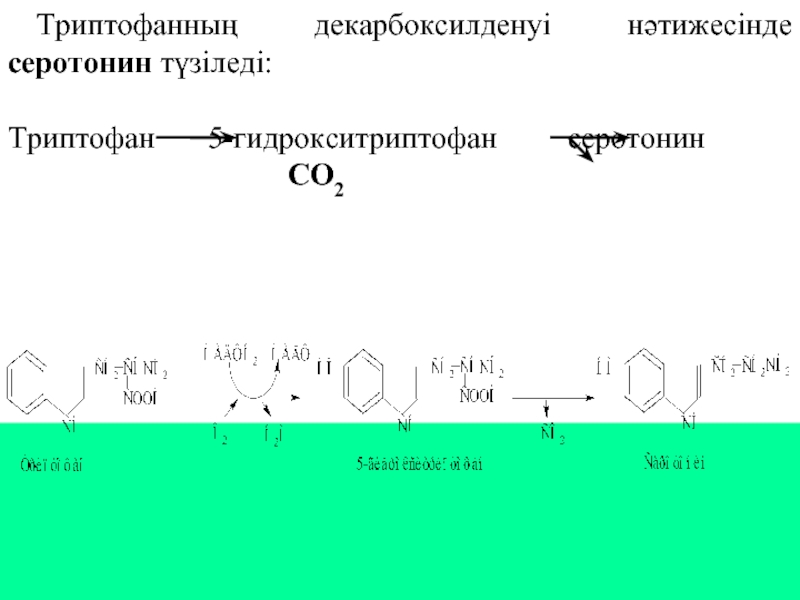
Слайд 26Триптофанның декарбоксилденуі нәтижесінде серотонин түзіледі:
Триптофан 5-гидрокситриптофан серотонин
СО2
Слайд 28Глутамин қышқылынан γ-аминомай қышқылы (ГАМҚ) түзіледі:
Глутамин қышқылы γ-аминомай қышқылы
СО2
Слайд 302 тобы. Карбангидраза.
Екікомпонентті, Ко-ң құрамында Zn 2+ бар. Катализдейтін
Н2О + СО2 Н2СО3
Негізінен эритроциттерде кездеседі, СО2 тіндерден өкпеге тасымалдауға қатысады. Бұл реакцияның бағыты СО2 концентрациясына тәуелді. 1 л қанда 2 г жуық фермент бар.
Слайд 31 Трансферазалар – атом немесе атом топтарын бір қосылыстан екіншісіне тасымалдау
Трансферазалар класы
Слайд 32Аминотрансферазалар амин қышқылдарындағы амин тобын кето қышқылдарына тасымалдап, жаңадан сәйкес амин
Аминотрансферазалар (трансаминазалар) тобы
Слайд 33Аминотрансферазалар катализдейтін реакцияларды қайта аминдену (трансаминдену) деп атайды, реакциялар –қайтымды.
Аминотрансферазалардың
Аланинаминотрансфераза (АЛТ)
Аспартатаминотрансфераза (АСТ)
Слайд 34АЛТ және АСТ органдық арнайылығы бар ферменттер.
Бауыр ауруларында (гепатит, сарғыштану)
Миокард инфарктысы кезінде қанда АСТ активтілігі артады.
Сондықтан бұл ферменттерді анықтаудың диагностикалық маңызы бар.
Слайд 35Оксидоредуктазалар – организмдегі тотығу-тотықсыздану реакцияларын катализдейтін ферменттер класы.
Екікомпонентті ферменттер, жасушаларда
90 тобы бар, негізгі 4 тобын қарастырамыз.
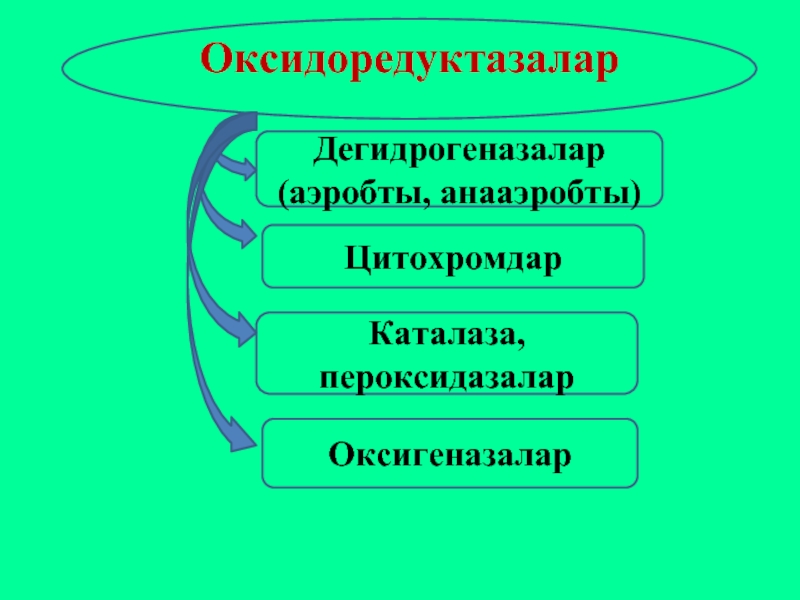
Слайд 36Оксидоредуктазалар
Дегидрогеназалар (аэробты, анааэробты)
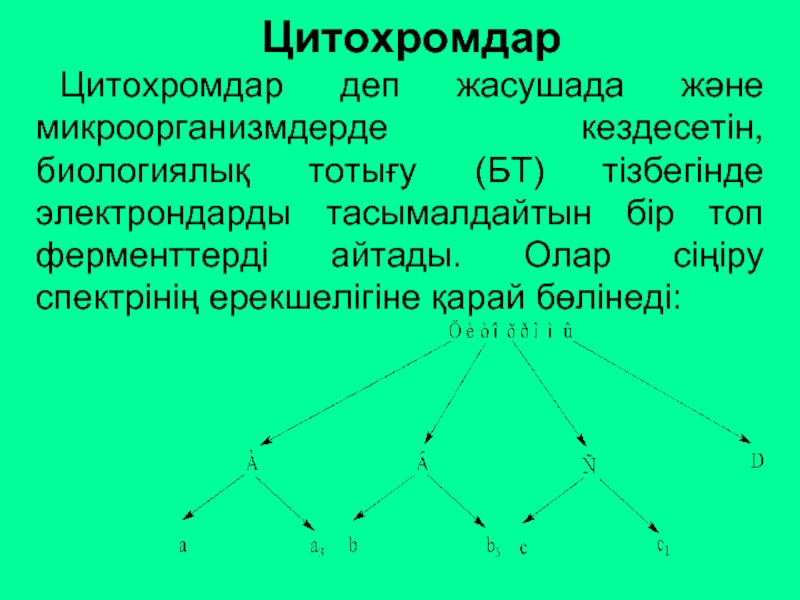
Цитохромдар
Каталаза, пероксидазалар
Оксигеназалар
Слайд 37ДГ субстраттан сутегін, гидрид ионын (Н-), электрондарды (е-) бөліп шығару арқылы
сутекті (электронды) беруші зат – сутектің (электронның) доноры,
сутекті (электронды) қосып алушы зат – сутектің (электронның) акцепторы.
Реакция барысында Н немесе е- жоғалтқан қосылыс тотығып, қосып алған қосылыс тотықсызданады.
Дегидрогеназалар (ДГ)
Слайд 38ДГ-ң саны 150-ден асады.
Негізгі өкілдері:
Пиридин ферменттері (ПФ);
Флавин ферменттері немесе
Слайд 39Пиридин ферменттері (ПФ)
ПФ – екі компонентті ферменттер.
Ко:
никотинамидадениндинуклеотид (НАД)
никотинамидадениндинуклеотидфосфат (НАДФ).
ПФ-нде апофермент
Слайд 40
ПФ коферменттерінің құрамы:
НАДФ -ң НАД -н айырмашылығы: АМФ –ң құрамындағы рибозаның
НАД-ң құрамы:
Никотинамид (РР вит.);
рибоза;
фосфор қышқылы;
АМФ.
Слайд 42ПФ тотыққан және тотықсызданған формада болады.
ПФ – біріншілік ДГ, яғни субстратты
ПФ құрылысы жағынан күрделі болғанымен, іс жүзінде никотинамид қана тотығу-тотықсыздану реакциясына қатысады. Қалған бөлігі реакция барысында коферменттің тұрақтылығын сақтап, реакцияның ақаусыз жүруін қамтамасыз етеді.
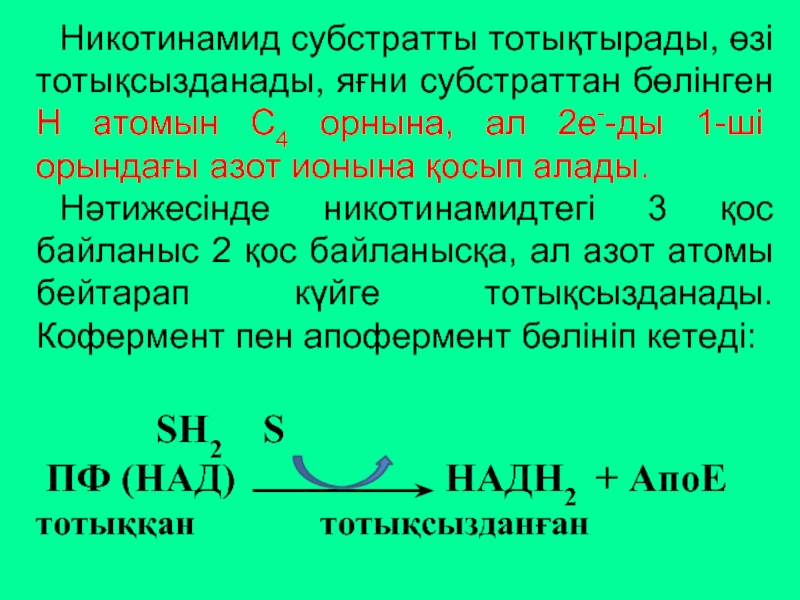
Слайд 43Никотинамид субстратты тотықтырады, өзі тотықсызданады, яғни субстраттан бөлінген Н атомын С4
Нәтижесінде никотинамидтегі 3 қос байланыс 2 қос байланысқа, ал азот атомы бейтарап күйге тотықсызданады. Кофермент пен апофермент бөлініп кетеді:
SH2 S
ПФ (НАД) НАДН2 + АпоЕ
тотыққан тотықсызданған
Слайд 45ФП – екікомпонентті,
Ко – флавинмононуклеотид (ФМН) және флавинадениндинуклеотид (ФАД).
Ко-нің
Апофермент пен кофермент берік байланысқан.
Флавин ферменттері немесе флавопротеиндер (ФП).
Слайд 47ФП тотыққан күйінде сары түс береді, сондықтан оларды ХП-ге, соның ішінде
ФП-нің тотығу-тотықсыздану потенциалы (ТТП) жоғары, сондықтан олар ПФ-ны тотықтырады, өзі тотықсызданған формаға айналады:
НАДН2 НАД
ФП (ФМН) ФПН2 (ФМНН2)
тотыққан тотықсызданған
Слайд 48
ФП тотықсызданғанда диметилизоаллоксазин сақинасындағы 2 қос байланыстың орнына 1 қос байланыс
тотыққан (сары) тотықсызданған (түссіз)
Слайд 49Кейбір ФП оттегімен тікелей әрекеттесіп, сутегінің асқын тотығын (Н2О2) түзеді. Реакцияның
Слайд 50Цитохромдар
Цитохромдар деп жасушада және микроорганизмдерде кездесетін, биологиялық тотығу (БТ) тізбегінде электрондарды
Слайд 51Цитохромдар (Цх) – екікомпонентті,
Ко – гем және оның туындылары.
Гемнің
тотыққан – ферри (Fe3+),
тотықсызданған – ферро (Fe2+).
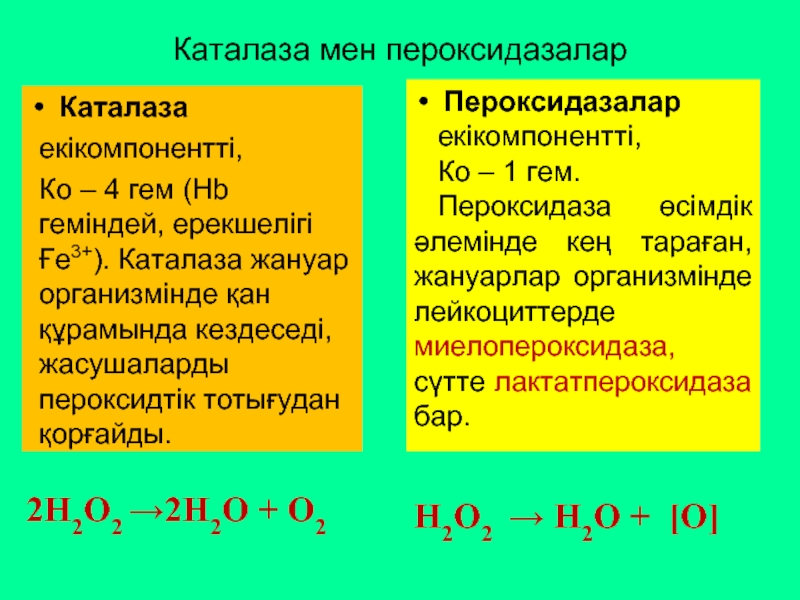
Слайд 52Каталаза мен пероксидазалар
2Н2О2 →2Н2О + О2
Каталаза
екікомпонентті,
Ко – 4 гем
Н2О2 → Н2О + [О]
Пероксидазалар
екікомпонентті,
Ко – 1 гем.
Пероксидаза өсімдік әлемінде кең тараған, жануарлар организмінде лейкоциттерде миелопероксидаза, сүтте лактатпероксидаза бар.
Слайд 53Оксигеназалар – оттегін қосып алушы ферменттер. Цитоплазмада, мембрананың эндотелиалдық жүйесінде, митохондрияларда
Гидроксилазалар екікомпонентті, коферментінің құрамында С витамині бар.
Оксигеназалар (Гидроксилазалар) тобы
Слайд 54стероидтар, ксенобиотиктер және басқа да циклді қосылыстардың алмасуында маңызды роль атқарады,
холестерол мен адреналиннің синтезіне қатысады.
Гидроксилазалар моно– және диоксигеназалар болып 2 топшаға бөлінеді.
Гидроксилазалардың ролі:
Слайд 55Оксигеназалар
RH + O2 + HAДФН + Н+→ ROH Н2О + НАДФ+
R
Монооксигеназалар ксенобиотиктерді залалсыздандырудың бірінші сатысына қатысады. Ол оттектің бір атомын субстратқа, екіншісін суға енгізу реакцияларын катализдейді:
Диоксигеназалар
активті орталығында темір иондарының электрондары арқылы молекулалық оттекті активтендіріп, оны субстратқа тікелей енгізеді:
Слайд 56ӘДЕБИЕТТЕР:
Қазақ тілінде:
1.Северин Е.С. (қазақ тіліне аударған және жауапты редакторы А.Ж.Сейтембетова)
2. Сеитов З.С. Биологиялық химия, Алматы, 2012 ж.
Сейтембетов Т.С., Төлеуов Б.И., Сейтембетова А.Ж.. Биологиялық химия.-Қарағанды, 2007.
Тапбергенов С.О. Медициналық биохимия.-Павлодар.-2008.
Плешкова С.М. және басқалары Биохимияны студенттердің өздігінен оқып-білуіне арналған оқу құралы
1Бөлім. Белоктар, ферменттер, энергия алмасуы, витаминдер.
2Бөлім. Заттар алмасуы және оның реттелуі.
3Бөлім. Адам ағзасындағы сұйықтықтар мен тіндер биохимиясы.– Алматы, 2009 ж.
6.Биохимия пәнінен студенттердің өздігінен дайындалауына арналған тест сұрақтары – Алматы, 2007
Слайд 57ӘДЕБИЕТТЕР:
Орыс тілінде:
Северин Е,С. «Биохимия», М.: ГЭОТАР-МЕДИА, 2013г.
Сеитов З.С. «Биохимия», Алматы, 2012
Harper's Illustrated Biochemistry, 29e, 2012 y.
Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека. 2003 г.
Кольман Я., Рем К-Г. Наглядная биохимия.- М.: Мир, 2004 г.
Шарманов Т.Ш., Плешкова С.М. «Метаболические основы питания с курсом общей биохимии», г. Алматы, 1998г.