- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Энергетика химических процессов. Основы термохимии презентация
Содержание
- 1. Энергетика химических процессов. Основы термохимии
- 2. Содержание Основные понятия химической термодинамики Внутренняя
- 3. Химическая термодинамика изучает переходы энергии из одной
- 4. Основные понятия химической термодинамики Система –
- 5. Типы систем по характеру взаимодействия
- 11. Взаимосвязь между параметрами системы – уравнение
- 12. Функции состояния внутренняя
- 13. Внутренняя энергия (U) - сумма кинетической энергии
- 20. ► Изохорический процесс – процесс, происходящий
- 21. ► Изобарический процесс – процесс, происходящий в
- 22. ► Изобарический процесс – процесс, происходящий в
- 23. Стандартные условия Все вещества, участвующие в реакции,
- 24. Термохимические уравнения - уравнения химических
- 25. Энтальпия образования - энтальпия реакции
- 26. Закон Гесса энтальпии реакций, протекающих при постоянном
- 29. Расчет стандартной энтальпии реакции FeO(к)
- 30. Закон Гесса. Следствие 1 Энтальпия реакции равна
- 36. Заключение Химическая термодинамика изучает энергетические эффекты химических
- 37. Рекомендуемая литература Никольский А.Б., Суворов А.В. Химия.
Слайд 1
ИННОВАЦИОННАЯ ОБРАЗОВАТЕЛЬНАЯ ПРОГРАММА
Лекция 1
ЭНЕРГЕТИКА ХИМИЧЕСКИХ
ПРОЦЕССОВ.
ОСНОВЫ ТЕРМОХИМИИ
Слайд 2Содержание
Основные понятия химической термодинамики
Внутренняя энергия. Первое начало термодинамики
Тепловые эффекты химических реакций.
Основы термохимии. Термохимические уравнения
Термохимические расчёты. Закон Гесса
Модуль I. Лекция 1. Энергетика химических процессов. Основы термохимии
Слайд 3Химическая термодинамика изучает
переходы энергии из одной формы в другую, от одной
энергетические эффекты, сопровождающие различные химические и физические процессы
возможность и направление самопроизвольного протекания процессов
Модуль I. Лекция 1. Энергетика химических процессов. Основы термохимии
Слайд 4Основные понятия
химической термодинамики
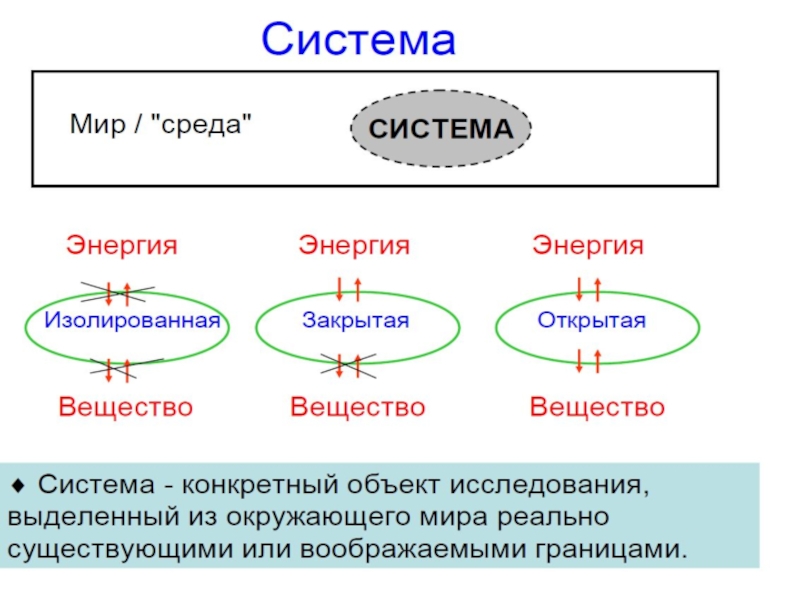
Система – вещество или совокупность веществ, находящихся во
Фаза – совокупность всех однородных по составу и свойствам частей системы, отделенная от остальных частей системы поверхностью раздела
Гомогенная система – однофазная,
гетерогенная система – многофазная
Модуль I. Лекция 1. Энергетика химических процессов. Основы термохимии
Слайд 5Типы систем
по характеру взаимодействия
с внешней средой
Открытая – система, для
Закрытая – система, для которой исключен обмен веществом и возможен обмен энергией с внешней средой
Изолированная – система, для которой исключен обмен веществом и энергией с внешней средой
Модуль I. Лекция 1. Энергетика химических процессов. Основы термохимии
Слайд 11Взаимосвязь между параметрами системы –
уравнение состояния
Пример: уравнение состояния идеального газа
Параметры состояния
температура
Т
давление
р
объем
V
концентрация
С
Модуль I. Лекция 1. Энергетика химических процессов. Основы термохимии
Слайд 12Функции состояния
внутренняя
энергия
U
энтальпия
H
энтропия
S
энергия
Гиббса
G
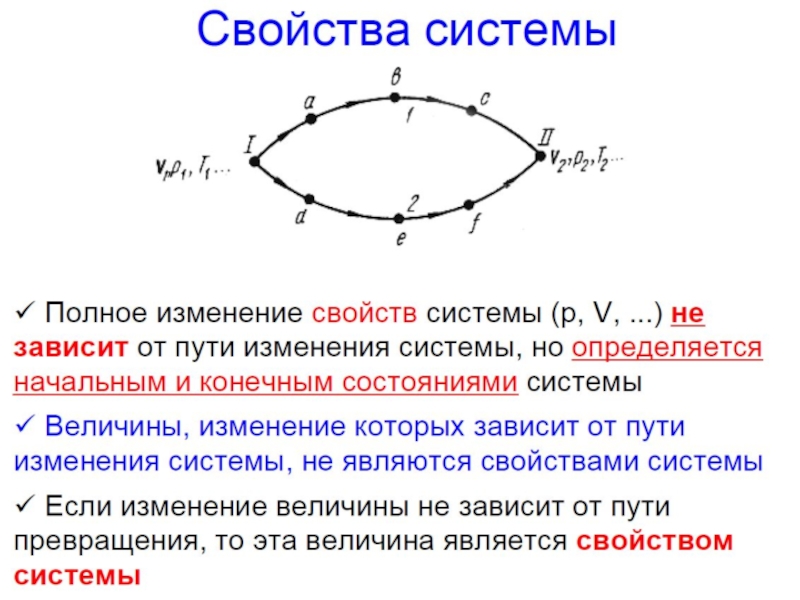
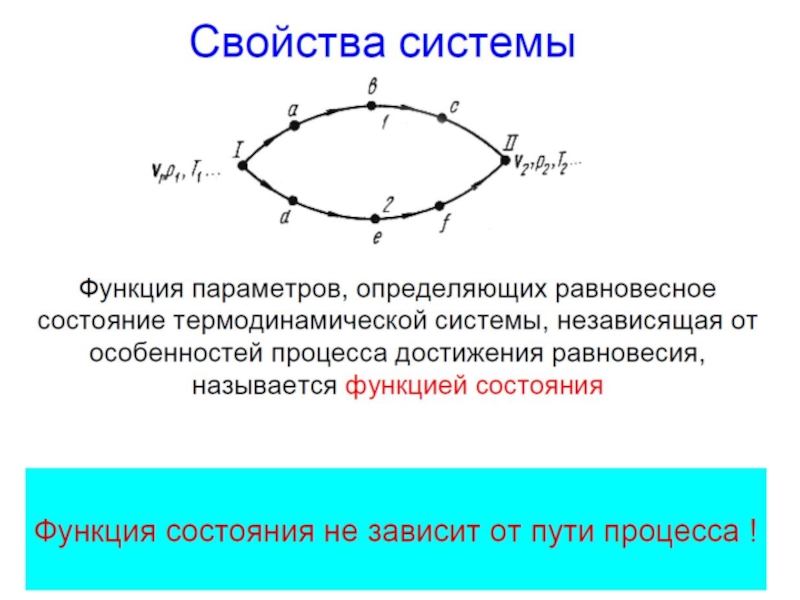
Свойства функций состояния:
численные значения однозначно определяются
составом системы
изменение при переходе системы из одного
состояния в другое не зависит от пути перехода и
может быть найдено как разность конечного и
начального значений функций
Модуль I. Лекция 1. Энергетика химических процессов. Основы термохимии
Слайд 13Внутренняя энергия (U) -
сумма кинетической энергии движения и потенциальной энергии взаимодействия
Зависит от природы системы, агрегатного состояния и массы образующих систему веществ, температуры
Единицы измерения – кДж.
Модуль I. Лекция 1. Энергетика химических процессов. Основы термохимии
Слайд 20
► Изохорический процесс – процесс, происходящий в физической системе при постоянном
- закон Шарля
При изохорическом процессе механическая работа газом не совершается.
Слайд 21 ► Изобарический процесс – процесс, происходящий в физической системе при постоянном
- закон Гей-Люссака
Слайд 22 ► Изобарический процесс – процесс, происходящий в физической системе при постоянном
- закон Гей-Люссака
Слайд 23Стандартные условия
Все вещества, участвующие в реакции, чистые
Температура 298 К
Парциальные давления газов или
Концентрации частиц в растворах равны 1 моль/л
Примеры обозначения стандартных величин:
или ; или
Модуль I. Лекция 1. Энергетика химических процессов. Основы термохимии
Слайд 24Термохимические уравнения -
уравнения химических реакций, записанные с указанием значения
ΔH < 0 ‑ экзотермическая реакция
(выделение теплоты)
N2(г) + 3H2(г) = 2NH3(г), ΔH0 = ‑ 92 кДж
ΔH > 0 ‑ эндотермическая реакция
(поглощение теплоты)
CaCO3(т) = CaO(т) + CO2(г), ΔH0 = 178 кДж
Модуль I. Лекция 1. Энергетика химических процессов. Основы термохимии
Слайд 25Энтальпия образования -
энтальпия реакции образования одного моля данного вещества
Энтальпии образования простых веществ равны нулю
Пример:
1/2N2(г) + 3/2H2(г) = NH3(г), ΔH0 = ‑ 46 кДж/моль = ΔH0NH3(г)
Энтальпия сгорания -
энтальпия реакции сгорания в кислороде одного моля данного вещества с образованием высших оксидов составляющих его элементов
Пример:
С2H5OH(ж) + 3O2(г) = 2СО2(г) + 3H2O(г) , ΔH0 = ‑ 1235 кДж =
Модуль I. Лекция 1. Энергетика химических процессов. Основы термохимии
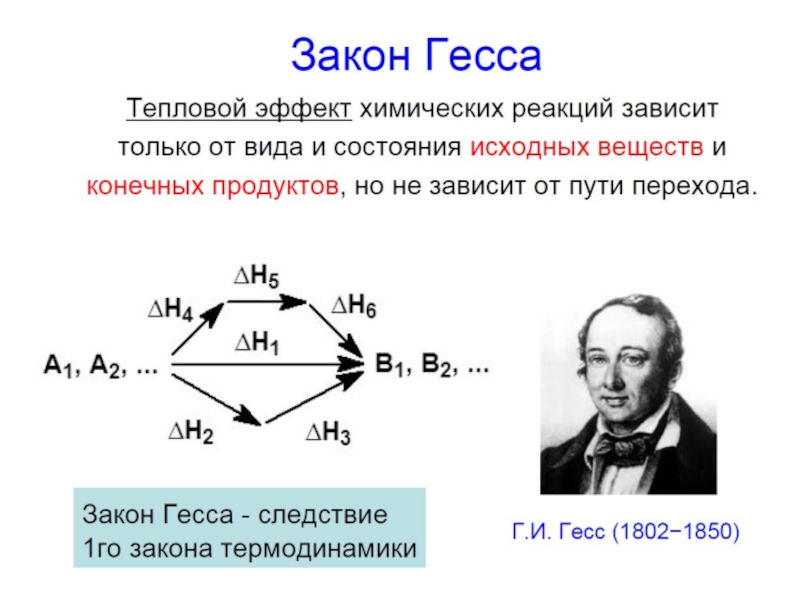
Слайд 26Закон Гесса
энтальпии реакций, протекающих при постоянном давлении или при постоянном объеме,
Пример: Fe(к) Fe2O3(к)
FeO(к)
I путь: 2Fe(к) + 3/2 O2(г) = Fe2O3(к),
II путь: 2Fe(к) + O2(г) = 2FeO(к),
2FeO(к) + 1/2O2(г) = Fe2O3(к),
Модуль I. Лекция 1. Энергетика химических процессов. Основы термохимии
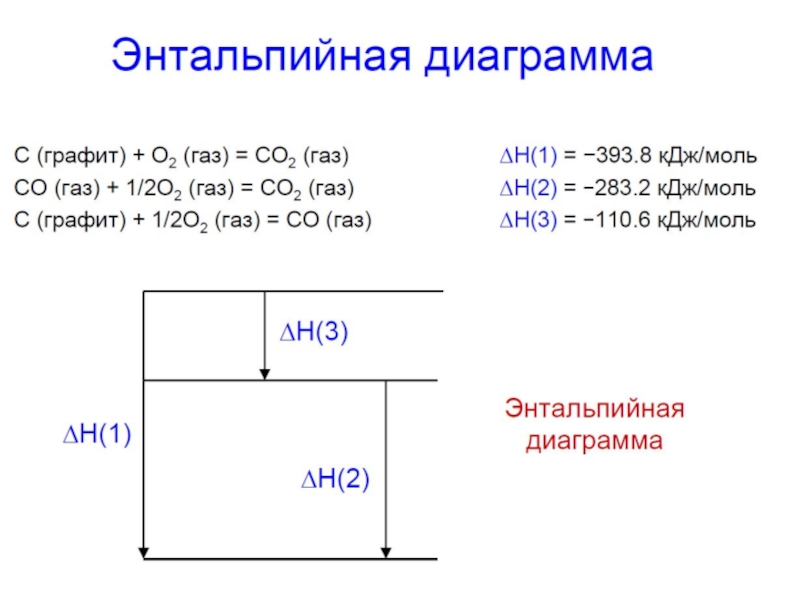
Слайд 28
2Fe(к) + 3/2 O2(г) = Fe2O3(к),
2Fe(к) + O2(г) = 2FeO(к),
2FeO(к) + 1/2O2(г) = Fe2O3(к),
2FeO(к) + 1/2O2(г)
Энтальпийные диаграммы реакций
Модуль I. Лекция 1. Энергетика химических процессов. Основы термохимии
Слайд 29 Расчет стандартной энтальпии реакции
FeO(к) + H2(г) = Fe(к) +
по известным термохимическим уравнениям
FeO(к) + СO(г) = Fe(к) + CO2(г), (2)
2H2(г) + O2(г) = 2H2O(г), (3)
2CO(г) + O2(г) = 2CO2(г), (4)
Согласно закону Гесса (1) = (2) + 1/2 (3) - 1/2(4)
FeO(к) + СO(г) = Fe(к) + CO2(г)
H2(г) + 1/2O2(г) = H2O(г)
CO(г) + 1/2O2(г) = CO2(г)
FeO(к)+ СO(г)+ H2(г) + 1/2O2(г) ‑ CO(г) ‑1/2O2(г) =Fe(к)+ CO2(г)+ H2O(г)‑ CO2(г)
FeO(к) + H2(г) = Fe(к) + H2O(г)
Модуль I. Лекция 1. Энергетика химических процессов. Основы термохимии
Слайд 30Закон Гесса. Следствие 1
Энтальпия реакции равна разности сумм энтальпий образования продуктов
Пример.
Стандартная энтальпия реакции
С2H5OH(ж) + 3O2(г) = 2СО2(г) + 3H2O(г)
Модуль I. Лекция 1. Энергетика химических реакций. Основы термохимии
Слайд 36Заключение
Химическая термодинамика изучает энергетические эффекты химических реакций
Объектами изучения химической термодинамики являются
S – энтропия, G – энергия Гиббса
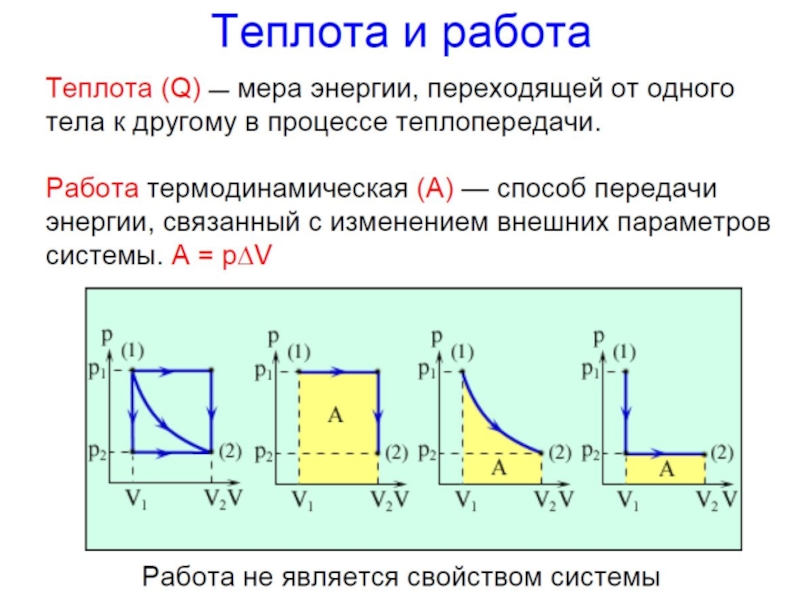
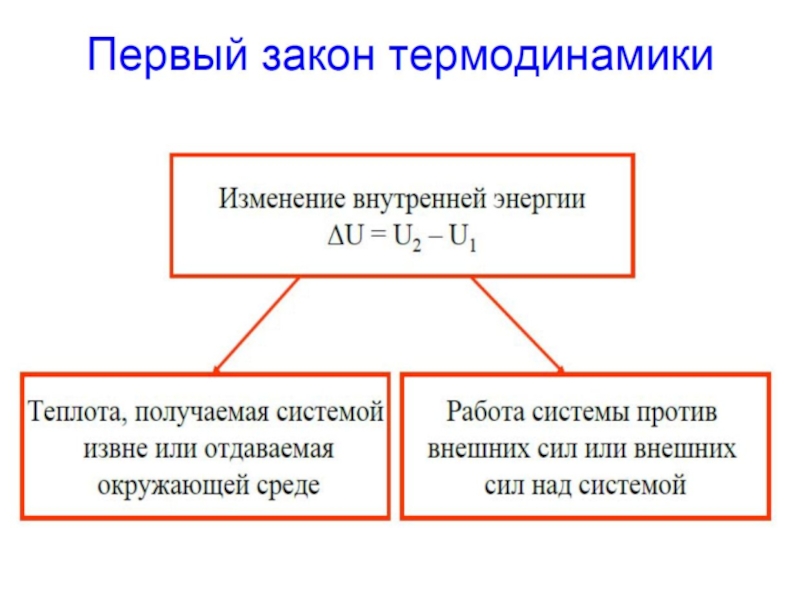
В соответствии с I началом термодинамики изменение внутренней энергии закрытой системы определяется количеством переданной теплоты и совершенной работы
Изменение энтальпии – тепловой эффект реакции при p=const:
Энтальпии реакций, протекающих при p=const или при V=const объеме, не зависят от пути протекания процесса, а определяются лишь начальным и конечным состояниями системы
Модуль I. Лекция 1. Энергетика химических реакций. Основы термохимии
Слайд 37Рекомендуемая литература
Никольский А.Б., Суворов А.В. Химия. - СПб: Химиздат, 2001
Степин Б.Д.,
Карапетьянц М.Х. Общая и неорганическая химия. - М.: Химия, 2000
Угай Я.А. Общая и неорганическая химия. - М.: Высш. шк., 2007
Неорганическая химия. В 3 т. Т. 1: Физико-химические основы неорганической химии. Под ред. Ю. Д. Третьякова. - М.: Академия, 2004
Гаршин А.П. Неорганическая химия в схемах, рисунках, таблицах, формулах, химических реакциях. - СПб.: Лань, 2000
Модуль I. Лекция 1. Энергетика химических реакций. Основы термохимии