в углеродной цепи кратные связи (двойные, тройные).
Алкены – это непредельные углеводороды …
содержащие в молекуле, помимо одинарных связей, одну двойную связь между атомами углерода и отвечают формуле СnH2n.
- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Алкены. Состав, строение, свойства и химические превращения презентация
Содержание
- 1. Алкены. Состав, строение, свойства и химические превращения
- 2. Простейший алкен – ... этен
- 3. Особенности строения алканов Атомы углерода при двойной
- 4. Особенности двойной связи Состоит из σ-связи и π-связи. Препятствует вращению атомов углерода вокруг своей оси.
- 8. 1. Ациклические углеводороды, в молекулах которых содержится
- 9. 3. Формула 2,3-диметилпентена-1 А) СН2=С−СН2−СН2−СН3
- 10. Химические свойства алкенов
- 11. Химические свойства Алкены вступают в реакции присоединения,
- 13. Реакции присоединения Гидрирование (+ Н2) Галогенирование (+ Г2) Гидрогалогенирование (+НГ) Гидратация (+ Н2О)
- 14. Качественная реакция на π-связь
- 16. Гидрогалогенирование Гидратация Реакции гидрогалогенирования и гидратации
- 17. Правило
- 18. Гидрогалогенирование Гидратация
- 19. Реакции окисления Полное окисление−горение. Неполное окисление−
- 20. Горение Этилен горит красноватым светящимся пламенем, в
- 22. Мягкое окисление Качественная реакция на π-связь−обесцвечивание фиолетового раствора перманганата калия. этиленгликоль (этандиол-1, 2)
- 24. Полимеризация Полимеризация (особый тип реакций присоединения, в
- 26. Полимер−это
- 27. Сырье−полиэтилен
- 28. Изделия из полиэтилена
- 29. Сырье−полипропилен
- 30. Изделия из полипропилена
- 31. Свойства полиэтилена Полиэтилен полупрозрачный, эластичный, жирный на
- 32. Горит синеватым пламенем, распространяя запах расплавленного парафина,
- 34. 1. Реакция присоединения водорода называется А) гидрирование
- 35. Реакция гидробромирования пропена протекает: 1) в соответствии
- 36. Предложите способ очистки пропана от примесей этилена.
- 37. Назовите химические реакции, которые являются общими для алканов и алкенов. Ответ: реакции горения.
- 38. 1. Дегидратация спиртов:
- 39. 1. Бутен можно получить крекингом: А) бутана
Слайд 2Простейший алкен – ...
этен (этилен).
Молекулярная формула этилена ...
С2H4
Структурная формула этилена ...
СН2= СН2
Электронное строение молекулы этилена обусловлено ...
гибридизацией атомов углерода.
Структурная формула этилена ...
СН2= СН2
Электронное строение молекулы этилена обусловлено ...
гибридизацией атомов углерода.
Слайд 3Особенности строения алканов
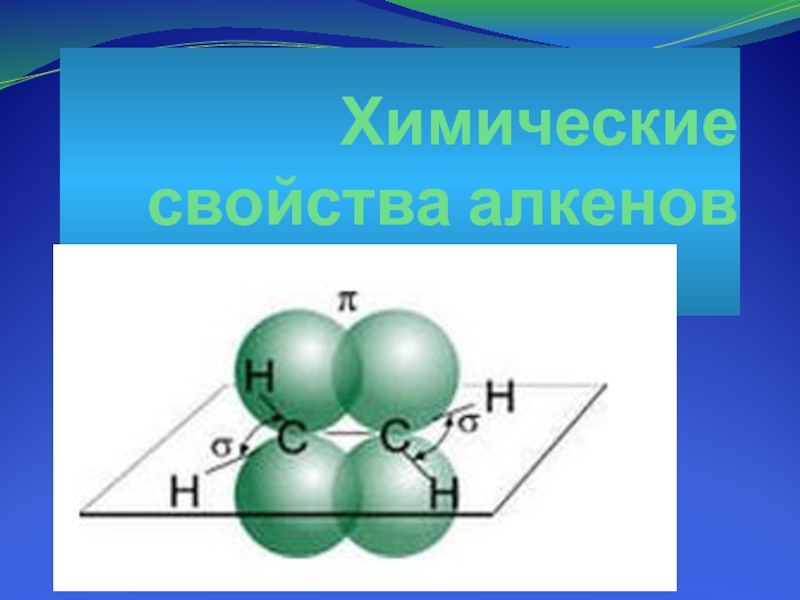
Атомы углерода при двойной связи находятся в sp2-гибридном состоянии
и между ними образуется двойная связь, состоящая из π-связи и σ-связи.
Длина двойной связи – 0,134 нм.
Все валентные углы близки к 120º.
Длина двойной связи – 0,134 нм.
Все валентные углы близки к 120º.
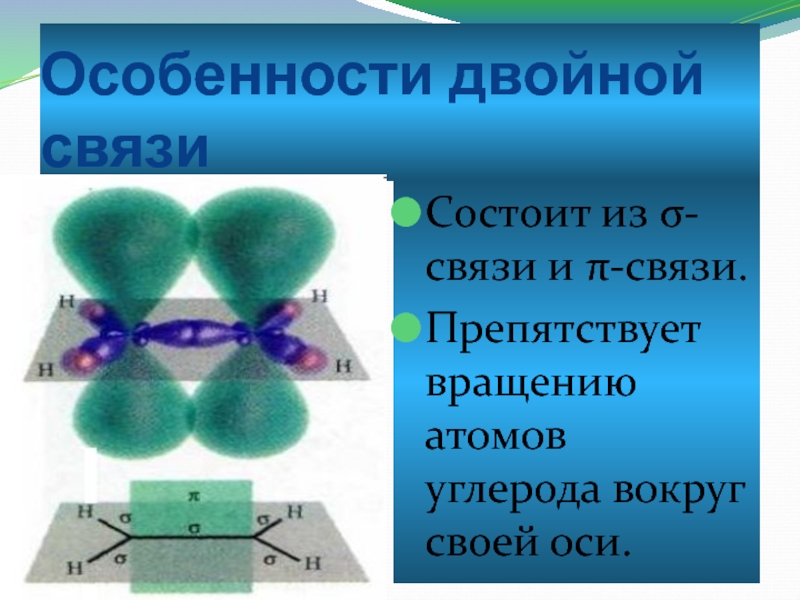
Слайд 4Особенности двойной связи
Состоит из σ-связи и π-связи.
Препятствует вращению атомов углерода вокруг
своей оси.
Слайд 81. Ациклические углеводороды, в молекулах которых содержится одна двойная связь, называются
А)
алканы Б) алкены
В) алкины Г) арены.
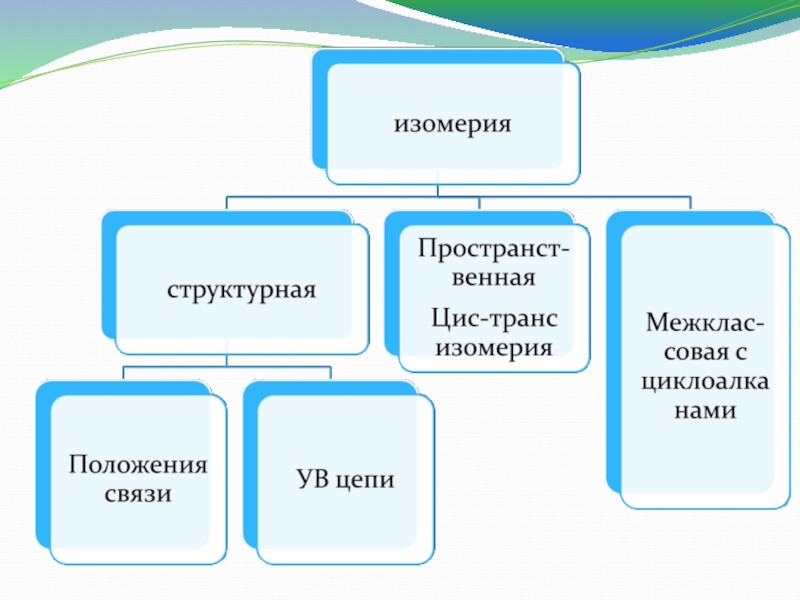
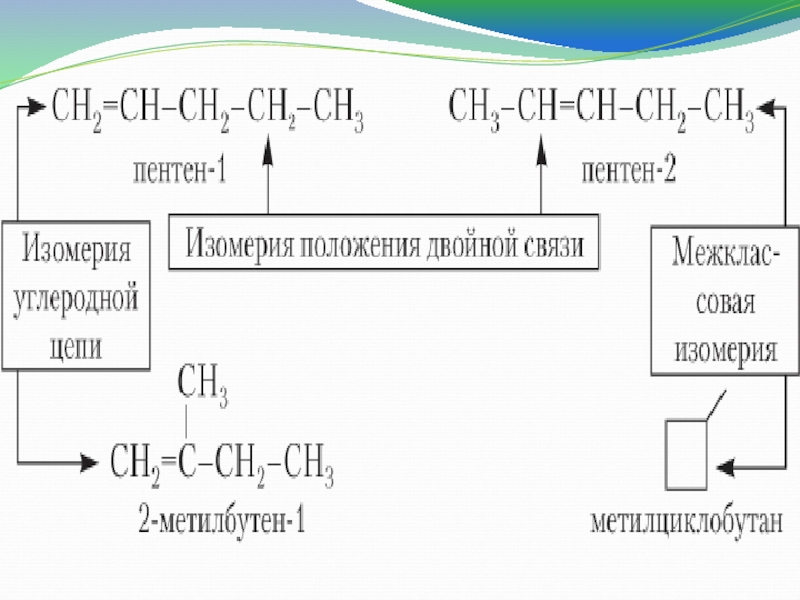
2. Для алкенов характерна изомерия
А) углеродного Б) положения
скелета кратной связи
В) пространственная Г) все ответы
верны.
В) алкины Г) арены.
2. Для алкенов характерна изомерия
А) углеродного Б) положения
скелета кратной связи
В) пространственная Г) все ответы
верны.
Слайд 93. Формула 2,3-диметилпентена-1
А) СН2=С−СН2−СН2−СН3 Б) СН3−С=С−СН2−СН3
| | |
СН3 Н3С СН3
В) СН3−СН−СН−СН2−СН3 Г) СН2=С−СН−СН2−СН3
| | | |
Н3С СН3 Н3С СН3
4. Какой пространственный изомер изображен на рисунке?
СН3 Н3С СН3
В) СН3−СН−СН−СН2−СН3 Г) СН2=С−СН−СН2−СН3
| | | |
Н3С СН3 Н3С СН3
4. Какой пространственный изомер изображен на рисунке?
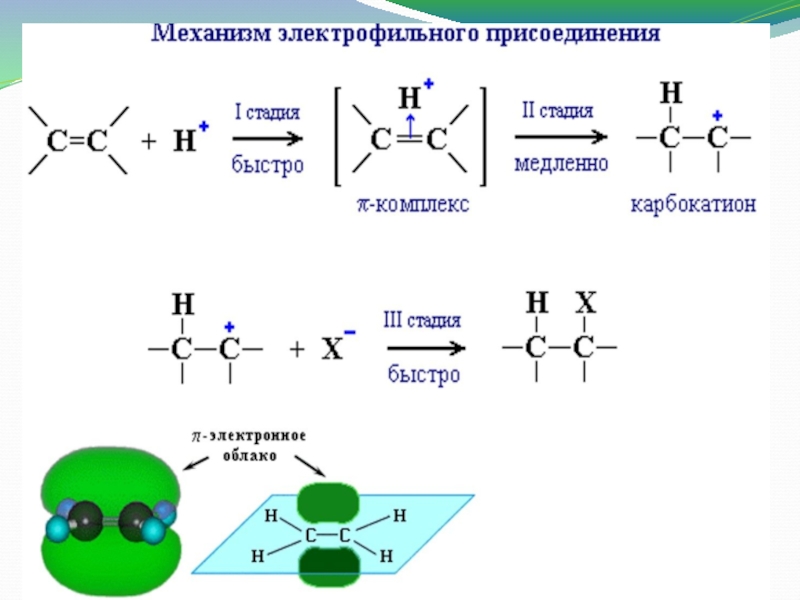
Слайд 11Химические свойства
Алкены вступают в реакции присоединения, которые протекают по месту разрыва
непрочной π-связи.
Для алкенов характерны реакции электрофильного присоединения (АЕ).
Механизм ионный.
Для алкенов характерны реакции электрофильного присоединения (АЕ).
Механизм ионный.
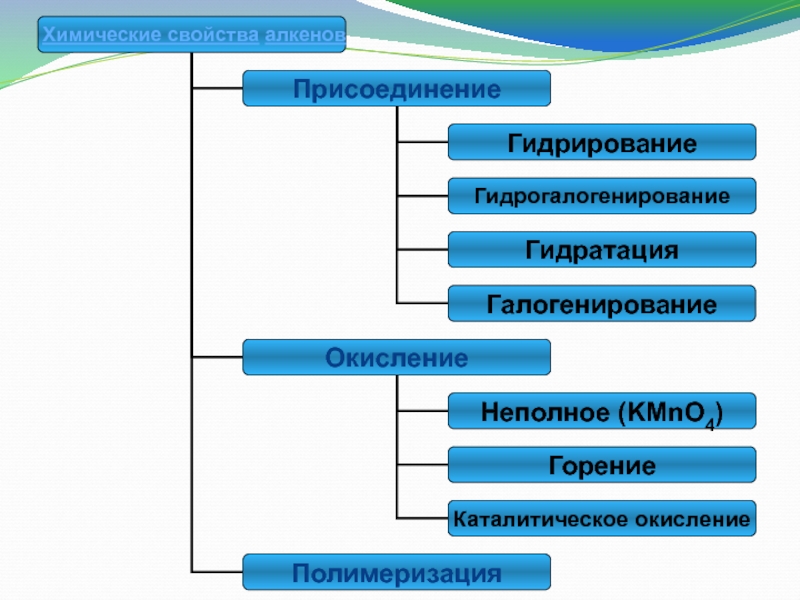
Слайд 13Реакции присоединения
Гидрирование (+ Н2)
Галогенирование (+ Г2)
Гидрогалогенирование (+НГ)
Гидратация (+ Н2О)
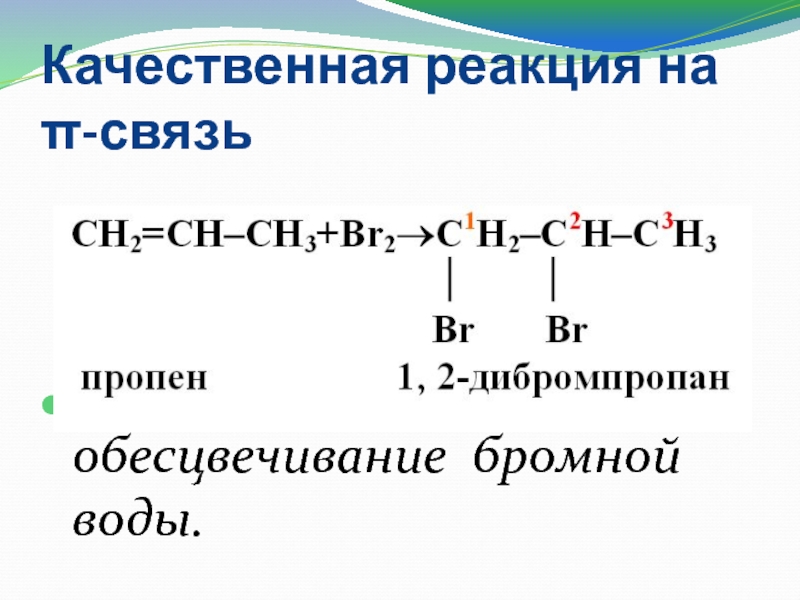
Слайд 14Качественная реакция на π-связь
Качественная реакция на π-связь−это обесцвечивание бромной воды.
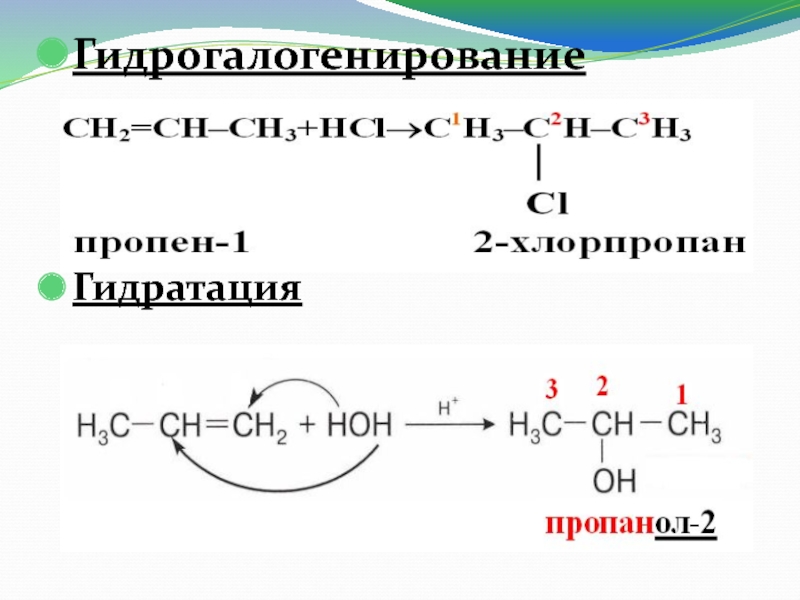
Слайд 16Гидрогалогенирование
Гидратация
Реакции гидрогалогенирования и гидратации несимметричных гомологов этилена идут легче по сравнению
с этиленом и проходят в соответствии с правилом Марковникова.
Слайд 17 Правило
В.В. Марковникова
При присоединении НГ или
Н2О к несимметричному алкену водород присоединяется к более гидрированному атому углерода, т.е. атому, при котором находится больше атомов водорода, а галоген или (ОН−)−к менее гидрированному атому углерода.
Слайд 19Реакции окисления
Полное окисление−горение.
Неполное окисление−
взаимодействие с окислителями:
KMnO4 −
фиолетовый раствор
Слайд 20Горение
Этилен горит красноватым светящимся пламенем, в то время как пламя предельных
углеводородов голубое; это происходит потому, что массовая доля углерода в алкенах выше, чем в алканах с тем же числом атомов углерода.
Слайд 22Мягкое окисление
Качественная реакция на π-связь−обесцвечивание фиолетового раствора перманганата калия.
этиленгликоль
(этандиол-1, 2)
Слайд 24Полимеризация
Полимеризация (особый тип реакций присоединения, в которых молекулы алкенов соединяются друг
с другом с образованием больших длинных молекул, макромолекул.
Реакция полимеризации алкенов и их производных протекает по свободнорадикальному механизму.
Реакция полимеризации алкенов и их производных протекает по свободнорадикальному механизму.
Слайд 26
Полимер−это высокомолекулярное соединение (вмс)
Мономер−это низкомолекулярное соединение
n−степень полимеризации
1 группа
− структурное звено
Слайд 31Свойства полиэтилена
Полиэтилен полупрозрачный, эластичный, жирный на ощупь материал.
При нагревании
размягчается, в размягченном состоянии легко меняет форму, из расплава можно вытянуть нити.
Слайд 32Горит синеватым пламенем, распространяя запах расплавленного парафина, продолжает гореть вне пламени.
Не
изменяет окраску желтой бромной воды и фиолетового раствора перманганата калия. Данные растворы веществ не действуют на полимер, т.к. отсутствует в составе полимера π-связь.
Слайд 341. Реакция присоединения водорода называется
А) гидрирование
Б) гидрогалогенирование
В) гидратация В) дегидрирование
2. В реакции бромирования пропена образуется
А) 1,3-дибромпропан Б) 1-бромпропан
В) 2-бромпропан Г) 1,2-дибромпропан
3. Сумма коэффициентов в уравнении горения пропена равна:
А) 11 Б) 15 В) 21 Г) 23
4. При гидрогалогенировании алкенов атом водорода присоединяется к … гидрированному атому углерода, а атом галогена – к … гидрированному.
А) более Б) менее
В) гидратация В) дегидрирование
2. В реакции бромирования пропена образуется
А) 1,3-дибромпропан Б) 1-бромпропан
В) 2-бромпропан Г) 1,2-дибромпропан
3. Сумма коэффициентов в уравнении горения пропена равна:
А) 11 Б) 15 В) 21 Г) 23
4. При гидрогалогенировании алкенов атом водорода присоединяется к … гидрированному атому углерода, а атом галогена – к … гидрированному.
А) более Б) менее
Слайд 35Реакция гидробромирования пропена протекает:
1) в соответствии с правилом В.В.Марковникова
2) в соответствии
с правилом А.М.Зайцева
3) по радикальному механизму
4) по электрофильному механизму
5) с преимущественным образованием 2-бромпропана
6) с преимущественным образованием 1-бромпропана
Ответы: 1, 4, 5
3) по радикальному механизму
4) по электрофильному механизму
5) с преимущественным образованием 2-бромпропана
6) с преимущественным образованием 1-бромпропана
Ответы: 1, 4, 5
Слайд 36Предложите способ очистки пропана от примесей этилена. Напишите уравнения соответствующих реакций.
Ответ: пропустить смесь газов через раствор бромной воды или перманганата калия, этилен прореагирует с данными растворами.
Слайд 37Назовите химические реакции, которые являются общими для алканов и алкенов.
Ответ: реакции
горения.
Слайд 381. Дегидратация спиртов:
H2SO4
H−CH2−CH2−OH → CH2=CH2 + H2O
2. Из галогеналканов:
H−CH2−CH2−Br + KOHсп. р-р → СH2=CH2 + KBr + H2O
3. Крекинг алканов: t
С8Н18 → С4Н10 + С4Н8
4. Дегидрирование алканов:
t, Cr2O3
H−CH2−CH2−H → CH2=CH2 + H2
H−CH2−CH2−OH → CH2=CH2 + H2O
2. Из галогеналканов:
H−CH2−CH2−Br + KOHсп. р-р → СH2=CH2 + KBr + H2O
3. Крекинг алканов: t
С8Н18 → С4Н10 + С4Н8
4. Дегидрирование алканов:
t, Cr2O3
H−CH2−CH2−H → CH2=CH2 + H2
Получение алкенов
Слайд 391. Бутен можно получить крекингом:
А) бутана Б) пентана
В) гексана Г) октана
2. Какие признаки характеризуют физические свойства этена: 1) бесцветная жидкость, 2) имеет резкий запах, 3) бесцветный газ, 4) немного легче воздуха, 5) почти без запаха, 6) плохо растворим в воде, 7) не горит, 8) с воздухом образует взрывоопасные смеси?
А) 3,4,5,6,8 Б) 1,2,6,7 В) 2,3,4,6,8 Г) 3,4,6,8
3. Плотность паров алкена по водороду равна 49. Массовая доля углерода в нём – 85,71%, массовая доля водорода – 14,29%. Молекулярная формула этого углеводорода
А) С5Н10 Б) С6Н12 В) С7Н14 Г) С8Н16
2. Какие признаки характеризуют физические свойства этена: 1) бесцветная жидкость, 2) имеет резкий запах, 3) бесцветный газ, 4) немного легче воздуха, 5) почти без запаха, 6) плохо растворим в воде, 7) не горит, 8) с воздухом образует взрывоопасные смеси?
А) 3,4,5,6,8 Б) 1,2,6,7 В) 2,3,4,6,8 Г) 3,4,6,8
3. Плотность паров алкена по водороду равна 49. Массовая доля углерода в нём – 85,71%, массовая доля водорода – 14,29%. Молекулярная формула этого углеводорода
А) С5Н10 Б) С6Н12 В) С7Н14 Г) С8Н16