- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Электролиз. Электролит презентация
Содержание
- 1. Электролиз. Электролит
- 2. Электролизом называют совокупность окислительно-восстановительных процессов, происходящих на электродах под действием постоянного электрического тока.
- 3. ЭЛЕКТРОЛИЗЕР – электрохимическая ячейка, в которой проводят электролиз растворов или расплавов веществ.
- 4. СОСТАВ ЭЛЕКТРОЛИЗЕРА ЭЛЕКТРОЛИТ – раствор или
- 5. АНОД – электрод, который подключен к
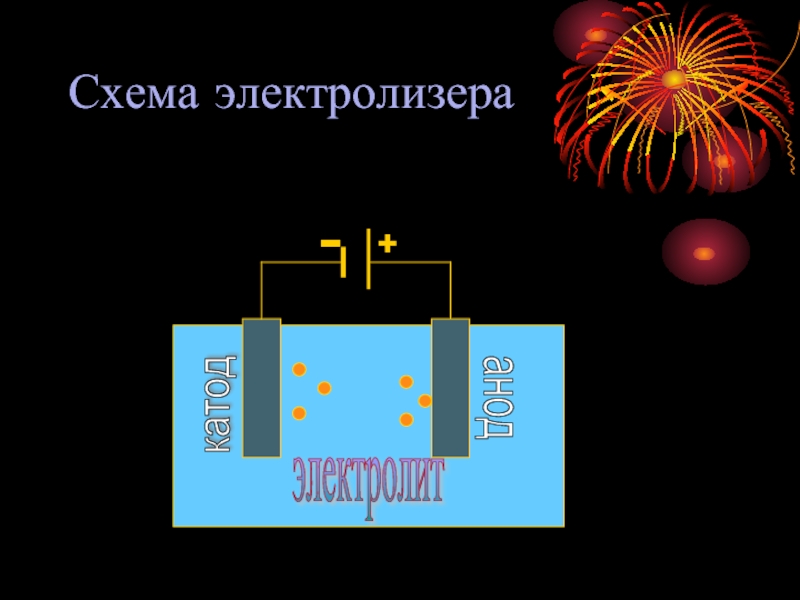
- 6. Схема электролизера анод
- 7. ЭЛЕКТРОЛИЗ РАСПЛАВОВ ПРИМЕР: схема электролиза расплава хлорида
- 8. КАТОД (-) : процесс восстановления Mg
- 9. ЭЛЕКТРОЛИЗ РАСТВОРОВ В данном случае
- 10. Возможные процессы на катоде Если металл расположен
- 11. 2. Если металл расположен от начала ряда
- 12. 3. Если металл расположен в ряду напряжений
- 14. Возможные процессы на аноде Если анод растворимый
- 15. 2. Если анод не растворяется (инертный –
- 16. ПРИМЕР: схема электролиза раствора сульфата магния MgSO4
- 17. Применение электролиза Получение металлов (Al, Mg, Na,Cd)
Слайд 2Электролизом называют совокупность окислительно-восстановительных процессов, происходящих на электродах под действием постоянного
электрического тока.
Слайд 3 ЭЛЕКТРОЛИЗЕР – электрохимическая ячейка, в которой проводят электролиз растворов или
расплавов веществ.
Слайд 4СОСТАВ ЭЛЕКТРОЛИЗЕРА
ЭЛЕКТРОЛИТ – раствор или расплав вещества, который проводит электрический
ток вследствие распада молекул данного вещества на ионы (катионы и анионы)
Слайд 5 АНОД – электрод, который подключен к положительному полюсу источника питания
(ПРОЦЕСС ОКСИЛЕНИЯ)
КАТОД - электрод, который подключен отрицательному полюсу источника питания (ПРОЦЕСС ВОССТАНОВЛЕНИЯ)
КАТОД - электрод, который подключен отрицательному полюсу источника питания (ПРОЦЕСС ВОССТАНОВЛЕНИЯ)
Слайд 7ЭЛЕКТРОЛИЗ РАСПЛАВОВ
ПРИМЕР: схема электролиза расплава хлорида магния MgCl2
В расплаве данного электролита
содержатся ионы: Mg и Сl.
Катионы Mg движутся к катоду, а
анионы Сl - к аноду
Катионы Mg движутся к катоду, а
анионы Сl - к аноду
2+
-
2+
-
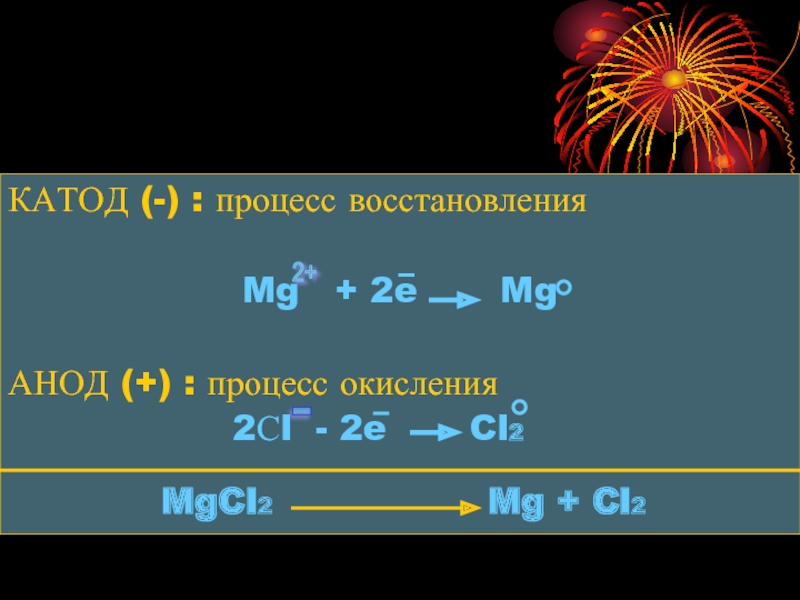
Слайд 8КАТОД (-) : процесс восстановления
Mg + 2e
Mg
АНОД (+) : процесс окисления
2Сl - 2e Cl2
MgCl2 Mg + Cl2
АНОД (+) : процесс окисления
2Сl - 2e Cl2
MgCl2 Mg + Cl2
2+
-
Слайд 9ЭЛЕКТРОЛИЗ РАСТВОРОВ
В данном случае в окислительно-восстановительных процессах, происходящих на
электродах возможно участие молекул ВОДЫ (Н2О)
Слайд 10Возможные процессы на катоде
Если металл расположен в ряду напряжений после водорода
(Cu, Hg, Ag, Pt, Au), то восстанавливаются катионы данного металла
Сu + 2e Cu
Сu + 2e Cu
2+
Слайд 112. Если металл расположен от начала ряда напряжений до Al включительно
(Li, Na, K, Mg и др.), то на катоде происходит процесс восстановления молекул Н2О:
2Н2О + 2е H2 + 2OH
2Н2О + 2е H2 + 2OH
Слайд 123. Если металл расположен в ряду напряжений между Al и водородом
(Zn, Fe, Ni, Mn и др.), то на катоде происходят процессы восстановления молекул Н2О и ионов данного металла:
2Н2О + 2е H2 + 2OH
Zn + 2e Zn
2Н2О + 2е H2 + 2OH
Zn + 2e Zn
2+
Слайд 14Возможные процессы на аноде
Если анод растворимый (Fe, Zn, Al, Сu и
др.), то окисляется металл анода, несмотря на природу аниона:
Сu - 2e Cu
Сu - 2e Cu
2+
Слайд 152. Если анод не растворяется (инертный – графит, Au, Pt и
др.), то:
анионы, не содержащие кислород (F , Cl , S и др.), окисляются на аноде
2Cl - 2e Cl2
анионы, содержащие кислород
(SO4 , NO3 и др.) не окисляются на аноде, а окисляются молекулы воды
2Н2О - 4е O2 + 4H
анионы, не содержащие кислород (F , Cl , S и др.), окисляются на аноде
2Cl - 2e Cl2
анионы, содержащие кислород
(SO4 , NO3 и др.) не окисляются на аноде, а окисляются молекулы воды
2Н2О - 4е O2 + 4H
-
-
2-
-
2-
-
+
Слайд 16ПРИМЕР: схема электролиза раствора сульфата магния MgSO4
В растворе существуют ионы Mg
и SO4
КАТОД (-) : процесс восстановления
2Н2О + 2е H2 + 2OH 2
АНОД (+) : процесс окисления
2Н2О - 4е O2 + 4H 1
2MgSO4 + 6Н2О 2 H2 + O2 + 2Mg(OH)2 + 2H2SO4
КАТОД (-) : процесс восстановления
2Н2О + 2е H2 + 2OH 2
АНОД (+) : процесс окисления
2Н2О - 4е O2 + 4H 1
2MgSO4 + 6Н2О 2 H2 + O2 + 2Mg(OH)2 + 2H2SO4
2+
2-
-
+
Слайд 17Применение электролиза
Получение металлов (Al, Mg, Na,Cd)
Получение H2, галогенов, щелочей
Очистка металлов (рафинирование)
Нанесение
защитных покрытий на металлические изделия
Получение металлических копий
Получение металлических копий