- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Электролитная адсорбция презентация
Содержание
- 1. Электролитная адсорбция
- 2. 1. Адсорбция сильных электролитов из водных растворов
- 3. Особенности ионной адсорбции: адсорбируются ионы, а не
- 4. Избирательная адсорбция - это процесс фиксации на
- 5. Избирательный характер адсорбции описывается следующими правилами:
- 6. II. Правило изоморфизма: На полярном адсорбенте из
- 7. III. Если ионы-адсорбаты имеют одинаковые по знаку
- 8. IV. Если ионы-адсорбаты имеют одинаковые по величине
- 9. Закономерности избирательной адсорбции можно проиллюстрировать на примере
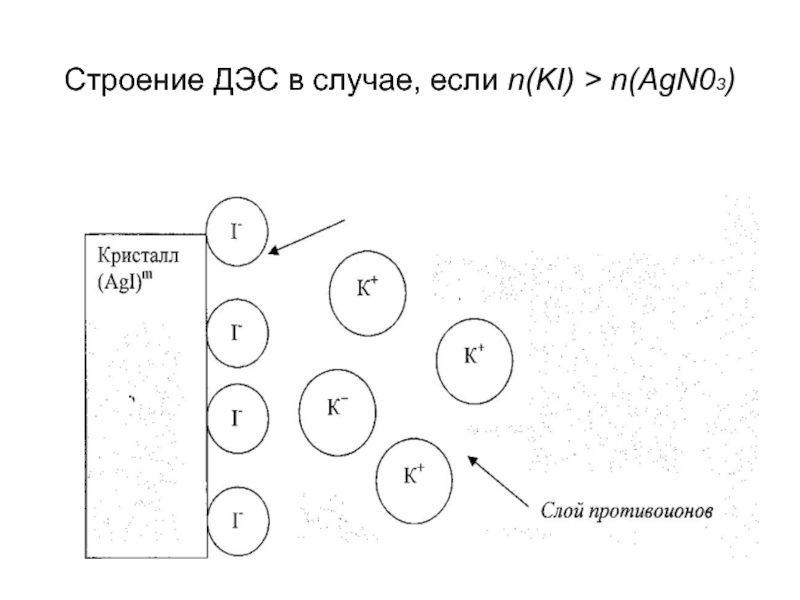
- 10. Строение ДЭС в случае, если n(KI) > n(AgN03)
- 11. Строение ДЭС в случае, если n(KI) < n(AgN03)
- 12. Исключения из правила Панета-Фаянса: крупные ионы с
- 13. Факторы, влияющие на избирательную адсорбцию: Природа адсорбента.
- 14. Ионы, расположенные в порядке возрастания (или уменьшения)
- 15. Различают необратимую и обратимую электролитную адсорбцию. При
- 16. 2. Ионообменная адсорбция - это процесс, при
- 17. Адсорбенты, способные к обмену ионов, называют ионитами
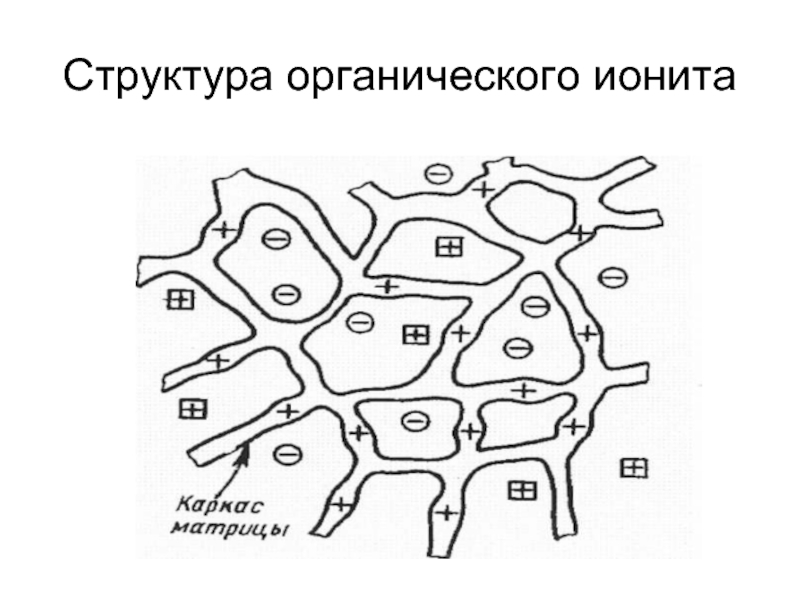
- 18. Структура органического ионита
- 19. Классификация ионитов: По происхождению: природные (кристаллические силикаты,
- 20. Каркас любого ионита, называемый матрица (R), не
- 21. Ионный обмен представляет собой обратимое стехиометрическое замещение
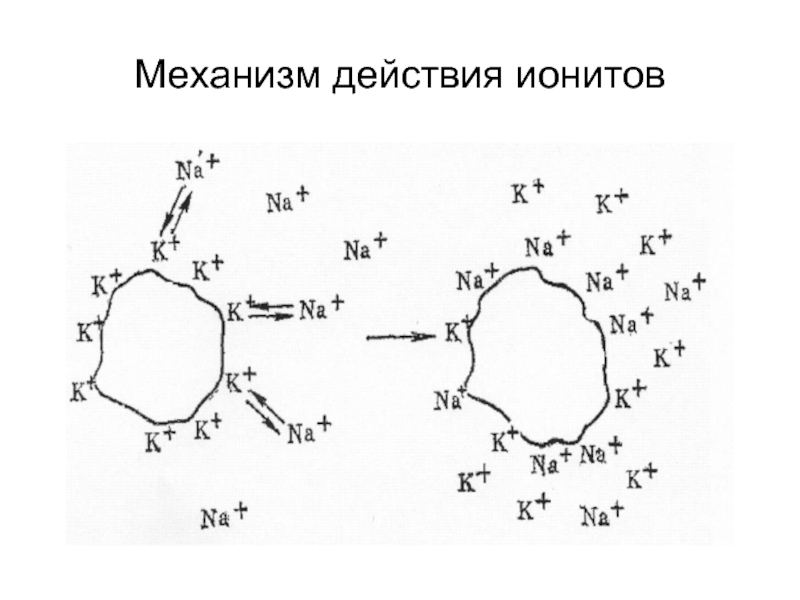
- 22. Механизм действия ионитов
- 23. Катиониты - представляют собой нерастворимые многоосновные кислоты;
- 24. Катиониты обмениваются только катионами, например: 2R
- 25. Регенерация ионитов Поскольку ионообменная адсорбция обратима, катиониты
- 26. Количественной характеристикой ионита является полная обменная емкость
- 27. Определение ПОЕ осуществляется на основе двух методов:
- 28. Использование ионитов в фармации и медицине: для
- 29. детоксикации организма при различных отравлениях. Аниониты —
Слайд 1ОМСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
КАФЕДРА ХИМИИ
Лекция 3. Электролитная адсорбция
Адсорбция электролитов: избирательная адсорбция
Адсорбция
Слайд 21. Адсорбция сильных электролитов из водных растворов твердым адсорбентом получила название
Слайд 3Особенности ионной адсорбции:
адсорбируются ионы, а не молекулы;
адсорбция протекает только на полярных
адсорбция ионов предполагает образование поверхностных химических соединений, т. е. ионная адсорбция не является адсорбцией в полном смысле слова, это химическая реакция между ионами растворенного вещества и твердой поверхностью;
при соприкосновении твердого адсорбента с раствором электролита образуется ДЭС за счет адсорбции ионов на кристаллах, либо за счет диссоциации твердого вещества;
в зависимости от механизма адсорбции различают избирательную адсорбцию и ионообменную адсорбцию.
Слайд 4Избирательная адсорбция - это процесс фиксации на твердой поверхности ионов одного
Слайд 5Избирательный характер адсорбции описывается следующими правилами: I. Правилом Панета-Фаянса: на поверхности
Слайд 6II. Правило изоморфизма: На полярном адсорбенте из раствора электролита адсорбируются ионы, близкие
Слайд 7III. Если ионы-адсорбаты имеют одинаковые по знаку и разные по величине
Слайд 8IV. Если ионы-адсорбаты имеют одинаковые по величине и знаку степени окисления,
Слайд 9Закономерности избирательной адсорбции можно проиллюстрировать на примере образования трудно растворимых соединений. KI
если n (KI) = n (AgN03), то поверхность осадка не заряжена;
если n (KI) < n (AgNO3), то поверхность осадка заряжена «положительно»;
если n (KI) > n (AgNO3), то поверхность осадка заряжена «отрицательно».
Слайд 12Исключения из правила Панета-Фаянса:
крупные ионы с жесткой электронной структурой: Сг042-, С2042-
органические ионы (красители, алкалоиды) адсорбируются благодаря лабильности структуры.
Слайд 13Факторы, влияющие на избирательную адсорбцию:
Природа адсорбента. Чем более полярным является адсорбент,
Природа иона-адсорбата. Адсорбируемость ионов зависит от заряда, радиуса и степени сольватации.
Слайд 14Ионы, расположенные в порядке возрастания (или уменьшения) адсорбционной способности, образуют ряды,
Слайд 15Различают необратимую и обратимую электролитную адсорбцию. При необратимой адсорбции адсорбат и адсорбент
Слайд 162. Ионообменная адсорбция - это процесс, при котором твердый адсорбент (ионит)
Слайд 17Адсорбенты, способные к обмену ионов, называют ионитами или ионообменниками. Иониты имеют
Слайд 19Классификация ионитов:
По происхождению: природные (кристаллические силикаты, апатиты, гуминовые кислоты) и синтетические
По составу: неорганические (апатиты,) и органические(гуминовые кислоты, сапропель, целлюлоза).
По знаку обменивающихся ионов: катиониты (пермутиты, сапропель, целлюлоза), аниониты (апатиты), амфолиты (гуминовые кислоты).
Слайд 20Каркас любого ионита, называемый матрица (R), не участвует в ионообменной адсорбции.
Слайд 21Ионный обмен представляет собой обратимое стехиометрическое замещение подвижного иона, связанного с
Слайд 23Катиониты - представляют собой нерастворимые многоосновные кислоты; они высвобождают и обменивают
Слайд 24Катиониты обмениваются только катионами, например: 2R – Na +
Слайд 25Регенерация ионитов Поскольку ионообменная адсорбция обратима, катиониты и аниониты можно использовать неоднократно.
Слайд 26Количественной характеристикой ионита является полная обменная емкость ПОЕ – количество вещества
Пусть обмен происходит по уравнению:
RX1 + X2 = RX2 + X1
Слайд 27Определение ПОЕ осуществляется на основе двух методов:
статического, в основе которого лежит
динамического, в основе которого лежит пропускание раствора электролита через хроматографическую колонку, наполненную ионитом и регистрация зависимости концентрации поглощаемого иона в выходящем растворе (элюате) от объема прошедшего раствора.
Слайд 28Использование ионитов в фармации и медицине:
для очистки, умягчения жесткой и опреснения
консервирования крови (удаление катионов Са2+);
осуществление гемодиализа крови (используется ионит - алюмогель);
беззондовой диагностики кислотности желудочного сока;
Слайд 29детоксикации организма при различных отравлениях. Аниониты — антоцидные средства, катиониты для
в фарм.технологии как катализатор реакций этерификации, гидратации, дегидратации;
для аналитических целей в качестве инструмента извлечения из смесей того или иного компонента.