- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Электродные потенциалы презентация
Содержание
- 1. Электродные потенциалы
- 2. План лекции Процессы на границе металл /
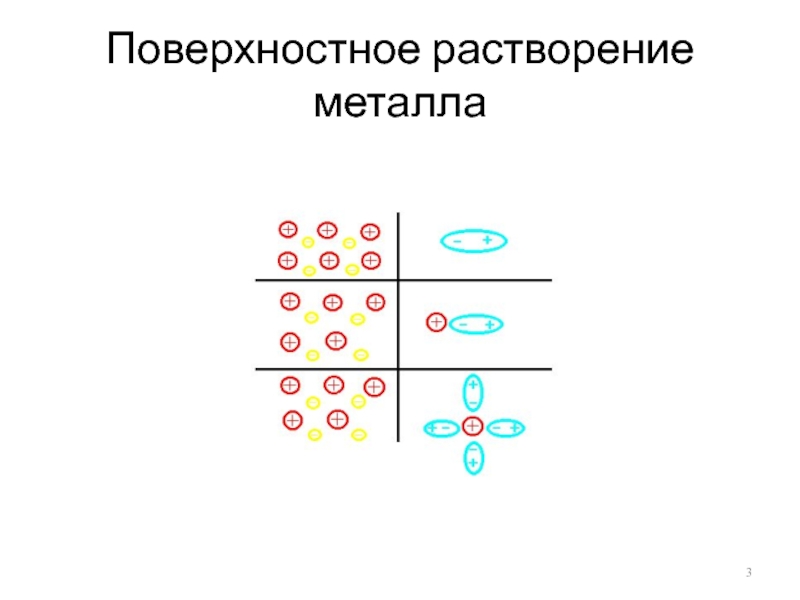
- 3. Поверхностное растворение металла
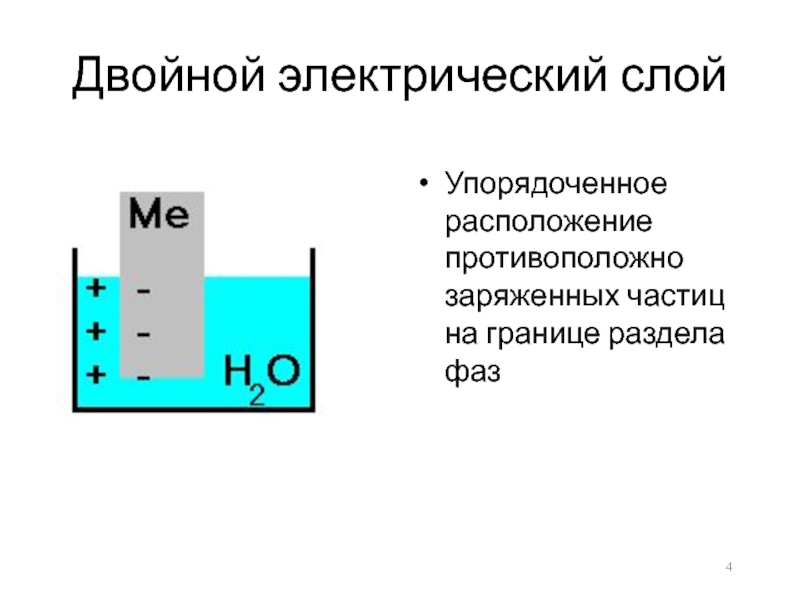
- 4. Двойной электрический слой Упорядоченное расположение противоположно заряженных частиц на границе раздела фаз
- 5. Устанавливается подвижное равновесие (скорость растворения = скорости
- 6. Процессы на границе металл/раствор Выход катионов из
- 7. Химически активные металлы (Zn, Mg, Al, Fe)
- 8. Уравнение Нернста 2,3RT
- 9. Стандартный электродный потенциал (Е°) Потенциал, возникающий на
- 10. Ряд напряжений Расположение металлов в порядке возрастания их стандартных электродных потенциалов
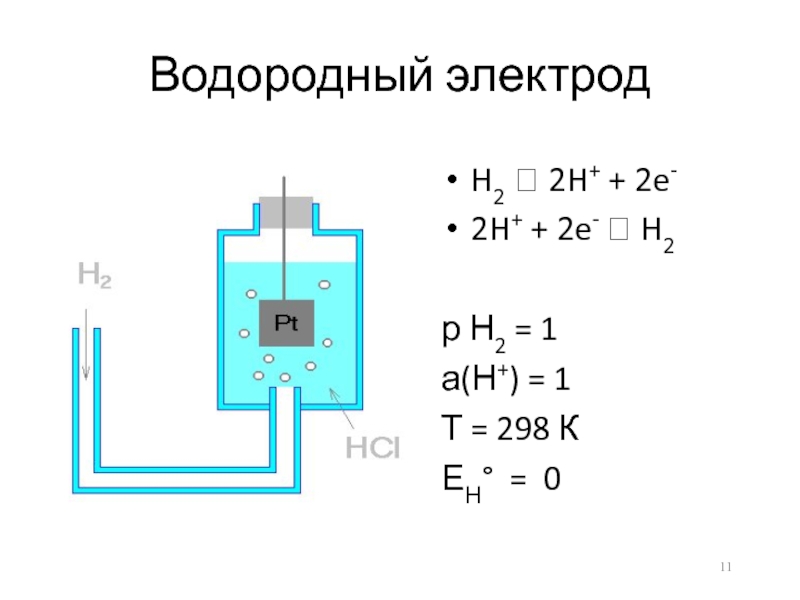
- 11. Водородный электрод H2 ⮀ 2H+ + 2e-
- 12. Недостатки стандартного водородного электрода Трудно изготавливать, сохранять
- 13. Названия электродов Анод – электрод, на котором
- 14. Хлорсеребряный электрод AgCl → Ag+ + Cl-
- 15. Классификация электродов Электроды I типа Электродный потенциал
- 16. Ионометаллические электроды 1-го рода: электроды, обратимые относительно
- 17. Окислительно-восстановительные электроды Электроды, в которых материал электрода
- 18. Если в системе преобладает окисленная форма –
- 19. Уравнение Нернста-Петерса
- 20. I вида: ОХ +zе- ⮀ Red II
- 21. Электроды II типа Электродный потенциал возникает на
- 22. Стандартные О-В потенциалы Характеризуют способность системы функционировать в качестве окислителя или восстановителя
- 23. О-В системы в живых организмах 0,2Т
- 24. Весь путь биологического окисления характеризуется изменением потенциала
Слайд 2План лекции
Процессы на границе металл / вода, металл / раствор
Электродный потенциал
Уравнение
Нернста
Водородный электрод
Классификация электродов
Уравнение Нернста-Петерса
О-В системы в живых организмах
Водородный электрод
Классификация электродов
Уравнение Нернста-Петерса
О-В системы в живых организмах
Слайд 4Двойной электрический слой
Упорядоченное расположение противоположно заряженных частиц на границе раздела фаз
Слайд 5Устанавливается подвижное равновесие (скорость растворения = скорости осаждения)
Образовавшаяся пограничная разность потенциалов
получила название электродного потенциала Е (лат. рotentia – возможность, мощь)
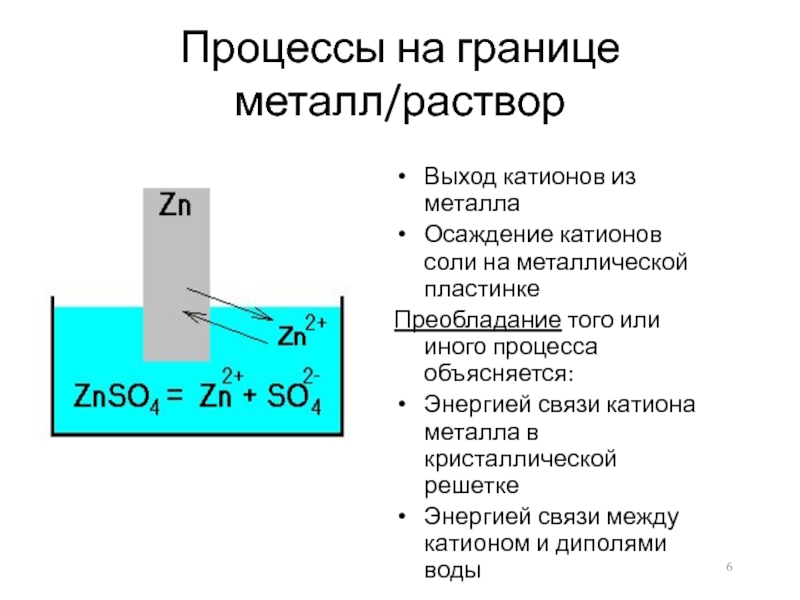
Слайд 6Процессы на границе металл/раствор
Выход катионов из металла
Осаждение катионов соли на металлической
пластинке
Преобладание того или иного процесса объясняется:
Энергией связи катиона металла в кристаллической решетке
Энергией связи между катионом и диполями воды
Преобладание того или иного процесса объясняется:
Энергией связи катиона металла в кристаллической решетке
Энергией связи между катионом и диполями воды
Слайд 7Химически активные металлы (Zn, Mg, Al, Fe) характеризуются большими величинами растворимости.
При любых больших концентрациях их солей, которые можно получить практически, эти металлы всегда будут в большей или меньшей степени растворяться, а возникающие при этом электродные потенциалы будут отрицательными (Е < 0)
Величины растворимости химически малоактивных металлов (Cu, Hg, Ag, Au, Pt) ничтожно малы. Даже при малых концентрациях солей этих металлов на границе металл / раствор будет преобладать процесс осаждения ионов металла из раствора на металлическую поверхность (Е > 0)
Величины растворимости химически малоактивных металлов (Cu, Hg, Ag, Au, Pt) ничтожно малы. Даже при малых концентрациях солей этих металлов на границе металл / раствор будет преобладать процесс осаждения ионов металла из раствора на металлическую поверхность (Е > 0)
Слайд 8Уравнение Нернста
2,3RT 2,3RT
E = ----------- ⋅
lgK + ---------- ⋅ lg a
nF nF
Е – электродный потенциал
R = 8,31 Дж/моль⋅К
F = 96 500 Кл – число Фарадея
К – константа, характеризующая природу металла
а – активность катиона металла
nF nF
Е – электродный потенциал
R = 8,31 Дж/моль⋅К
F = 96 500 Кл – число Фарадея
К – константа, характеризующая природу металла
а – активность катиона металла
Слайд 9Стандартный электродный потенциал (Е°)
Потенциал, возникающий на границе металл / раствор при
активности катионов металла в растворе 1 моль/л и температуре 298 К
2,3RT
Е = Е° + ----------- ⋅ lg a(К+)
nF
0,2Т
Е = Е° + ----------- ⋅ lg a(К+)
n
Зависит от природы металла, от заряда катиона, от активности иона, от температуры
2,3RT
Е = Е° + ----------- ⋅ lg a(К+)
nF
0,2Т
Е = Е° + ----------- ⋅ lg a(К+)
n
Зависит от природы металла, от заряда катиона, от активности иона, от температуры
Слайд 10Ряд напряжений
Расположение металлов в порядке возрастания их стандартных электродных потенциалов
Слайд 12Недостатки стандартного водородного электрода
Трудно изготавливать, сохранять и поддерживать в рабочем состоянии
Водород
должен быть химически чистым
Давление и реакция среды должны быть постоянными
Давление и реакция среды должны быть постоянными
Слайд 13Названия электродов
Анод – электрод, на котором протекает реакция окисления, т.е. отдача
электронов; активный металл, заряд отрицательный
Катод – электрод, на котором протекает реакция восстановления, т.е. присоединение электронов, заряд положительный
Катод – электрод, на котором протекает реакция восстановления, т.е. присоединение электронов, заряд положительный
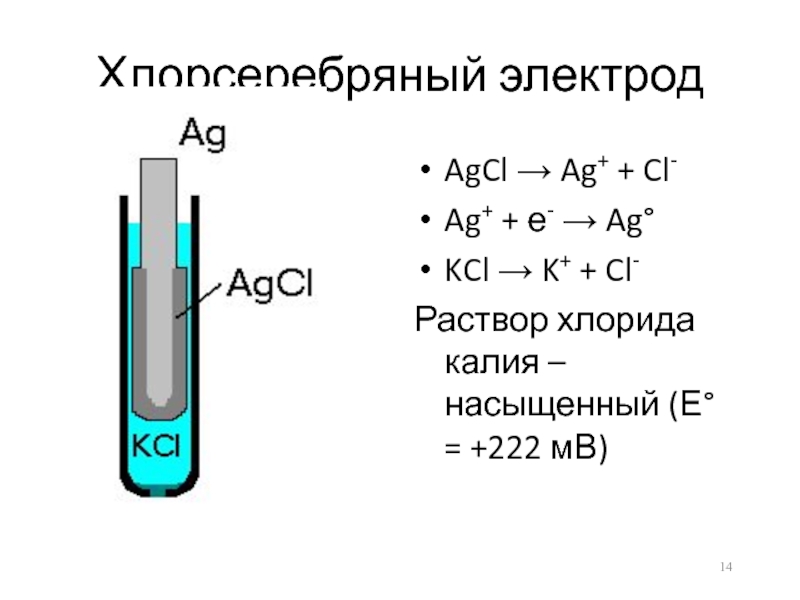
Слайд 14Хлорсеребряный электрод
AgCl → Ag+ + Cl-
Ag+ + е- → Ag°
KCl →
K+ + Cl-
Раствор хлорида калия – насыщенный (Е° = +222 мВ)
Раствор хлорида калия – насыщенный (Е° = +222 мВ)
Слайд 15Классификация электродов
Электроды I типа
Электродный потенциал создается на границе металл / раствор
в результате окислительно-восстановительной реакции
Ионометаллические – потенциал возникает в результате обмена ионами
Окислительно-восстановительные (редокс-электроды) – в результате обмена электронами
Ионометаллические – потенциал возникает в результате обмена ионами
Окислительно-восстановительные (редокс-электроды) – в результате обмена электронами
Слайд 16Ионометаллические электроды
1-го рода: электроды, обратимые относительно или катиона или аниона (цинковый,
медный, газовые). Представляет собой металл, опущенный в раствор собственной соли
2-го рода: электроды, обратимые относительно и катиона и аниона. Электродный потенциал зависит от концентрации катиона и аниона (хлорсеребряный). Представляют собой трехфазную систему, в которой металл покрыт труднорастворимой солью и погружен в раствор, содержащий анионы этой соли
2-го рода: электроды, обратимые относительно и катиона и аниона. Электродный потенциал зависит от концентрации катиона и аниона (хлорсеребряный). Представляют собой трехфазную систему, в которой металл покрыт труднорастворимой солью и погружен в раствор, содержащий анионы этой соли
Слайд 17Окислительно-восстановительные электроды
Электроды, в которых материал электрода в окислительно-восстановительном процессе не участвует;
он является только переносчиком электронов
Представляют собой систему, содержащую окисленную и восстановленную формы одного и того же вещества. В его раствор опущен инертный металлический электрод (Pt, Au), который является или поставщиком электронов или их переносчиком
Представляют собой систему, содержащую окисленную и восстановленную формы одного и того же вещества. В его раствор опущен инертный металлический электрод (Pt, Au), который является или поставщиком электронов или их переносчиком
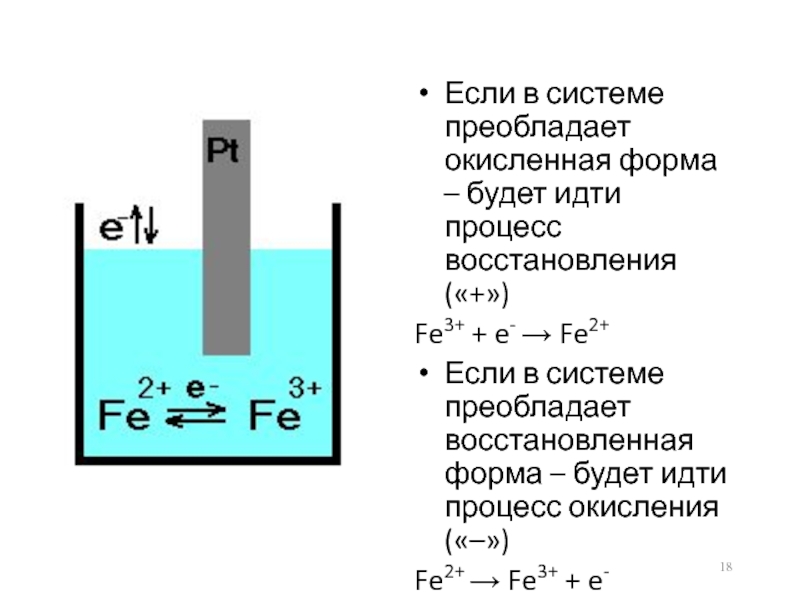
Слайд 18Если в системе преобладает окисленная форма – будет идти процесс восстановления
(«+»)
Fe3+ + e- → Fe2+
Если в системе преобладает восстановленная форма – будет идти процесс окисления («–»)
Fe2+ → Fe3+ + e-
Fe3+ + e- → Fe2+
Если в системе преобладает восстановленная форма – будет идти процесс окисления («–»)
Fe2+ → Fe3+ + e-
Слайд 19Уравнение Нернста-Петерса
0,2Т [OX]
Eо-в =
Е°о-в + ---------- ⋅ lg-----------
n [Red]
n – количество электронов, которые передаются от одной формы к другой
Е°о-в – потенциал окислительно-восстановительной системы, в которой соотношение окисленной и восстановленной форм = 1
n [Red]
n – количество электронов, которые передаются от одной формы к другой
Е°о-в – потенциал окислительно-восстановительной системы, в которой соотношение окисленной и восстановленной форм = 1
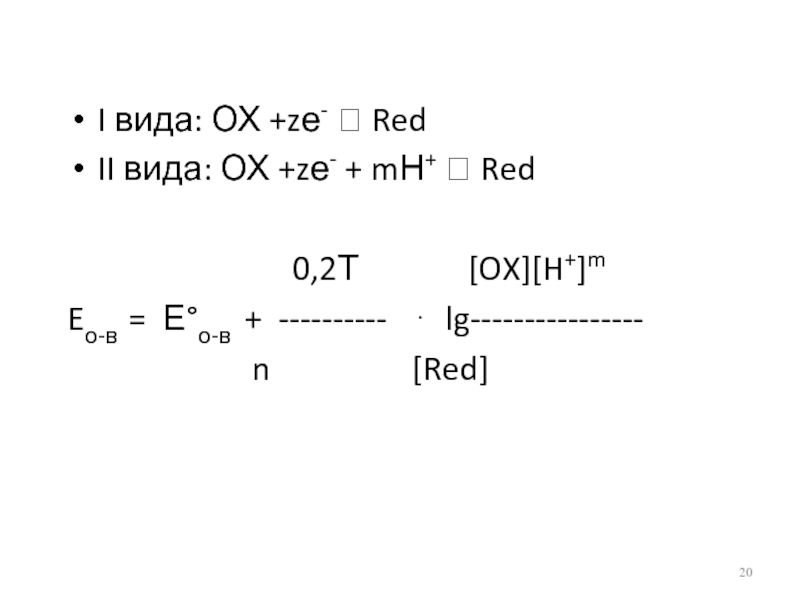
Слайд 20I вида: ОХ +zе- ⮀ Red
II вида: ОХ +zе- + mН+
⮀ Red
0,2Т [OX][H+]m
Eо-в = Е°о-в + ---------- ⋅ lg----------------
n [Red]
0,2Т [OX][H+]m
Eо-в = Е°о-в + ---------- ⋅ lg----------------
n [Red]
Слайд 21Электроды II типа
Электродный потенциал возникает на границе раздела двух растворов, отделенных
мембраной с избирательной проницаемостью для отдельных ионов – мембранные электроды (ферментные)
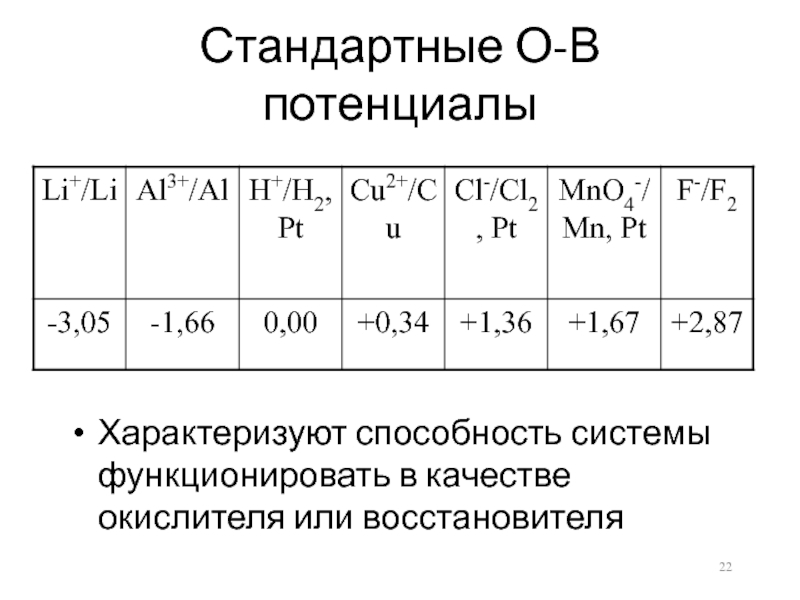
Слайд 22Стандартные О-В потенциалы
Характеризуют способность системы функционировать в качестве окислителя или восстановителя
Слайд 23О-В системы в живых организмах
0,2Т [пируват][H+]2
Ео-в =
Е°о-в + ----------- ⋅ lg-------------------
2 [лактат]
Е°о-в = -0,185 В
2 [лактат]
Е°о-в = -0,185 В
Слайд 24Весь путь биологического окисления характеризуется изменением потенциала от –0,42 до +0,81
В
При переходе электронов от одной формы вещества к другой в цепи реакций потенциал изменяется постепенно
Минимальная разность потенциалов, необходимая для превращения АДФ в АТФ составляет 0,17 В
При переходе электронов от одной формы вещества к другой в цепи реакций потенциал изменяется постепенно
Минимальная разность потенциалов, необходимая для превращения АДФ в АТФ составляет 0,17 В












![Уравнение Нернста-Петерса 0,2Т [OX]Eо-в = Е°о-в + ---------- ⋅ lg----------- n](/img/tmb/5/416304/93b84edc93a2580311e0506733fa6d78-800x.jpg)

![О-В системы в живых организмах 0,2Т [пируват][H+]2Ео-в = Е°о-в + ----------- ⋅ lg-------------------](/img/tmb/5/416304/abf9af719bd6e40d7cea8a6f08d07802-800x.jpg)






