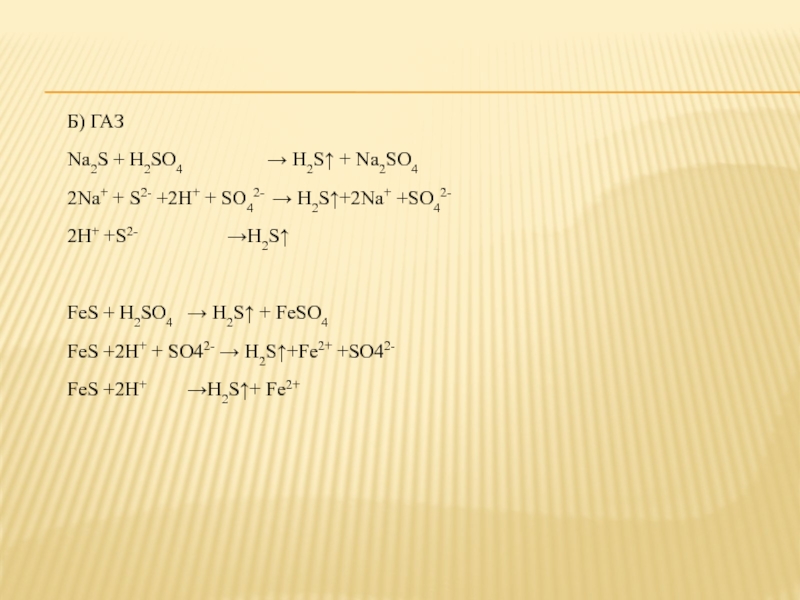- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Электродитическая диссоциация презентация
Содержание
- 1. Электродитическая диссоциация
- 2. 1) Электролитическая диссоциация – распад молекулы веществ
- 4.
- 5. 3) СТЕПЕНЬ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ (Α) – ЭТО ОТНОШЕНИЕ ЧИСЛА МОЛЕКУЛ РАСПАВШИХСЯ К ОБЩЕМУ ЧИСЛУ МОЛЕКУЛ.
- 6. ПО ВЕЛИЧИНЕ (АЛЬФА) РАЗЛИЧАЮТ :
- 9. Средние электролиты ( в порядке убывания
- 11. 4) КЛАССЫ ВЕЩЕСТВ С ТОЧКИ ЗРЕНИЯ ДИССОЦИАЦИИ
- 14. 5) УСЛОВИЯ НЕОБРАТИМОСТИ РЕАКЦИЙ ОБМЕНА В РАСТВОРАХ. Продукт
- 15. А) ОСАДОК NaCl р + AgNO3
- 16. Б) ГАЗ Na2S + H2SO4 → H2S↑
- 17. В) СЛАБЫЙ ЭЛЕКТРОЛИТ CH3COONa +HCl→ CH3COOH+NaCl
Слайд 2
1) Электролитическая диссоциация – распад молекулы веществ на ионы пол действием полярных
молекул растворителя
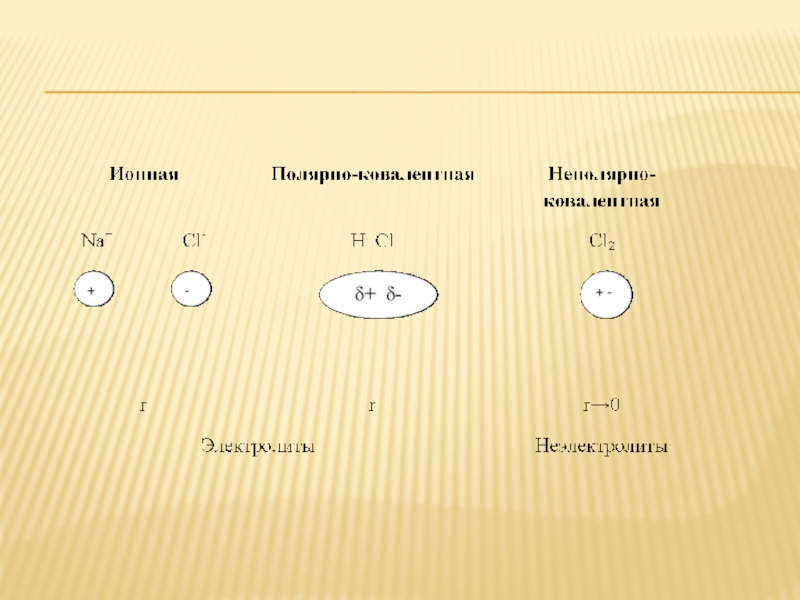
2) Электролиты – вещества, водные растворы которые (или расплавы) проводят электрический ток.
Все электролиты имеют ионную или полярную ковалентную связь
2) Электролиты – вещества, водные растворы которые (или расплавы) проводят электрический ток.
Все электролиты имеют ионную или полярную ковалентную связь
Слайд 53) СТЕПЕНЬ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ (Α) – ЭТО ОТНОШЕНИЕ ЧИСЛА МОЛЕКУЛ РАСПАВШИХСЯ К
ОБЩЕМУ ЧИСЛУ МОЛЕКУЛ.
Слайд 9
Средние электролиты ( в порядке убывания силы)
H2SO3 > HSO4 > H3PO4
> HF > HNO2
Слабые ( в порядке убывания)
CH3COOH >H2CO3 > H2S > HSO3 и H2PO4> HCO3 > HPO4 > HS
Слабые ( в порядке убывания)
CH3COOH >H2CO3 > H2S > HSO3 и H2PO4> HCO3 > HPO4 > HS
Слайд 145) УСЛОВИЯ НЕОБРАТИМОСТИ РЕАКЦИЙ ОБМЕНА В РАСТВОРАХ.
Продукт реакции должен выделяться из сферы
реакции :
- ОСАДОК, - ГАЗ, - СЛАБЫЙ ЭЛЕКТРОЛИТ.
Нерастворимые соединения, газы, слабые электролиты в ионных уравнениях записываются в молекулярных формулах.
- ОСАДОК, - ГАЗ, - СЛАБЫЙ ЭЛЕКТРОЛИТ.
Нерастворимые соединения, газы, слабые электролиты в ионных уравнениях записываются в молекулярных формулах.
Слайд 15
А) ОСАДОК
NaCl р + AgNO3 р → AgCl ↓+ NaNO3
Na+ +Cl-
+ Ag+ +NO3 - → AgCl ↓+ Na+ +NO3- ПОЛНОЕ УРАВНЕНИЕ
Ag+ + Cl- → AgCl СОКРАЩЕННОЕ ИОННОЕ УРАВНЕНИЕ
Ag+ + Cl- → AgCl СОКРАЩЕННОЕ ИОННОЕ УРАВНЕНИЕ
Слайд 16Б) ГАЗ
Na2S + H2SO4 → H2S↑ + Na2SO4
2Na+ + S2- +2H+
+ SO42- → H2S↑+2Na+ +SO42-
2H+ +S2- →H2S↑
FeS + H2SO4 → H2S↑ + FeSO4
FeS +2H+ + SO42- → H2S↑+Fe2+ +SO42-
FeS +2H+ →H2S↑+ Fe2+
2H+ +S2- →H2S↑
FeS + H2SO4 → H2S↑ + FeSO4
FeS +2H+ + SO42- → H2S↑+Fe2+ +SO42-
FeS +2H+ →H2S↑+ Fe2+
Слайд 17
В) СЛАБЫЙ ЭЛЕКТРОЛИТ
CH3COONa +HCl→ CH3COOH+NaCl
CH3COO- +Na ++H+ + Cl-→ CH3COOH+Na+ +Cl-
CH3COO-
+H+ → CH3COOH