- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Дисперсные системы презентация
Содержание
- 1. Дисперсные системы
- 2. * Дисперсной называют систему (ДС), состоящую
- 3. *
- 4. * Классификация по агрегатному состоянию
- 5. *
- 6. *
- 7. * Дисперсные системы Со слабым
- 8. * Дисперсные системы Со связью
- 9. * Методы получения лиофобных коллоидов: 1.
- 10. * 2. конденсационные физическая конденсация
- 11. * Метод получения лиофильных коллоидов: Увеличение концентрации ПАВ до критической концентрации мицелообразования.
- 12. * методы очистки фильтрация (фильтр)
- 13. * Строение мицелл в лиофобных коллоидных
- 14. * Pb(NO3)2 + 2KI = PbI2
- 15. * Pb(NO3)2 + 2KI = PbI2
- 16. * Строение мицелл в лиофильных коллоидных
- 17. * Коллоидные ПАВ – вещества, которые
- 18. * В полярной ДС (воде): В неполярной ДС (масле):
- 19. * Способностью к мицеллообразованию обладают не
- 20. * Молекулы фосфолипидов образуют в липосомах бислойную мембрану:
- 21. * Липосомы используют для направленной доставки
- 22. * Важнейшее свойство растворов коллоидных ПАВ
- 23. * Молекулярно-кинетические свойства коллоидных систем: Броуновское
- 24. * 2. Диффузия (медленнее, чем в
- 25. * 3. Осмотическое давление (подчиняется
- 26. * 4. Седиментационное равновесие - сила
- 27. * Оптические свойства коллоидных систем: рассеяние
- 28. *
- 29. * истинный раствор коллоидный раствор свет свет желтоватый свет голубоватый свет
- 30. * Электрические свойства коллоидных систем: перемещение
- 31. * катод (-) анод (+) граница скольжения, ξ-потенциал
- 32. * Биологические жидкости организма (кровь,
- 33. * Седиментационная (кинетическая) устойчивость способность частиц
- 34. * Конденсационная устойчивость -способность дисперсных систем сохранять неизменной с течением времени удельную поверхность.
- 35. * Коагуляция процесс слипания коллоидных частиц
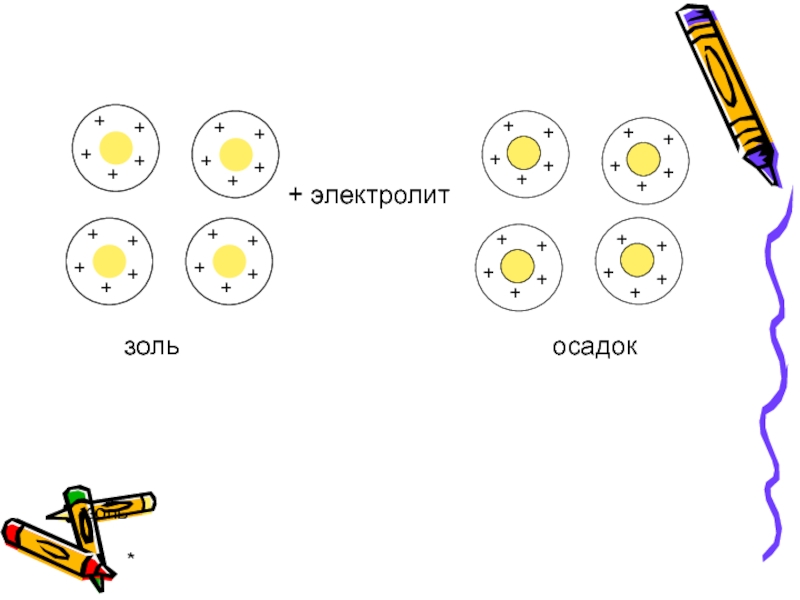
- 36. * золь + электролит осадок золь
- 37. * Правило Шульце-Гарди: коагулирующая способность
- 38. * Для биологических систем наибольшее значение
- 39. * Пептизация – процесс перехода свежеполученного
- 40. * Значение коллоидной защиты: недостаток защитного
- 41. * Эмульсии - микрогетерогенные системы, у
- 42. * Суспензии – микрогетергенные системы с
- 43. * Значение для медицины: положительное Эмульсии
- 44. * 2) Многие лекарственные вещества используют
Слайд 2*
Дисперсной называют систему (ДС), состоящую из дисперсной фазы – совокупности раздробленных
Условие получение ДС – взаимная нерастворимость диспергируемого вещества и дисперсной фазы
Слайд 3*
Количественная характеристика дисперсности – степень раздробленности
D =
по степени дисперсности:
грубодисперсные (микрогетерогенные) системы – размер частиц дисперсной фазы > 10-7м,
коллоидно-дисперсные (ультрамикрогетерогенные) системы – размер частиц 10-7-10-9м.
Слайд 7*
Дисперсные системы
Со слабым
взаимодействием
между ДС и ДФ
С сильным
взаимодействием
между
Лиофобные
(гидрофобные)
- необратимые
Лиофильные
(гидрофильные)
- обратимые
Слайд 8*
Дисперсные системы
Со связью
между частицами
ДФ
Без связи
между частицами
ДФ
Связнодисперсные
(гели)
Свободнодисперсные
(коллоидные растворы)
Слайд 9*
Методы получения лиофобных коллоидов:
1. диспергационные
механическое дробление
измельчение с помощью ультразвука
электрическое диспергирование
химическое диспергирование
Слайд 10*
2. конденсационные
физическая конденсация (замена растворителя)
химическая конденсация (реакции гидролиза, окисления, восстановления, конденсации)
Слайд 11*
Метод получения лиофильных коллоидов:
Увеличение концентрации ПАВ до критической концентрации мицелообразования.
Слайд 12*
методы очистки
фильтрация (фильтр)
диализ (растворитель+мембрана)
электродиализ (растворитель+мембрана +ток)
компенсационный диализ (раствор+мембрана+ток)
ультрафильтрация (диализ под
от низко-
молеку-лярных
веществ
от крупных
частиц
Слайд 13*
Строение мицелл в лиофобных коллоидных растворах.
Мицеллой лиофобной системы называется
Слайд 14*
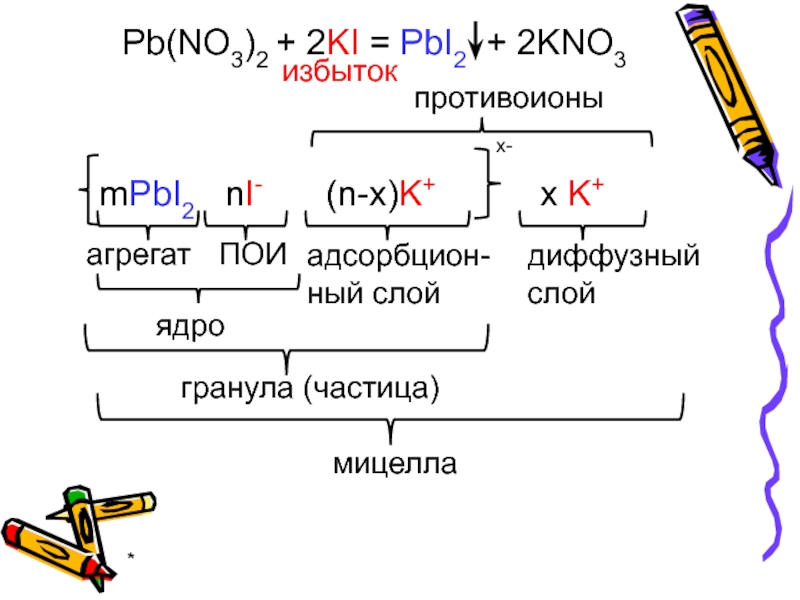
Pb(NO3)2 + 2KI = PbI2 + 2KNO3
избыток
mPbI2
nPb2+
2(n-x)NO3-
2x NO3-
2x+
агрегат
ПОИ
противоионы
ядро
адсорбцион-
ный слой
диффузный
слой
гранула
мицелла
Слайд 15*
Pb(NO3)2 + 2KI = PbI2 + 2KNO3
избыток
mPbI2
nI-
(n-x)K+
x K+
x-
агрегат
ПОИ
противоионы
ядро
адсорбцион-
ный слой
диффузный
слой
гранула
мицелла
Слайд 16*
Строение мицелл в лиофильных коллоидных растворах.
Мицеллами лиофильных коллоидных растворов называются
Слайд 17*
Коллоидные ПАВ – вещества, которые с одним и тем же растворителем
Структура мицелл зависит от свойств ДС
Слайд 19*
Способностью к мицеллообразованию обладают не все ПАВ. В водных растворах к
Слайд 21*
Липосомы используют для направленной доставки лекарственных веществ (противоопухолевых препаратов, инсулина) к
антителами и антигенами.
Слайд 22*
Важнейшее свойство растворов коллоидных ПАВ – солюбилизация.
Солюбилизация – самопроизвольный переход нерастворимых
Слайд 23*
Молекулярно-кинетические свойства коллоидных систем:
Броуновское движение (беспрерывние хаотическое, медленнее частиц истинного раствора)
Слайд 25*
3. Осмотическое давление (подчиняется
з-ну Вант-Гоффа, меньше π
р-ров той же % концентрации (частицы!))
Слайд 26*
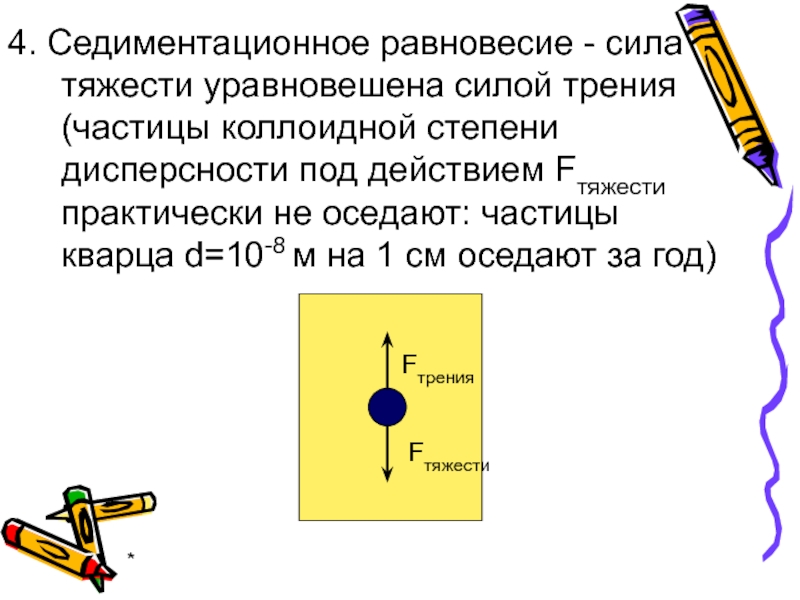
4. Седиментационное равновесие - сила тяжести уравновешена силой трения (частицы коллоидной
Fтяжести
Fтрения
Слайд 27*
Оптические свойства коллоидных систем:
рассеяние света
опалесценция (окраска в рассеянном и проходящем
конус Тиндаля
Слайд 30*
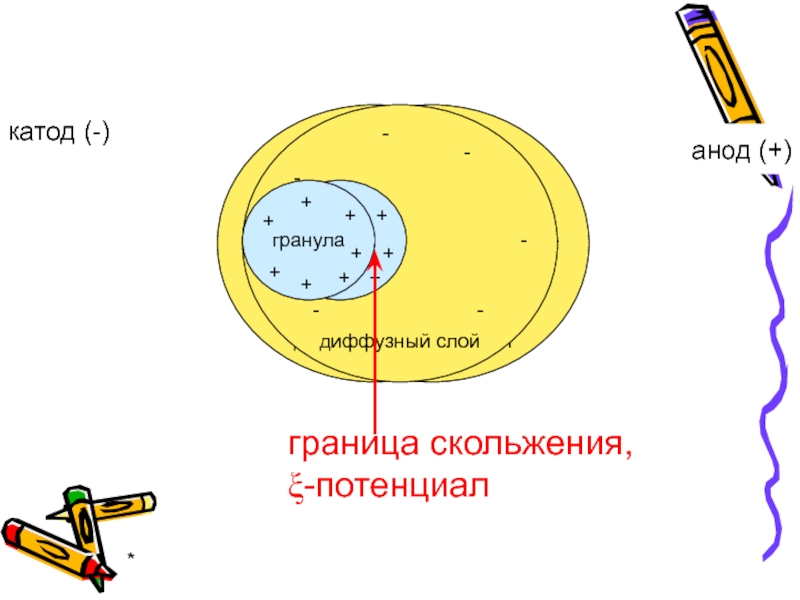
Электрические свойства коллоидных систем:
перемещение частиц одной фазы относительно частиц другой фазы
Слайд 32*
Биологические жидкости организма (кровь, плазма, моча и т. п.) -
Устойчивость дисперсных систем это способность их сохранять свое состояние и свойства неизменными с течением времени.
Слайд 33*
Седиментационная (кинетическая) устойчивость способность частиц ДФ находится во взвешенном состоянии и
Агрегативная устойчивость - способность частиц ДФ противодействовать их слипанию между собой (сохранять свои размеры).
Слайд 34*
Конденсационная устойчивость -способность дисперсных систем сохранять неизменной с течением времени удельную
Слайд 35*
Коагуляция процесс слипания коллоидных частиц с образованием более крупных агрегатов из-за
Может быть вызвана прибавлением электролитов, изменением температуры, механическим воздействием…
Слайд 37*
Правило Шульце-Гарди: коагулирующая способность электролита возрастает с увеличением заряда коагулирующего иона,
Для золя { [mPbI2] nPb2+ (n-x)NO3- }2x+ 2xNO3-
коагулирующими ионами могут быть анионы: Cl-, SO42-, PO43-.
Коагулирующая способность возрастает
Слайд 38*
Для биологических систем наибольшее значение имеет коагуляция при добавлении электролита (коллоидные
Слайд 39*
Пептизация – процесс перехода свежеполученного при коагуляции осадка в золь под
Повышение агрегативной устойчивости лиофобных золей при добавлении к ним ВМС называется коллоидной защитой.
Слайд 40*
Значение коллоидной защиты:
недостаток защитного действия –
образование в организме почечных и желчных
Для количественной характеристики защитного действия используют «золотое», «рубиновое», «железное» и др. числа. Все эти числа характеризуют защитную способность веществ по отношению к данному стандартному золю, используют для диагностических целей.
Слайд 41*
Эмульсии - микрогетерогенные системы, у которых ДФ и ДС - несмешивающиеся
эмульсии
прямые
(непол. Ж в пол. Ж, масло в воде)
обратные
(пол. Ж в непол. Ж,
вода в масле)
Слайд 42*
Суспензии – микрогетергенные системы с жидкой ДС и твердыми частицами ДФ.
Аэрозоли
Слайд 43*
Значение для медицины:
положительное
Эмульсии лекарственных веществ прямые – для внутреннего применения, обратные
Растительные и животные жиры лучше усваиваются организмом в эмульгированном виде (молоко), эмульгаторы - производные холевой и дезоксихолевой кислоты.
Слайд 44*
2) Многие лекарственные вещества используют в виде суспензий и паст (конц.
3) аэрозоли используют для дезинфекции помещений, ингаляций лекарственных средств, аэрозольной вакцинации, обработки ран, ожогов, эрозий, мелких травм.
отрицательное:
аэрозоли могут вызывать легочные и аллергические заболевания.