- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Биоорганическая химия презентация
Содержание
- 1. Биоорганическая химия
- 2. Учебники 1. Тюкавкина Н.А., Бауков Ю.И. Биоорганическая
- 3. Органические соединения - углеводороды и их функциональных
- 4. Функциональные группы: - атомные группировки –
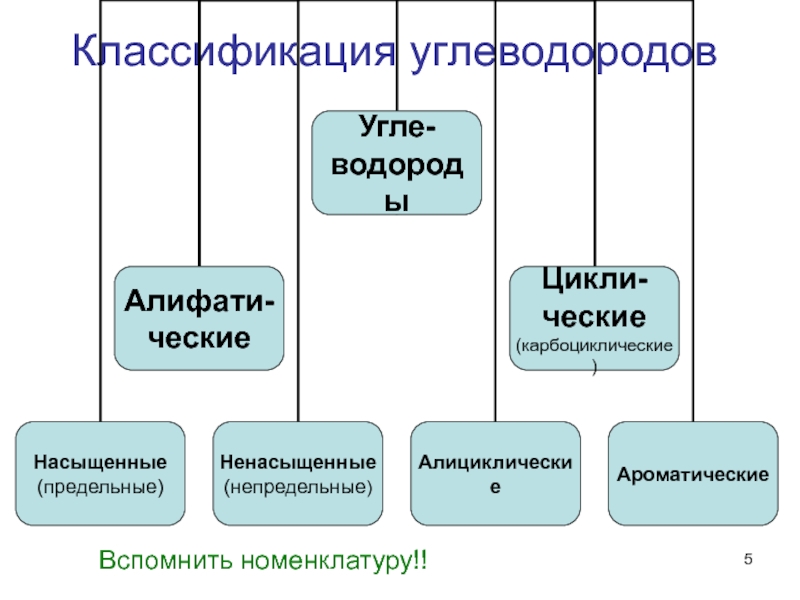
- 5. Классификация углеводородов Вспомнить номенклатуру!!
- 7. алканы
- 8. Алканы – малореакционноспособные соединения, «химические мертвецы».
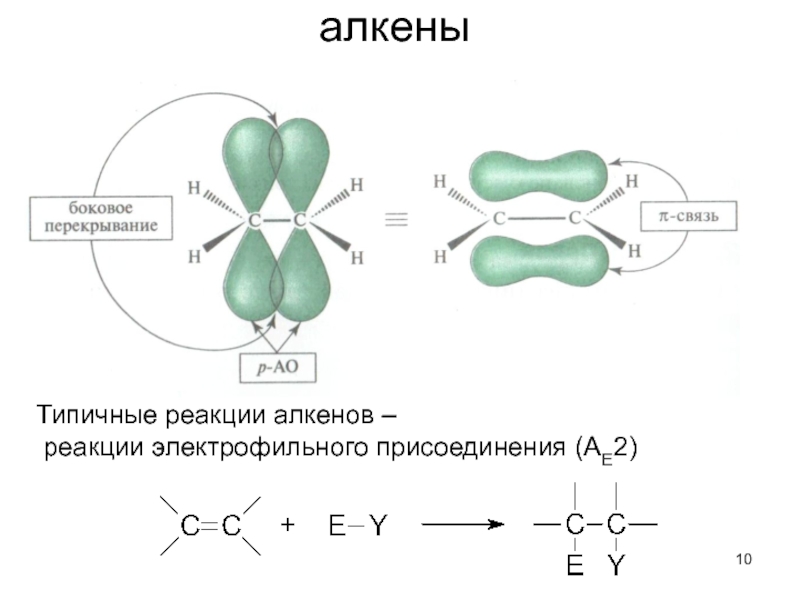
- 10. алкены
- 12. присоединение галогенов (Cl2, Br2)
- 13. Присоединение галогеноводородов в растворе
- 14. Реакции полимеризации – взаимодействие двух или более
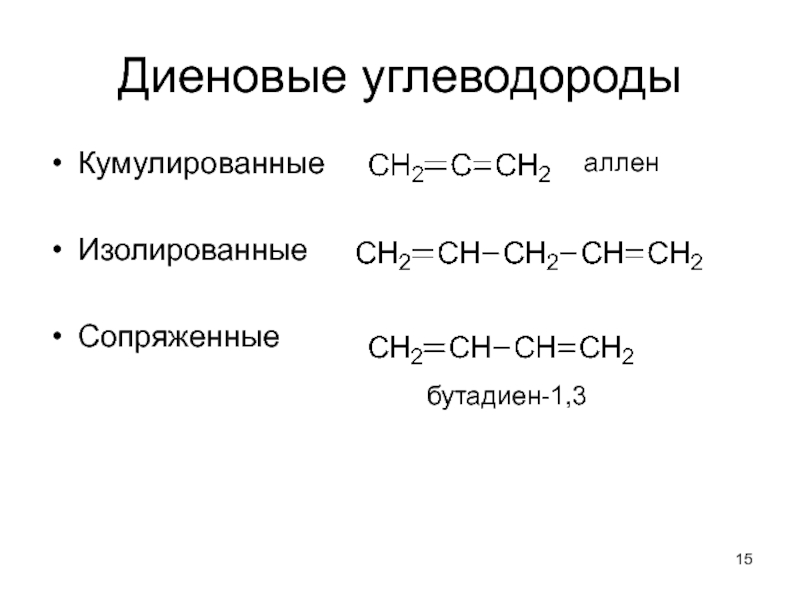
- 15. Диеновые углеводороды Кумулированные Изолированные Сопряженные аллен бутадиен-1,3
- 16. Делокализованная связь – ковалентная связь, молекулярная орбиталь
- 18. Особенности реакций присоединения к алкинам Алкины
- 19. Гидратация алкинов
- 20. Более важной in vivo является двойная
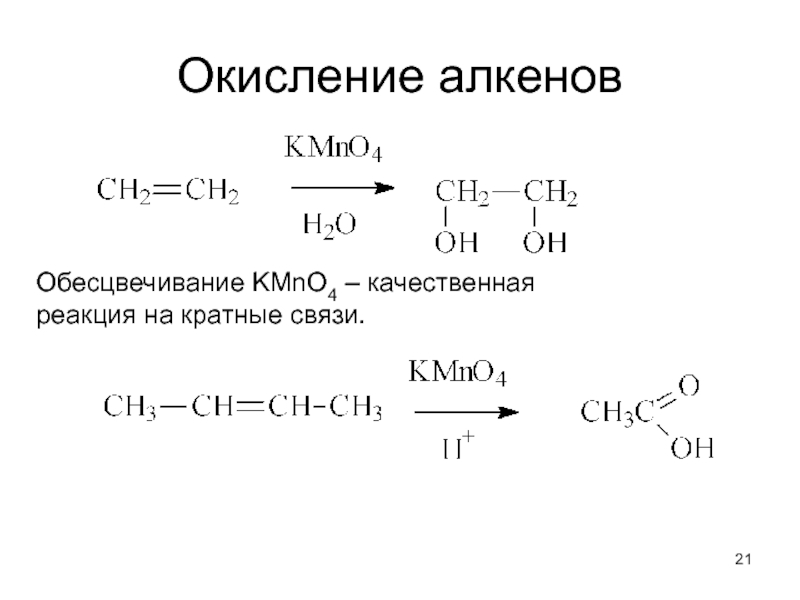
- 21. Окисление алкенов Обесцвечивание KMnO4 – качественная реакция на кратные связи.
- 22. Способы получения алканов, алкенов, алкинов, алкадиенов самостоятельно
- 23. Циклические углеводороды Алициклические углеводороды: - полиметиленовые углеводороды
- 24. Полиметиленовые углеводороды По величине цикла - малые
- 25. нормальные циклы (5, 6, 7
- 26. Конформации циклогексана «кресло» «ванна»
- 27. средние циклы (8 – 11 атомов С) макроциклы (12 и больше атомов С)
- 28. II. Ароматические углеводороды
- 29. Критерии ароматичности Геометрический: все ароматические системы имеют
- 30. Механизм электрофильного замещения в ароматическом ядре SE2
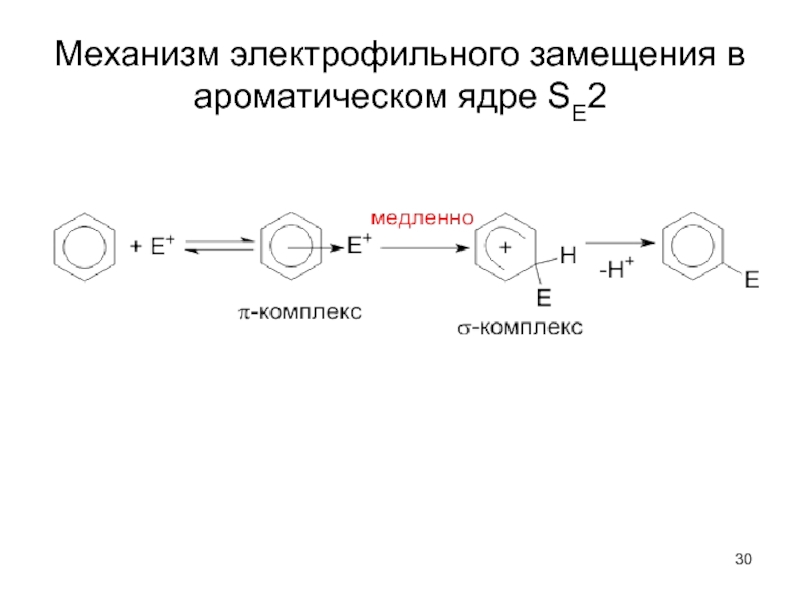
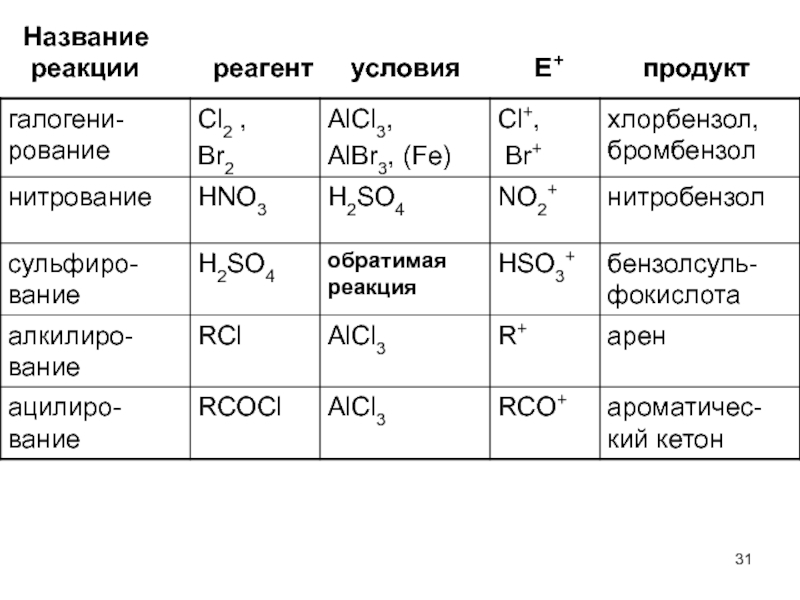
- 31. Название реакции
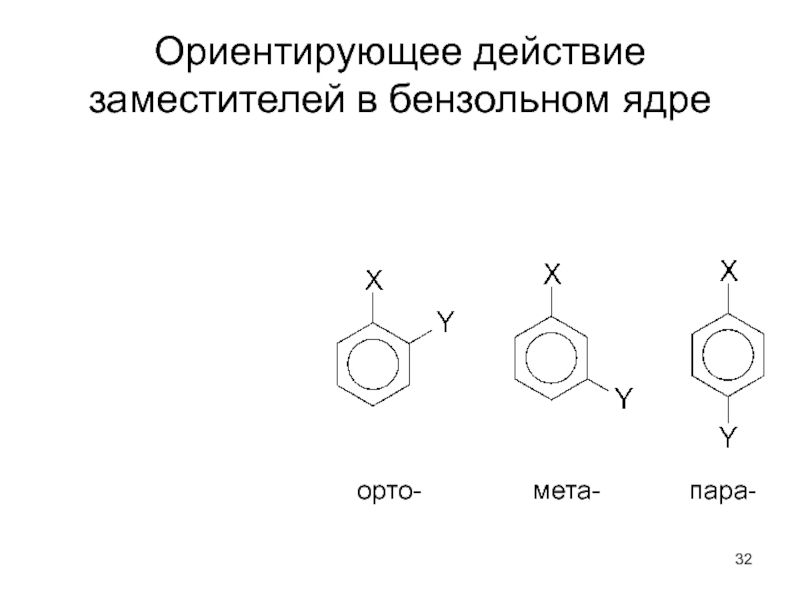
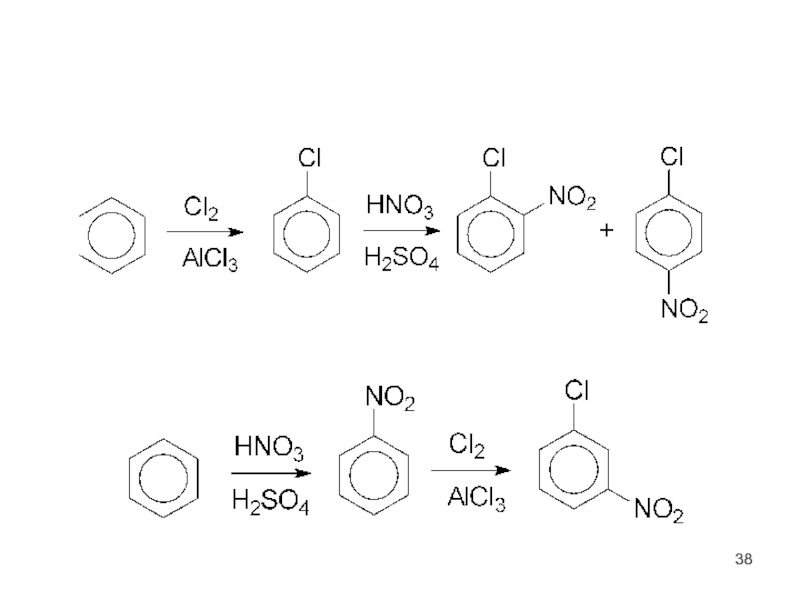
- 32. Ориентирующее действие заместителей в бензольном ядре орто-
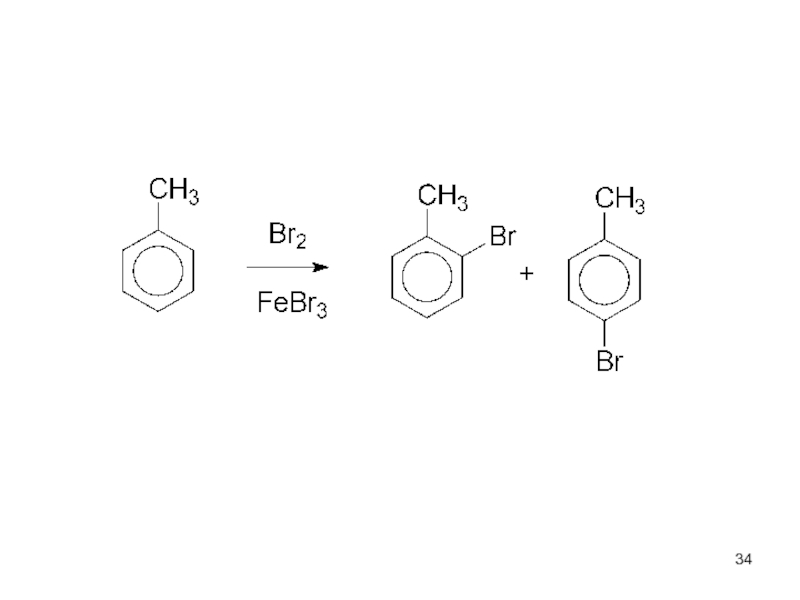
- 33. Заместители I. Активирующие ЭД-заместители. Облегчают ЭФ-замещение
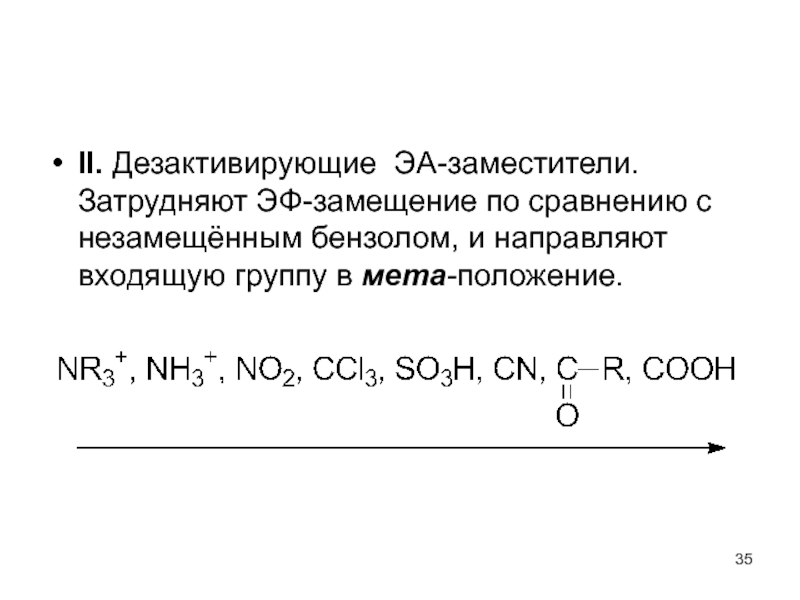
- 35. II. Дезактивирующие ЭА-заместители. Затрудняют ЭФ-замещение по
- 37. III. Дезактивирующие орто- и пара-ориентанты: F, Cl, Br, I (-I), (+C)
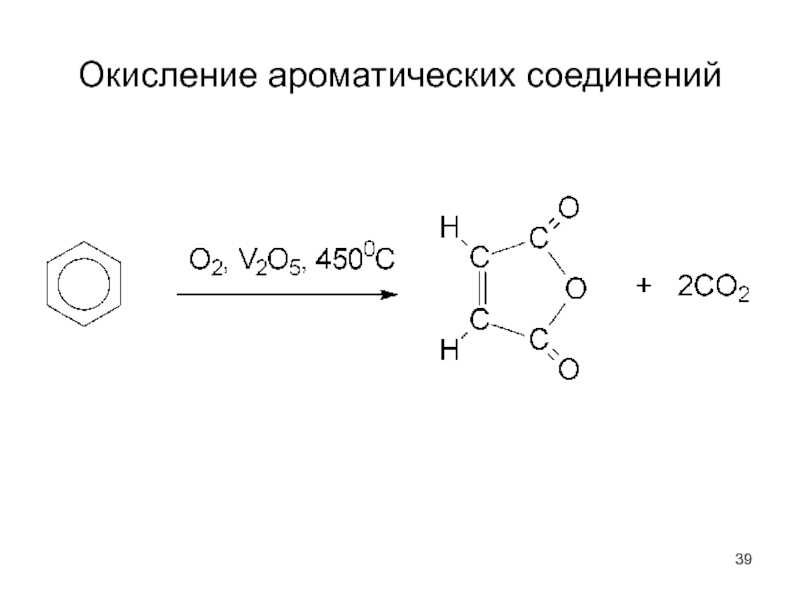
- 39. Окисление ароматических соединений
- 40. Окисление аренов
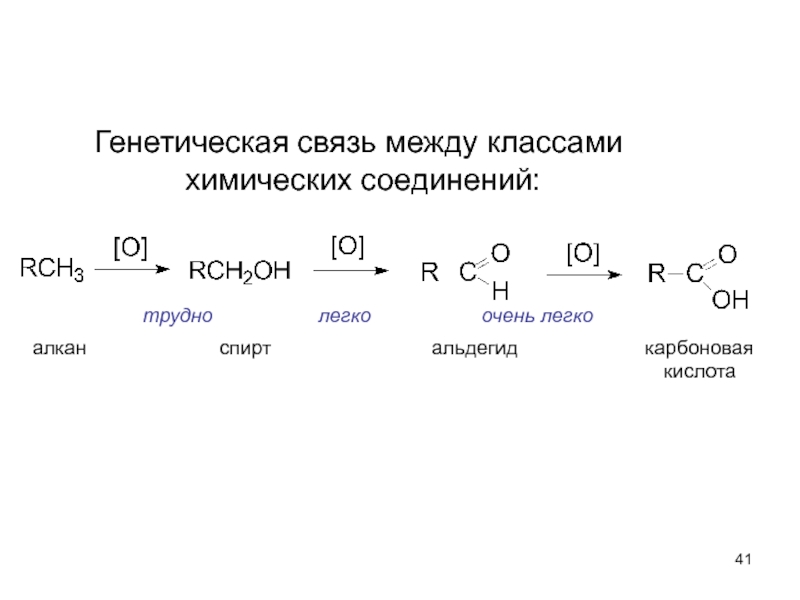
- 41. трудно
- 42. Гидроксилпроизводные углеводородов Спирты. Фенолы.
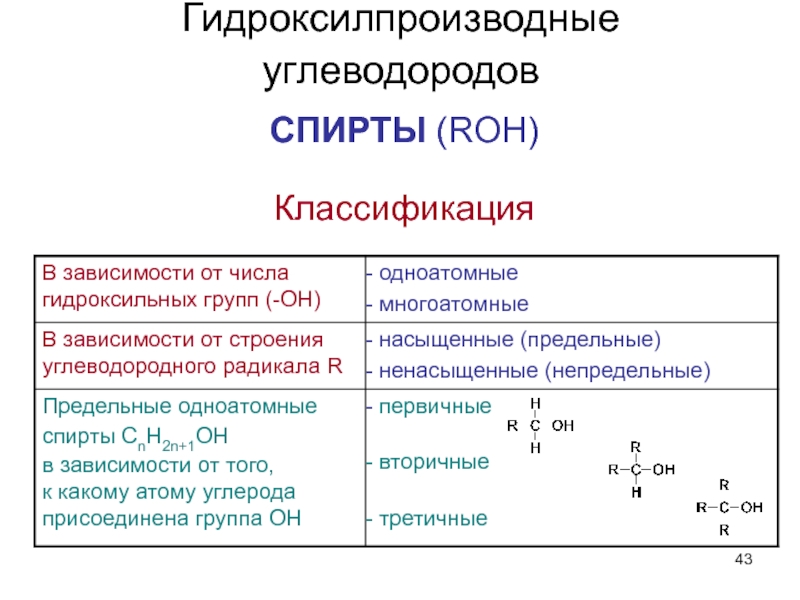
- 43. Гидроксилпроизводные углеводородов СПИРТЫ (ROH) Классификация
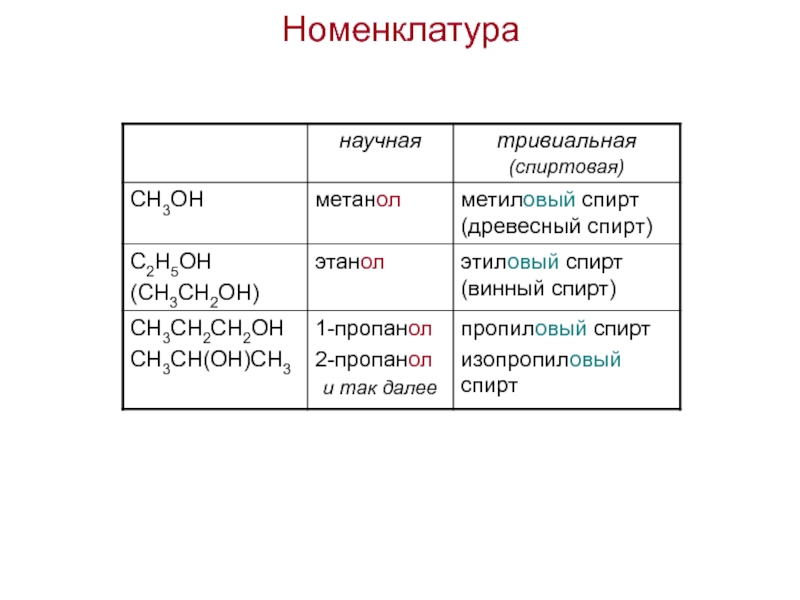
- 44. Номенклатура
- 45. Химические свойства спиртов I. Реакции с сохранением
- 46. Как основания спирты сильнее, чем вода:
- 47. 2) образование простых эфиров через алканоляты
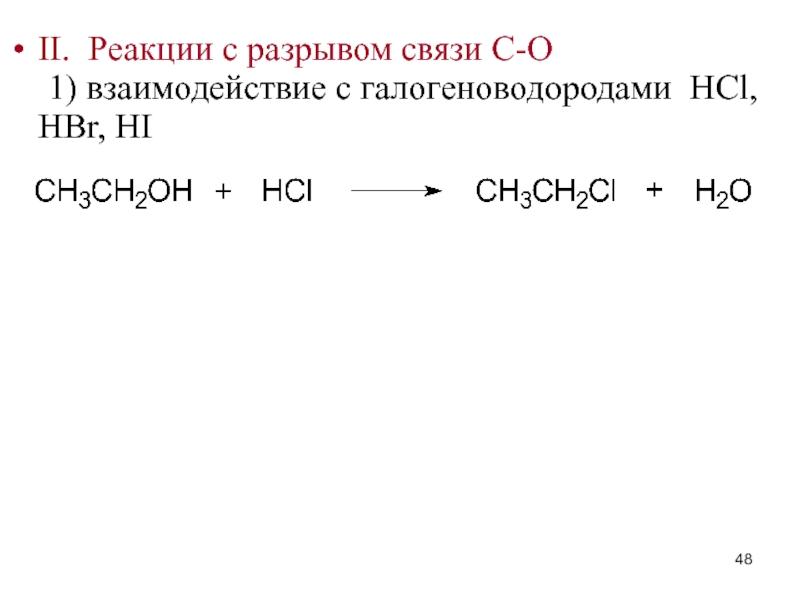
- 48. II. Реакции с разрывом связи C-O 1)
- 49. 2) Взаимодействие с галогенидами фосфора
- 50. 4) образование простых эфиров (межмолекулярное отщепление H2O)
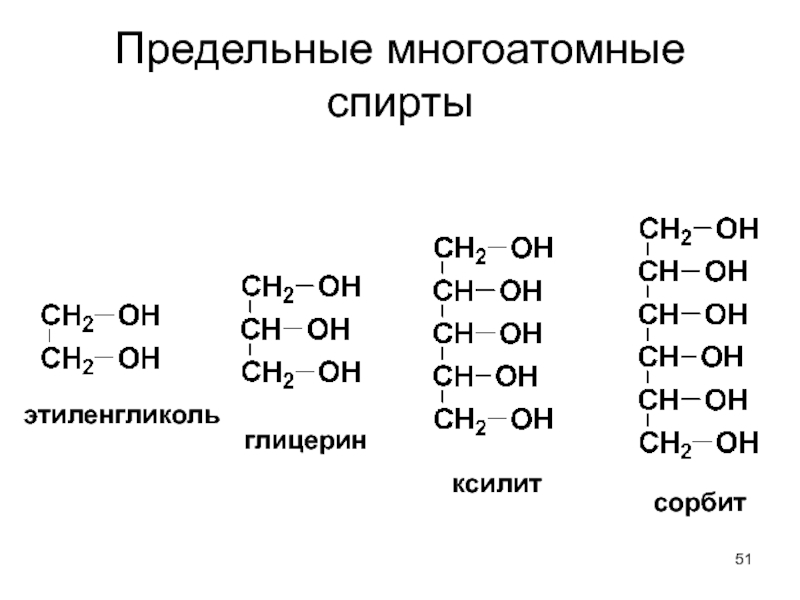
- 51. Предельные многоатомные спирты этиленгликоль глицерин ксилит сорбит
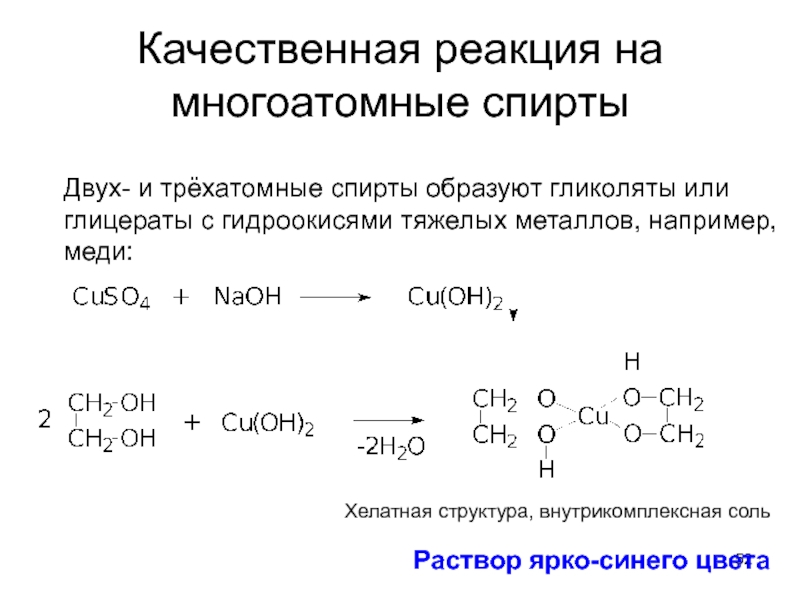
- 52. Качественная реакция на многоатомные спирты Двух-
- 53. ФЕНОЛЫ Одноатомные фенолы (оксибензол)
- 54. Химические свойства фенолов
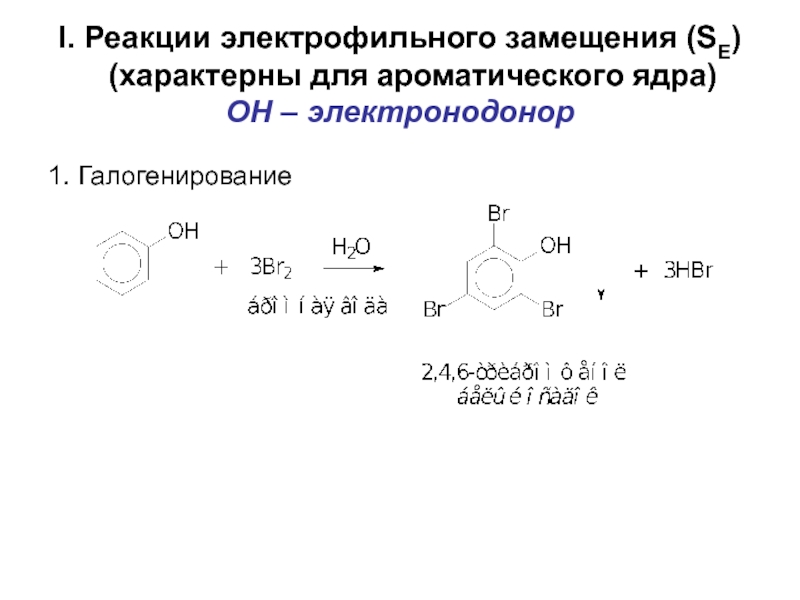
- 55. I. Реакции электрофильного замещения (SE)
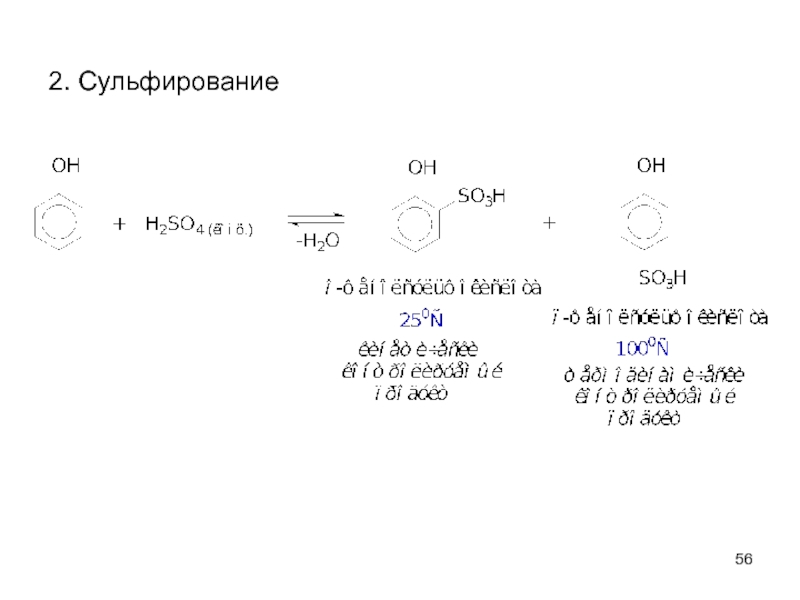
- 56. 2. Сульфирование
- 57. 3. Нитрование Концентрированная азотная кислота и нитрующая смесь окисляют фенол, поэтому его нитруют разбавленной HNO3
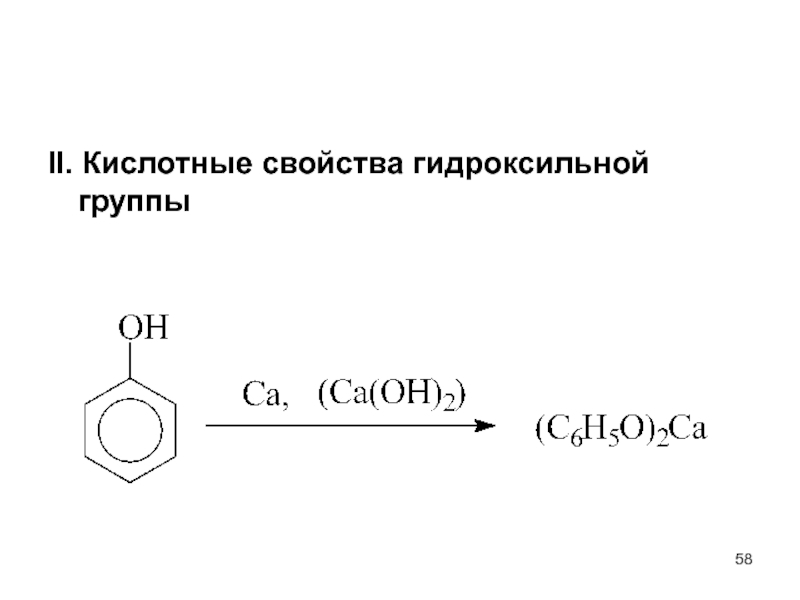
- 58. II. Кислотные свойства гидроксильной группы
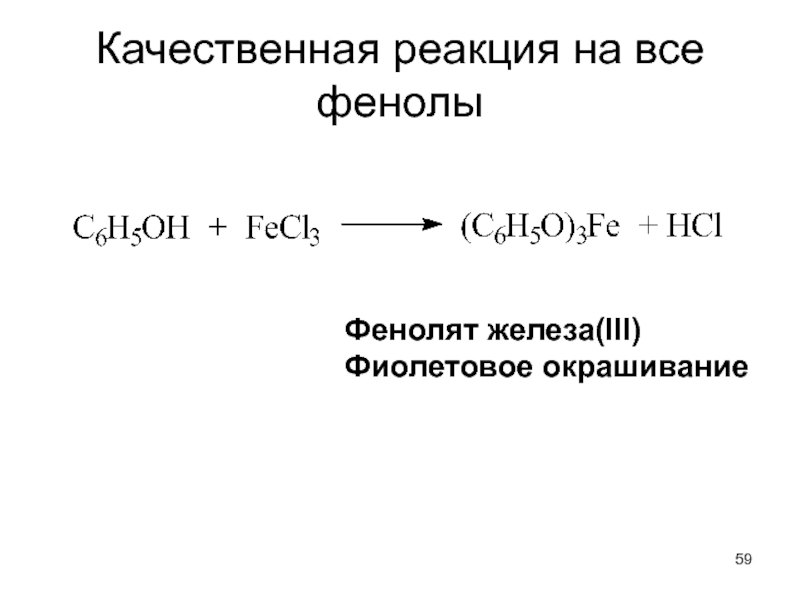
- 59. Качественная реакция на все фенолы Фенолят железа(III) Фиолетовое окрашивание
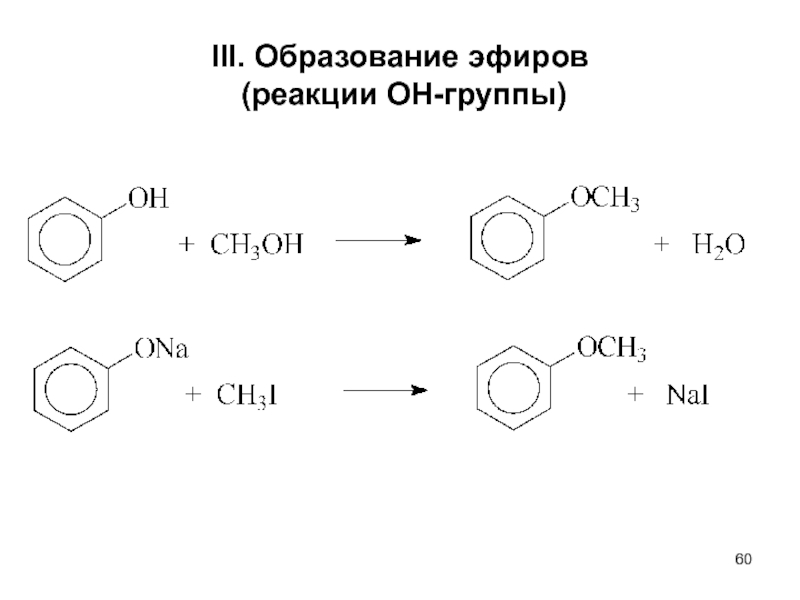
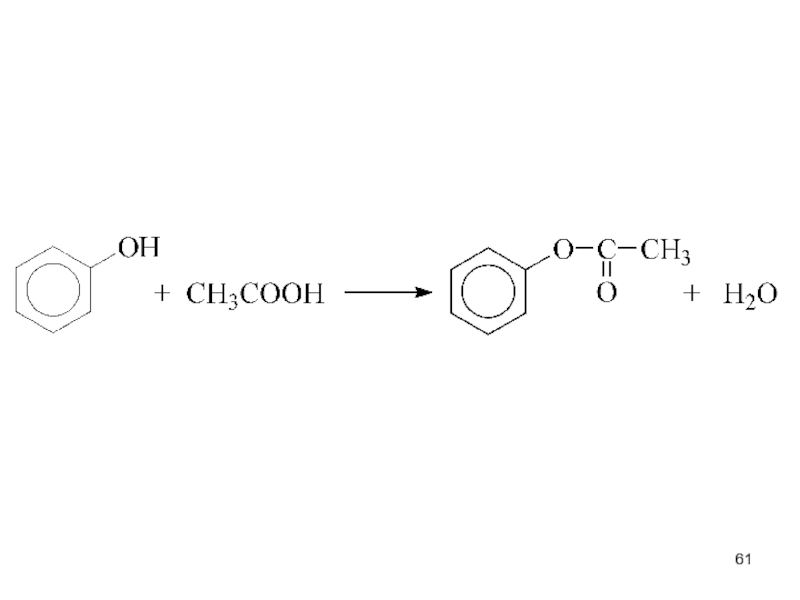
- 60. III. Образование эфиров (реакции ОН-группы)
- 62. ПРОСТЫЕ ЭФИРЫ R-O-R, Ar-O-R, Ar-O-Ar
- 63. Малореакционноспособные соединения. Устойчивы к гидролизу, действию разбавленных кислот, сильных оснований.
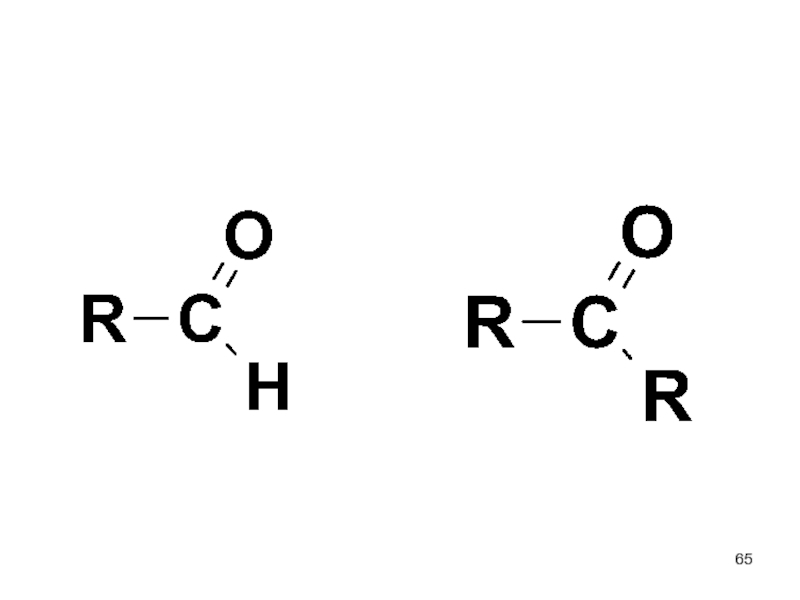
- 64. Карбонильные производные
- 67. - ароматические альдегиды бензальдегид
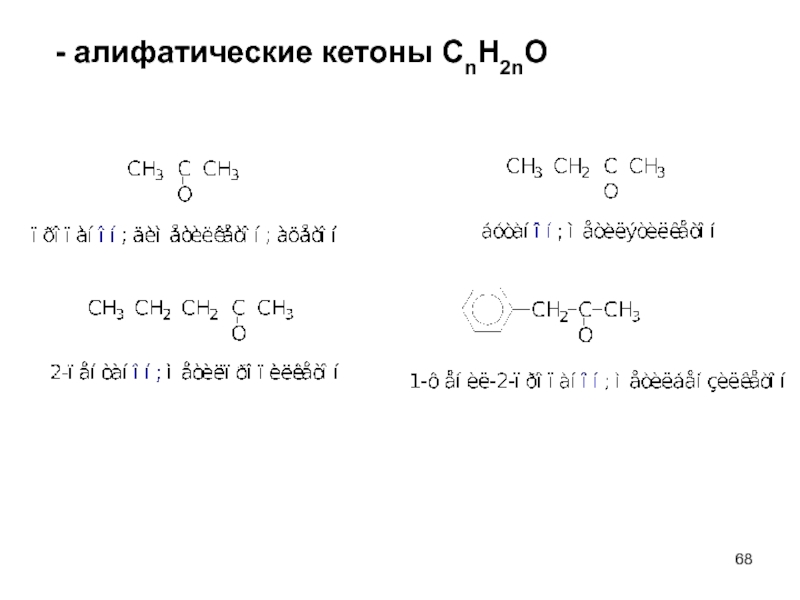
- 68. - алифатические кетоны СnH2nO
- 69. Строение и свойства карбонильной группы
- 70. Химические свойства альдегидов и кетонов
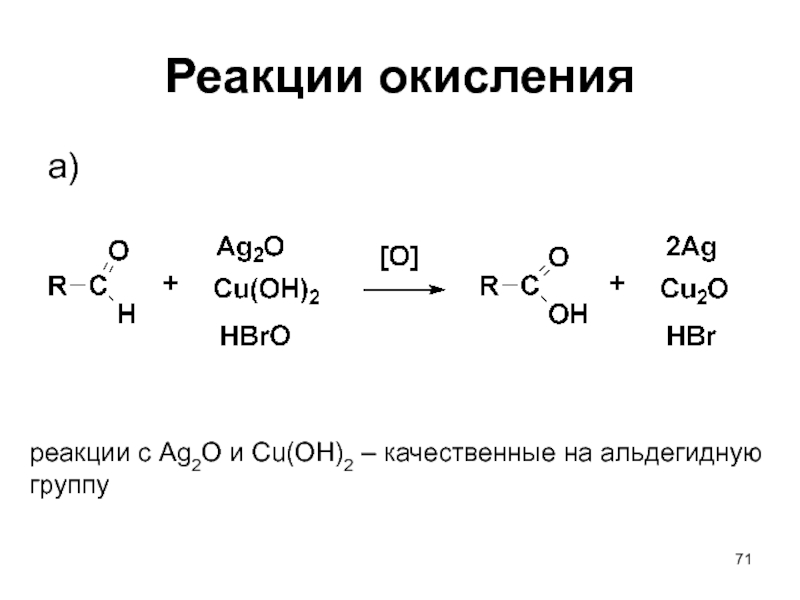
- 71. Реакции окисления a) реакции с
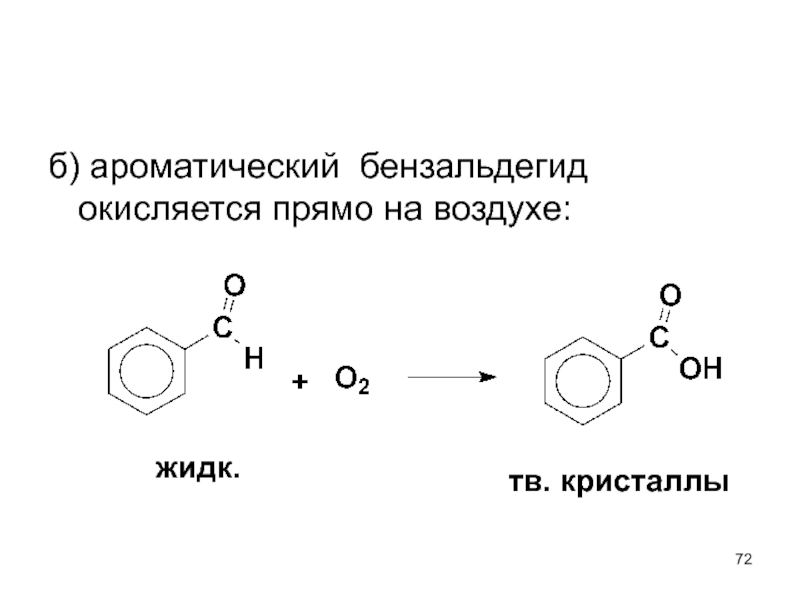
- 72. б) ароматический бензальдегид окисляется прямо на воздухе: жидк. тв. кристаллы
- 73. в) кетоны не окисляются, а в жестких условиях разрушаются.
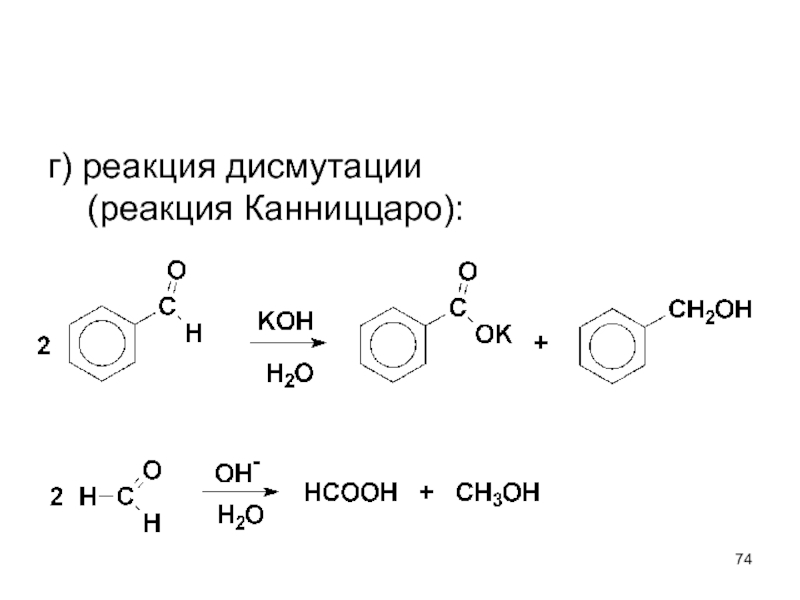
- 74. г) реакция дисмутации (реакция Канниццаро):
- 75. Реакции полимеризации и конденсации а) полимеризация
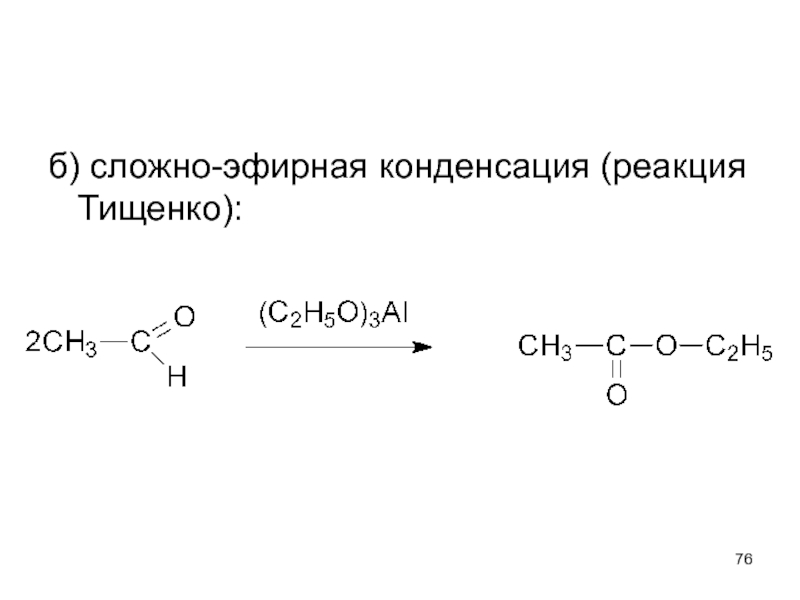
- 76. б) сложно-эфирная конденсация (реакция Тищенко):
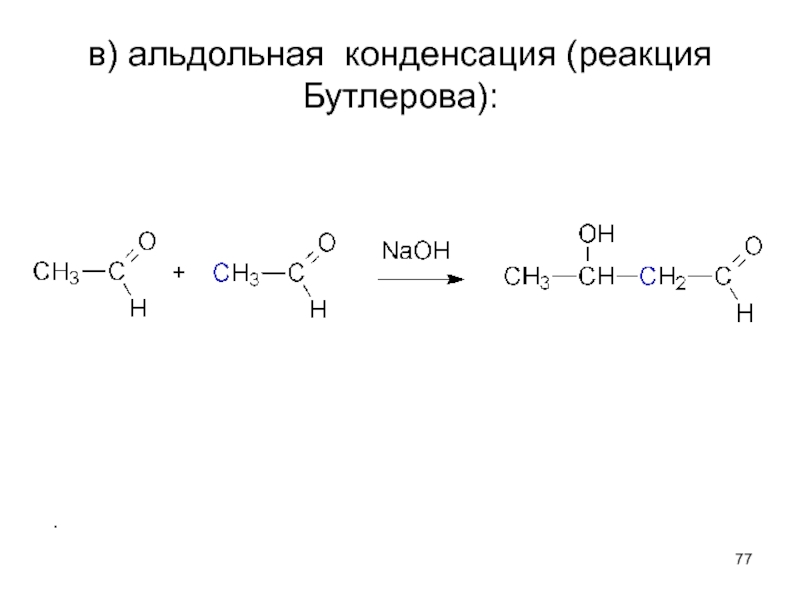
- 77. в) альдольная конденсация (реакция Бутлерова):
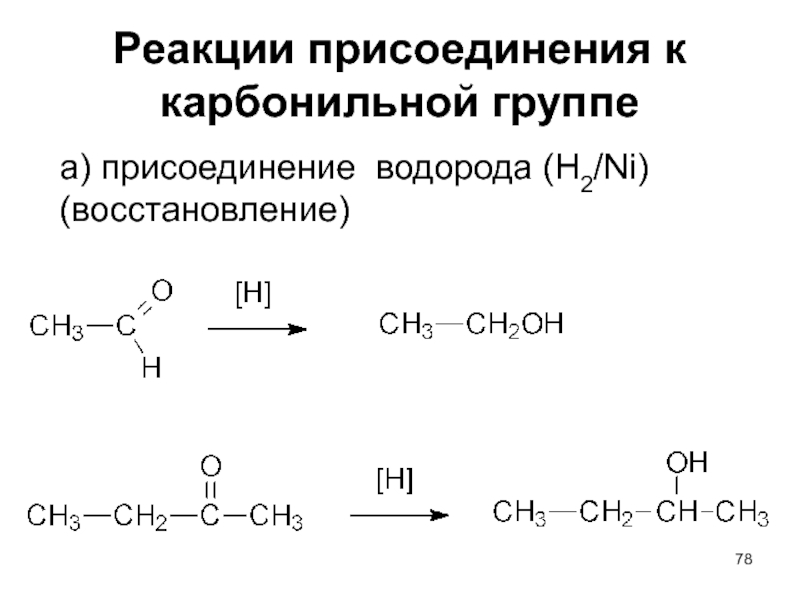
- 78. Реакции присоединения к карбонильной группе а) присоединение водорода (H2/Ni) (восстановление)
- 79. б) +HCN HCN – очень слабая кислота. Анион любой слабой кислоты является сильным нуклеофилом.
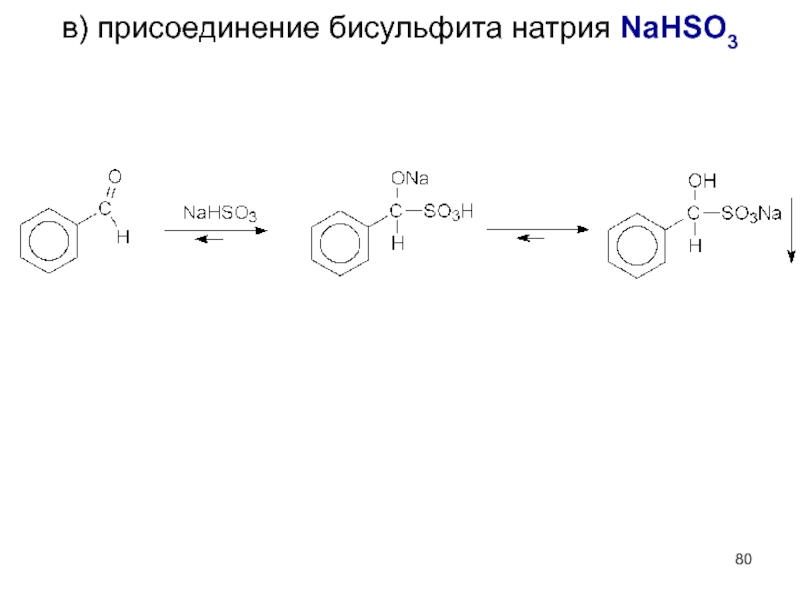
- 80. в) присоединение бисульфита натрия NaHSO3
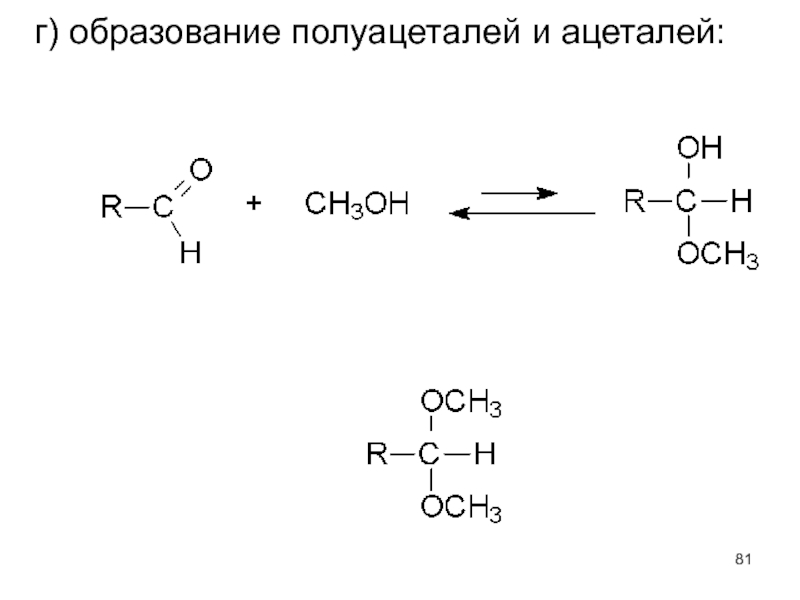
- 81. г) образование полуацеталей и ацеталей:
- 82. д) аналогично для кетонов идет образование полукеталей и кеталей
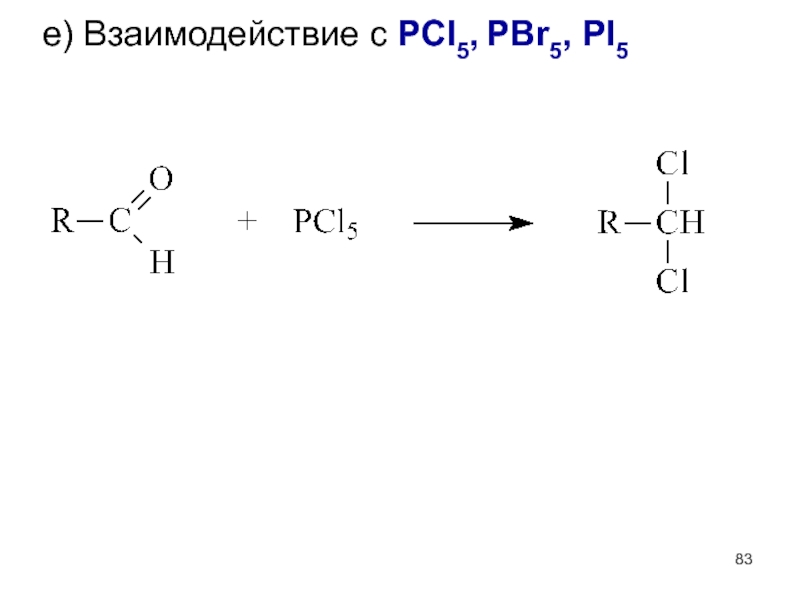
- 83. е) Взаимодействие с PCl5, PBr5, PI5
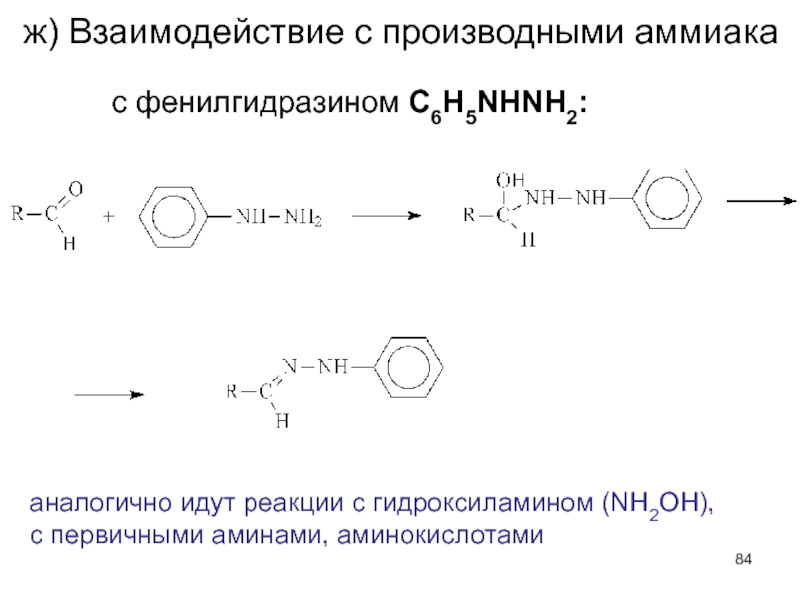
- 84. ж) Взаимодействие с производными аммиака с фенилгидразином
- 85. Реакции по связям С-Н в алкильном радикале
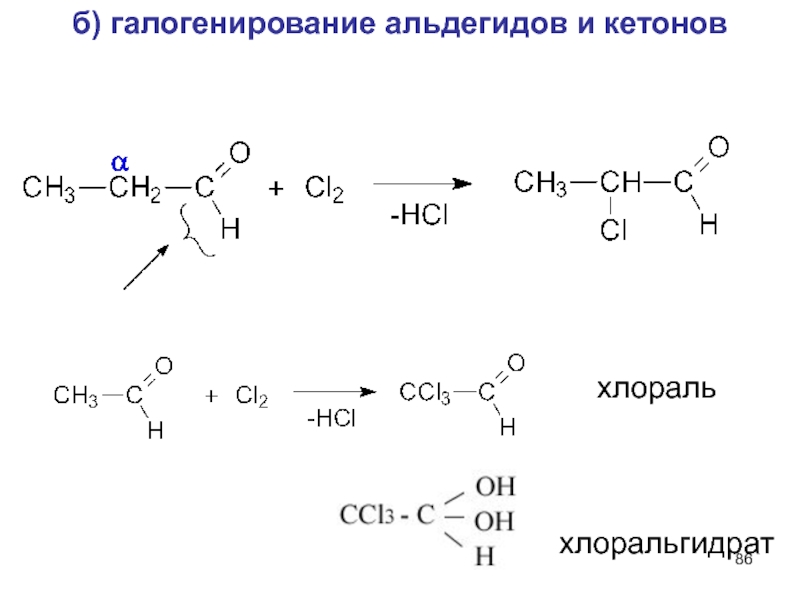
- 86. б) галогенирование альдегидов и кетонов хлораль хлоральгидрат
- 87. Получение альдегидов и кетонов Окислением первичных
- 88. КАРБОНОВЫЕ КИСЛОТЫ (карбоксильные производные)
- 89. Классификация: алифатические КК (предельные и непредельные) ароматические
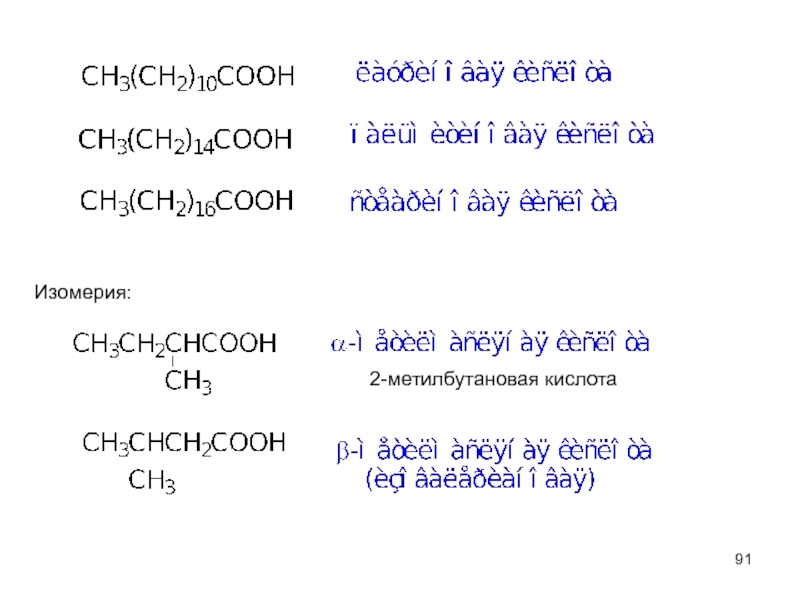
- 90. Предельные монокарбоновые кислоты CnH2n+1COOH Номенклатура
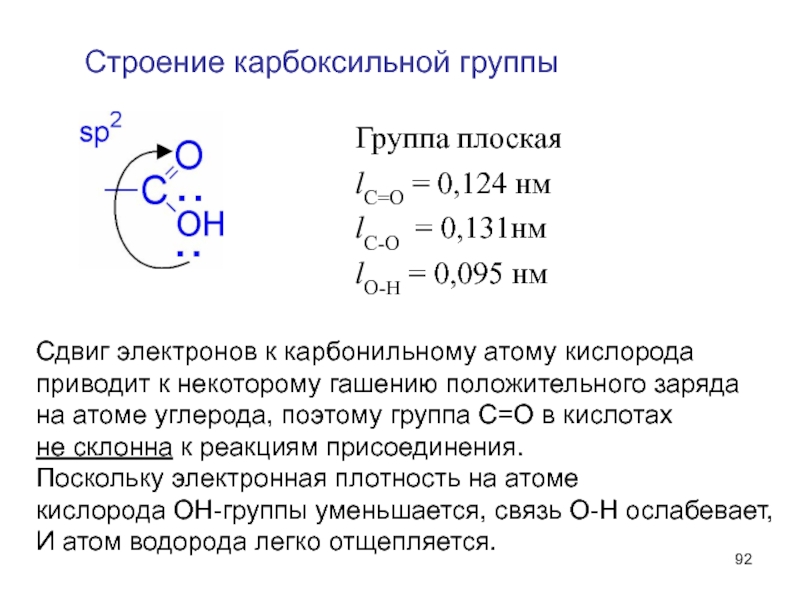
- 92. Строение карбоксильной группы Группа плоская lC=O =
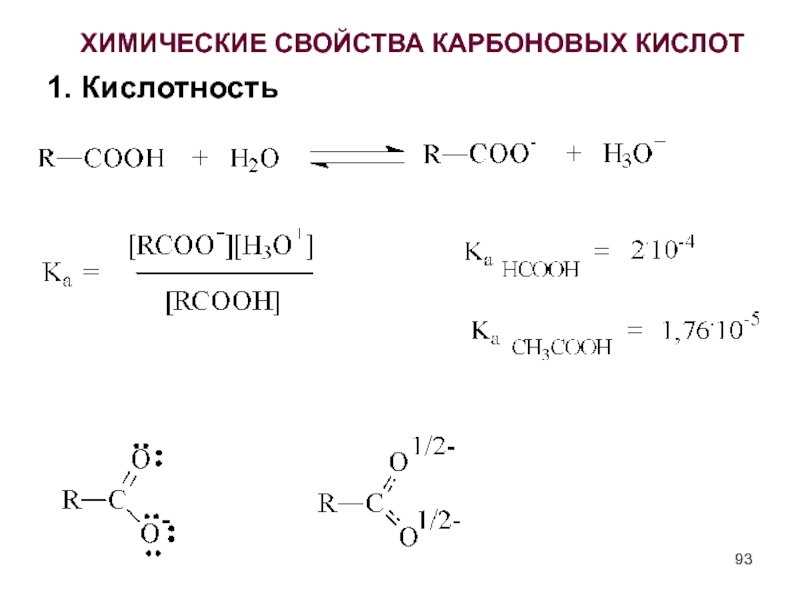
- 93. ХИМИЧЕСКИЕ СВОЙСТВА КАРБОНОВЫХ КИСЛОТ 1. Кислотность
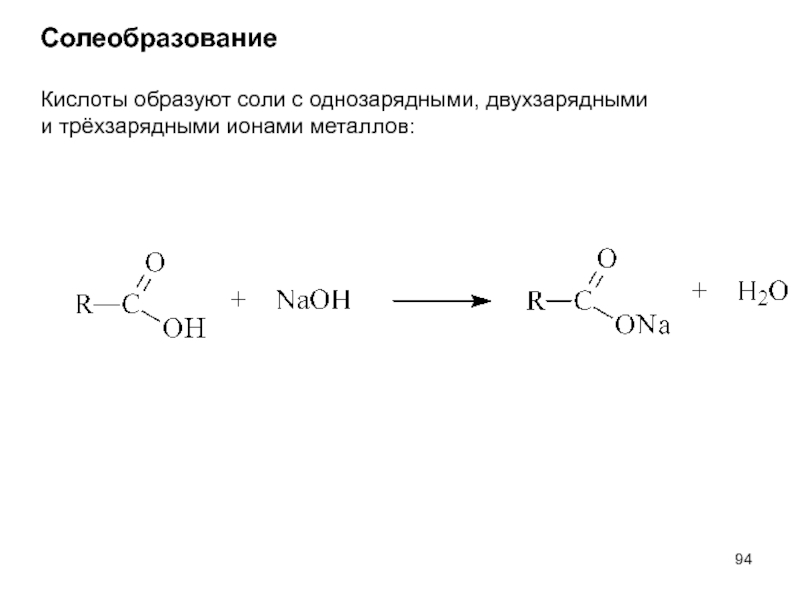
- 94. Солеобразование Кислоты образуют соли с однозарядными, двухзарядными и трёхзарядными ионами металлов:
- 95. 2. Реакции нуклеофильного замещения в
- 96. ФУНКЦИОНАЛЬНЫЕ ПРОИЗВОДНЫЕ КАРБОНОВЫХ КИСЛОТ (ФПКК)
- 97. I. Сложные эфиры
- 98. II. Хлорангидриды
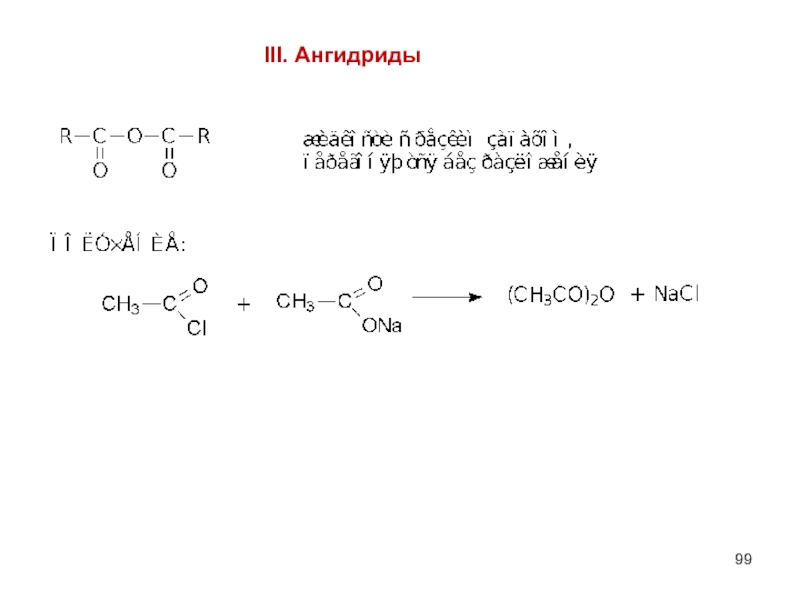
- 99. III. Ангидриды
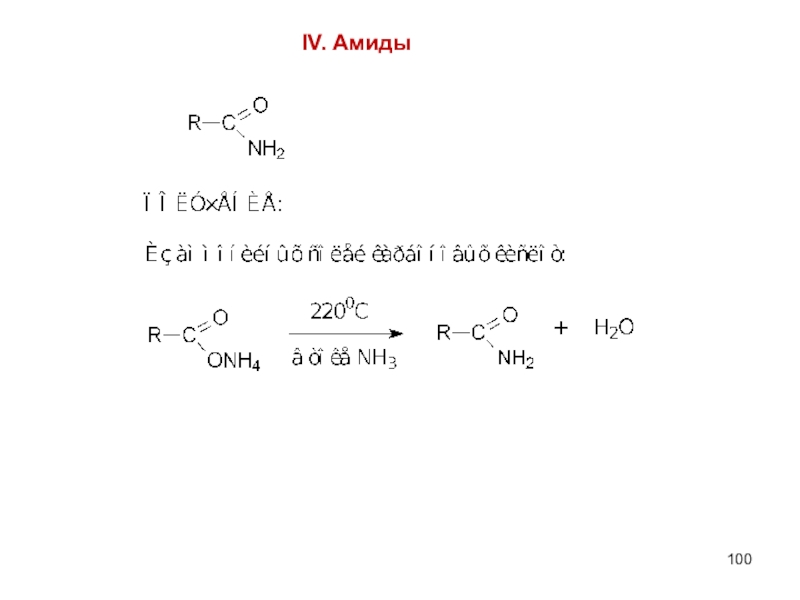
- 100. IV. Амиды
- 101. Липиды содержатся в животных и растительных
- 102. Структурные компоненты липидов СПИРТЫ ВЫСШИЕ ЖИРНЫЕ КАРБОНОВЫЕ КИСЛОТЫ другие вещества
- 103. СПИРТЫ ВЫСШИЕ ЖИРНЫЕ КК другие вещества СПИРТЫ ВЫСШИЕ ЖИРНЫЕ КК
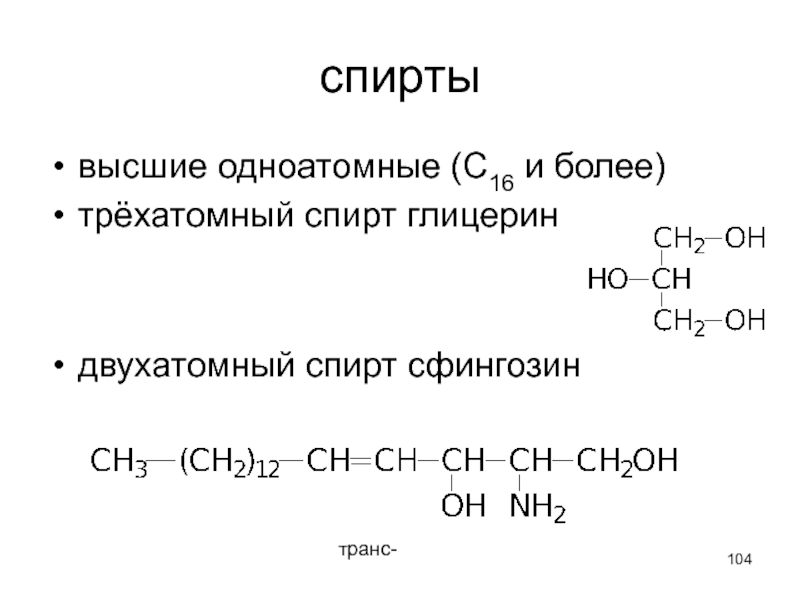
- 104. спирты высшие одноатомные (С16 и более) трёхатомный
- 105. Простые липиды воски жиры и масла церамиды стериды
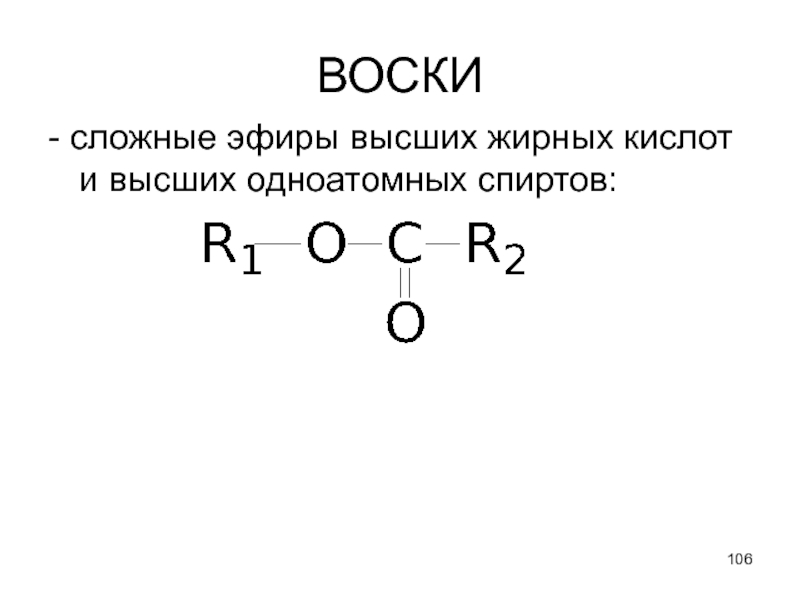
- 106. ВОСКИ - сложные эфиры высших жирных кислот
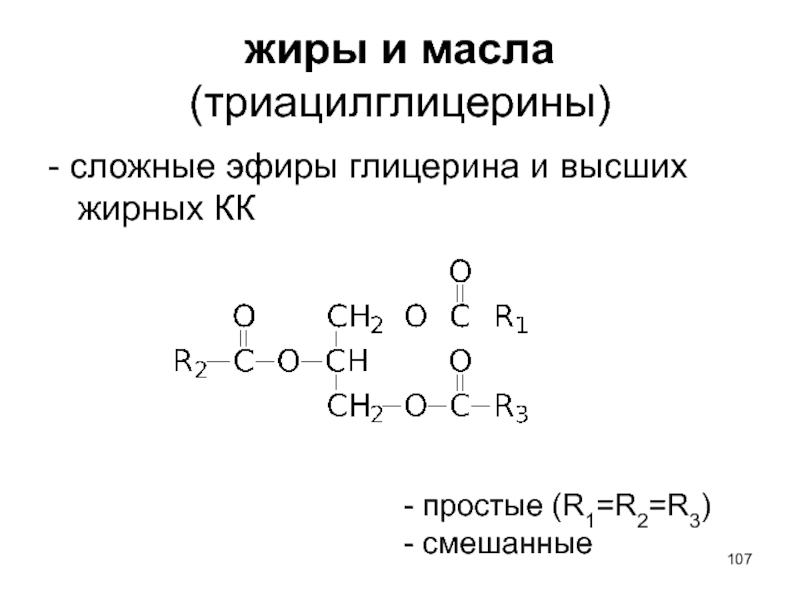
- 107. жиры и масла (триацилглицерины) - сложные эфиры
- 108. церамиды - N-ацилированные производные спирта сфингозина
- 109. стериды - сложные эфиры высокосмолекулярного циклического спирта стерола и высокомолекулярной КК
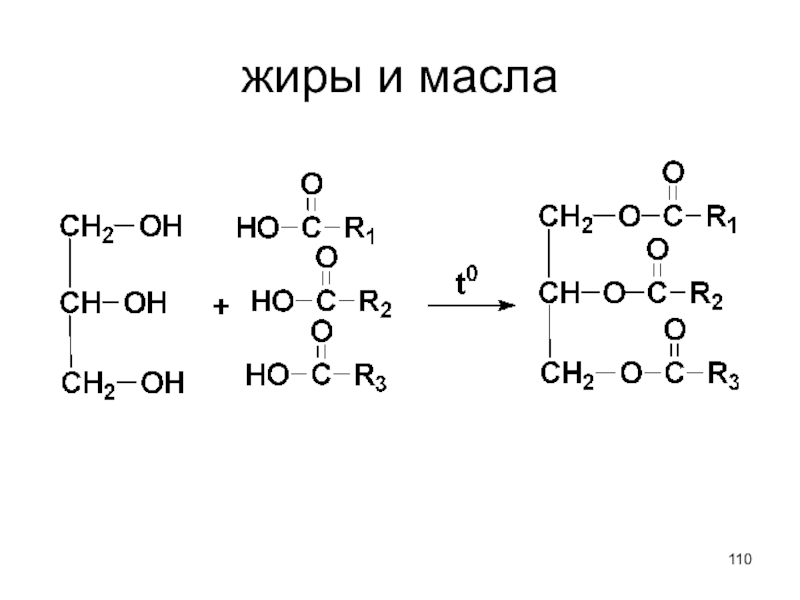
- 110. жиры и масла
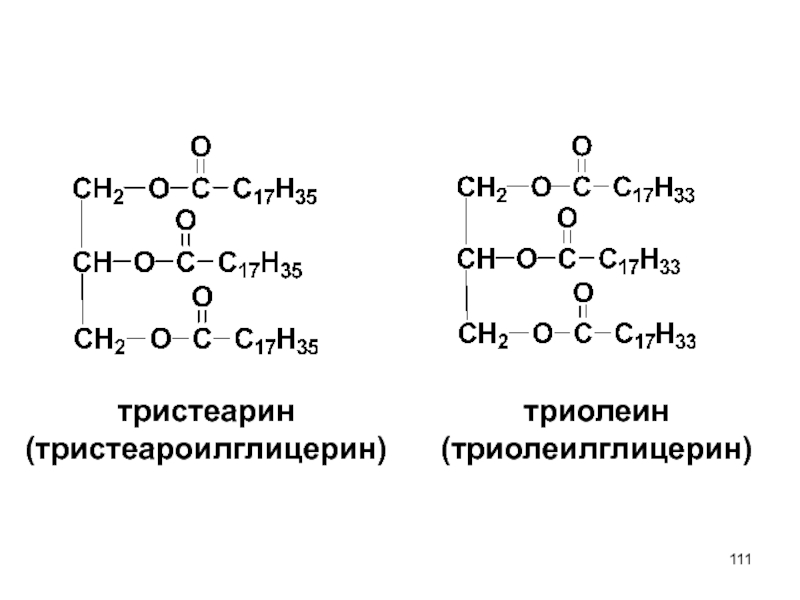
- 111. тристеарин (тристеароилглицерин) триолеин (триолеилглицерин)
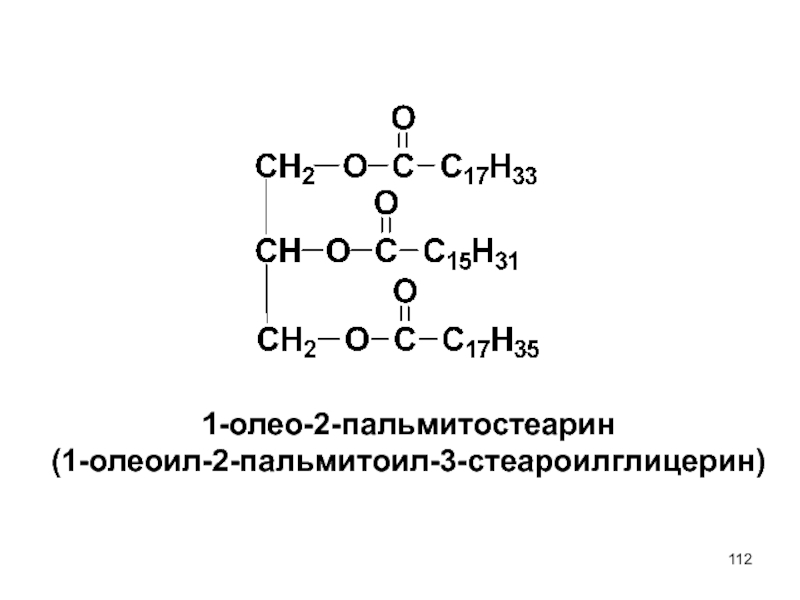
- 112. 1-олео-2-пальмитостеарин (1-олеоил-2-пальмитоил-3-стеароилглицерин)
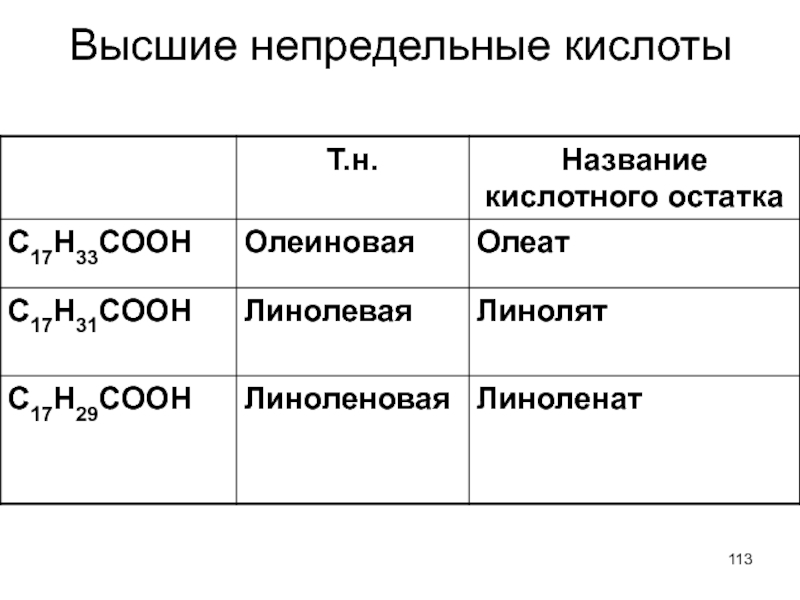
- 113. Высшие непредельные кислоты
- 114. химические свойства - гидрогенизация
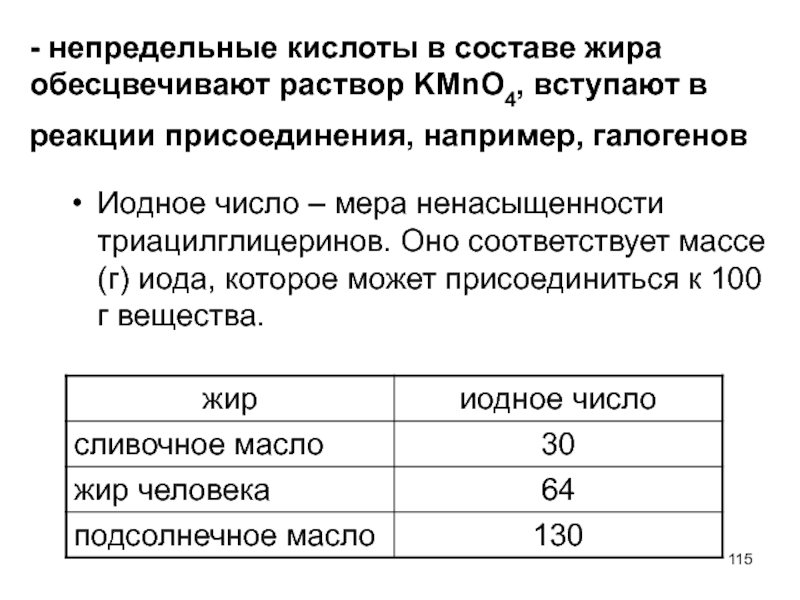
- 115. - непредельные кислоты в составе жира обесцвечивают
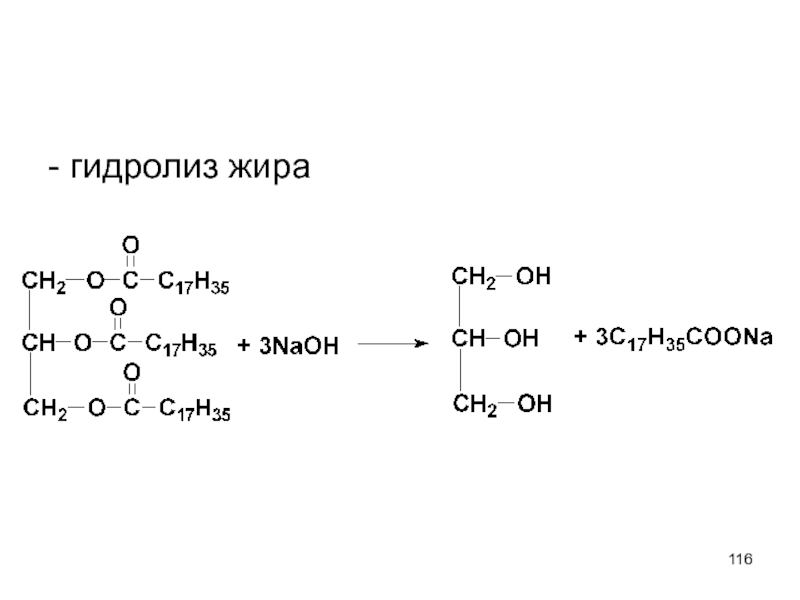
- 116. - гидролиз жира
- 117. - акролеиновая проба
- 118. Биологическая роль жиров Энергетическая Структурная Резервная
- 119. Сложные липиды Фосфолипиды Сфинголипиды Гликолипиды
- 120. Фосфолипиды - липиды, при гидролизе отщепляющие фосфорную
- 121. Глицерофосфолипиды – главные липидные компоненты клеточных
- 122. Глицерофосфолипиды являются производными фосфатидной кислоты. В их
- 123. глицерофосфолипид Как правило, в
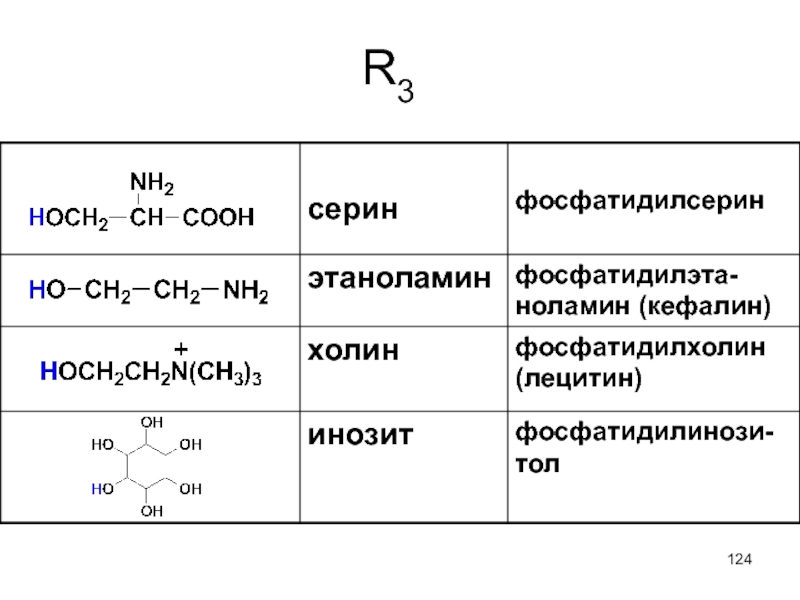
- 124. R3
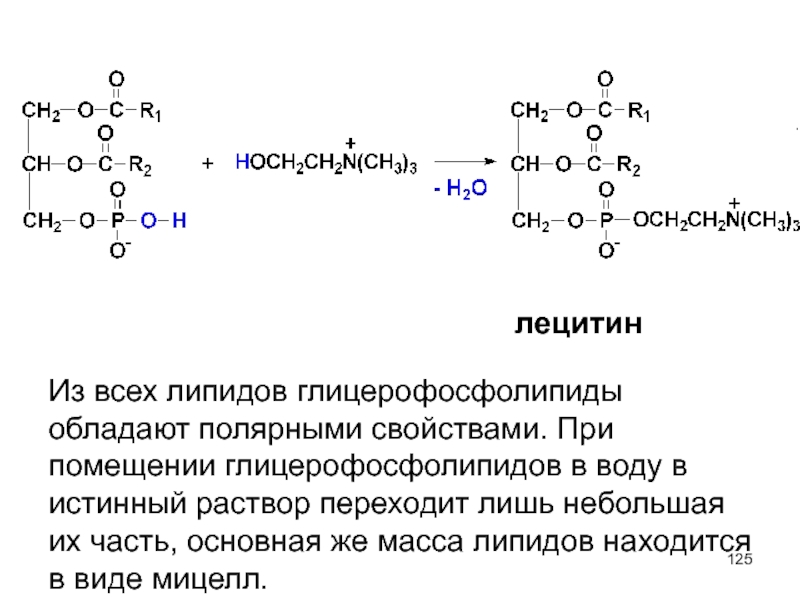
- 125. лецитин Из всех липидов глицерофосфолипиды обладают полярными
- 126. Биологическая роль фосфолипидов Структурная - входят в
Слайд 2Учебники
1. Тюкавкина Н.А., Бауков Ю.И. Биоорганическая химия (2012, 2008, 1985г.)
2. Степаненко
Слайд 3Органические соединения - углеводороды и их функциональных производных (соединений, содержащих функциональные
Биоорганическая химия изучает строение и свойства веществ, участвующих в процессах жизнедеятельности, в непосредственной связи с познанием их биологических функций.
Основные объекты изучения:
- биополимеры (белки, углеводы, нуклеиновые кислоты)
- биорегуляторы (витамины, гормоны, лекарственные вещества)
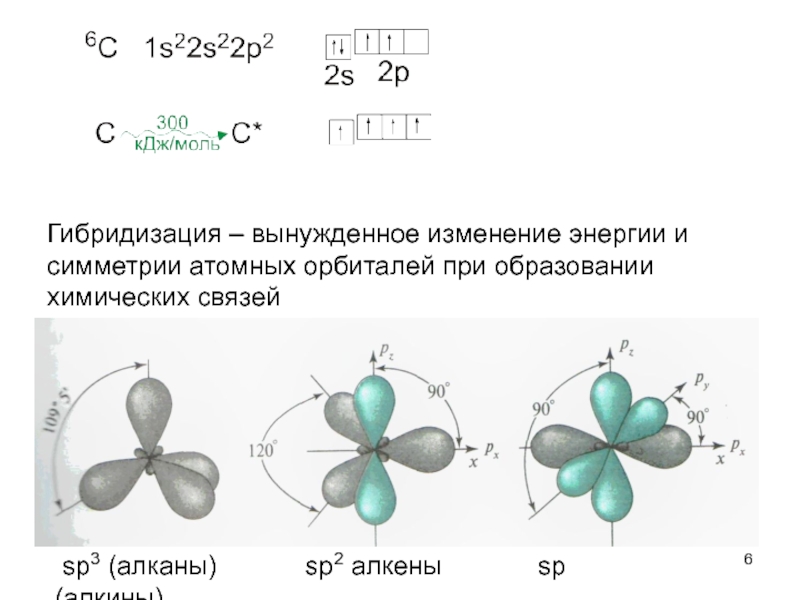
Слайд 4 Функциональные группы:
- атомные группировки – атомы металлов и неметаллов (CH3Cl,
- молекулярные группировки – остатки молекул неорганических веществ (CH3NO2, CH3OH)
- π-электронные группировки – двойные и тройные связи.
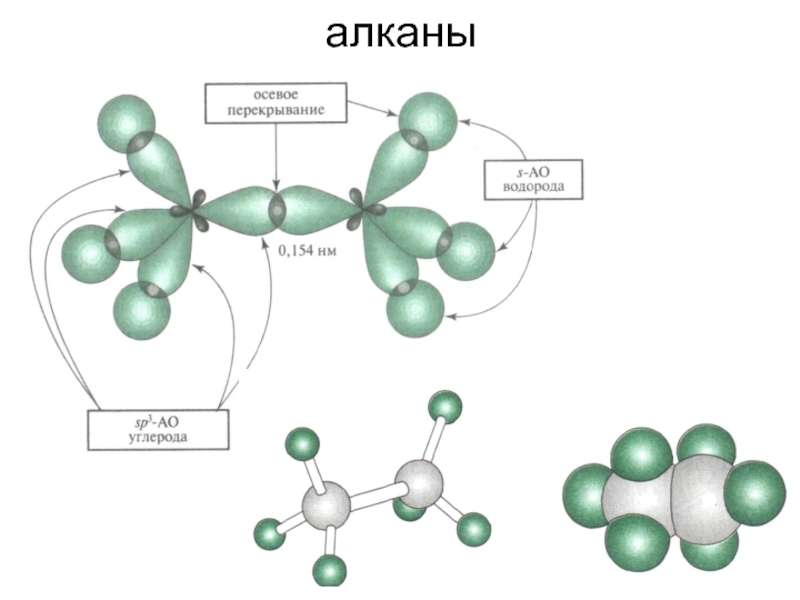
Слайд 8Алканы – малореакционноспособные соединения, «химические мертвецы».
С трудом вступают в
Для образования радикалов нужны жёсткие условия (облучение УФ светом, нагревание выше 3000С).
Радикал – частица, имеющая неспаренный электрон. Образуется при гомолитическом разрыве ковалентной связи:
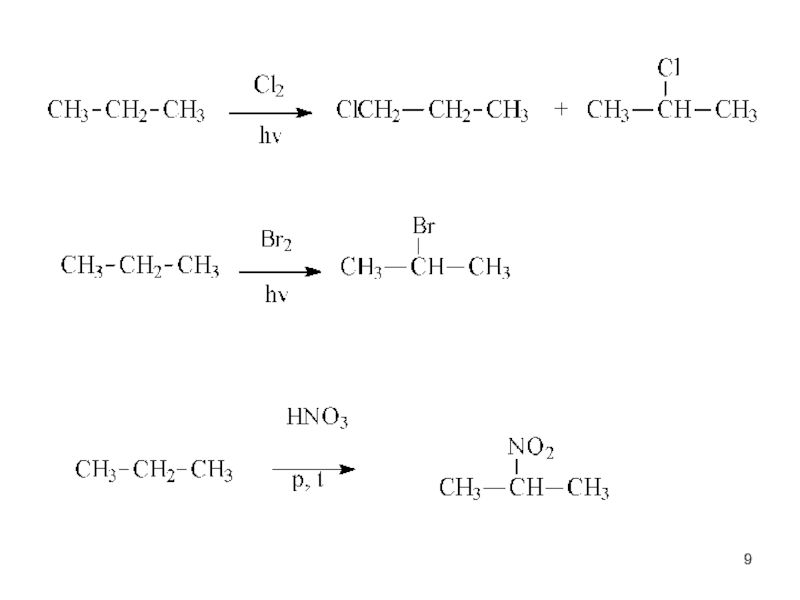
Слайд 12 присоединение галогенов (Cl2, Br2)
при комнатной температуре в
Обесцвечивание брома – качественная реакция на кратные связи.
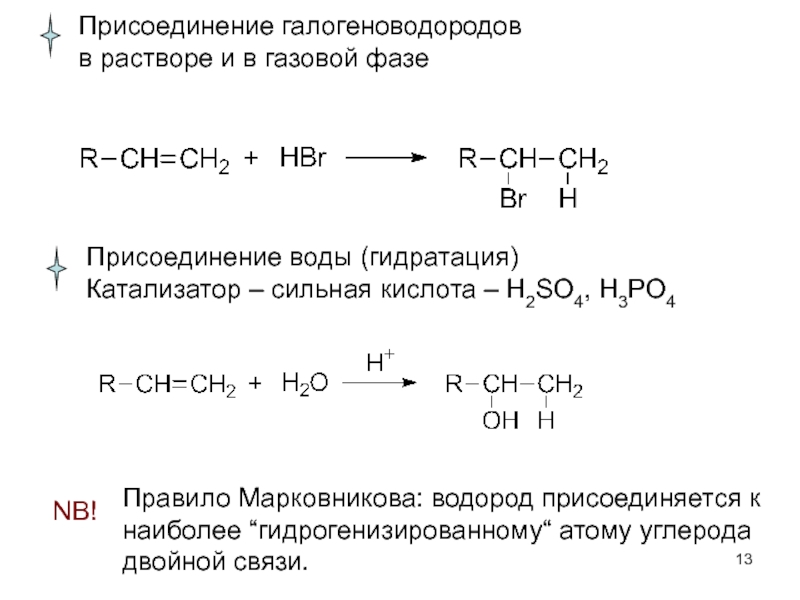
Слайд 13
Присоединение галогеноводородов
в растворе и в газовой фазе
Присоединение воды (гидратация)
Катализатор – сильная
NB!
Правило Марковникова: водород присоединяется к наиболее “гидрогенизированному“ атому углерода двойной связи.
Слайд 14Реакции полимеризации – взаимодействие двух или более молекул ненасыщенных соединений или
Никогда не сопровождаются отщеплением каких-либо атомов или молекул.
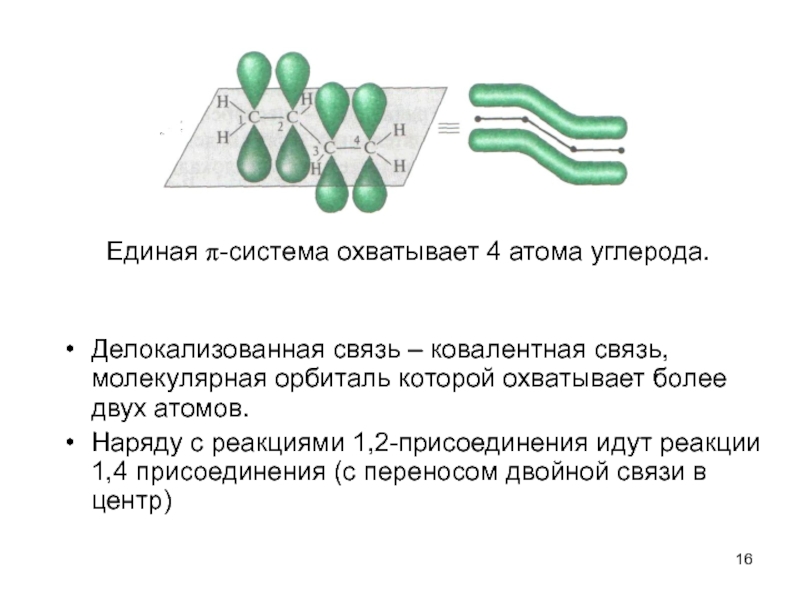
Слайд 16Делокализованная связь – ковалентная связь, молекулярная орбиталь которой охватывает более двух
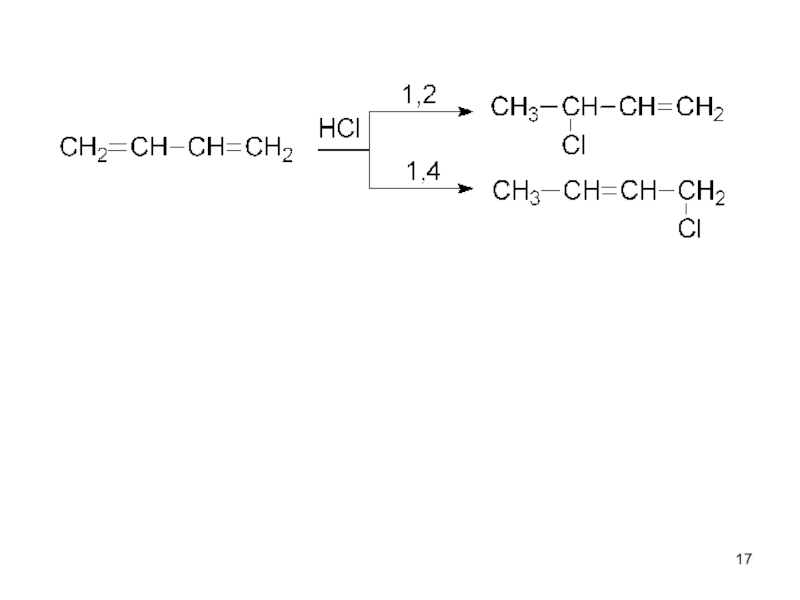
Наряду с реакциями 1,2-присоединения идут реакции 1,4 присоединения (с переносом двойной связи в центр)
Единая π-система охватывает 4 атома углерода.
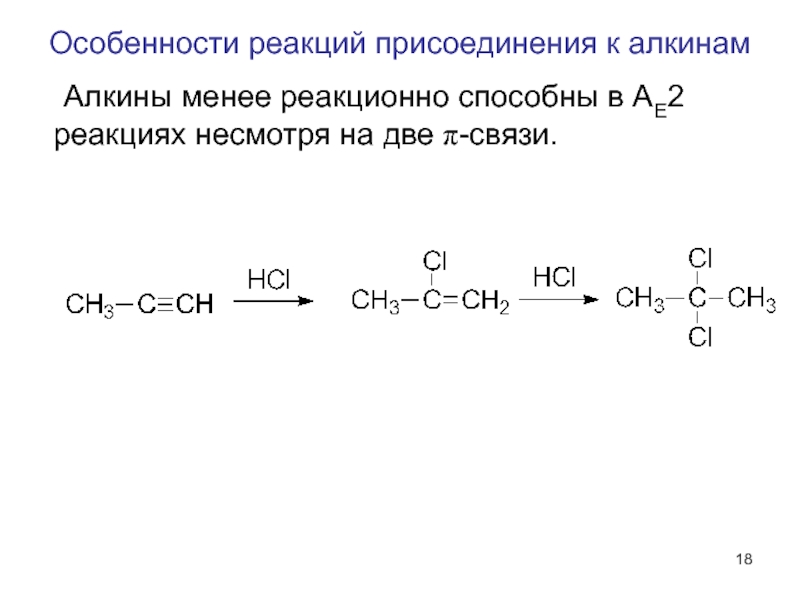
Слайд 18Особенности реакций присоединения к алкинам
Алкины менее реакционно способны в AE2
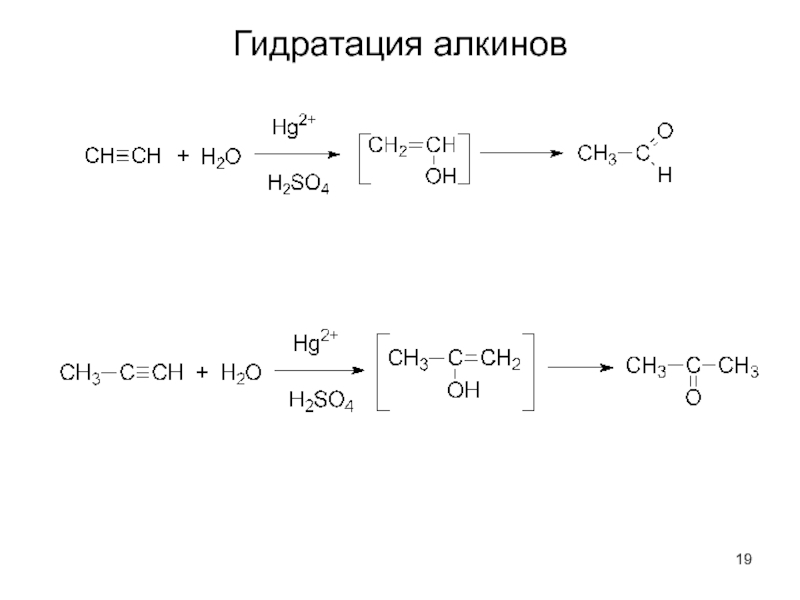
Слайд 20
Более важной in vivo является двойная связь. Возникновение двойной связи и
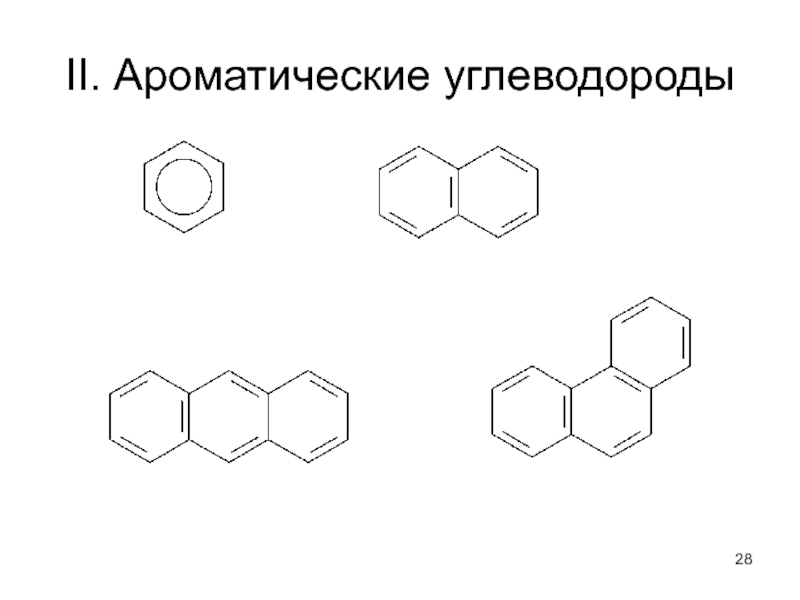
Слайд 23Циклические углеводороды
Алициклические углеводороды:
- полиметиленовые углеводороды
- производные ментана
По числу циклов: - моноциклические
- полициклические
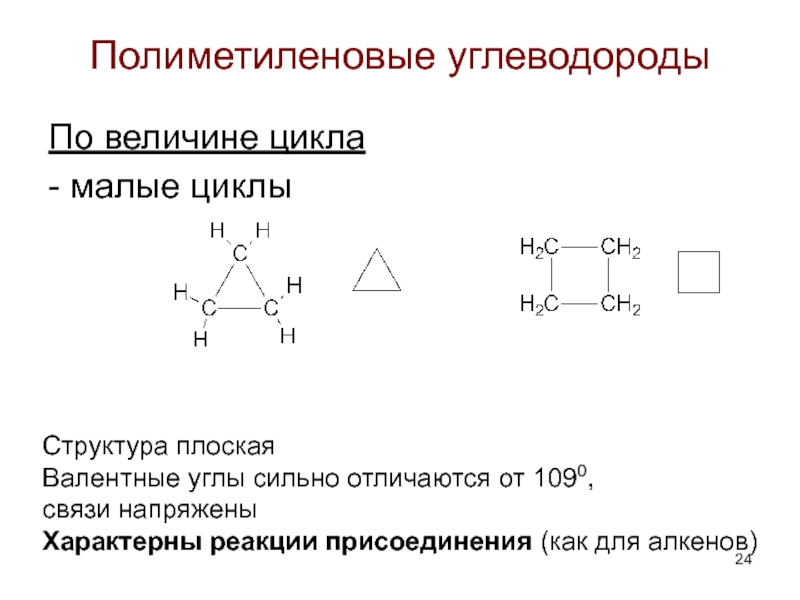
Слайд 24Полиметиленовые углеводороды
По величине цикла
- малые циклы
Структура плоская
Валентные углы сильно отличаются от
Характерны реакции присоединения (как для алкенов)
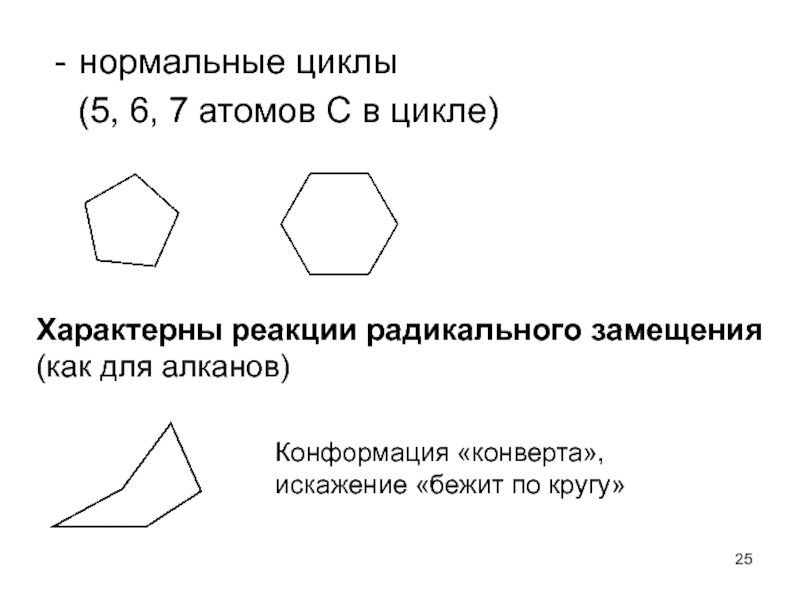
Слайд 25нормальные циклы
(5, 6, 7 атомов С в цикле)
Характерны реакции
Конформация «конверта», искажение «бежит по кругу»
Слайд 29Критерии ароматичности
Геометрический: все ароматические системы имеют плоскую замкнутую в цикл сопряжённую
Электронный: число π-электронов
N=4n+2 (n=0,1,2 и т.д.) – правило Хюккеля
Химический: ароматические молекулы в обычных условиях несмотря на свою ненасыщенность не вступают в реакции присоединения, а склонны к реакциям замещения по связям С-Н
Слайд 33Заместители
I. Активирующие ЭД-заместители. Облегчают ЭФ-замещение по сравнению с незамещённым бензолом,
Слайд 35
II. Дезактивирующие ЭА-заместители. Затрудняют ЭФ-замещение по сравнению с незамещённым бензолом, и
Слайд 41трудно легко
алкан спирт альдегид карбоновая
кислота
Генетическая связь между классами
химических соединений:
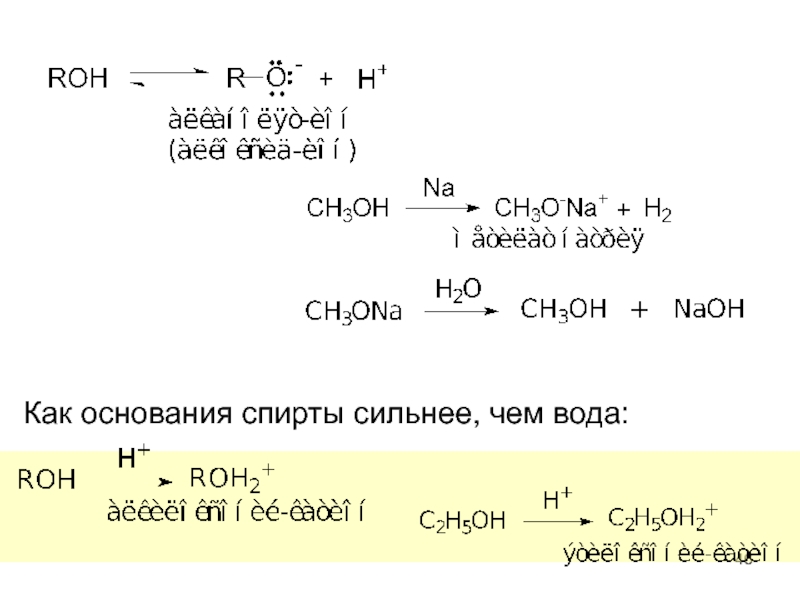
Слайд 45Химические свойства спиртов
I. Реакции с сохранением атома кислорода в молекуле спирта
кислотно-основные
Спирты – производные воды, обладают слабо выраженными кислотными и основными свойствами.
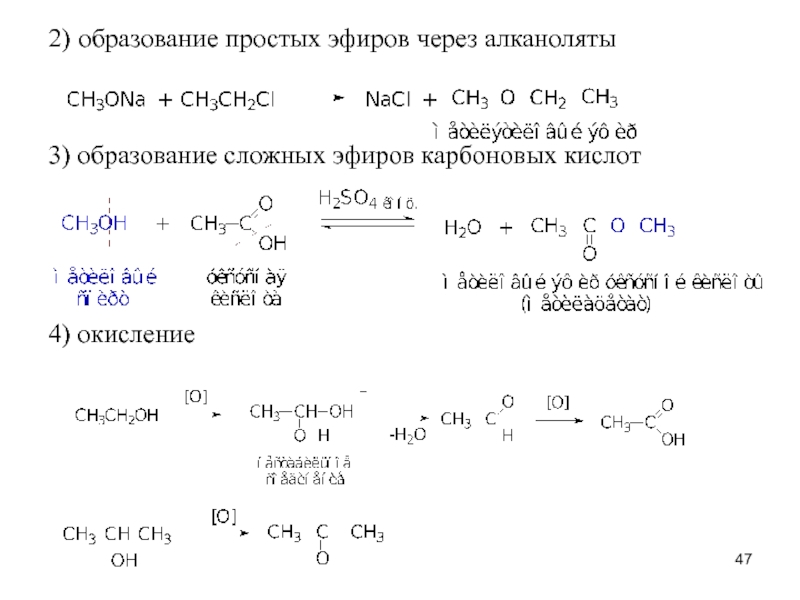
Слайд 472) образование простых эфиров через алканоляты
3) образование сложных эфиров карбоновых кислот
4)
Слайд 492) Взаимодействие с галогенидами фосфора
3) С кислородсодержащими неорганическими кислотами
Лаурилсульфат
+I2 + Pкрасный
Слайд 504) образование простых эфиров (межмолекулярное отщепление H2O)
5) дегидратация (внутримолекулярное отщепление H2O)
Слайд 52Качественная реакция на многоатомные спирты
Двух- и трёхатомные спирты образуют гликоляты или
Хелатная структура, внутрикомплексная соль
Раствор ярко-синего цвета
Слайд 55I. Реакции электрофильного замещения (SE) (характерны для ароматического ядра) OH
Слайд 573. Нитрование
Концентрированная азотная кислота и нитрующая смесь
окисляют фенол, поэтому его нитруют
Слайд 62ПРОСТЫЕ ЭФИРЫ
R-O-R, Ar-O-R, Ar-O-Ar
Изомерны соответствующим спиртам
Слайд 63Малореакционноспособные соединения.
Устойчивы к гидролизу, действию разбавленных кислот,
сильных оснований.
Слайд 75Реакции полимеризации и конденсации
а) полимеризация характерна для низших альдегидов:
снотворное средство
метальдегид
Слайд 78Реакции присоединения к карбонильной группе
а) присоединение водорода (H2/Ni) (восстановление)
Слайд 84ж) Взаимодействие с производными аммиака
с фенилгидразином C6H5NHNH2:
аналогично идут реакции с гидроксиламином
Слайд 85Реакции по связям С-Н в алкильном радикале R
а) кислотность и енолизация
Альдегиды и кетоны с водородным атомом
в α-положении к >C=O группе – слабые C-H- кислоты
Кето - енольное
равновесие
α
Слайд 87Получение альдегидов и кетонов
Окислением первичных спиртов (CuO) получают альдегиды, а
Из дигалогенпроизводных
Слайд 89Классификация:
алифатические КК (предельные и непредельные)
ароматические КК
гетероциклические КК
Содержат карбоксильную группу,
связанную с
монокарбоновые кислоты (одноосновные)
дикарбоновые (двухосновные)
поликарбоновые
Слайд 92Строение карбоксильной группы
Группа плоская
lC=O = 0,124 нм
lC-O = 0,131нм
lO-H = 0,095
Сдвиг электронов к карбонильному атому кислорода
приводит к некоторому гашению положительного заряда
на атоме углерода, поэтому группа С=О в кислотах
не склонна к реакциям присоединения.
Поскольку электронная плотность на атоме
кислорода ОН-группы уменьшается, связь О-Н ослабевает,
И атом водорода легко отщепляется.
Слайд 94Солеобразование
Кислоты образуют соли с однозарядными, двухзарядными
и трёхзарядными ионами металлов:
Слайд 952. Реакции нуклеофильного замещения
в карбоксильной группе -
получение функциональных производных
Все они содержат ацильную группу
ФПКК можно превращать друг в друга, а гидролизом снова превратить в кислоту.
ацильная группа
Слайд 101Липиды
содержатся в животных и растительных тканях
Большая группа соединений, содержащих в
Слайд 104спирты
высшие одноатомные (С16 и более)
трёхатомный спирт глицерин
двухатомный спирт сфингозин
транс-
Слайд 107жиры и масла (триацилглицерины)
- сложные эфиры глицерина и высших жирных КК
смешанные
Слайд 109стериды
- сложные эфиры высокосмолекулярного циклического спирта стерола и высокомолекулярной КК
Слайд 115- непредельные кислоты в составе жира обесцвечивают раствор KMnO4, вступают в
Иодное число – мера ненасыщенности триацилглицеринов. Оно соответствует массе (г) иода, которое может присоединиться к 100 г вещества.
Слайд 118Биологическая роль жиров
Энергетическая
Структурная
Резервная
Механическая защита внутренних органов от повреждений
Термоизоляционная
Источник эндогенной воды
Растворяют
Слайд 120Фосфолипиды
- липиды, при гидролизе отщепляющие фосфорную кислоту
Глицерофосфолипиды - сложные эфиры глицерина
В состав фосфолипидов входят также азотсодержащие соединения, такие как холин, этаноламин или серин.
Слайд 121
Глицерофосфолипиды – главные липидные компоненты клеточных мембран. Они сопутствуют жирам в
Слайд 122Глицерофосфолипиды являются производными фосфатидной кислоты. В их состав входят глицерин, жирные
фосфатидная кислота
Слайд 123
глицерофосфолипид
Как правило, в положении 1 – остаток насыщенной, а в
Слайд 125лецитин
Из всех липидов глицерофосфолипиды обладают полярными свойствами. При помещении глицерофосфолипидов в
Слайд 126Биологическая роль фосфолипидов
Структурная - входят в состав клеточных мембран
Повышают растворимость
Препятствуют синтезу жира в печени