- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Биофизические основы патологии клетки. Свободные радикалы и болезни человека презентация
Содержание
- 1. Биофизические основы патологии клетки. Свободные радикалы и болезни человека
- 2. Хемилюминесценция при перекисном окислении липидов
- 3. Триггерная функция Fe2+ При γ = 0
- 4. Железо как про- и антиоксидант
- 5. Уравнения реакций цепного окисления липидов
- 6. Кинетика перекисного окисления липидов БВ
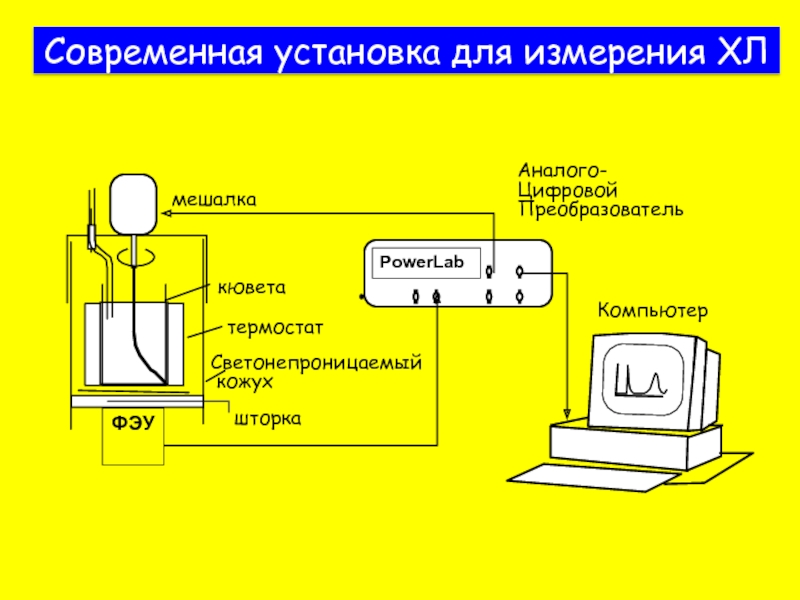
- 7. Современная установка для измерения ХЛ
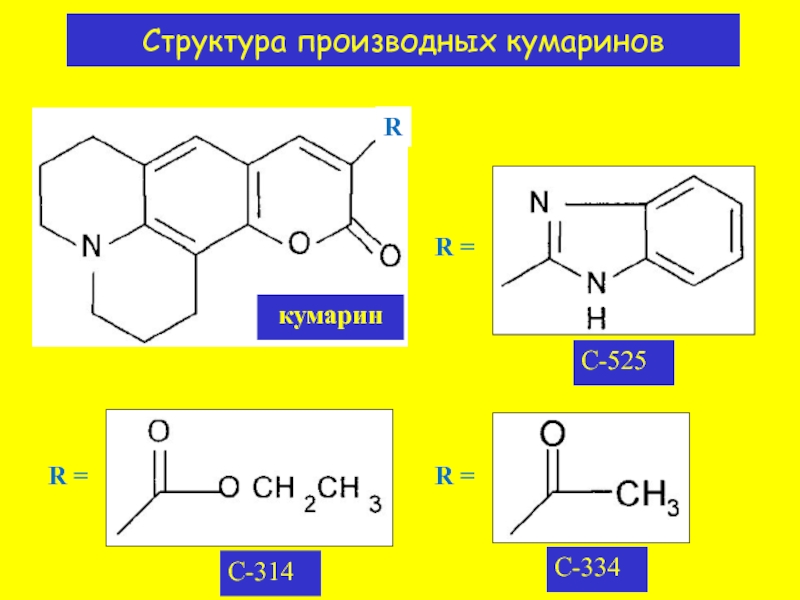
- 8. Структура производных кумаринов кумарин C-525 C-314 C-334 R = R = R = R
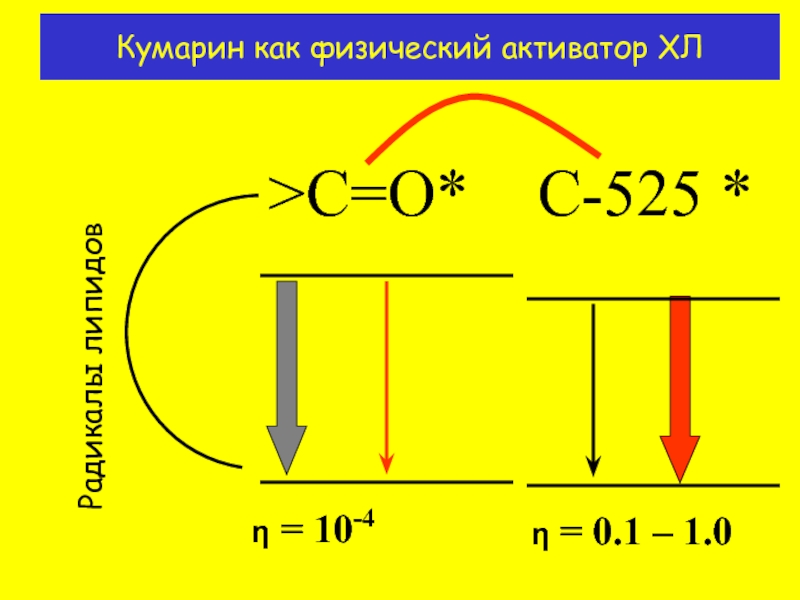
- 9. Кумарин как физический активатор ХЛ
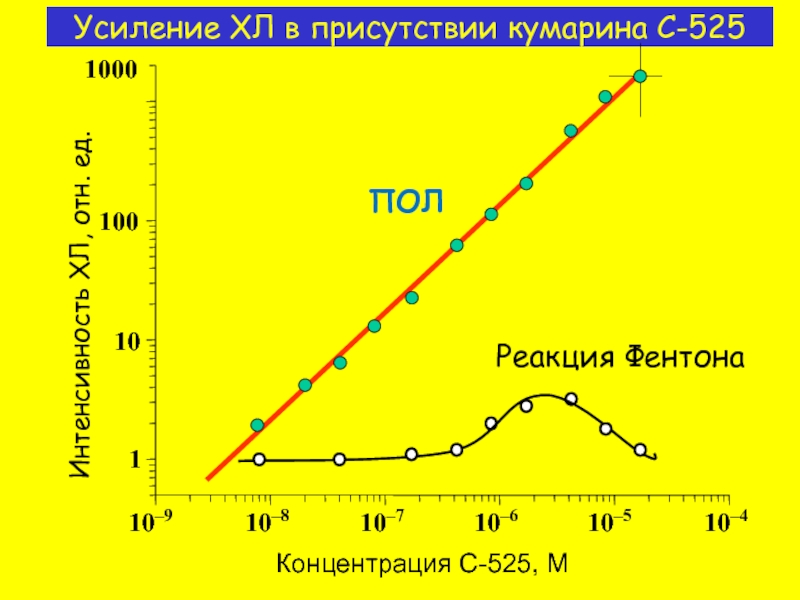
- 10. ПОЛ Реакция Фентона Концентрация
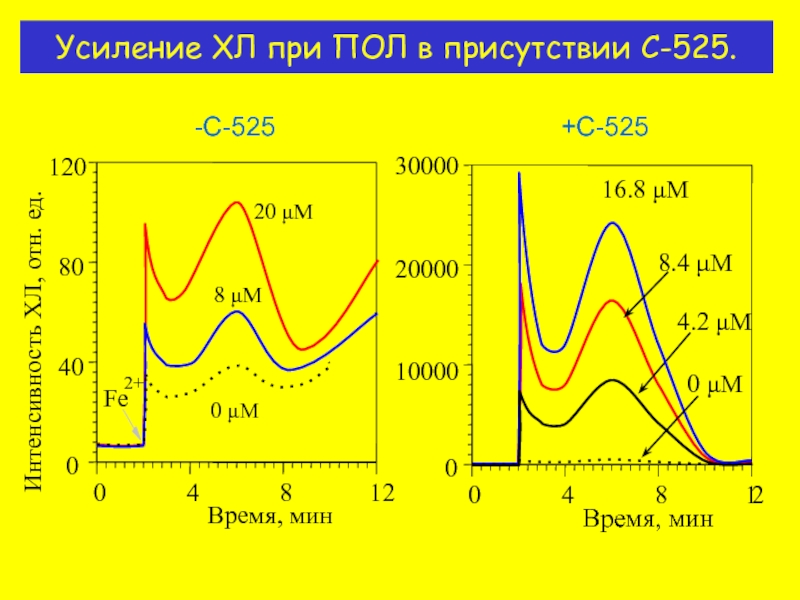
- 11. Усиление ХЛ при ПОЛ в присутствии C-525. -С-525 +С-525
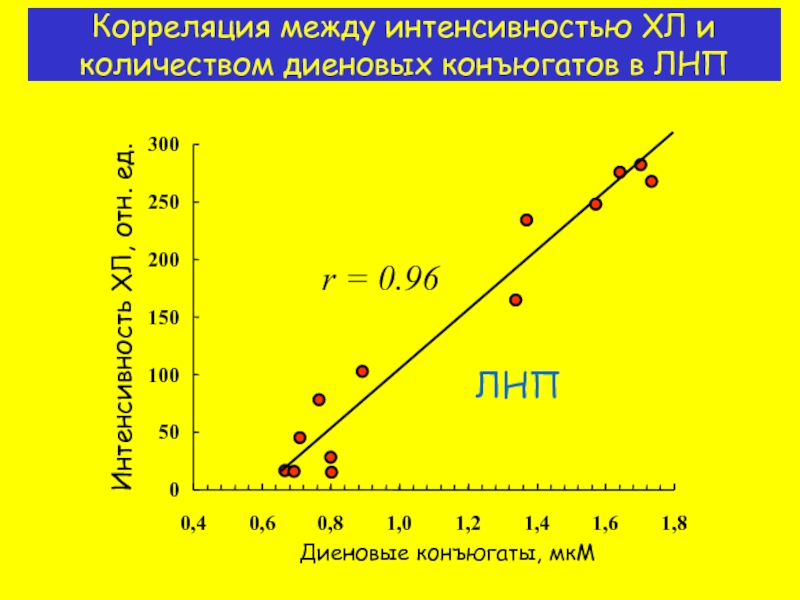
- 12. Корреляция между интенсивностью ХЛ и количеством диеновых конъюгатов в ЛНП
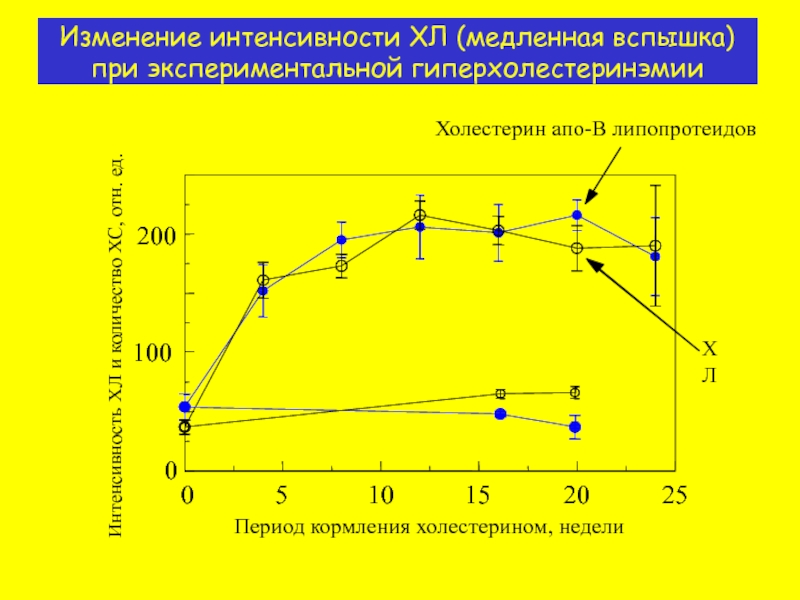
- 13. Изменение интенсивности ХЛ (медленная вспышка) при экспериментальной
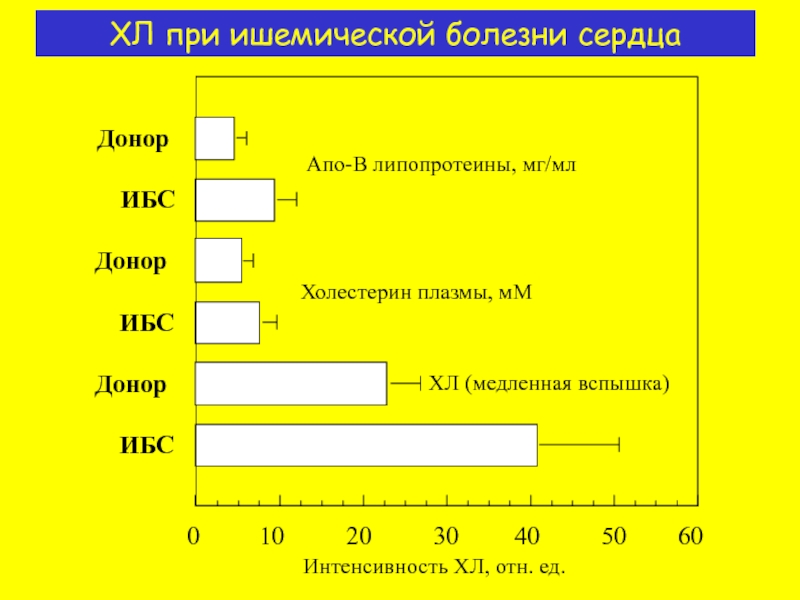
- 14. ХЛ при ишемической болезни сердца
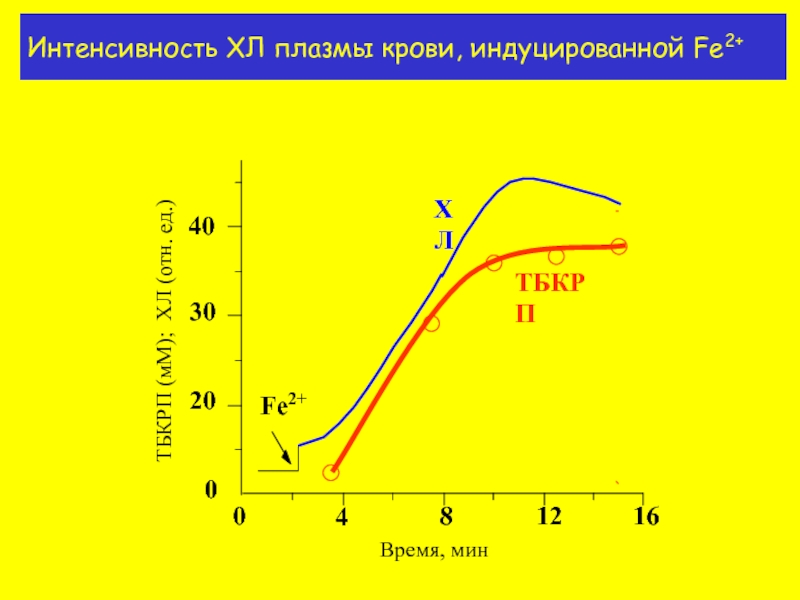
- 15. Интенсивность ХЛ плазмы крови, индуцированной Fe2+
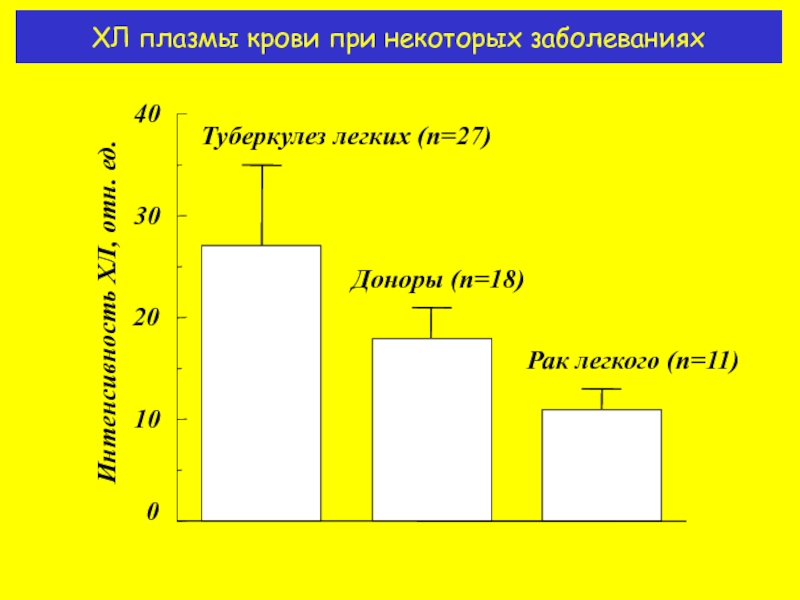
- 16. ХЛ плазмы крови при некоторых заболеваниях
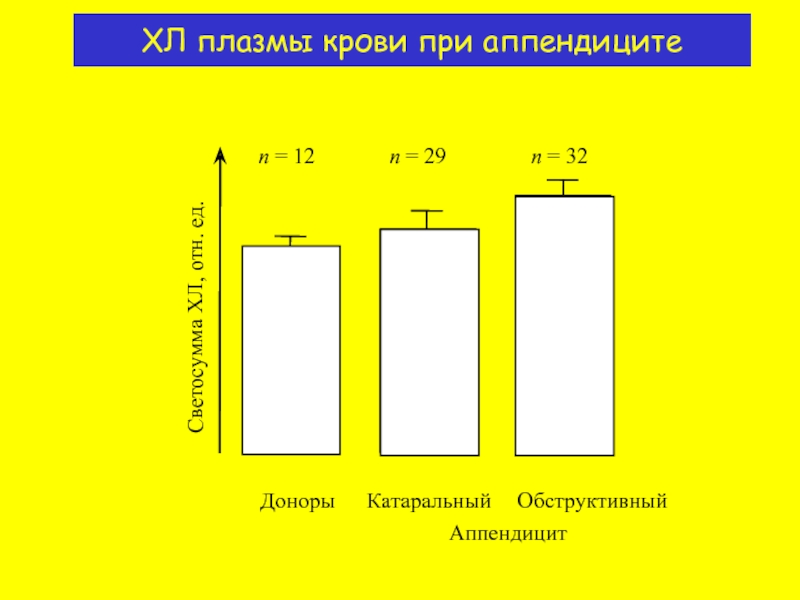
- 17. n = 12 n
- 18. Действие радикалов на клеточные структуры
- 19. Действие ПОЛ изучали на многих мембранных объектах
- 20. Элементы мембранных структур, чувствительные к действию повреждающих
- 21. Действие перекисного окисления липидов на –белки
- 22. Действие перекисного окисления липидов на мембранные белки
- 23. Строение глаза человека
- 24. Морфологические изменения в хрусталике при катаракте Норма
- 25. Развитие радиационной катаракты
- 27. Действие липопероксидации на –Ca2+-транспортную АТФазу
- 28. Регуляция уровня Са2+ в клетке Клетка Ca2+
- 29. Кальциевые насосы в живой клетке Cell membrane
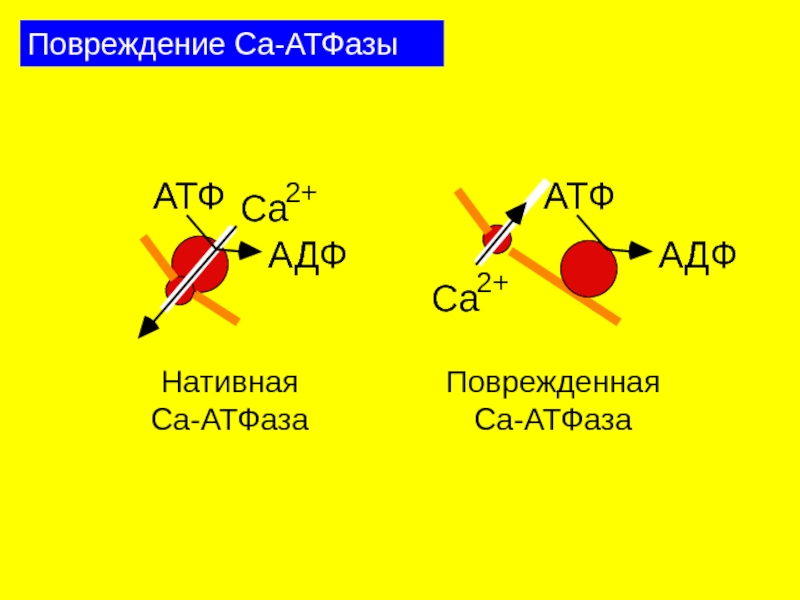
- 30. Повреждение Са-АТФазы Ca 2+
- 31. Влияние ПОЛ на Ca2+-ATPазу 0,33 1,66
- 32. Effect of UV on Liposomes + Globin
- 33. Effect of UV on Ca2+-ATPase
- 34. Effect of UV on Ca2+ Transport
- 35. Тиолы и ПОЛ в эритроцитах при УФ облучении
- 36. На какие элементы биологических мембран действуют свободные
- 37. Электрический пробой мембран при перекисном окислении липидов
- 38. Изучение электрического пробоя на БЛМ
- 39. R (сопротивление) БЛМ = 107 – 108
- 40. 5 нм (50 А) A – C
- 41. Вольт-амперные характеристики БЛМ При потенциалах, ниже порогового
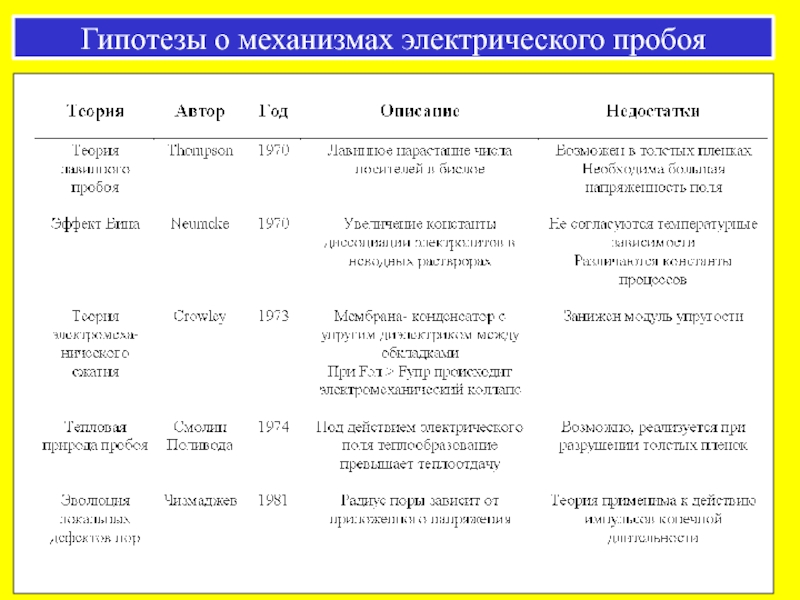
- 42. Гипотезы о механизмах электрического пробоя
- 43. Неспецифическая проницаемость для разных низкомолекулярных веществ;
- 44. Зависимость времени жизни липидных пор от
- 45. Пробой БЛМ при УФ облучении БЛМ из
- 46. Стрелкой показано начало УФ-облучения. фm, - потенциал,
- 47. 1 2 3 4
- 48. Электрический пробой мембран собственным мембранным потенциалом
- 49. Пробой БЛМ при разном диффузионном потенциале Две
- 50. Изучение электрического пробоя в липосомах
- 51. Электрический пробой мембран липосом Изменения светопропускания суспензии
- 52. ΔT/T (отн. ед.) Мембранный потенциал Изменение светопропускания
- 53. Липосомы (0.2 мг липидов/мл) были изготовлены из
- 54. Липосомы приготовлены из лецитина яичного желтка, сформированы
- 55. Уменьшение электрической стабильности мембран липосом (из яичного
- 56. Изучение электрического пробоя мембран митохондрий
- 57. Электрический пробой мембран митохондрий При добавлении к
- 58. Зависимость скорости падения мембранного потенциала от концентрации
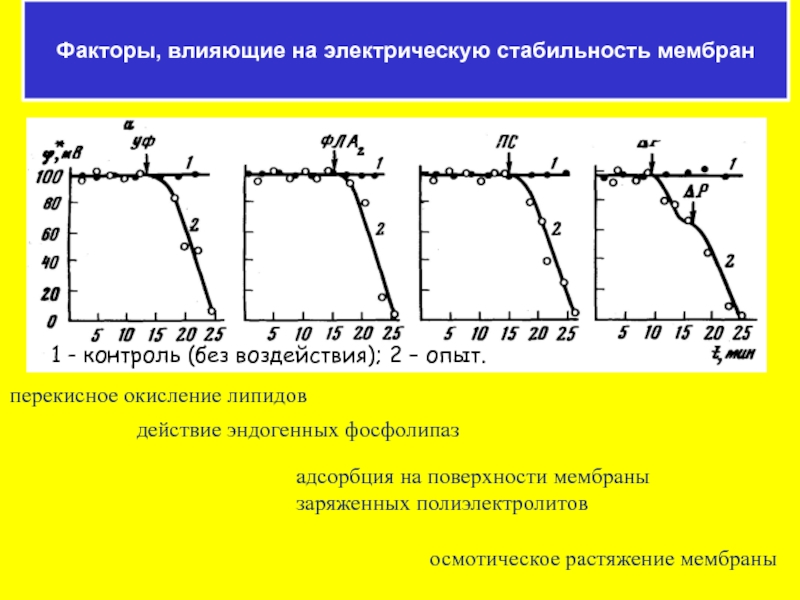
- 59. перекисное окисление липидов действие эндогенных фосфолипаз адсорбция
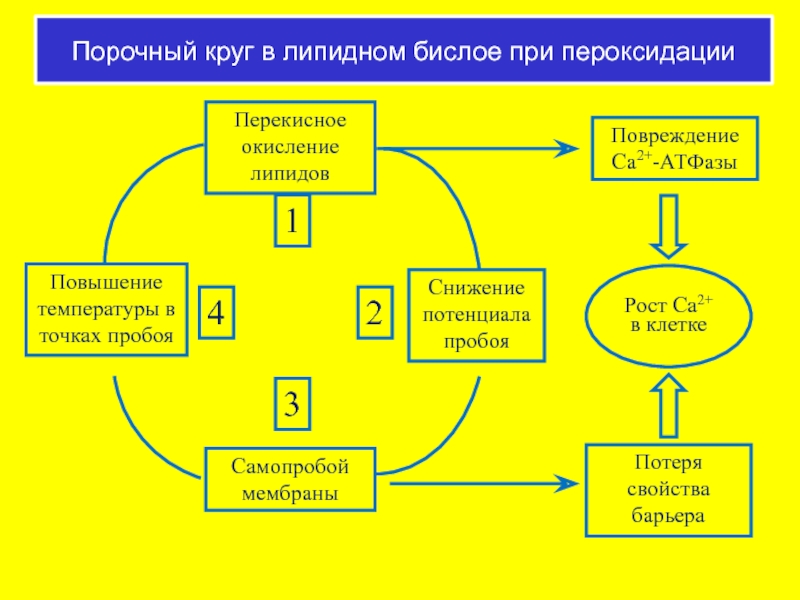
- 60. Порочный круг в липидном бислое при пероксидации
- 61. Электрические потенциалы (мВ) на мембранах клеток и потенциалы пробоя модельных и биологических мембран
- 62. Загрузка клеток лекарственными препаратами Электрослияние
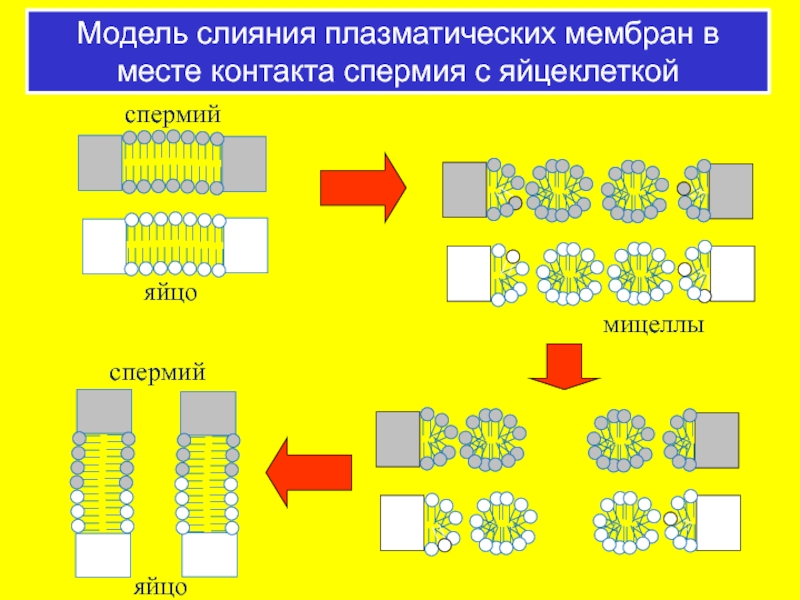
- 63. Модель слияния плазматических мембран в месте контакта спермия с яйцеклеткой
- 64. 1. Физические факторы Величина приложенного потенциала Температура
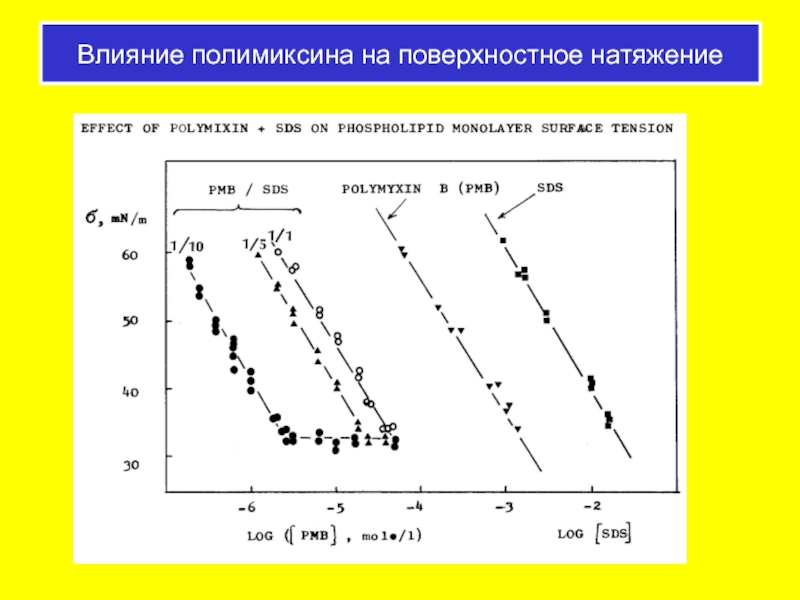
- 65. Влияние полимиксина на поверхностное натяжение
- 66. Вопросы к зачету Электрический пробой плоской бислойной
Слайд 1Свободные радикалы и болезни человека
Ю.А. Владимиров, А.Н. Осипов
2018
Биофизические основы патологии клетки
Слайд 3Триггерная функция Fe2+
При γ = 0
При [Fe2+] > [Fe2+] *, γ
γ = kp([Fe2+]* – [Fe2+])
При [Fe2+] < [Fe2+] *, γ > 0
1
2
3
4
5
6
Слайд 4Железо как про- и антиоксидант
[Fe2+] > [Fe2+] *
γ < 0
[Fe2+]
γ > 0
Скорость цепного окисления
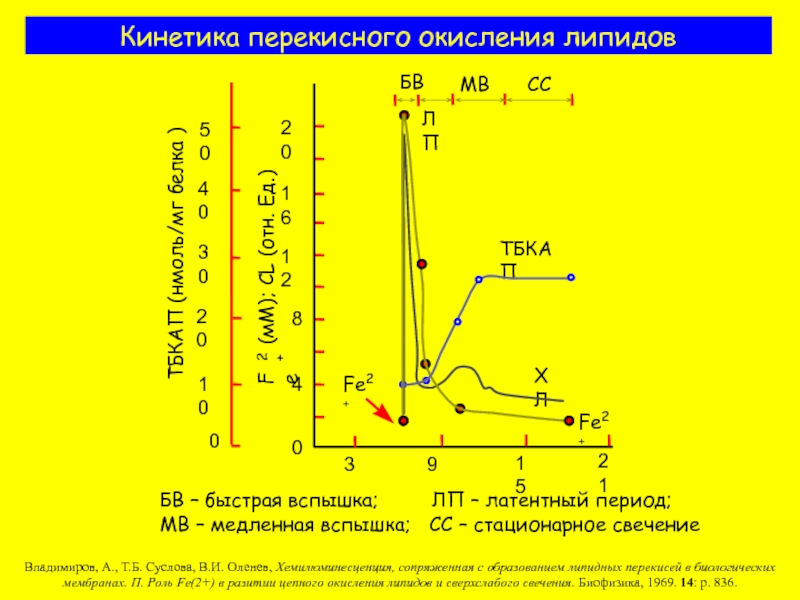
Слайд 6Кинетика перекисного окисления липидов
БВ – быстрая вспышка;
МВ – медленная вспышка; СС – стационарное свечение
Владимиров, А., Т.Б. Суслова, В.И. Оленев, Хемилюминесценция, сопряженная с образованием липидных перекисей в биологических мембранах. П. Роль Fe(2+) в разитии цепного окисления липидов и сверхслабого свечения. Биофизика, 1969. 14: p. 836.
Fe2+
Слайд 10
ПОЛ
Реакция Фентона
Концентрация C-525, M
Интенсивность ХЛ, отн. ед.
Усиление ХЛ в присутствии кумарина
10–9
10–8
10–7
10–6
10–5
10–4
1
10
100
1000
Слайд 13Изменение интенсивности ХЛ (медленная вспышка) при экспериментальной гиперхолестеринэмии
Период кормления холестерином, недели
Холестерин
ХЛ
200
100
0
0
5
10
15
20
25
Интенсивность ХЛ и количество ХС, отн. ед.
Слайд 17
n = 12
n = 29
n = 32
Светосумма ХЛ, отн. ед.
Доноры
Аппендицит
Катаральный
Обструктивный
ХЛ плазмы
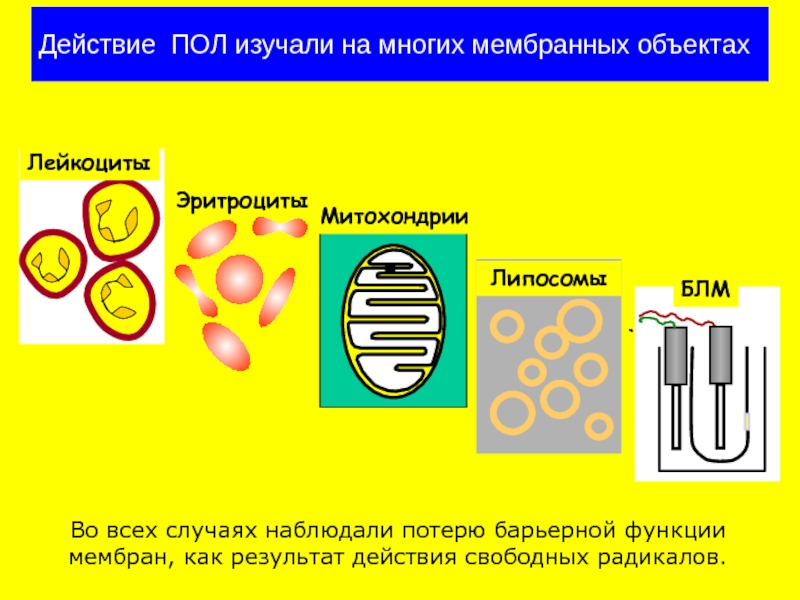
Слайд 19Действие ПОЛ изучали на многих мембранных объектах
Во всех случаях наблюдали потерю
БЛМ
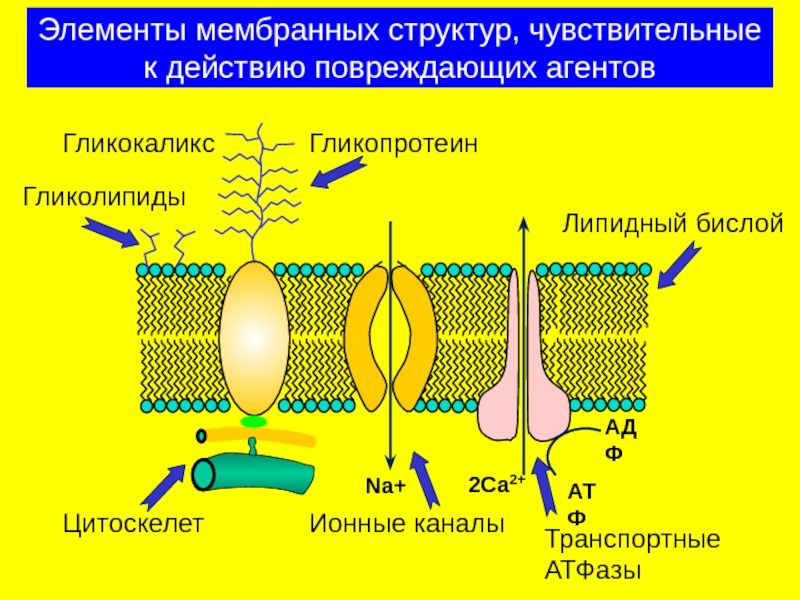
Слайд 20Элементы мембранных структур, чувствительные к действию повреждающих агентов
АТФ
АДФ
Na+
2Ca2+
Гликокаликс
Гликопротеин
Гликолипиды
Ионные каналы
Транспортные АТФазы
Цитоскелет
Липидный бислой
Слайд 22Действие перекисного окисления липидов на мембранные белки
Окисление тиоловых групп
Обратимое: R1SH + HSR2
Необратимое: RSH + LO2• + O2 ⇒ RSO2
Инактивация мембранных ферментов
Инактивация Са2+-АТФазы
Агрегация белковых молекул
Помутнение хрусталика при катаракте
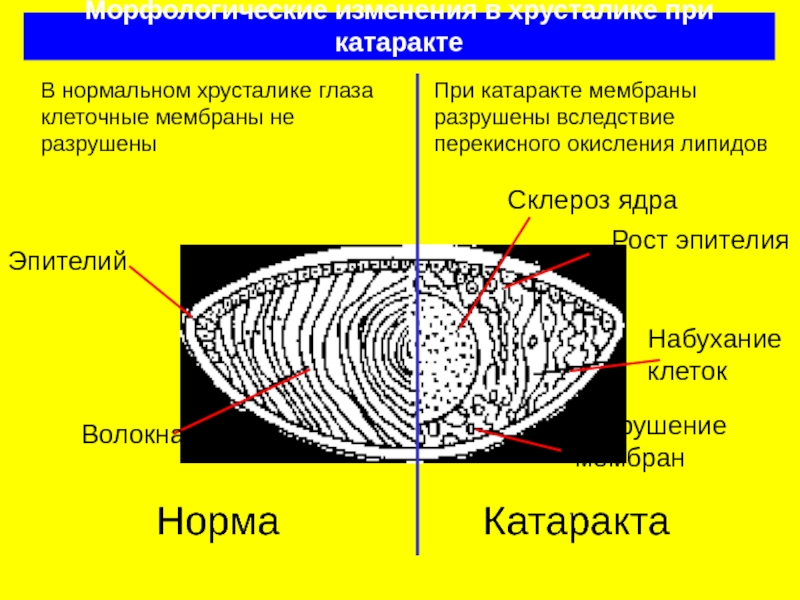
Слайд 24Морфологические изменения в хрусталике при катаракте
Норма
Эпителий
Волокна
Склероз ядра
Набухание клеток
Катаракта
Рост эпителия
Разрушение мембран
В нормальном
При катаракте мембраны разрушены вследствие перекисного окисления липидов
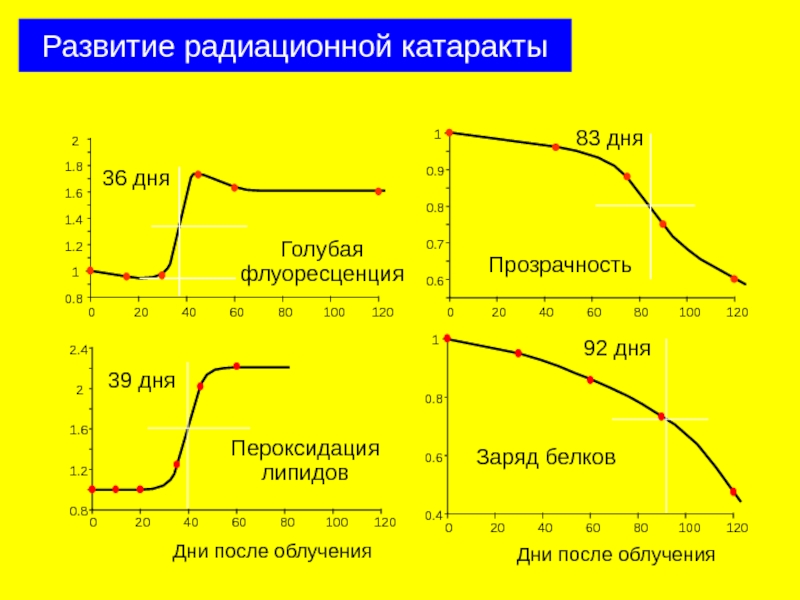
Слайд 26
0
40
80
120
0.4
1.2
0.8
Lens transparency
[GSH]/[GSH]0
0.4
1.2
0.8
0
0
40
80
120
Время после облучения, дни
Прозрачность хрусталика
Содержание GSH
Развитие радиационной катаракты
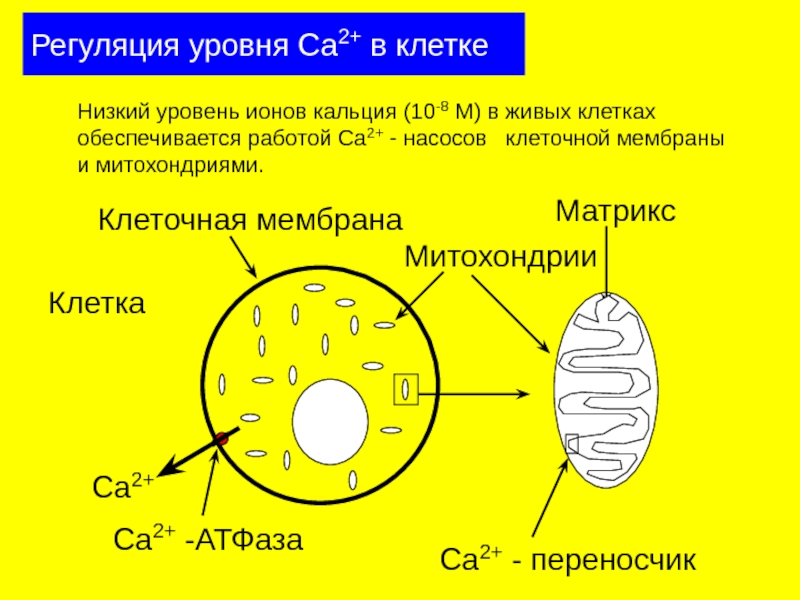
Слайд 28Регуляция уровня Са2+ в клетке
Клетка
Ca2+
Низкий уровень ионов кальция (10-8 М) в
Слайд 29Кальциевые насосы в живой клетке
Cell membrane
2Ca2+
10-7 М
10-3 М
Ca2+
Ca2+ - ATPase in
Electrophoretic Ca2+ transport across mitochondrial inner membrane
Клетка
Митохондрия
Ca2+
Ca2+
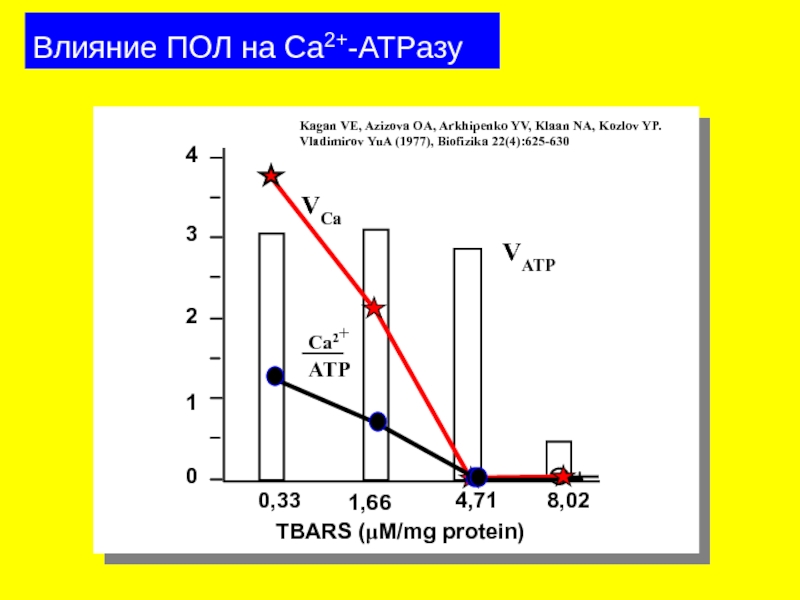
Слайд 31Влияние ПОЛ на Ca2+-ATPазу
0,33
1,66
4,71
8,02
0
1
2
3
4
VATP
TBARS (μM/mg protein)
Kagan VE, Azizova OA, Arkhipenko YV,
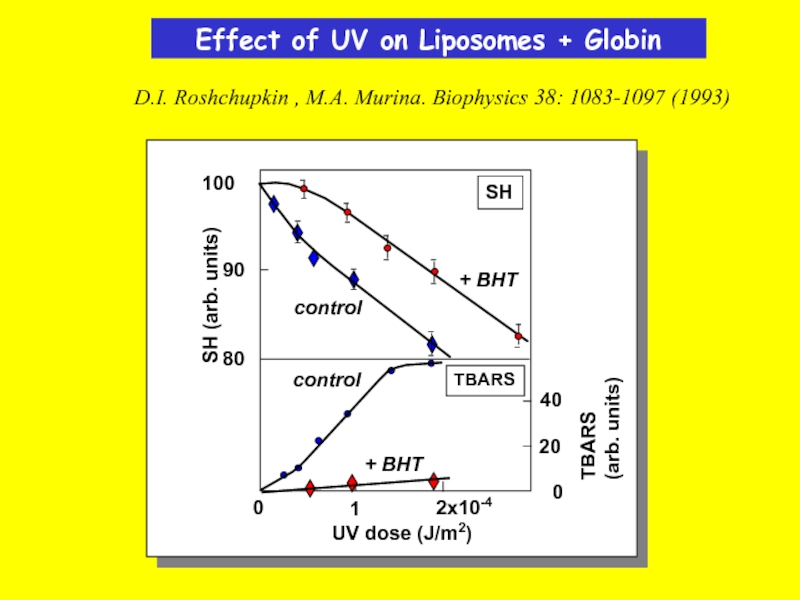
Слайд 32Effect of UV on Liposomes + Globin
D.I. Roshchupkin , M.A. Murina.
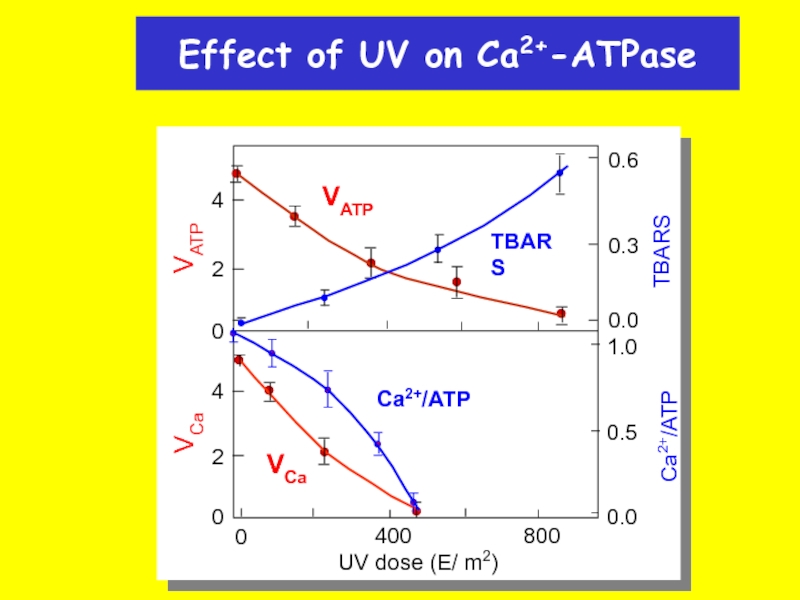
Слайд 33
Effect of UV on Ca2+-ATPase
VATP
4
2
0
4
2
0
VCa
TBARS
0.6
0.3
0.0
VATP
TBARS
VCa
Ca2+/ATP
1.0
0.5
0.0
Ca2+/ATP
800
0
400
UV dose (E/ m2)
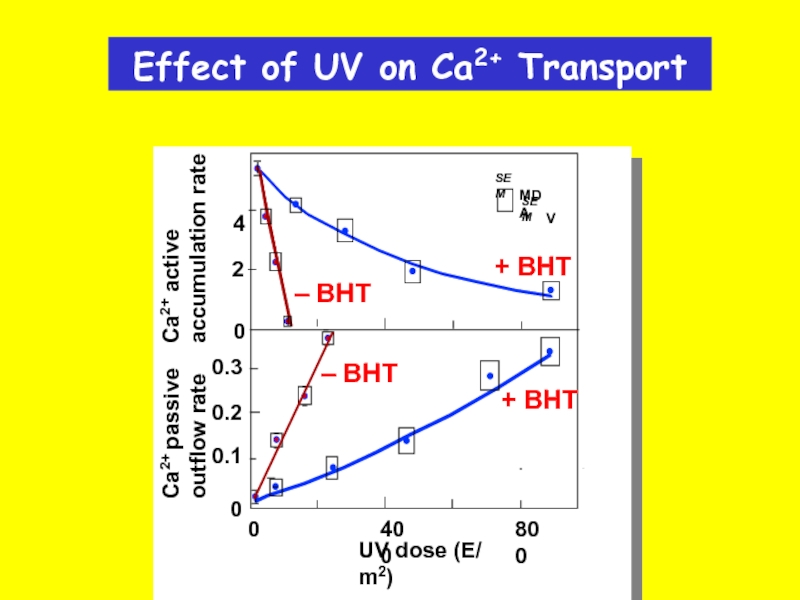
Слайд 34Effect of UV on Ca2+ Transport
SEM
MDA
SEM
V
0.3
4
0
2
0
0.2
0.1
0
800
400
Ca2+ active
accumulation rate
Ca2+ passive
outflow rate
UV dose (E/ m2)
+ BHT
+ BHT
– BHT
– BHT
Слайд 36На какие элементы биологических мембран действуют свободные радикалы?
На каких объектах изучали
Последовательность событий при развитии катаракты: изменения, связанные с белками, тиолами и липидами.
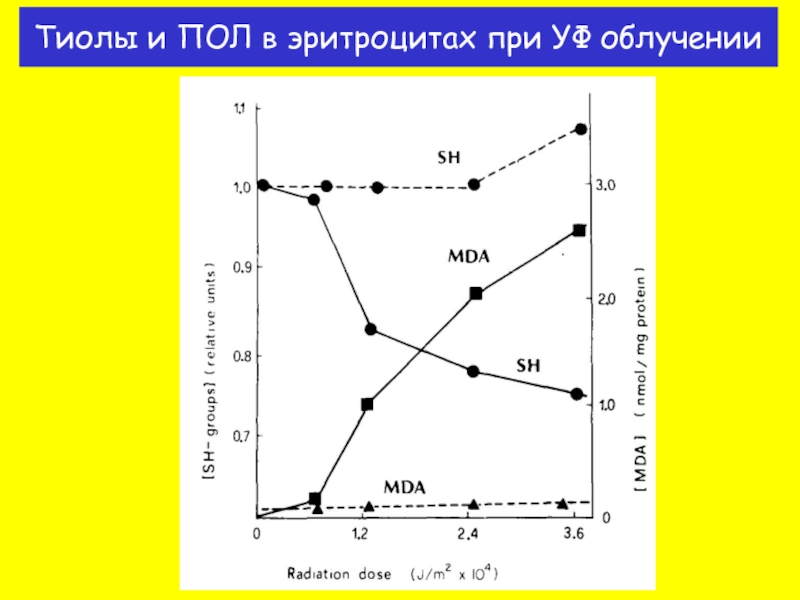
Связь липидной пероксидации с уровнем тиолов. Факты и механизм.
Действие липидной пероксидации на способность митохондрий удерживать ионы кальция. Механизм этого действия.
Действие липидной пероксидации на работу Ca-АТФазы. Экспериментальные данные и интерпретация. Биологические последствия.
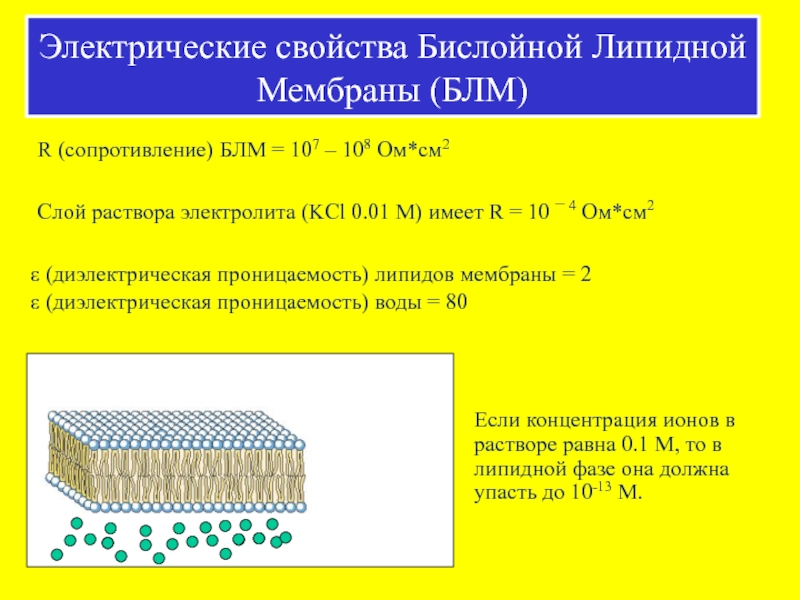
Слайд 39R (сопротивление) БЛМ = 107 – 108 Ом*см2
Слой раствора электролита (KCl
5 нм (50 А)
(диэлектрическая проницаемость) липидов мембраны = 2
(диэлектрическая проницаемость) воды = 80
Если концентрация ионов в растворе равна 0.1 М, то в липидной фазе она должна упасть до 10-13 М.
Электрические свойства Бислойной Липидной Мембраны (БЛМ)
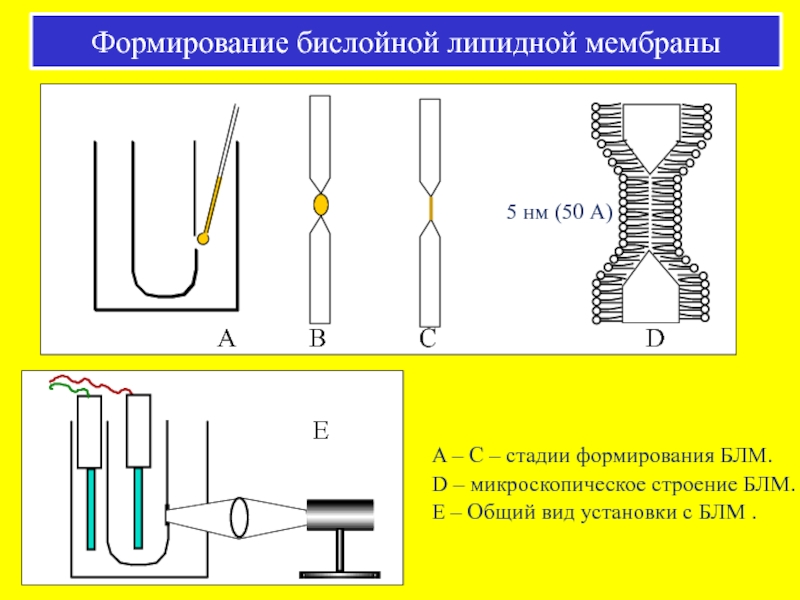
Слайд 405 нм (50 А)
A – C – стадии формирования БЛМ.
D –
E – Общий вид установки с БЛМ .
Формирование бислойной липидной мембраны
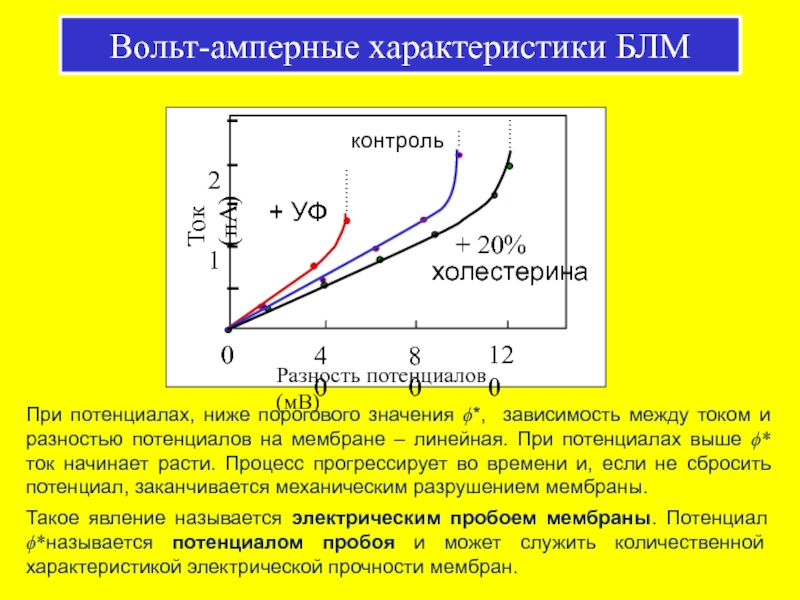
Слайд 41Вольт-амперные характеристики БЛМ
При потенциалах, ниже порогового значения ϕ*, зависимость между током
Такое явление называется электрическим пробоем мембраны. Потенциал ϕ*называется потенциалом пробоя и может служить количественной характеристикой электрической прочности мембран.
Слайд 43 Неспецифическая проницаемость для разных низкомолекулярных веществ;
Локальность изменения свойств мембраны;
Существование легко измеряемого эффективного диаметра проницаемых структур, который зависит от параметров электрообработки.
Факты подтверждающие теорию порообразования
Слайд 44
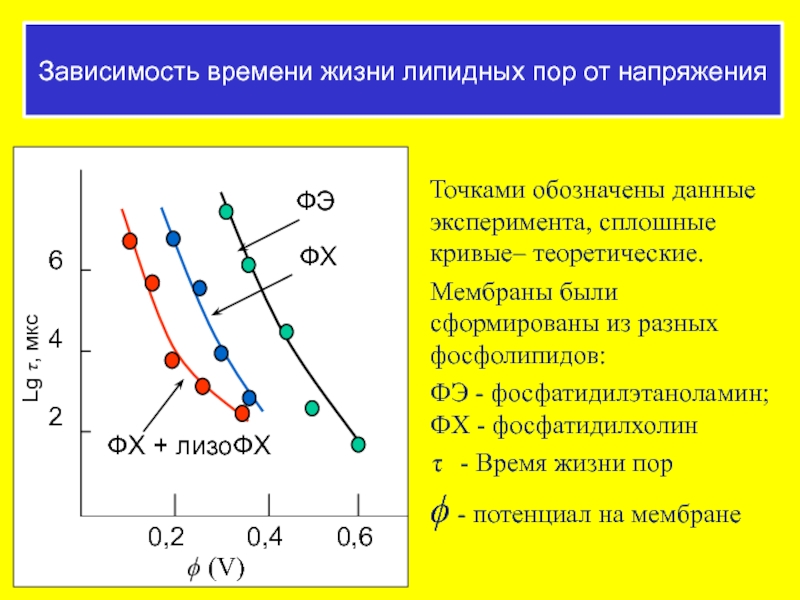
Зависимость времени жизни липидных пор от напряжения
Точками обозначены данные эксперимента, сплошные
Мембраны были сформированы из разных фосфолипидов:
ФЭ - фосфатидилэтаноламин; ФХ - фосфатидилхолин
- Время жизни пор
ϕ - потенциал на мембране
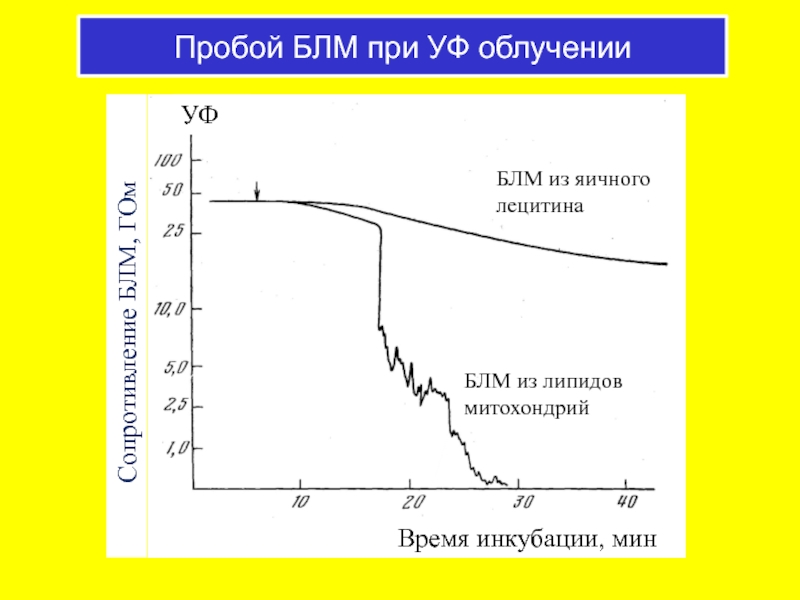
Слайд 45Пробой БЛМ при УФ облучении
БЛМ из липидов митохондрий
БЛМ из яичного лецитина
УФ
Время инкубации, мин
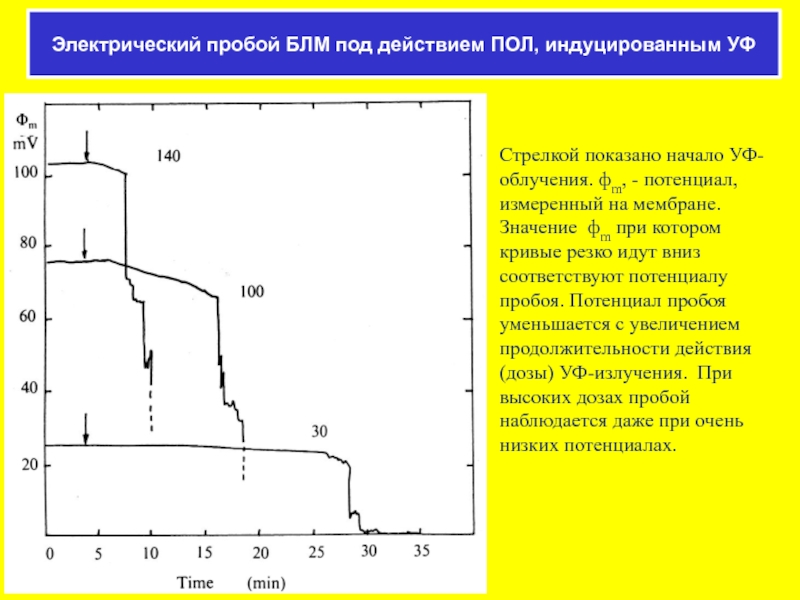
Слайд 46Стрелкой показано начало УФ-облучения. фm, - потенциал, измеренный на мембране. Значение
Электрический пробой БЛМ под действием ПОЛ, индуцированным УФ
Слайд 47
1
2
3
4
5
6
7
8
9
120
100
80
60
40
20
0
Время (мин)
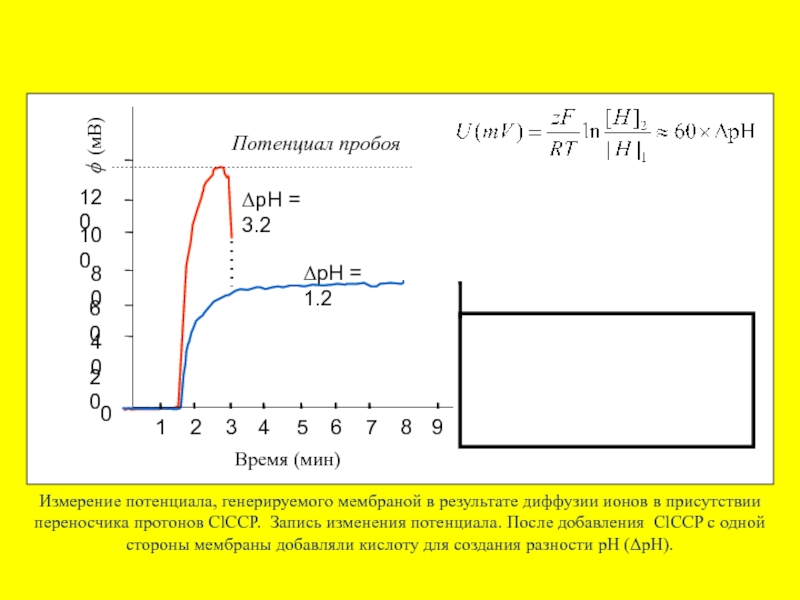
ΔpH = 1.2
ΔpH = 3.2
ϕ (мВ)
Потенциал пробоя
Измерение потенциала, генерируемого мембраной
HCl
ϕ (mV)
Самопробой БЛМ протонным диффузионным потенциалом
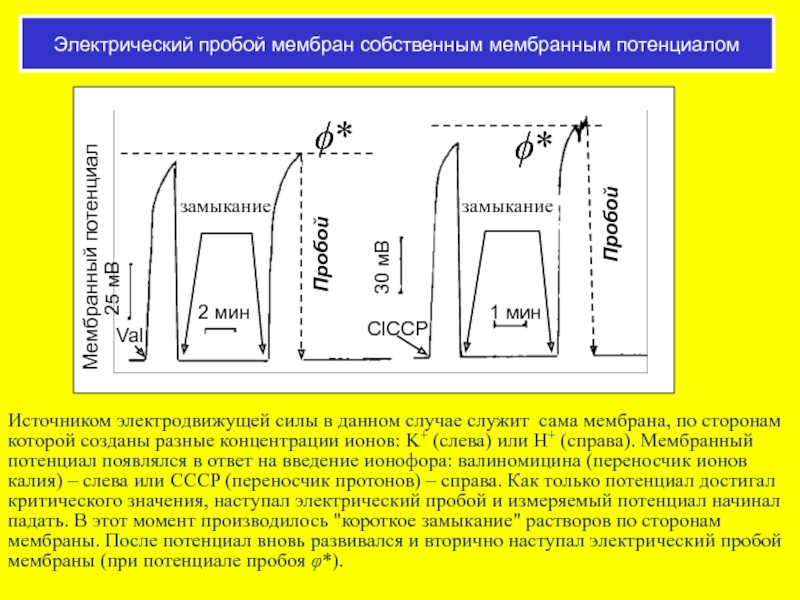
Слайд 48Электрический пробой мембран собственным мембранным потенциалом
Источником электродвижущей силы в данном случае
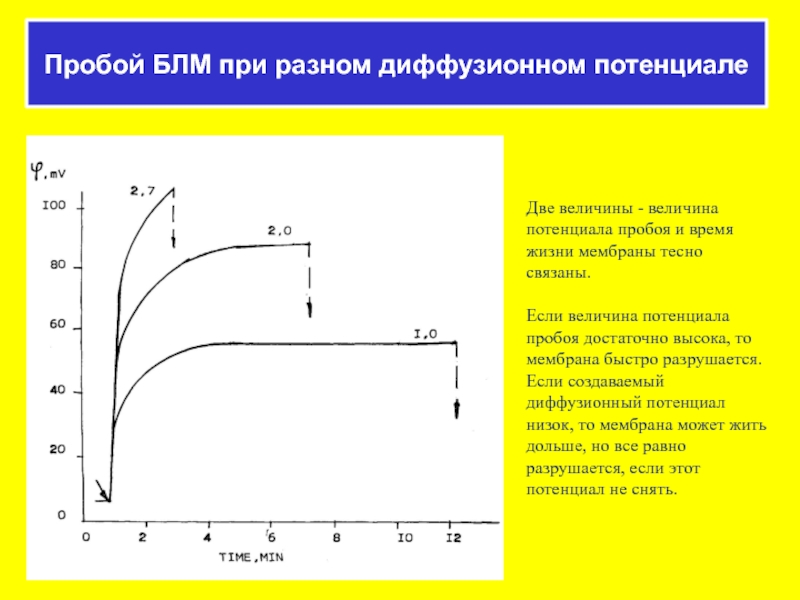
Слайд 49Пробой БЛМ при разном диффузионном потенциале
Две величины - величина потенциала пробоя
Если величина потенциала пробоя достаточно высока, то мембрана быстро разрушается. Если создаваемый диффузионный потенциал низок, то мембрана может жить дольше, но все равно разрушается, если этот потенциал не снять.
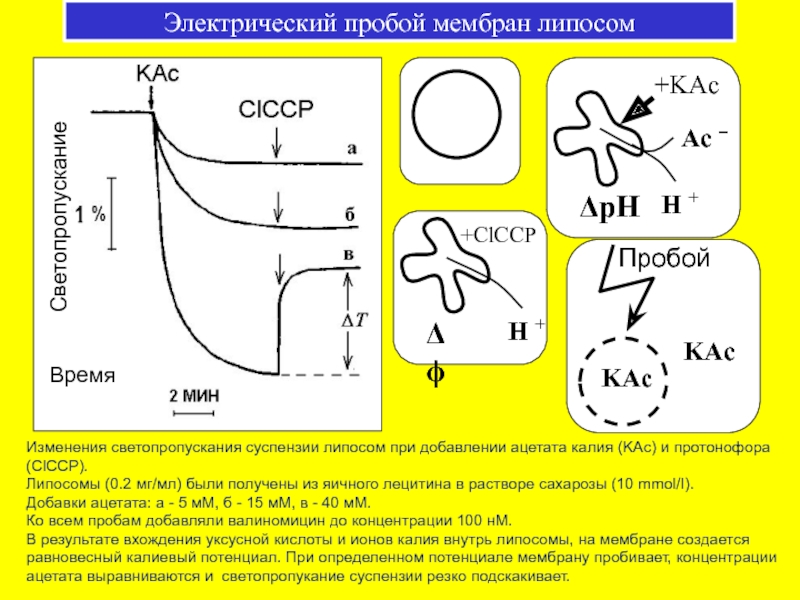
Слайд 51Электрический пробой мембран липосом
Изменения светопропускания суспензии липосом при добавлении ацетата калия
Липосомы (0.2 мг/мл) были получены из яичного лецитина в растворе сахарозы (10 mmol/I).
Добавки ацетата: а - 5 мМ, б - 15 мМ, в - 40 мМ.
Ко всем пробам добавляли валиномицин до концентрации 100 нМ.
В результате вхождения уксусной кислоты и ионов калия внутрь липосомы, на мембране создается равновесный калиевый потенциал. При определенном потенциале мембрану пробивает, концентрации ацетата выравниваются и светопропукание суспензии резко подскакивает.
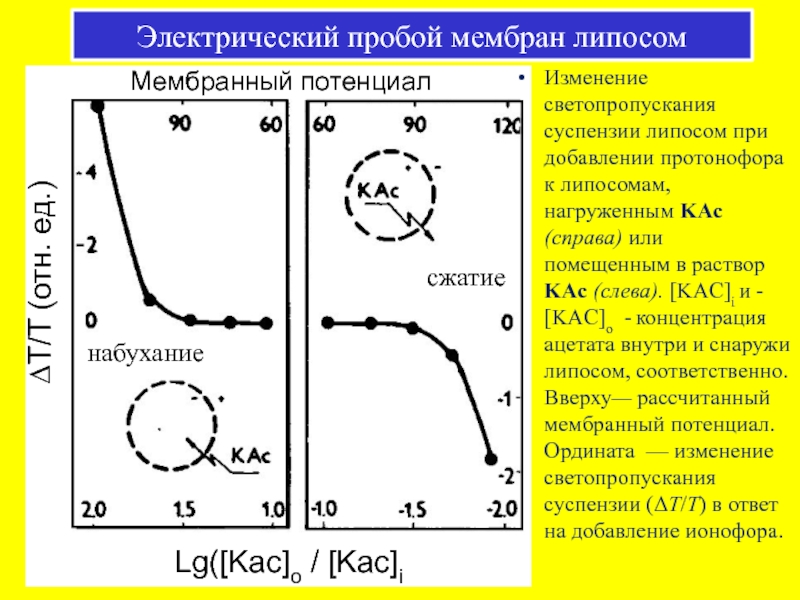
Слайд 52ΔT/T (отн. ед.)
Мембранный потенциал
Изменение светопропускания суспензии липосом при добавлении протонофора к
Электрический пробой мембран липосом
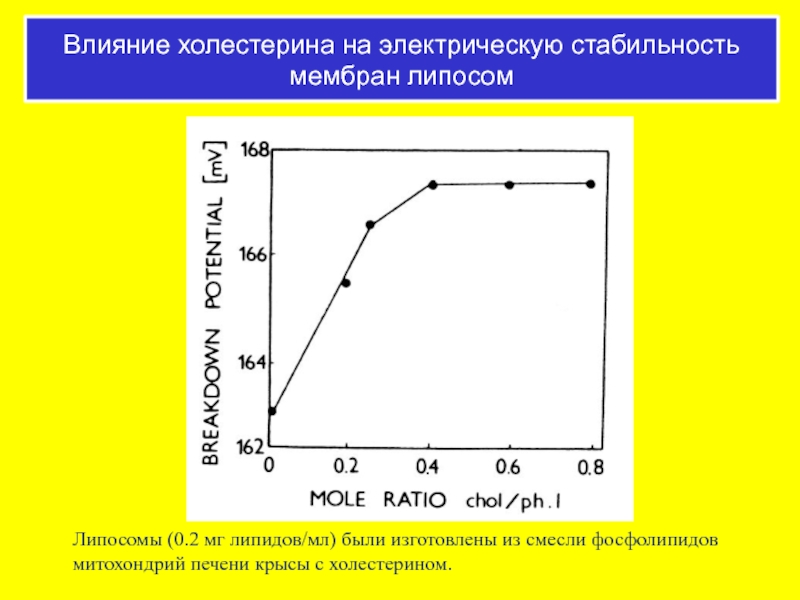
Слайд 53Липосомы (0.2 мг липидов/мл) были изготовлены из смесли фосфолипидов митохондрий печени
Влияние холестерина на электрическую стабильность мембран липосом
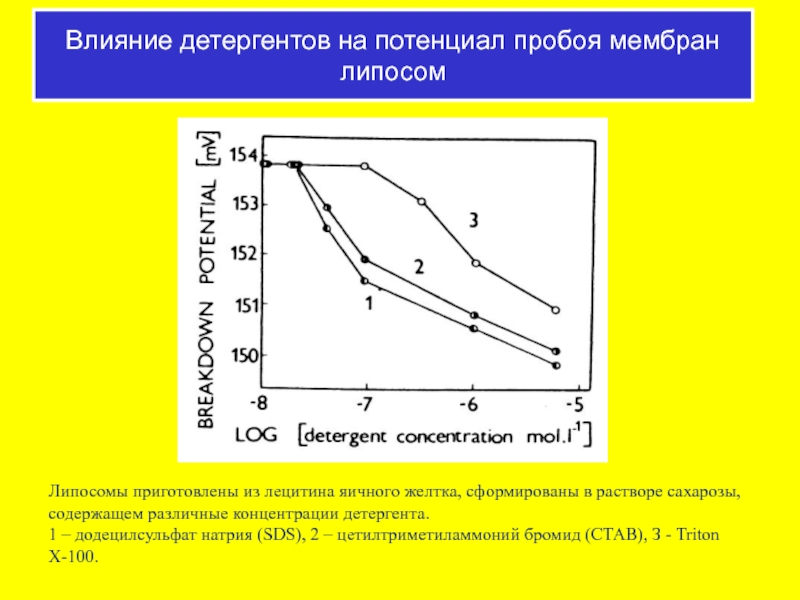
Слайд 54Липосомы приготовлены из лецитина яичного желтка, сформированы в растворе сахарозы, содержащем
1 – додецилсульфат натрия (SDS), 2 – цетилтриметиламмоний бромид (СТАВ), З - Triton X-100.
Влияние детергентов на потенциал пробоя мембран липосом
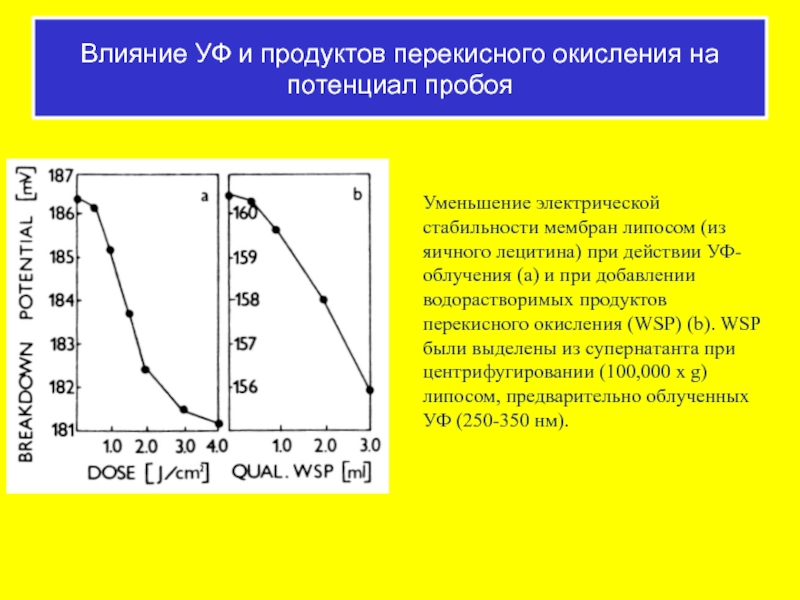
Слайд 55Уменьшение электрической стабильности мембран липосом (из яичного лецитина) при действии УФ-облучения
Влияние УФ и продуктов перекисного окисления на потенциал пробоя
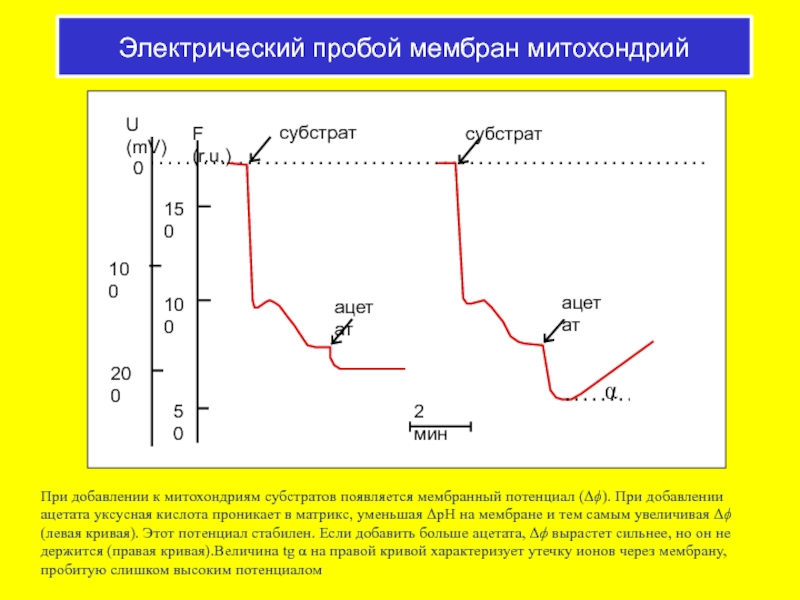
Слайд 57Электрический пробой мембран митохондрий
При добавлении к митохондриям субстратов появляется мембранный потенциал
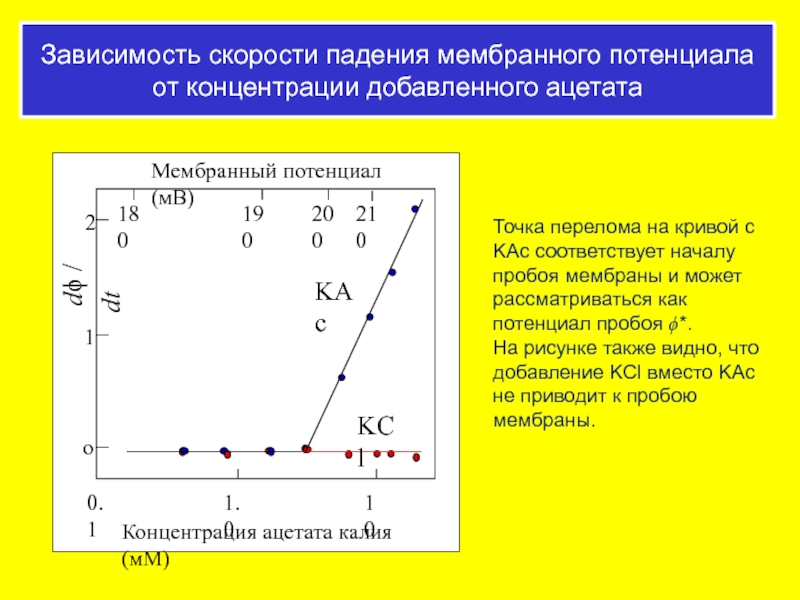
Слайд 58Зависимость скорости падения мембранного потенциала от концентрации добавленного ацетата
Точка перелома на
На рисунке также видно, что добавление KCl вместо KAc не приводит к пробою мембраны.
Слайд 59перекисное окисление липидов
действие эндогенных фосфолипаз
адсорбция на поверхности мембраны
заряженных полиэлектролитов
осмотическое растяжение
Факторы, влияющие на электрическую стабильность мембран
Слайд 60Порочный круг в липидном бислое при пероксидации
Перекисное окисление липидов
Самопробой мембраны
Повышение температуры
1
2
3
4
Слайд 61Электрические потенциалы (мВ) на мембранах клеток и потенциалы пробоя модельных и
Слайд 62 Загрузка клеток лекарственными препаратами
Электрослияние клеток
Генная трансформация клеток
Стерилизация
Электростимуляция
Применение
Слайд 641. Физические факторы
Величина приложенного потенциала
Температура
Высокочастотное электромагнитное поле
Гидростатическое давление
УФ облучение
2. Качественный состав мембраны
Фосфатидная кислота
Лецитин
Ганглиозиды
Длина жирнокислотного остатка жирной кислоты
3. Химические соединения
Глицерин
Голотурин
Полимиксин
Влияние различных веществ и факторов на состояние мембраны
Слайд 66Вопросы к зачету
Электрический пробой плоской бислойной мембраны (БЛМ): формирование и свойства
Понятие электрического пробоя. Изучение пробоя клеточных мембран. Гипотезы о механизме электричского пробоя.
Принципы теории локальных пор Ю.А. Чизмаджева. Основные факты, подтверждающие теорию локальных пор.
Вольт-амперные характеристики БЛМ и условия электрического пробоя.
Влияние растяжения, липопероксидации и фосфолипазы на потенциал пробоя БЛМ. Факты и объяснение.
Вляиние электрического пробоя на электрическую стабильность мембран.
Самопробой БЛМ ионным диффузионным потенциалом.
Самопробой мембран при пероксидации липидов, индуцированной УФ излучением.
Принцип метода изучения электрического пробоя везикулярных липидных структур (липосом).
Электрический пробой мембран эритроцитов. Принцип метода, влияние растяжения мембраны, выход гемоглобина.
Электрический пробой митохондрий. Метод создания и измерения потенциала. Проявление пробоя.
Электрический пробой мембран при снижении поврехностного натяжения на границе раздела фаз.


![Триггерная функция Fe2+При γ = 0При [Fe2+] > [Fe2+] *, γ < 0γ = kp([Fe2+]*](/img/tmb/5/483440/0dd21afa8ab277c11eefe6eacb4742db-800x.jpg)
![Железо как про- и антиоксидант[Fe2+] > [Fe2+] *γ < 0[Fe2+] < [Fe2+] *γ > 0Скорость](/img/tmb/5/483440/4179d7e32e05d0b45f7b688d168a766d-800x.jpg)




![040801200.41.20.8Lens transparency[GSH]/[GSH]00.41.20.8004080120Время после облучения, дниПрозрачность хрусталикаСодержание GSHРазвитие радиационной катаракты](/img/tmb/5/483440/d5784e6f8a35f70255d2331b0af0e070-800x.jpg)