- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Азотсодержащие органические соединения презентация
Содержание
- 1. Азотсодержащие органические соединения
- 2. Амины органические соединения, содержащие в своём составе
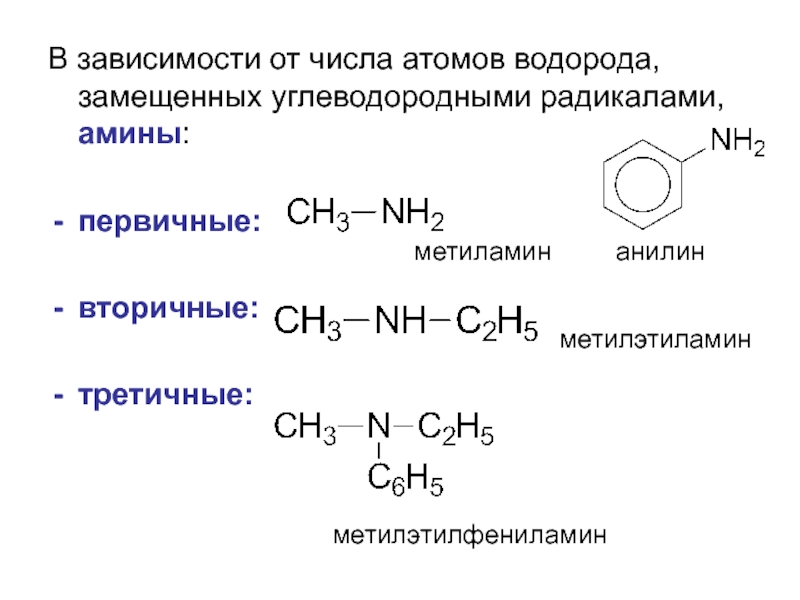
- 3. В зависимости от числа атомов водорода, замещенных
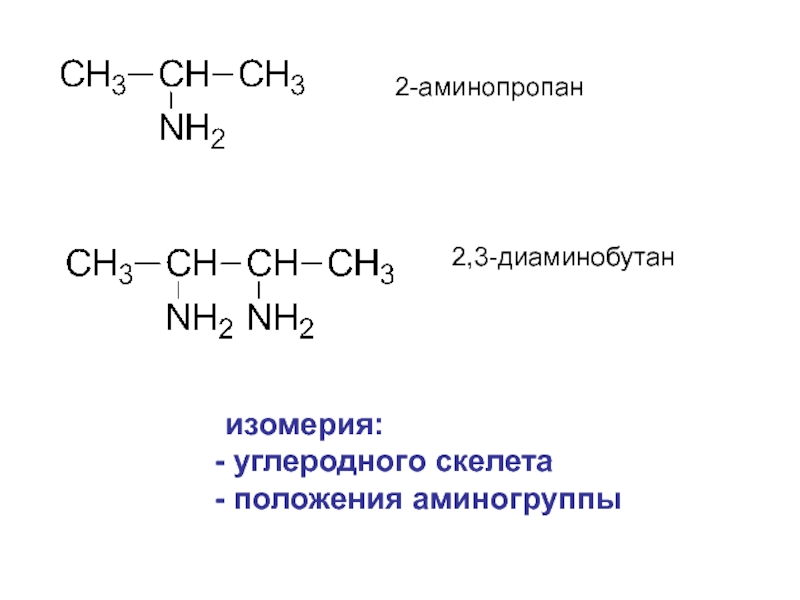
- 4. 2-аминопропан 2,3-диаминобутан изомерия: углеродного скелета положения аминогруппы
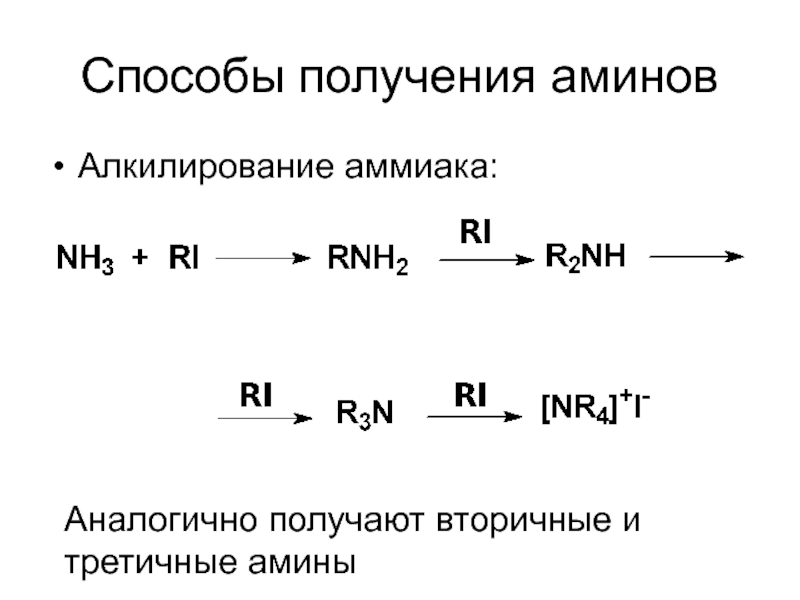
- 5. Способы получения аминов Алкилирование аммиака: Аналогично получают вторичные и третичные амины
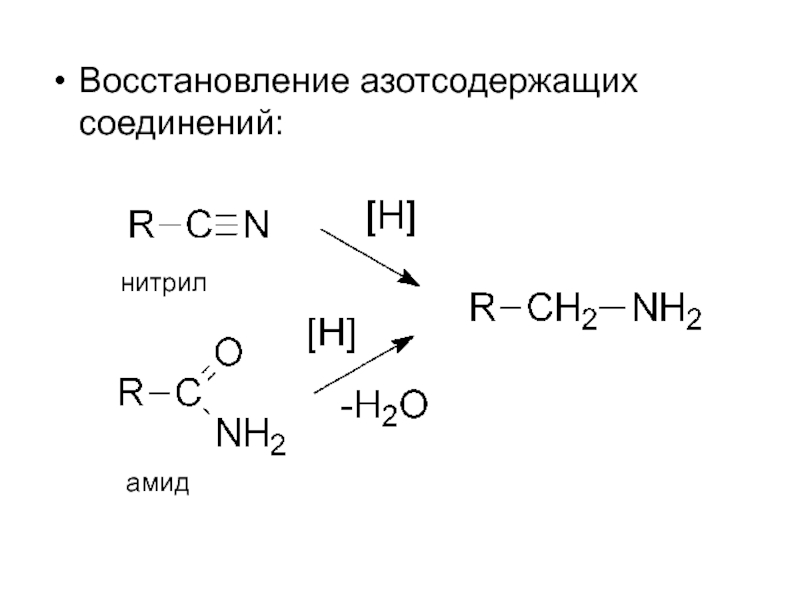
- 6. Восстановление азотсодержащих соединений: нитрил амид
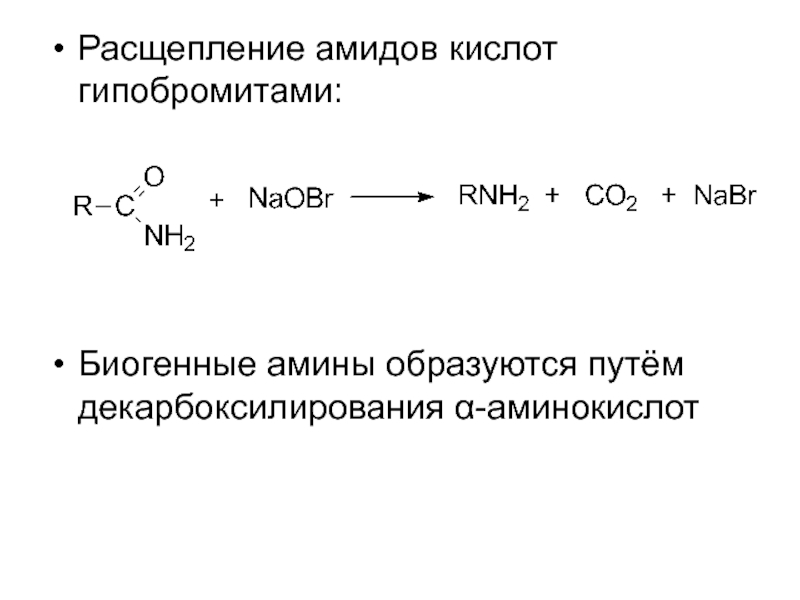
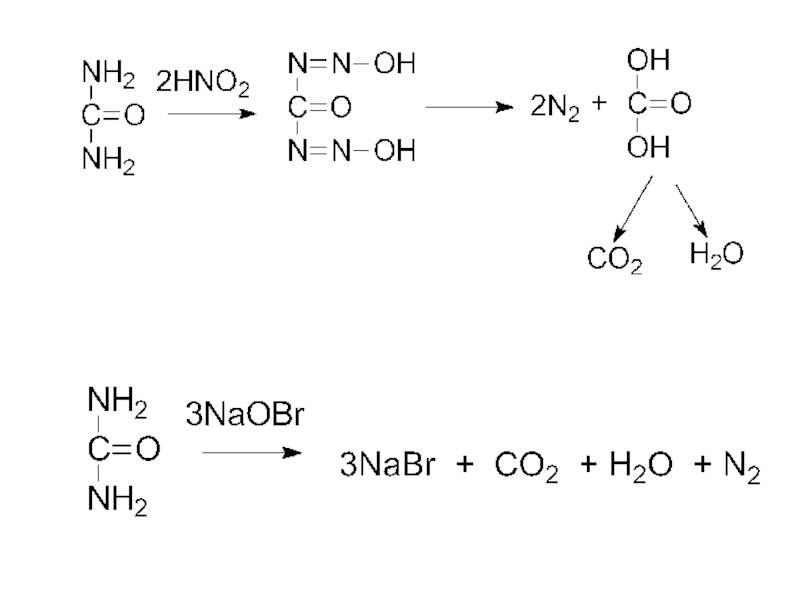
- 7. Расщепление амидов кислот гипобромитами:
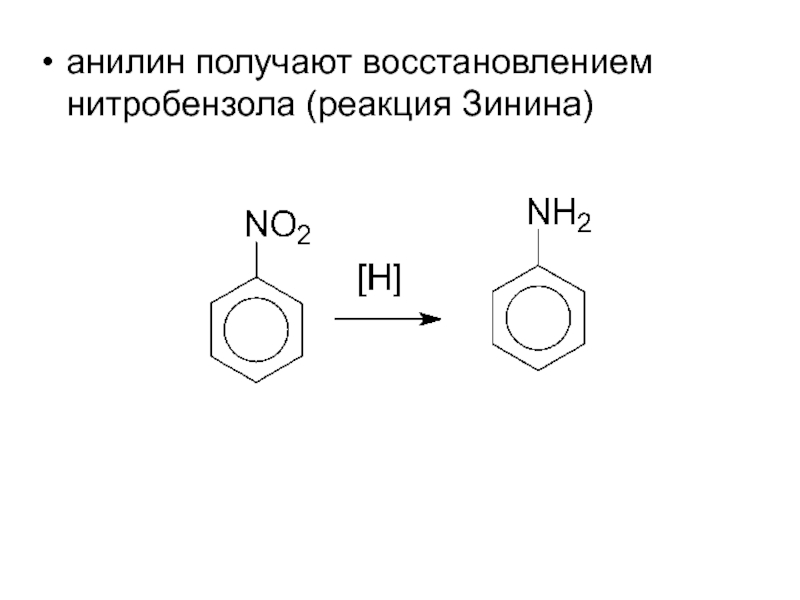
- 8. анилин получают восстановлением нитробензола (реакция Зинина)
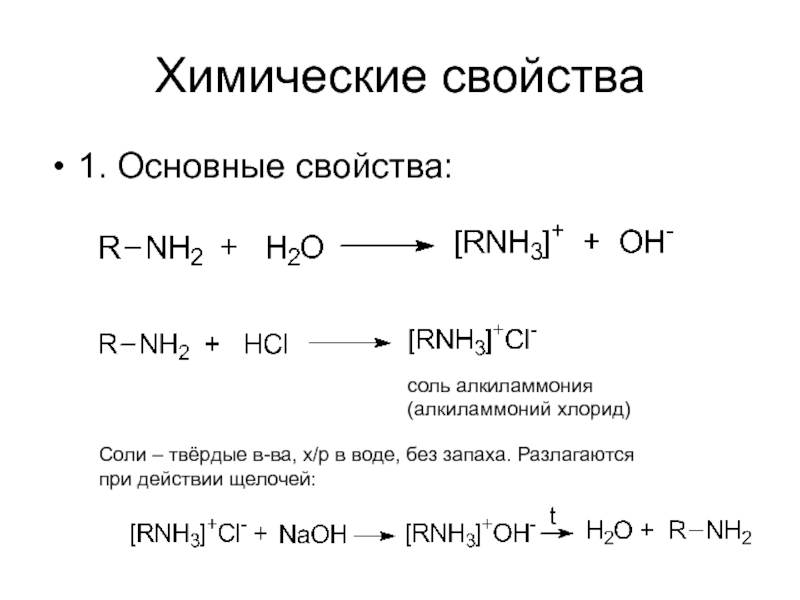
- 9. Химические свойства 1. Основные свойства:
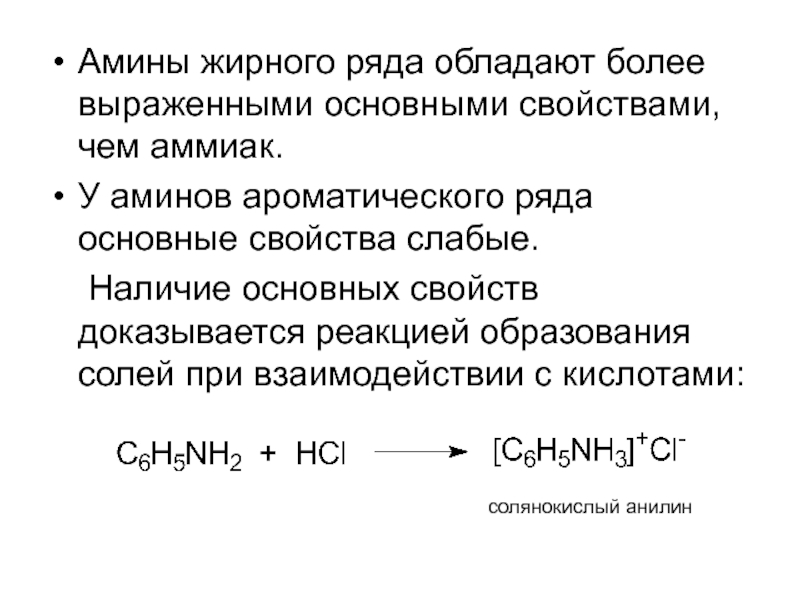
- 10. Амины жирного ряда обладают более выраженными основными
- 11. 2. Взаимодействие с азотистой кислотой проходит с
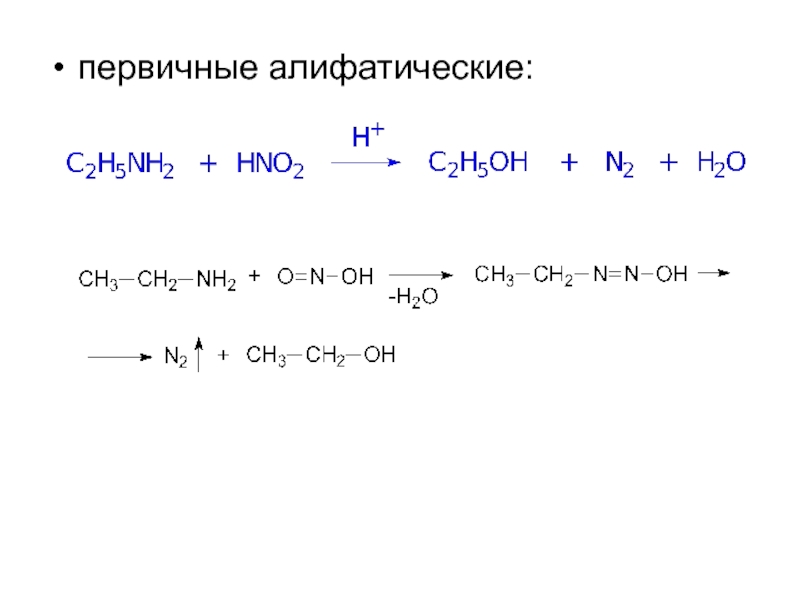
- 12. первичные алифатические:
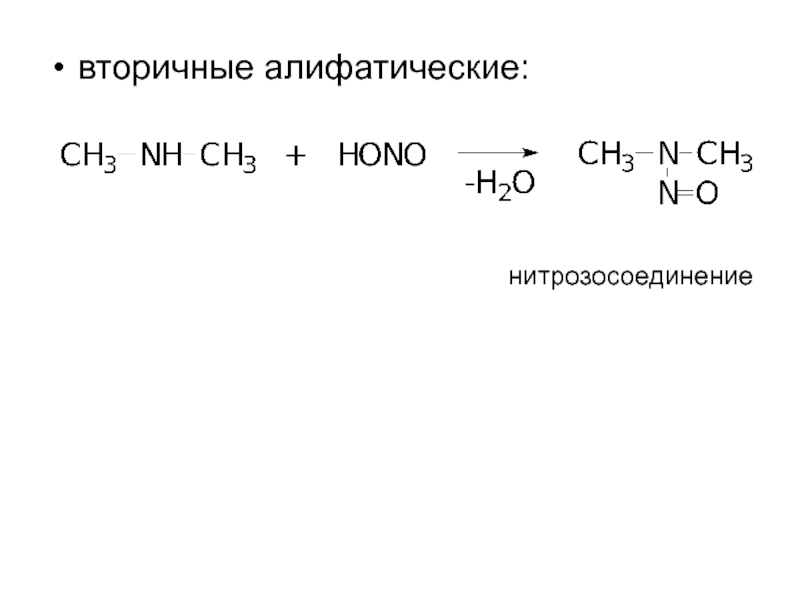
- 13. вторичные алифатические: нитрозосоединение
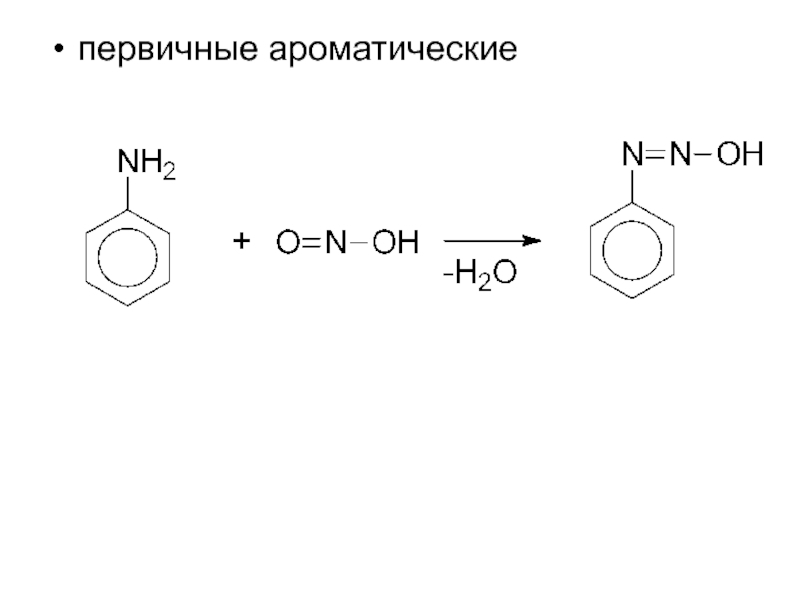
- 14. первичные ароматические
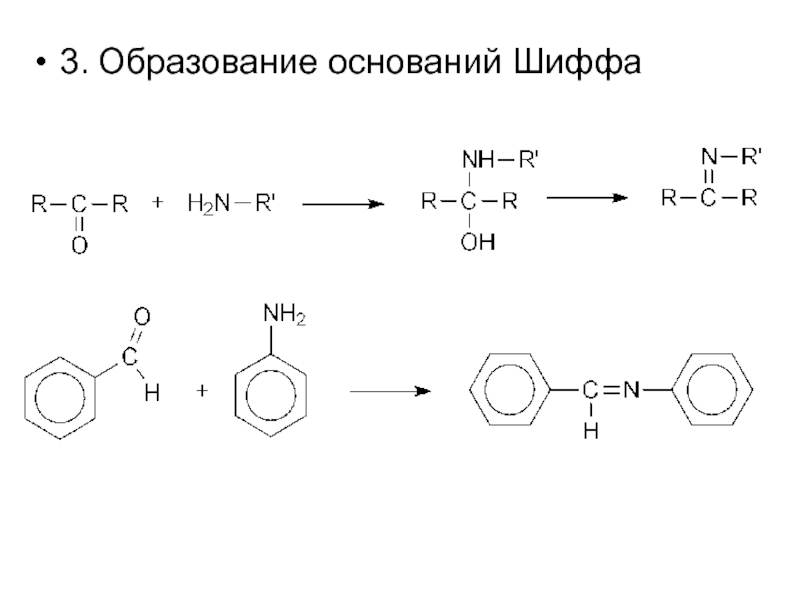
- 15. 3. Образование оснований Шиффа
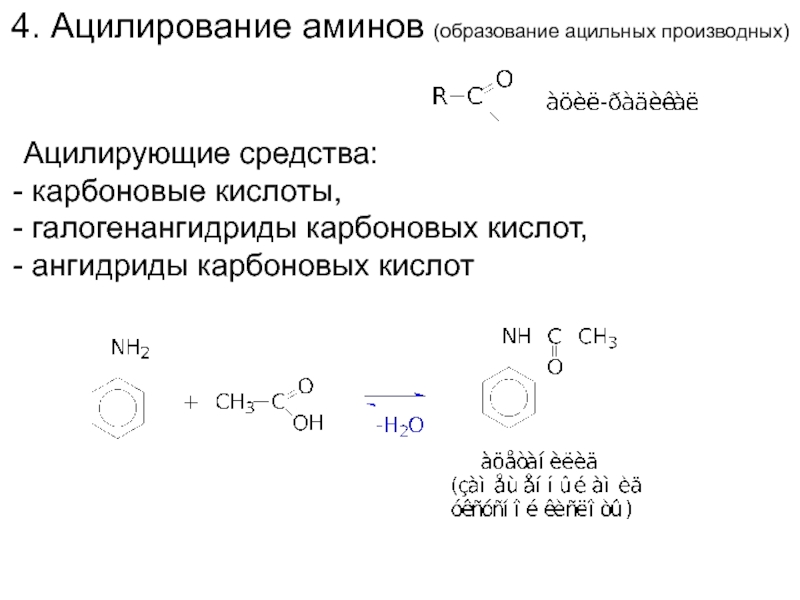
- 16. 4. Ацилирование аминов (образование ацильных производных) Ацилирующие
- 17. 5. Реакции электрофильного замещения для ароматических аминов а) галогенирование
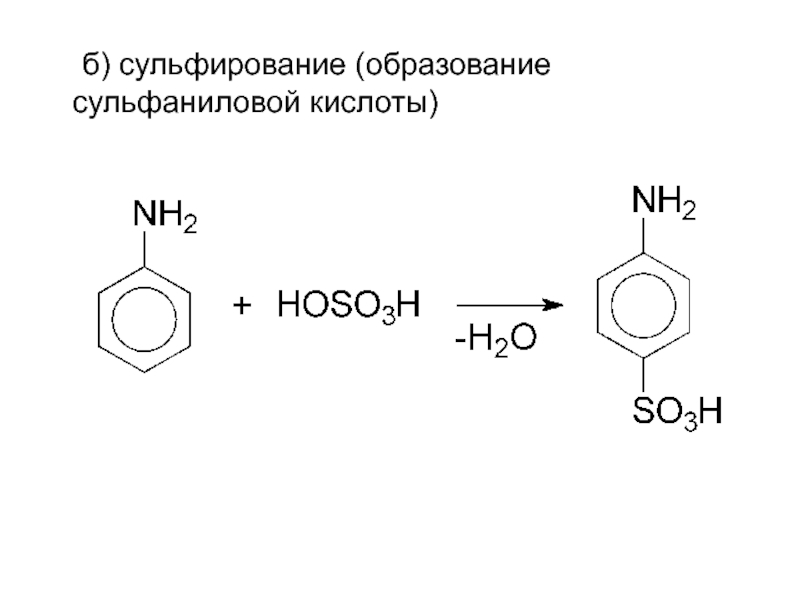
- 18. б) сульфирование (образование сульфаниловой кислоты)
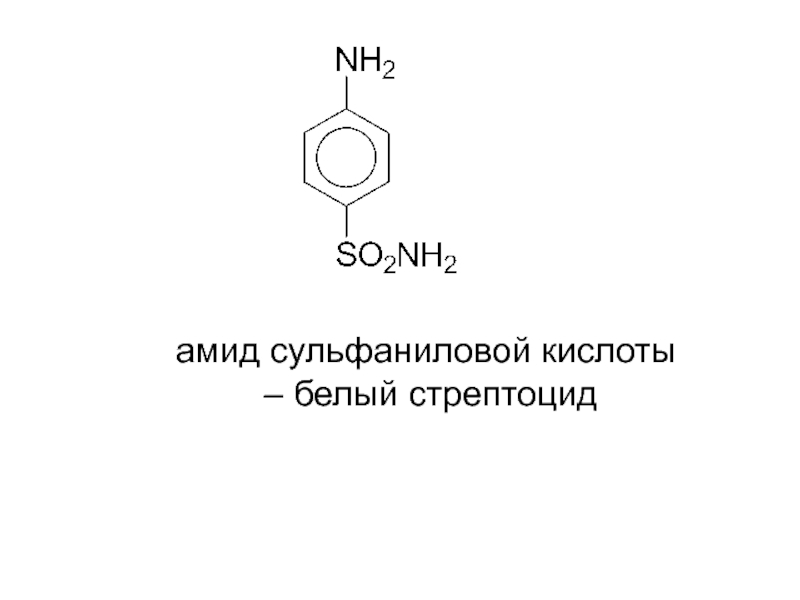
- 19. амид сульфаниловой кислоты – белый стрептоцид
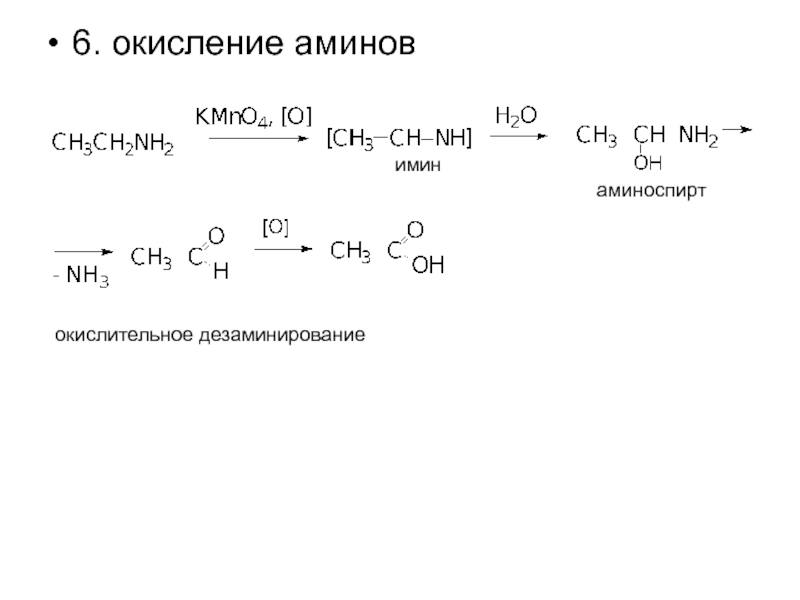
- 20. 6. окисление аминов окислительное дезаминирование имин аминоспирт
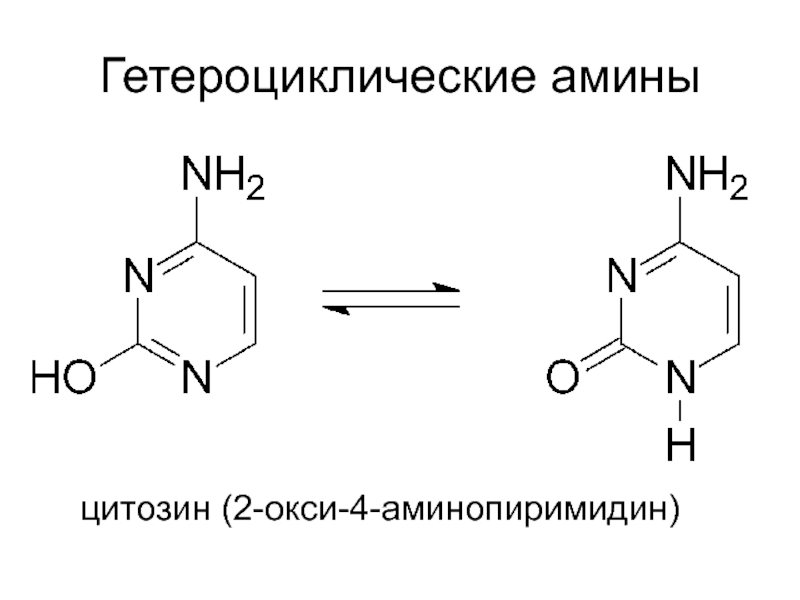
- 21. Гетероциклические амины цитозин (2-окси-4-аминопиримидин)
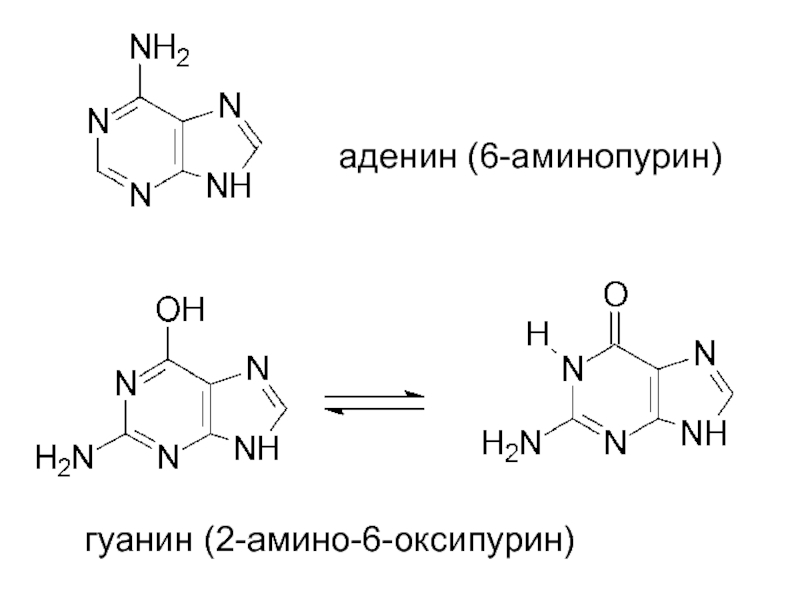
- 22. аденин (6-аминопурин) гуанин (2-амино-6-оксипурин)
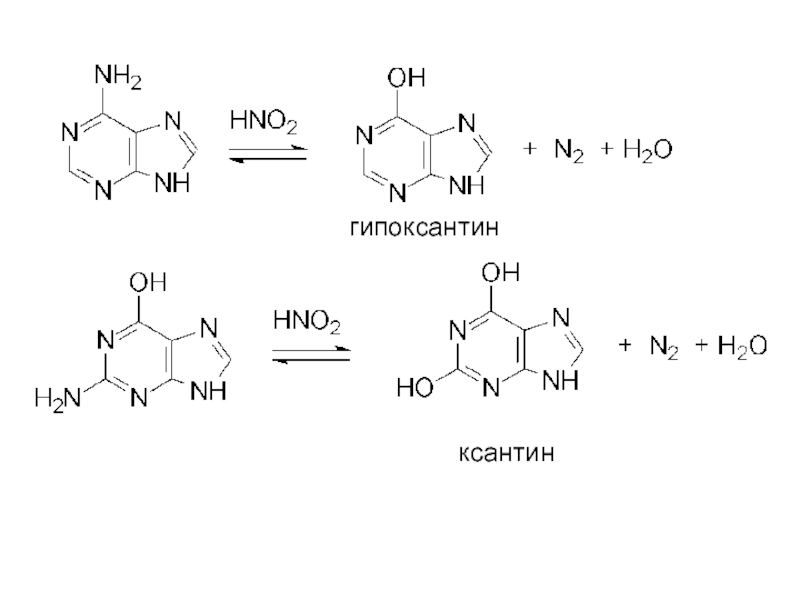
- 23. гипоксантин ксантин
- 24. Аминоспирты содержат в молекуле одновременно амино- и
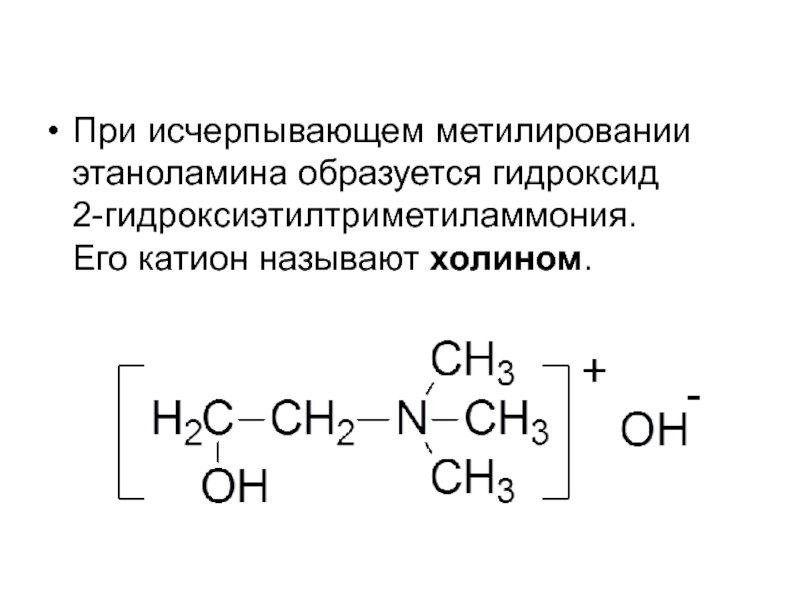
- 25. При исчерпывающем метилировании этаноламина образуется гидроксид 2-гидроксиэтилтриметиламмония. Его катион называют холином.
- 26. Холин – структурный элемент сложных липидов.
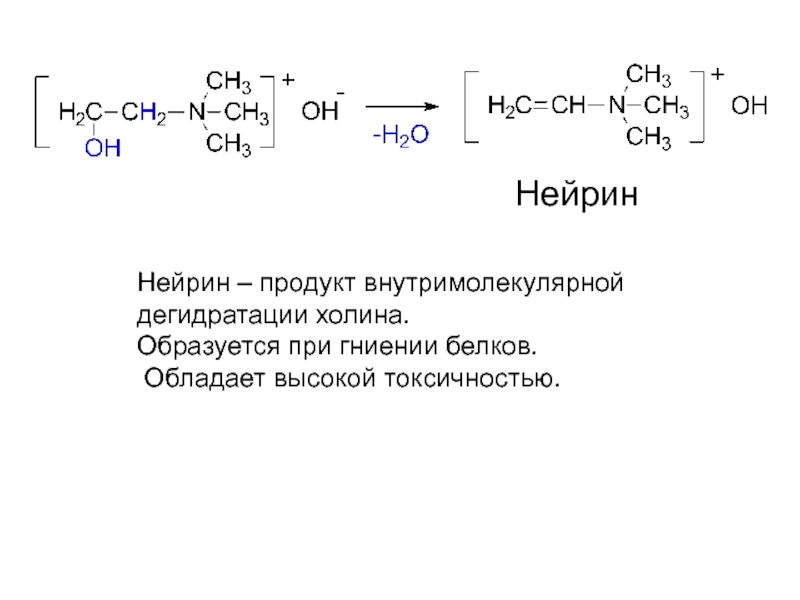
- 27. Нейрин Нейрин – продукт внутримолекулярной дегидратации холина. Образуется при гниении белков. Обладает высокой токсичностью.
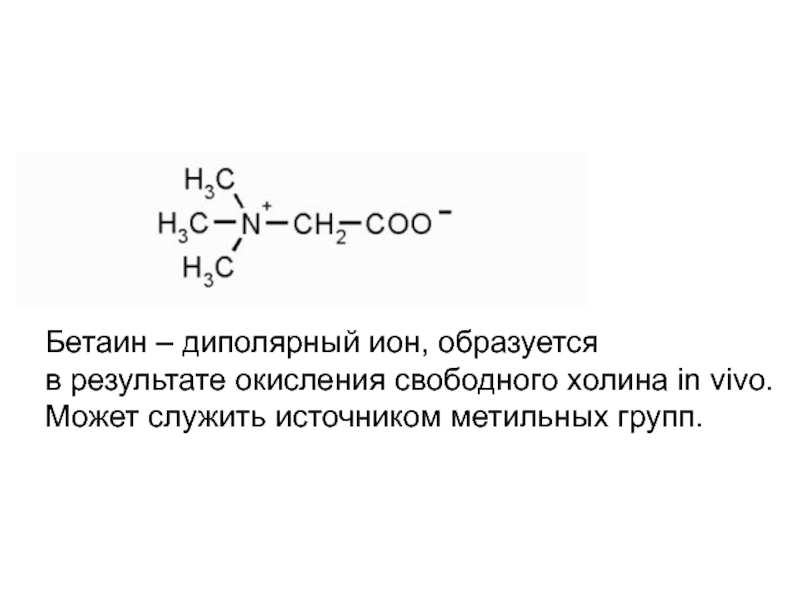
- 28. Бетаин – диполярный ион, образуется в
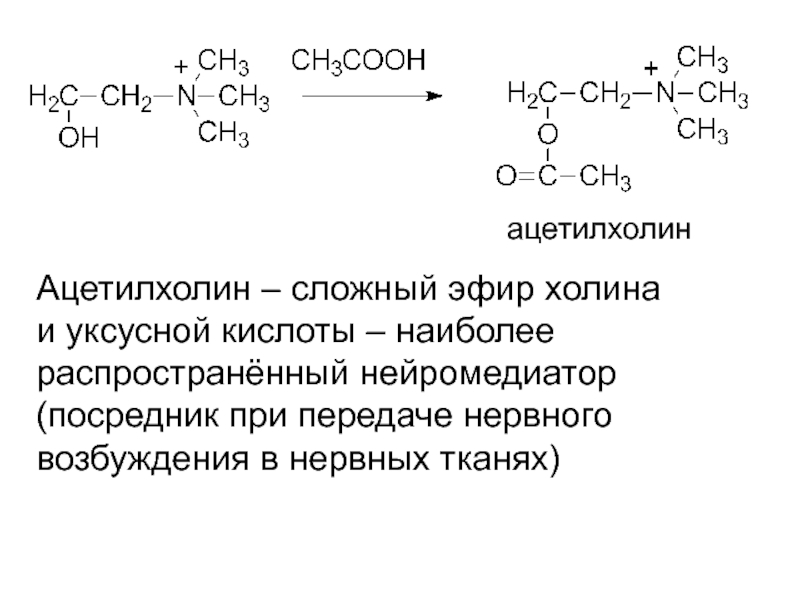
- 29. ацетилхолин Ацетилхолин – сложный эфир холина и
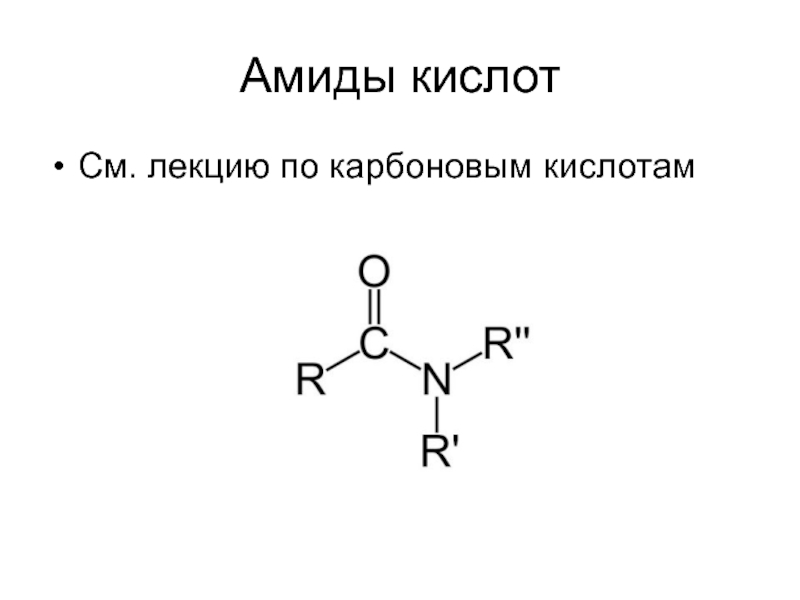
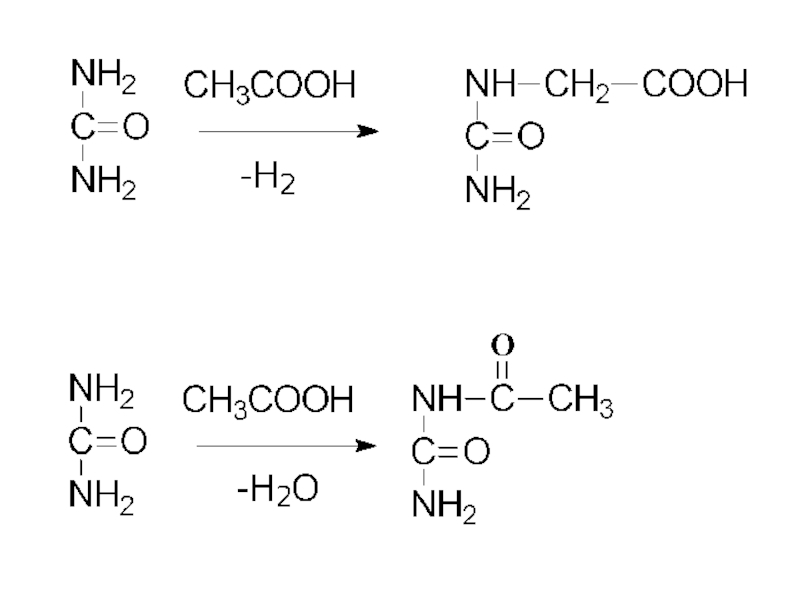
- 30. Амиды кислот См. лекцию по карбоновым кислотам
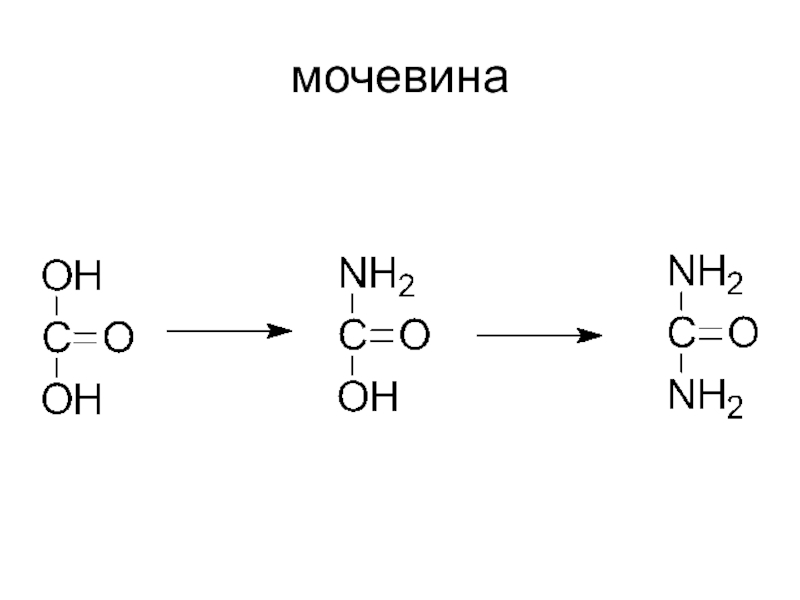
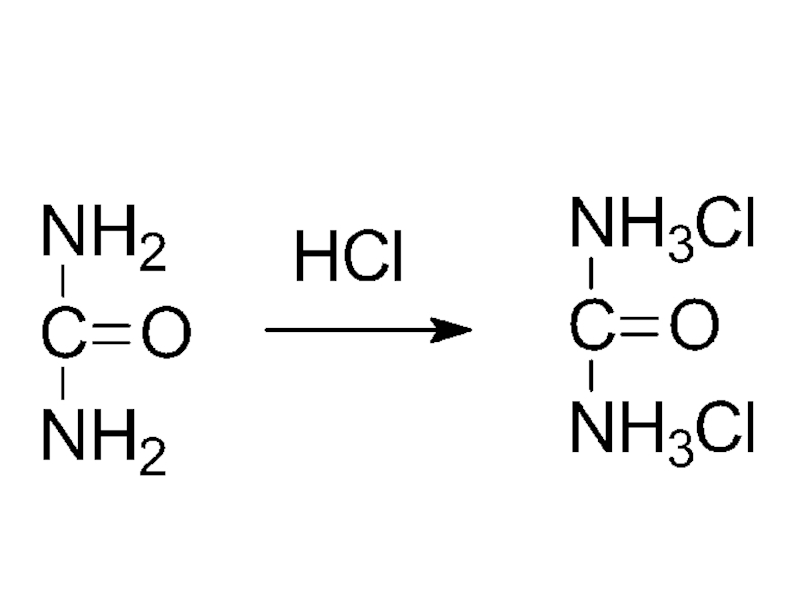
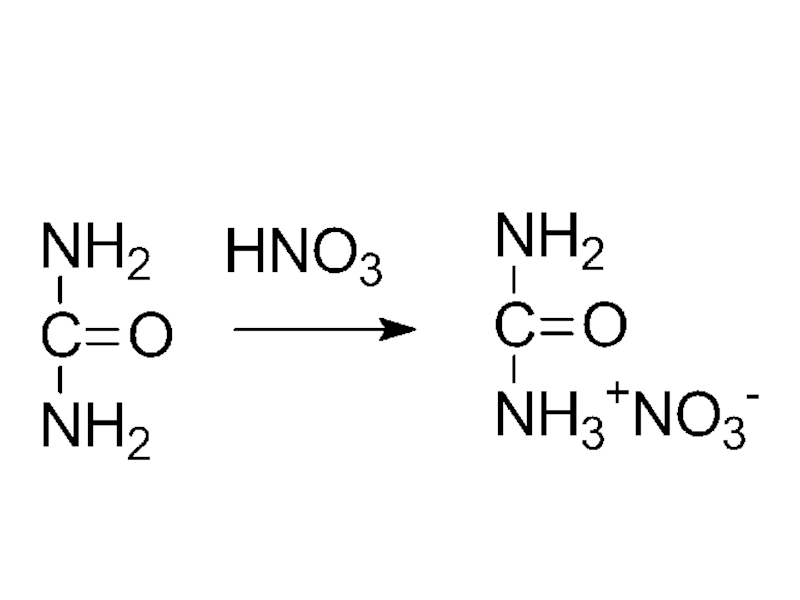
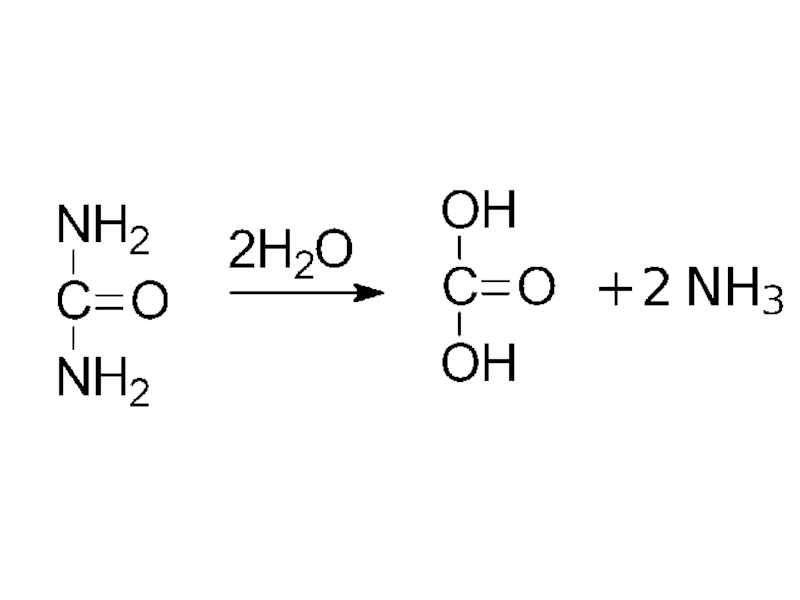
- 31. мочевина
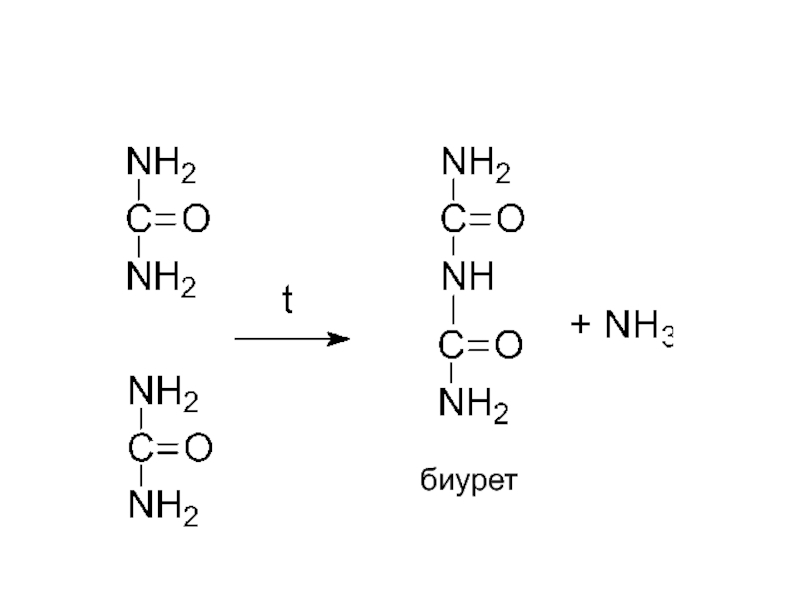
- 37. биурет
- 38. АМИНОКИСЛОТЫ
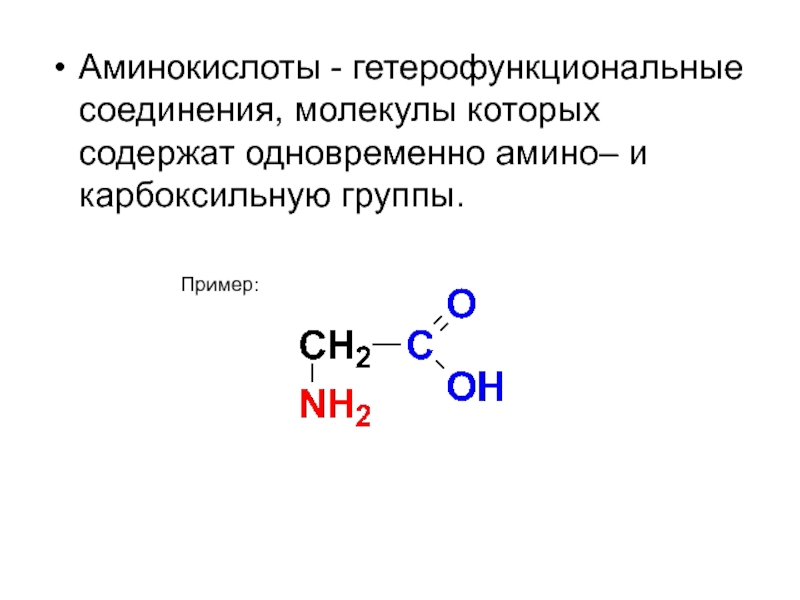
- 39. Аминокислоты - гетерофункциональные соединения, молекулы которых содержат одновременно амино– и карбоксильную группы. Пример:
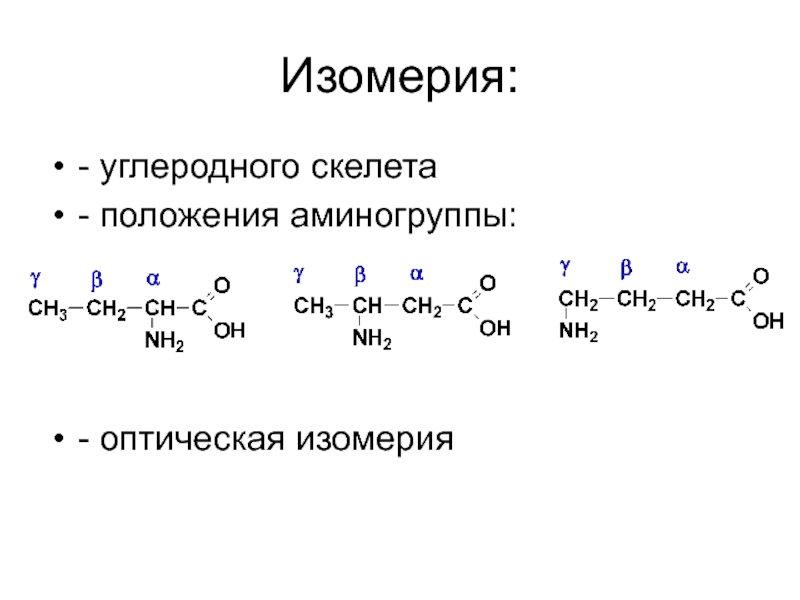
- 40. Изомерия: - углеродного скелета - положения аминогруппы: - оптическая изомерия
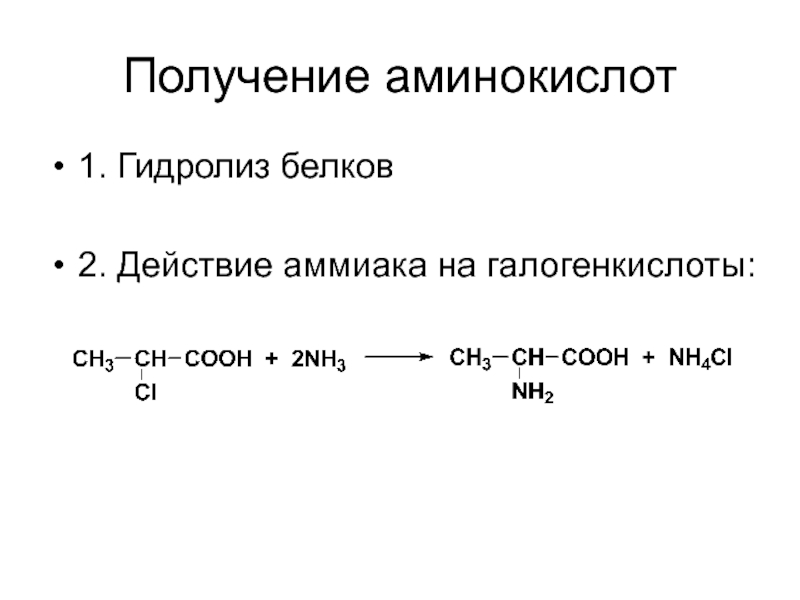
- 41. Получение аминокислот 1. Гидролиз белков 2. Действие аммиака на галогенкислоты:
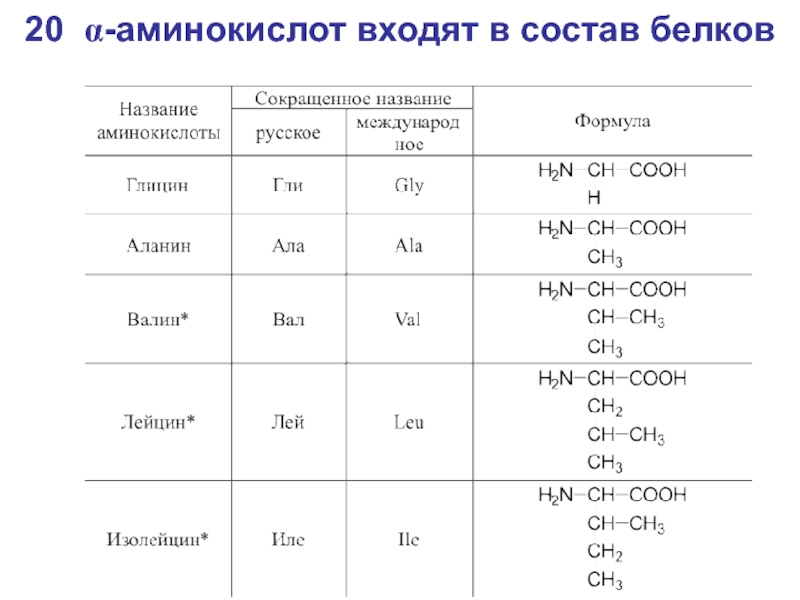
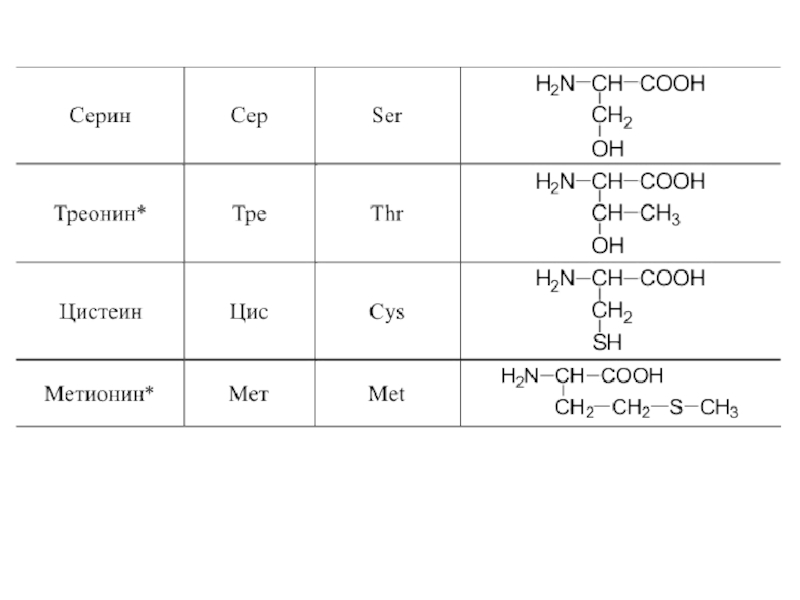
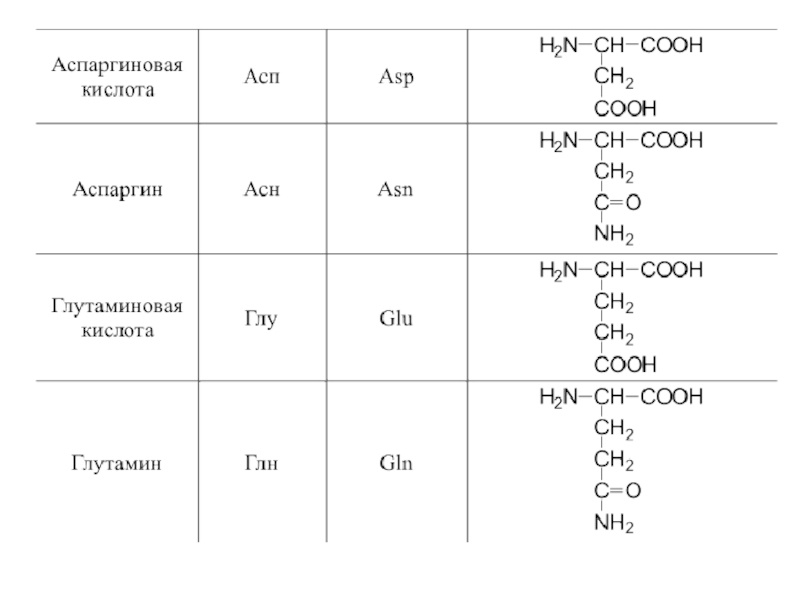
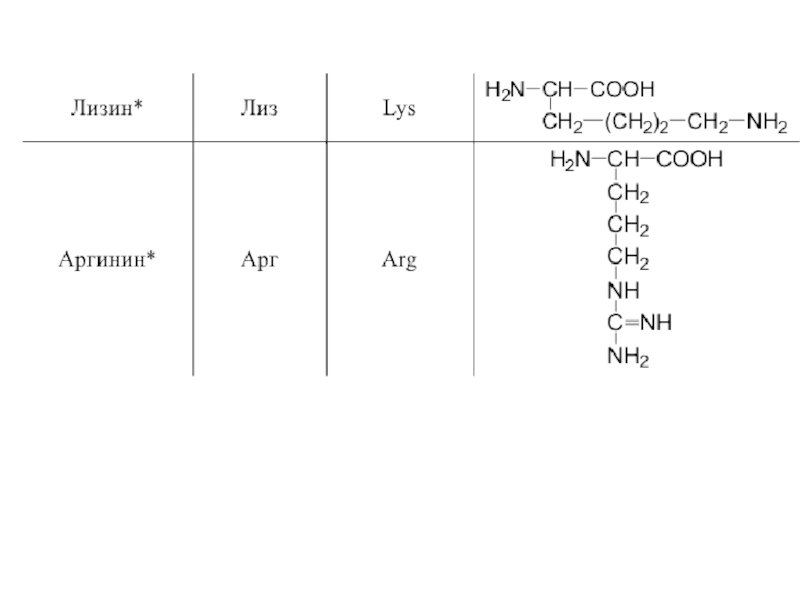
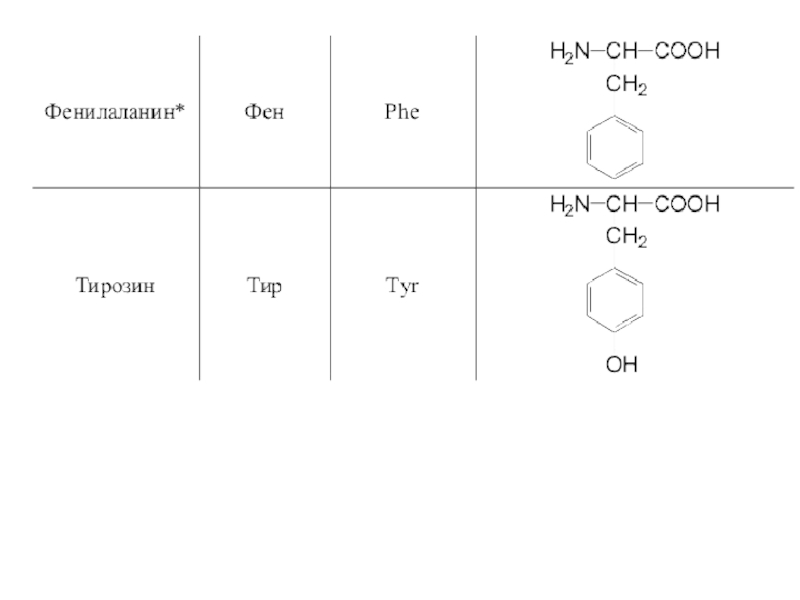
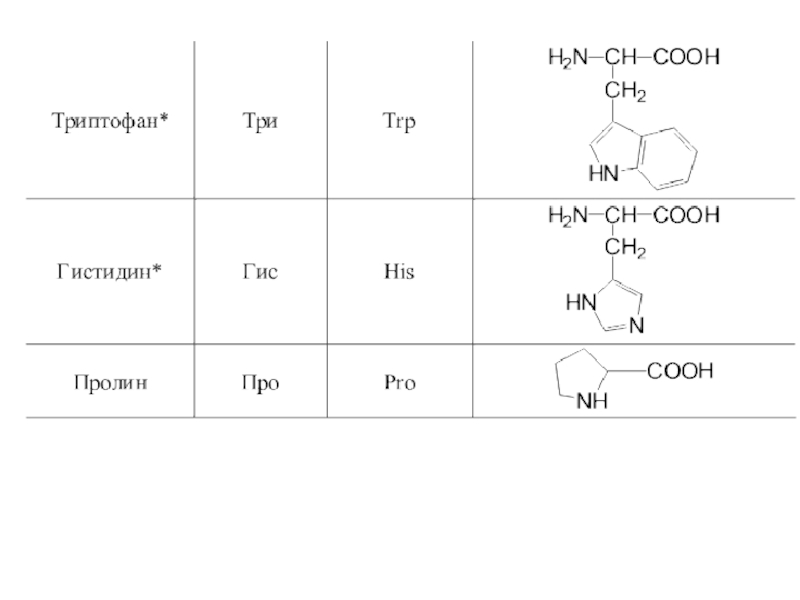
- 42. 20 α-аминокислот входят в состав белков
- 48. Оптическая изомерия Все полученные из белков аминокислоты
- 49. Физические и химические свойства аминокислот
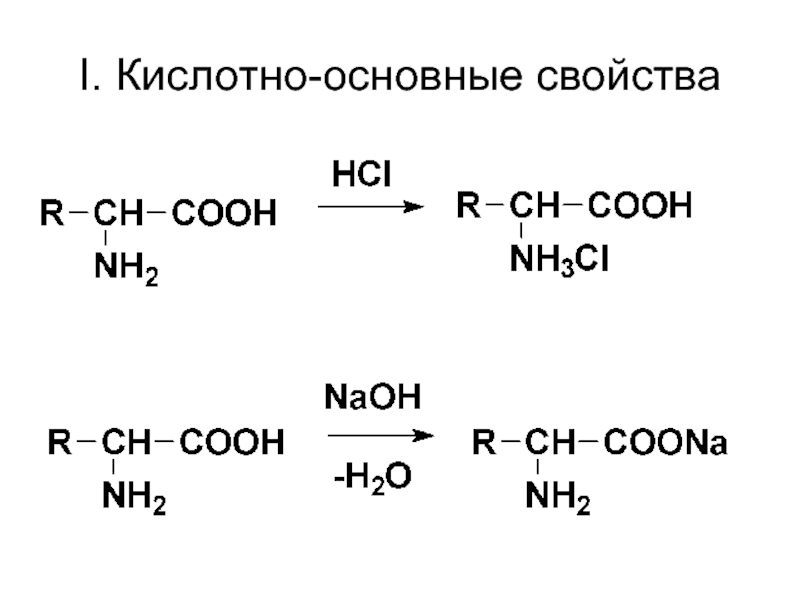
- 50. I. Кислотно-основные свойства
- 51. Высокая температура плавления, легкость кристаллизации, высокие дипольные
- 52. В твёрдом состоянии α-аминокислоты существуют в виде
- 53. Положение равновесия, т.е. соотношение различных форм аминокислоты,
- 54. Значение рН, при котором концентрация диполярных
- 55. II. Все реакции карбоновых кислот, протекающие за
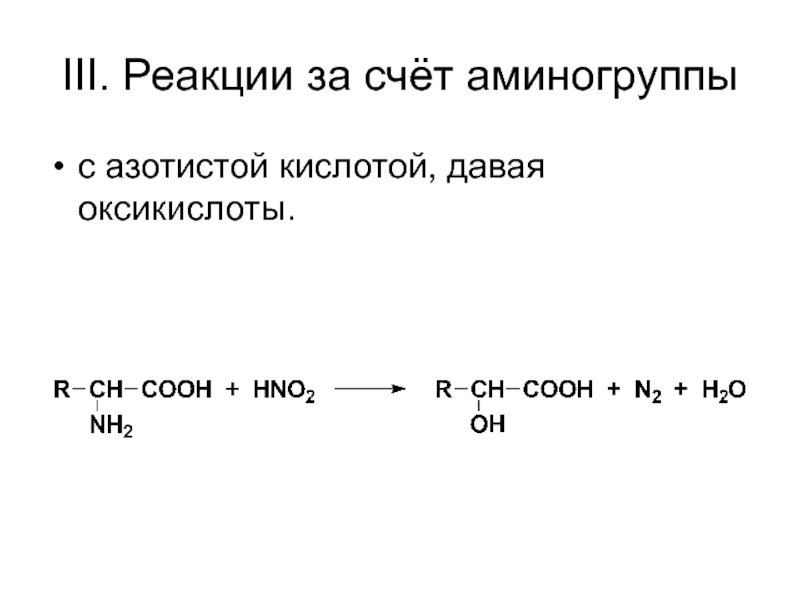
- 56. III. Реакции за счёт аминогруппы с азотистой кислотой, давая оксикислоты.
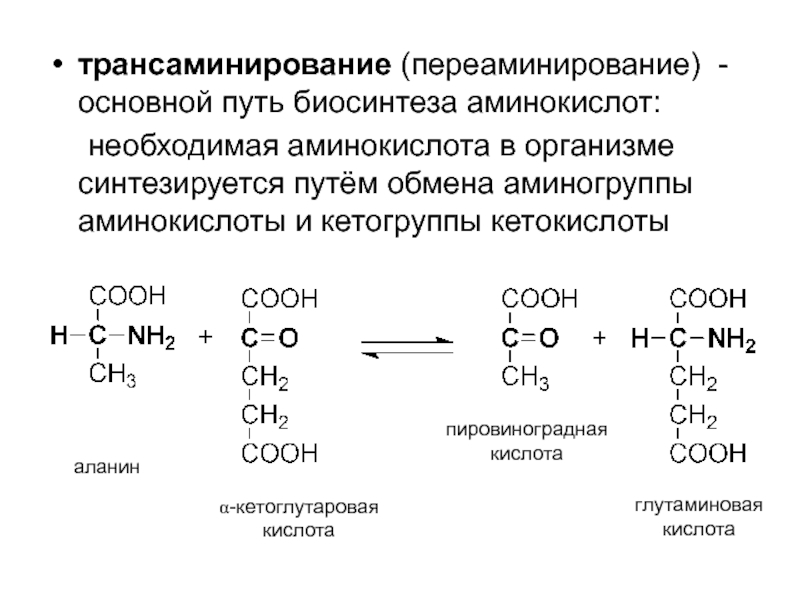
- 57. трансаминирование (переаминирование) - основной путь биосинтеза аминокислот:
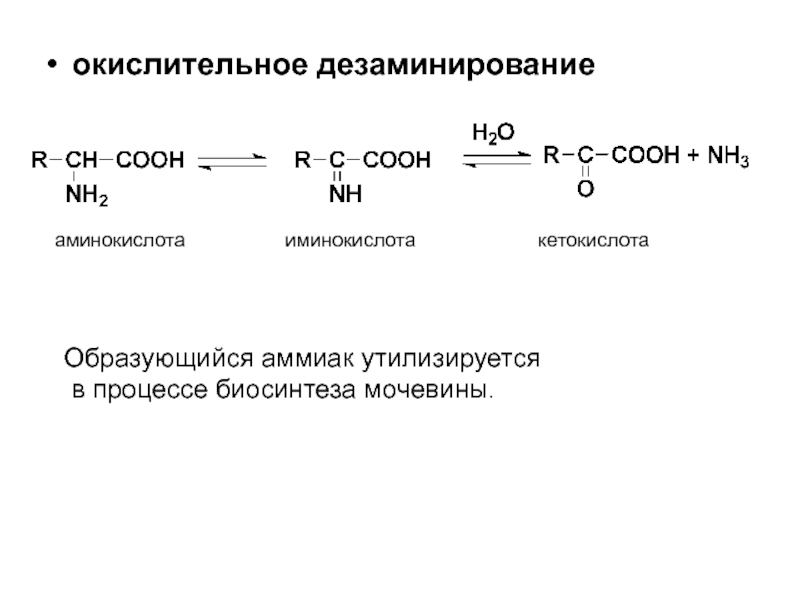
- 58. окислительное дезаминирование аминокислота
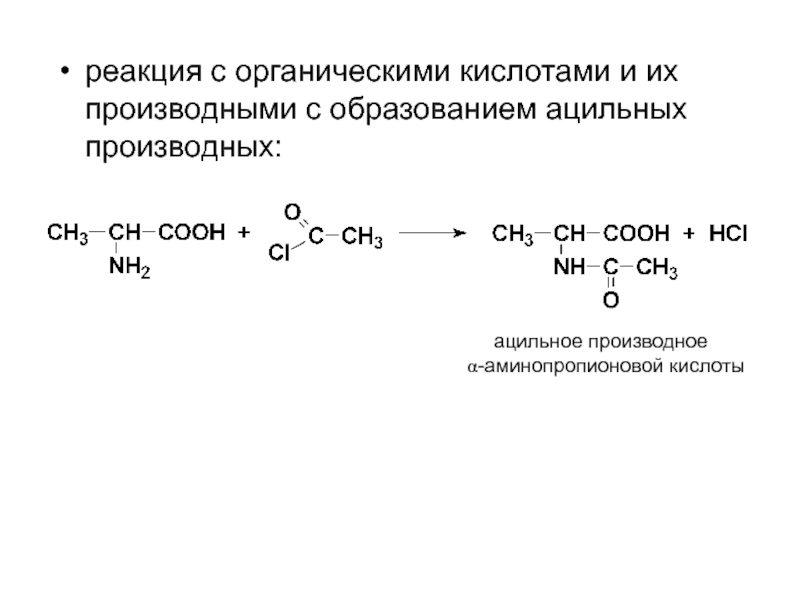
- 59. реакция с органическими кислотами и их производными
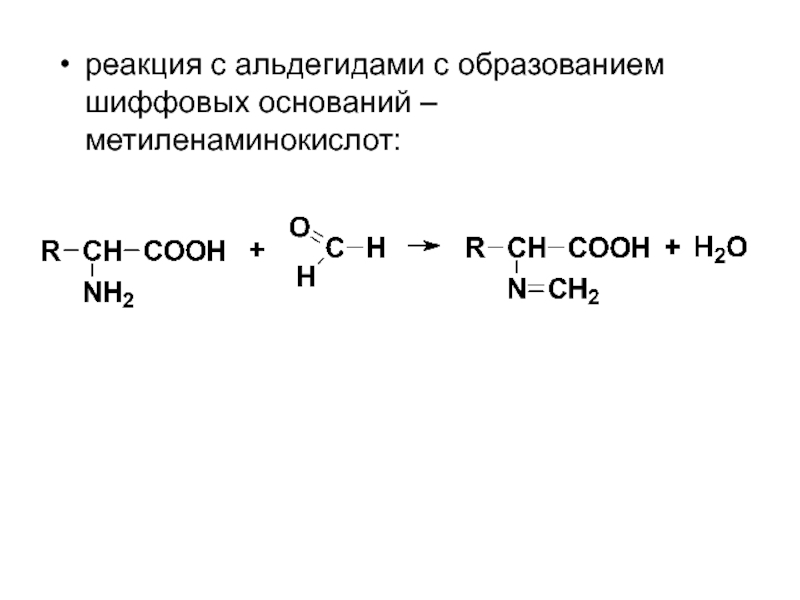
- 60. реакция с альдегидами с образованием шиффовых оснований – метиленаминокислот:
- 61. IV. Специфические свойства аминокислот Образование пептидов. Одновременное
- 62. Номенклатура пептидов N-концевой аминокислотный остаток (имеющий свободную
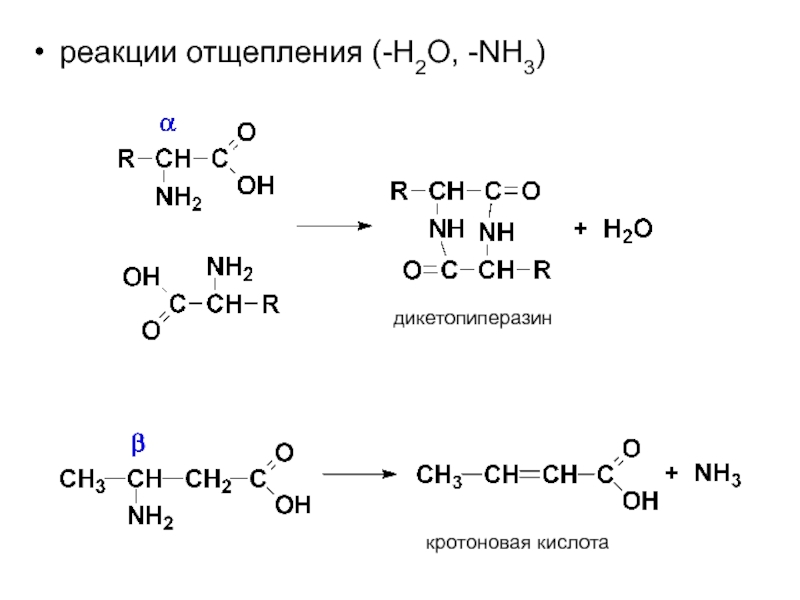
- 63. реакции отщепления (-H2O, -NH3) дикетопиперазин кротоновая кислота
Слайд 2Амины
органические соединения, содержащие в своём составе аминогруппу –NH2 или замещённую аминогруппу
производные аммиака, в котором один или несколько атомов водорода замещены углеводородными радикалами
Слайд 3В зависимости от числа атомов водорода, замещенных углеводородными радикалами, амины:
первичные:
вторичные:
третичные:
Слайд 5Способы получения аминов
Алкилирование аммиака:
Аналогично получают вторичные и третичные амины
Слайд 7Расщепление амидов кислот гипобромитами:
Биогенные амины образуются путём декарбоксилирования α-аминокислот
Слайд 10Амины жирного ряда обладают более выраженными основными свойствами, чем аммиак.
У аминов
Наличие основных свойств доказывается реакцией образования солей при взаимодействии с кислотами:
солянокислый анилин
Слайд 112. Взаимодействие с азотистой кислотой
проходит с образованием различных продуктов для аминов
Это качественная реакция, позволяющая различить первичный, вторичный, третичный амины.
Слайд 164. Ацилирование аминов (образование ацильных производных)
Ацилирующие средства:
карбоновые кислоты,
галогенангидриды карбоновых
ангидриды карбоновых кислот
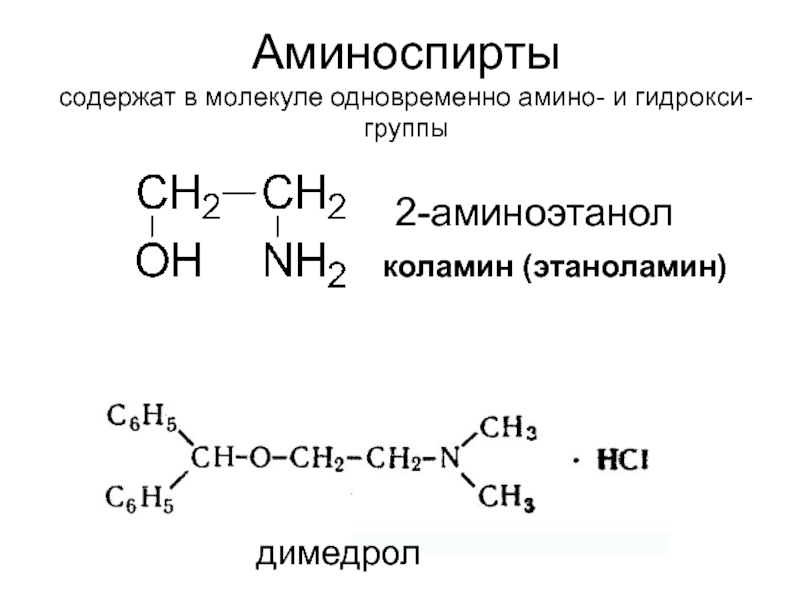
Слайд 24Аминоспирты
содержат в молекуле одновременно амино- и гидрокси-группы
коламин (этаноламин)
холин (триметил-β-гидроксиэтилгидрат аммония):
2
2-аминоэтанол
димедрол
Слайд 25
При исчерпывающем метилировании этаноламина образуется гидроксид
2-гидроксиэтилтриметиламмония.
Его катион называют холином.
Слайд 26
Холин – структурный элемент сложных липидов. Имеет большое значение как витаминоподобное
Слайд 27Нейрин
Нейрин – продукт внутримолекулярной
дегидратации холина.
Образуется при гниении белков.
Обладает высокой токсичностью.
Слайд 28
Бетаин – диполярный ион, образуется
в результате окисления свободного холина in vivo.
Может служить источником метильных групп.
Слайд 29ацетилхолин
Ацетилхолин – сложный эфир холина
и уксусной кислоты – наиболее
распространённый нейромедиатор
(посредник при
возбуждения в нервных тканях)
Слайд 39Аминокислоты - гетерофункциональные соединения, молекулы которых содержат одновременно амино– и карбоксильную
Пример:
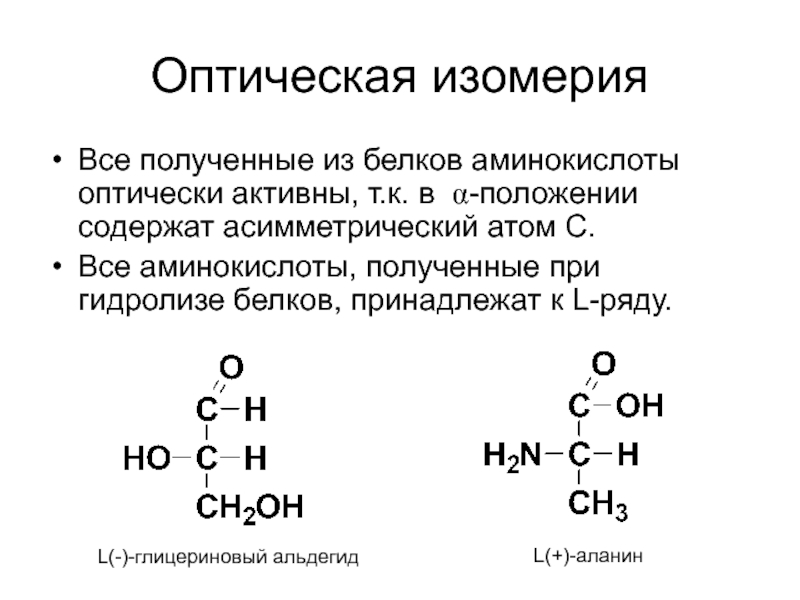
Слайд 48Оптическая изомерия
Все полученные из белков аминокислоты оптически активны, т.к. в α-положении
Все аминокислоты, полученные при гидролизе белков, принадлежат к L-ряду.
L(-)-глицериновый альдегид
L(+)-аланин
Слайд 51 Высокая температура плавления, легкость кристаллизации, высокие дипольные моменты и хорошая растворимость
Способность α-аминокислот растворяться в воде является важным фактором обеспечения их биологического функционирования – с ней связаны всасываемость α-аминокислот, их транспорт в организме и т. п.
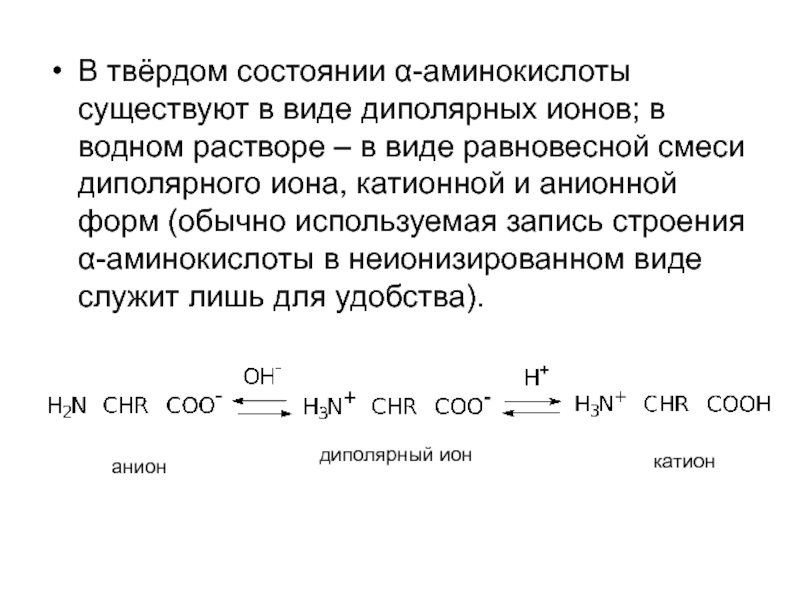
Слайд 52В твёрдом состоянии α-аминокислоты существуют в виде диполярных ионов; в водном
анион
катион
диполярный ион
Слайд 53Положение равновесия, т.е. соотношение различных форм аминокислоты, в водном растворе при
Слайд 54
Значение рН, при котором концентрация диполярных ионов максимальна, а минимальные концентрации
Слайд 55II. Все реакции карбоновых кислот, протекающие за счёт карбоксильной группы (-COOH),
соли (с металлами, оксидами и гидроксидами металлов),
эфиры,
ангидриды,
галогенангидриды,
амиды,
амины (реакцией декарбоксилирования)
Слайд 57трансаминирование (переаминирование) - основной путь биосинтеза аминокислот:
необходимая аминокислота в организме синтезируется
аланин
α-кетоглутаровая
кислота
пировиноградная
кислота
глутаминовая
кислота
Слайд 58окислительное дезаминирование
аминокислота иминокислота
Образующийся аммиак утилизируется
в процессе биосинтеза мочевины.
Слайд 59реакция с органическими кислотами и их производными с образованием ацильных производных:
ацильное
α-аминопропионовой кислоты
Слайд 61IV. Специфические свойства аминокислот
Образование пептидов. Одновременное присутствие в молекулах α–аминокислот аминной
пептидные связи
Слайд 62Номенклатура пептидов
N-концевой аминокислотный остаток (имеющий свободную аминогруппу) пишут с левой стороны
трипептид глицилаланилфенилаланин