- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Азот. Нахождение в природе презентация
Содержание
- 1. Азот. Нахождение в природе
- 2. Нахождение в природе По распространённости азот среди
- 3. История открытия Опыты Антуан Лавуазье, посвященные исследованию
- 4. Физические свойства Азот при нормальных условиях двухатомный
- 5. Химические свойства Азот при обычных условиях химически
- 6. ХИМИЧЕСКИЕ СВОЙСТВА И СПОСОБЫ ПОЛУЧЕНИЯ АЗОТА
- 7. ПРИМЕНЕНИЕ АЗОТА Области применения газообразного азота обусловлены
- 8. ДОМАШНЕЕ ЗАДАНИЕ ЗНАТЬ: - физические
Слайд 2Нахождение в природе
По распространённости азот среди всех элементов занимает четвёртое место.
Причем в земной коре его содержится не так уж много, самыми известными минералами, содержащими азот, являются чилийская и индийская селитра.
Зато воздух на 78% состоит из азота. Существование свободного азота (N2) свидетельствует о его относительной инертности и трудности взаимодействия с другими элементами при обычной температуре.
Связанный азот входит в состав растений и животных.
Зато воздух на 78% состоит из азота. Существование свободного азота (N2) свидетельствует о его относительной инертности и трудности взаимодействия с другими элементами при обычной температуре.
Связанный азот входит в состав растений и животных.
Слайд 3История открытия
Опыты Антуан Лавуазье, посвященные исследованию роли атмосферы в поддержании жизни
и процессов горения, подтвердили существование относительно инертного вещества в воздухе. Не сумев понять сущности своего открытия, Лавуазье назвал вещество azote, что на древнегреческом означает «безжизненный».
В 1772г. Даниэль Резерфорд из Эдинбурга установил, что этот газ является элементом, и назвал его «вредный воздух».
Латинское название азота происходит от греческих слов nitron и gen, что означает «образующий селитру». Селитрами тогда называли соли азотной кислоты.
В 1772г. Даниэль Резерфорд из Эдинбурга установил, что этот газ является элементом, и назвал его «вредный воздух».
Латинское название азота происходит от греческих слов nitron и gen, что означает «образующий селитру». Селитрами тогда называли соли азотной кислоты.
Слайд 4Физические свойства
Азот при нормальных условиях двухатомный газ без цвета, вкуса и
запаха.
Почти нерастворим в воде, поэтому его можно собирать и хранить под водой.
При температуре -196˚С азот превращается в бесцветную жидкость. При охлаждении до -210°С появляются кристаллы твёрдого азота похожие на снег или лёд.
И в виде жидкости, и в виде «снега» азот сохраняет свою инертность, поэтому его применяют для глубокого охлаждения или вымораживания различных веществ и биологических препаратов.
Почти нерастворим в воде, поэтому его можно собирать и хранить под водой.
При температуре -196˚С азот превращается в бесцветную жидкость. При охлаждении до -210°С появляются кристаллы твёрдого азота похожие на снег или лёд.
И в виде жидкости, и в виде «снега» азот сохраняет свою инертность, поэтому его применяют для глубокого охлаждения или вымораживания различных веществ и биологических препаратов.
Слайд 5Химические свойства
Азот при обычных условиях химически инертен, поэтому все реакции протекают
при высоких температурах, давлении, а многие только в присутствии катализаторов. Ученые всего мира не одно столетие бились над вопросом, как получить связанный азот. Однако почти аномальная прочность молекулы азота долгое время обеспечивала его «неприступность».
Реакция азота с кислородом протекает при температуре электрической дуги (1200°С) с образованием оксида азота (II). Реакция с водородом протекает при температуре 450°С в присутствии катализатора – железа или платины. Реакции с металлами также идут при высокой температуре, при этом образуются нитриды. При комнатной температуре азот взаимодействует только с литием и кальцием.
Азот не взаимодействует с калием, серой, галогенами, золотом и платиной!
Реакция азота с кислородом протекает при температуре электрической дуги (1200°С) с образованием оксида азота (II). Реакция с водородом протекает при температуре 450°С в присутствии катализатора – железа или платины. Реакции с металлами также идут при высокой температуре, при этом образуются нитриды. При комнатной температуре азот взаимодействует только с литием и кальцием.
Азот не взаимодействует с калием, серой, галогенами, золотом и платиной!
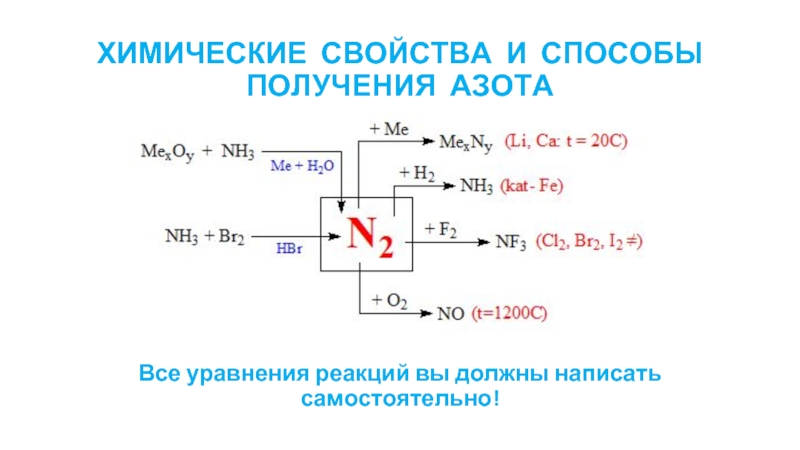
Слайд 6ХИМИЧЕСКИЕ СВОЙСТВА И СПОСОБЫ ПОЛУЧЕНИЯ АЗОТА
Все уравнения реакций вы должны написать
самостоятельно!
Слайд 7ПРИМЕНЕНИЕ АЗОТА
Области применения газообразного азота обусловлены его инертными свойствами. Газообразный азот
пожаро- и взрывобезопасен, препятствует окислению, гниению.
В нефтехимии азот применяется для продувки резервуаров и трубопроводов, в горнодобывающем деле азот может использоваться для создания в шахтах взрывобезопасной среды. В музеях, галереях, выставочных залах, архивах, библиотеках, хранилищах банков установки азотного пожаротушения позволяют не только быстро погасить пожар, но и максимально сохранить находящиеся в помещениях ценности.
Важной областью применения азота является его использование для дальнейшего синтеза самых разнообразных соединений: аммиака, азотных удобрений, взрывчатых веществ, красителей и т. п.
В пищевой промышленности азот зарегистрирован в качестве пищевой добавки E941, как газовая среда для упаковки и хранения пищевых продуктов, а жидкий азот применяется при розливе масел и негазированных напитков для создания инертной среды в мягкой таре.
В нефтехимии азот применяется для продувки резервуаров и трубопроводов, в горнодобывающем деле азот может использоваться для создания в шахтах взрывобезопасной среды. В музеях, галереях, выставочных залах, архивах, библиотеках, хранилищах банков установки азотного пожаротушения позволяют не только быстро погасить пожар, но и максимально сохранить находящиеся в помещениях ценности.
Важной областью применения азота является его использование для дальнейшего синтеза самых разнообразных соединений: аммиака, азотных удобрений, взрывчатых веществ, красителей и т. п.
В пищевой промышленности азот зарегистрирован в качестве пищевой добавки E941, как газовая среда для упаковки и хранения пищевых продуктов, а жидкий азот применяется при розливе масел и негазированных напитков для создания инертной среды в мягкой таре.
Слайд 8ДОМАШНЕЕ ЗАДАНИЕ
ЗНАТЬ:
- физические и химические свойства азота;
- области применения азота;
- историю открытия азота;
- что такое сосуд Дьюара.
УМЕТЬ записывать уравнения реакций, характеризующие химические свойства и способы получения азота.
СДЕЛАТЬ конспект презентации.
- историю открытия азота;
- что такое сосуд Дьюара.
УМЕТЬ записывать уравнения реакций, характеризующие химические свойства и способы получения азота.
СДЕЛАТЬ конспект презентации.