- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Амінокислоти. Класифікація та номенклатура презентация
Содержание
- 1. Амінокислоти. Класифікація та номенклатура
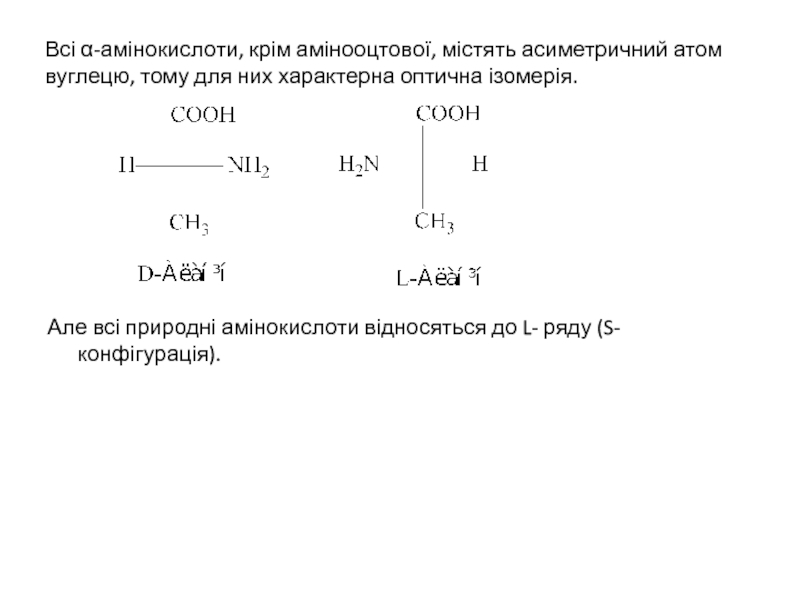
- 3. Всі α-амінокислоти, крім амінооцтової, містять асиметричний атом
- 4. МЕТОДИ ОДЕРЖАННЯ 1. Гідроліз білкових
- 5. 3. Синтез α-амінокислот за реакцією Штреккера-Зелінського
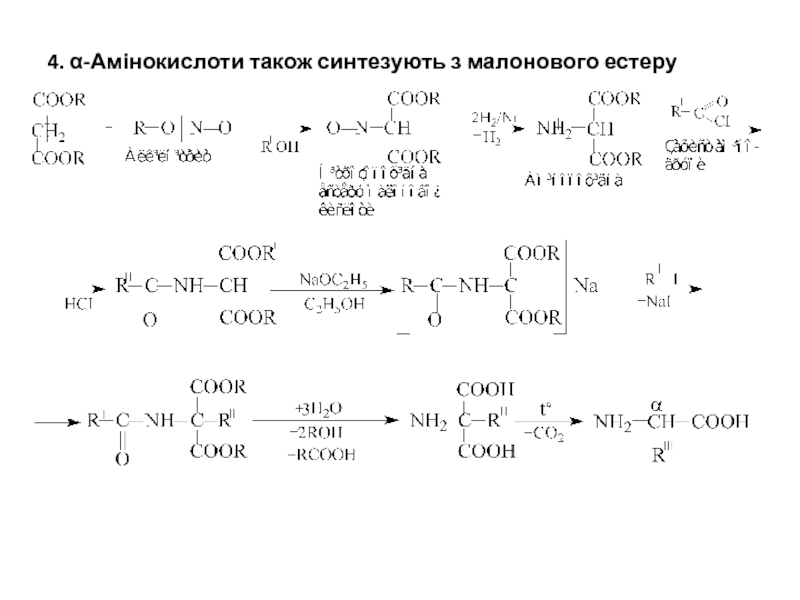
- 6. 4. α-Амінокислоти також синтезують з малонового естеру
- 7. 5. Приєднання аміаку до ненасичених кислот веде
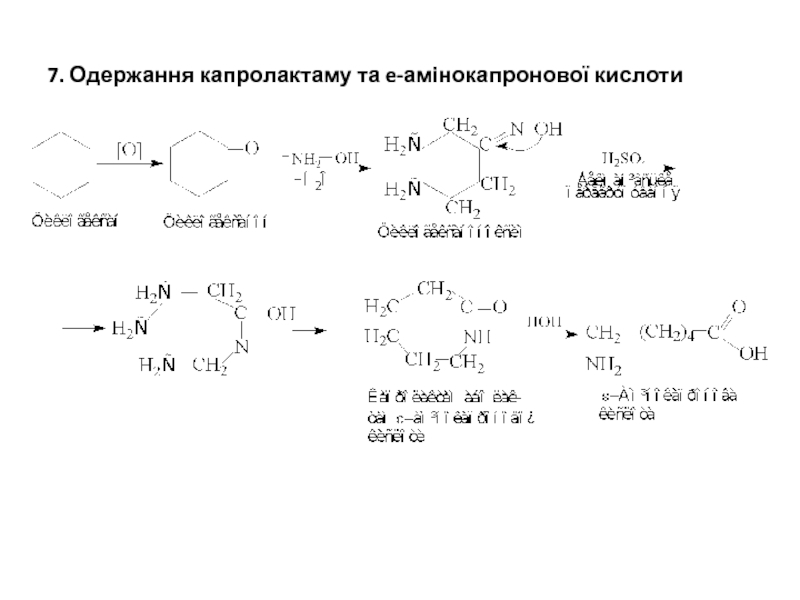
- 8. 7. Одержання капролактаму та e-амінокапронової кислоти
- 9. ФІЗИЧНІ ТА ХІМІЧНІ ВЛАСТИВОСТІ Амінокислоти є
- 10. У водних розчинах, залежно від рН середовища,
- 11. 1. Реакції аміногрупи Основна аміногрупа здатна
- 12. 1.3. Аміногрупа здатна ацилюватись з утворенням ациламінопохідних.
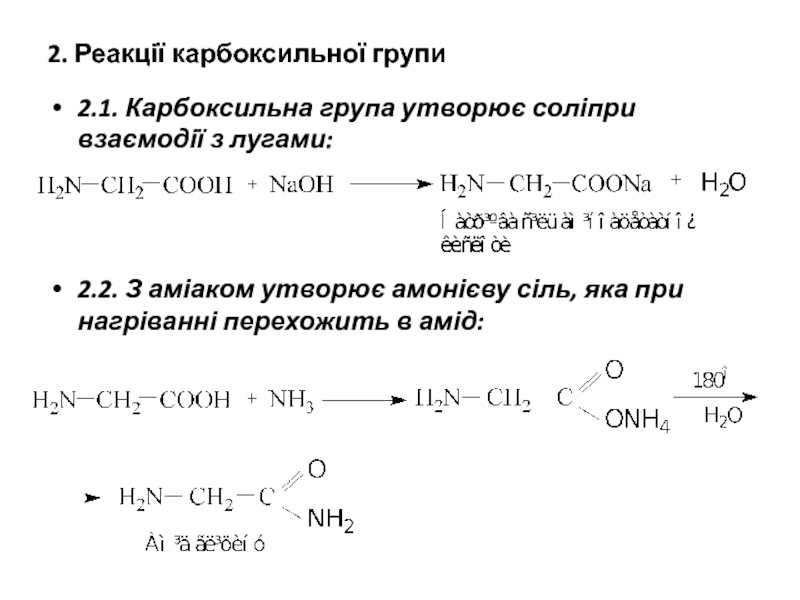
- 13. 2. Реакції карбоксильної групи 2.1. Карбоксильна
- 14. 2.3. При взаємодії зі спиртами в кислому
- 15. 3. Утворення комплексних солей з йонами важких
- 16. 4. Реакції, що дозволяють розрізняти α-, β-
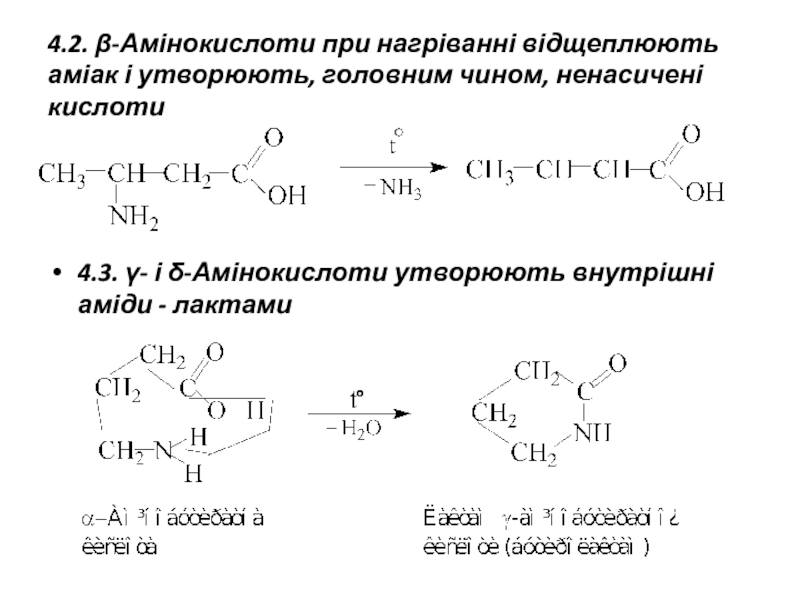
- 17. 4.2. β-Амінокислоти при нагріванні відщеплюють аміак і
- 19. 5. Утворення пептидних груп Карбоксильна група
- 20. Дипептид може взаємодіяти ще з однією молекулою
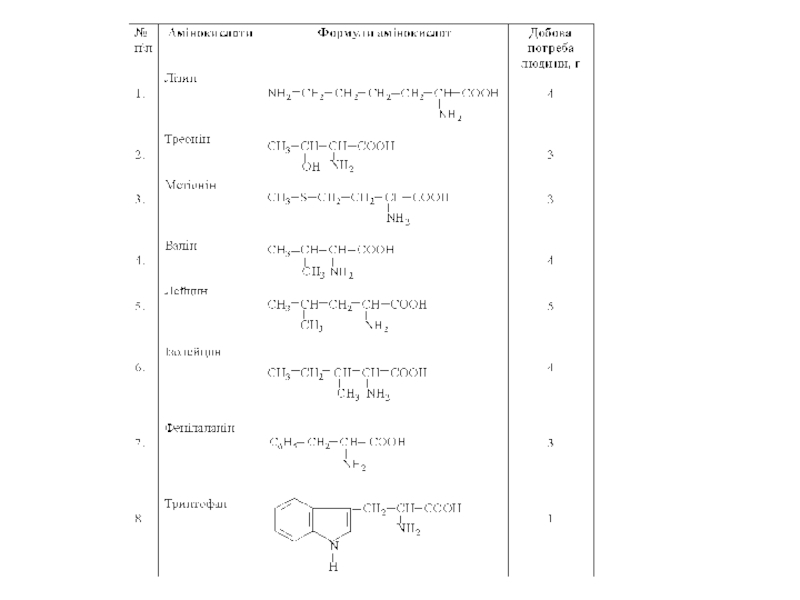
- 21. Окремі представники α-Амінокислоти є головним компонентом
- 23. Практичне значення має лактам ε-амінокапронової кислоти -
- 24. n-Амінобензоатна кислота являється вітаміном, що забезпечує нормальний
- 25. o-Амінобензойну (антранілову) кислоту одержують з фталіміду перегрупуванням
- 26. Комплексони. Комплексонами називають групу α-амінокислот, що містять
- 27. ПОЛІПЕПТИДИ ТА БІЛКИ Білки - складні
- 28. КЛАСИФІКАЦІЯ БІЛКІВ Білки діляться на
- 29. Протеїди класифікують залежно від природи небілкових складових.
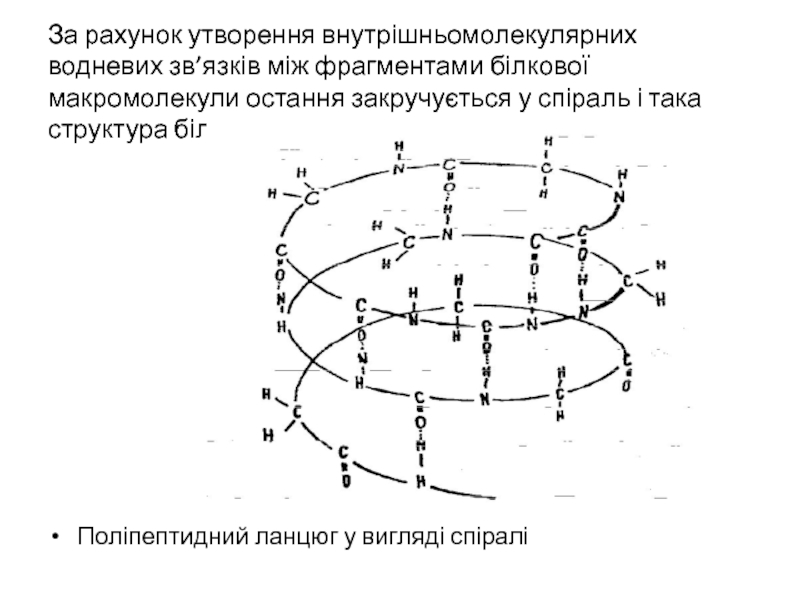
- 31. За рахунок утворення внутрішньомолекулярних водневих зв’язків між
- 32. Такі спіралі можуть згортатись в
- 34. Глобулярну третинну структуру має гемоглобін крові, більшість
- 35. Інколи для виконання тої чи іншої
- 36. СИНТЕЗ ПОЛІПЕПТИДІВ Синтез поліпептидів і балків
- 37. Захист аміно- або карбоксильних груп.
- 38. Якщо виникає потреба захисту —СООН-групи, то її
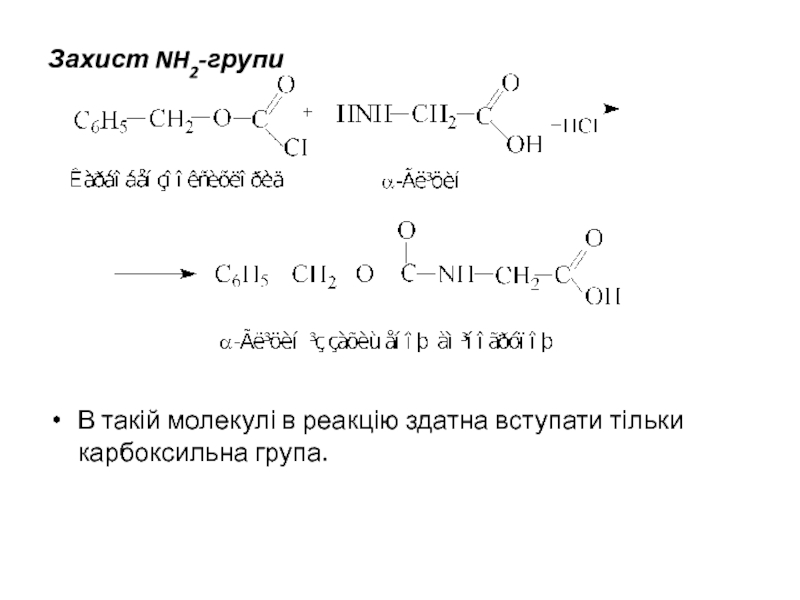
- 39. Захист NH2-групи
- 40. Для одержання гліцилаланіну треба сполучити цей захищений
- 41. У випадку використання ДЦГКДІ, останній взаємодіє з карбоксильною групою за сземою:
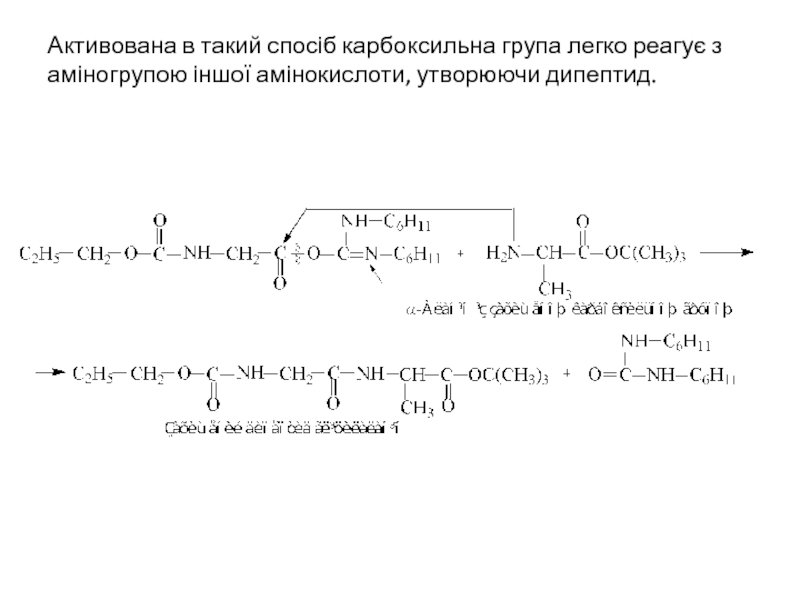
- 42. Активована в такий спосіб карбоксильна група легко
- 43. Відщеплення захищаючих груп Захист аміногрупи знімається
- 44. ЯКІСНІ РЕАКЦІЇ НА БІЛОК 1. Біуретова
- 45. 2. Ксантопротеїнова реакція - при взаємодії
Слайд 1АМІНОКИСЛОТИ
Сполуки, які містять одночасно аміногрупу NH2 та карбоксильну COOH, називаються
КЛАСИФІКАЦІЯ ТА НОМЕНКЛАТУРА
За взаємним розташуванням аміно- та карбоксильної груп амінокислоти поділяють на α, β, γ тощо, за аналогією до галогенозаміщених, гідрокси- та оксокислот.
За систематичною номенклатурою назви амінокислот утворюються з назв карбонових незаміщених кислот додаванням префіксу "аміно-", положення аміногрупи вказується локантом .
За радикало-функціональною номенклатурою назви утворюють за аналогією з назвами гідроксикислот.
Широко застосовують тривіальні назви.
Слайд 3Всі α-амінокислоти, крім амінооцтової, містять асиметричний атом вуглецю, тому для них
Але всі природні амінокислоти відносяться до L- ряду (S-конфігурація).
Слайд 4МЕТОДИ ОДЕРЖАННЯ
1. Гідроліз білкових речовин
Гідроліз білків у присутності кислот веде до
2. α-Амінокислоти синтезують з α-галогенозаміщених кислот
Слайд 53. Синтез α-амінокислот за реакцією Штреккера-Зелінського
Для утворення HCN та NH3
Слайд 75. Приєднання аміаку до ненасичених кислот веде до утворення β-амінокислот
Приєднання відбувається
6. Одержання β-амінокислот з малонової кислоти за В.М.Родіоновим
Слайд 9ФІЗИЧНІ ТА ХІМІЧНІ ВЛАСТИВОСТІ
Амінокислоти є безбарвними кристалічними речовинами, що розчиняються у
Амінокислоти містять одночасно основну (NH2) і кислотну (COOH) групи, тобто виявляють амфотерний характер. Крім того вони здатні утворювати внутрішні солі - біполярні або цвіттер-йони.
Слайд 10У водних розчинах, залежно від рН середовища, існує рівновага між цвіттер-йоном,
Значення рН розчину, при якому концентрація цвітер-йонів максимальна, називається ізоелектрочною точкою даної амінокислоти.
Амінокислоти володіють всіма властивостями, що притаманні аміносполукам та карбоновим кислотам.
Слайд 111. Реакції аміногрупи
Основна аміногрупа здатна утворювати солі з сильними кислотами.
1.2. При
Слайд 121.3. Аміногрупа здатна ацилюватись з утворенням ациламінопохідних. Цю реакцію інколи використовують
1.4. При реакції з нітритною кислотою утворюється гідроксикислота і виділяється азот.
Слайд 132. Реакції карбоксильної групи
2.1. Карбоксильна група утворює соліпри взаємодії з лугами:
2.2. З аміаком утворює амонієву сіль, яка при нагріванні перехожить в амід:
Слайд 142.3. При взаємодії зі спиртами в кислому середовищі утворюються естери:
Взаємний
Слайд 153. Утворення комплексних солей з йонами важких металів
У таких хелатах йон
Слайд 164. Реакції, що дозволяють розрізняти α-, β- і γ-амінокислоти
4.1. α-Амінокислоти при
Слайд 174.2. β-Амінокислоти при нагріванні відщеплюють аміак і утворюють, головним чином, ненасичені
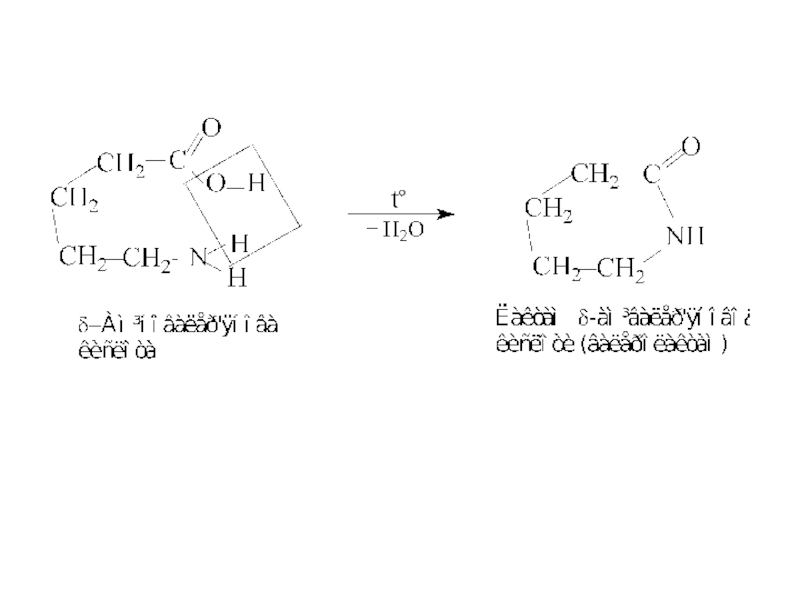
4.3. γ- і δ-Амінокислоти утворюють внутрішні аміди - лактами
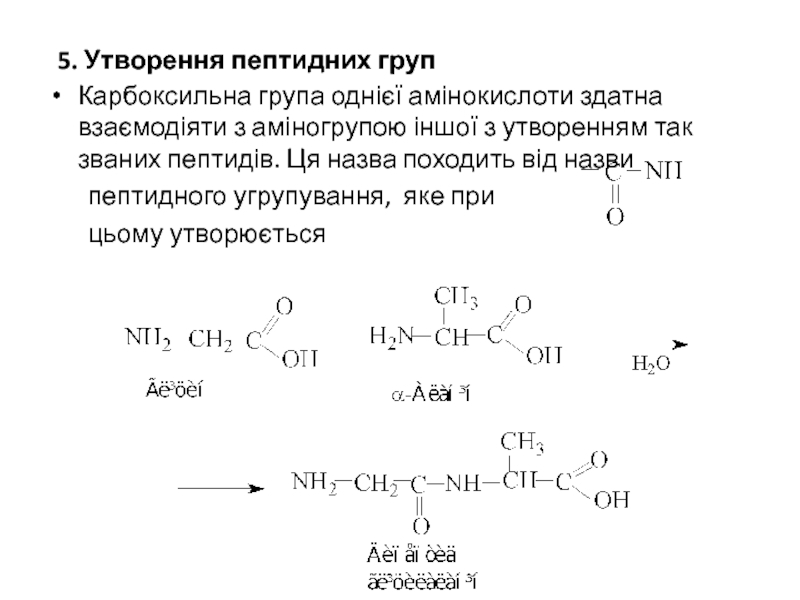
Слайд 195. Утворення пептидних груп
Карбоксильна група однієї амінокислоти здатна взаємодіяти з аміногрупою
пептидного угрупування, яке при
цьому утворюється
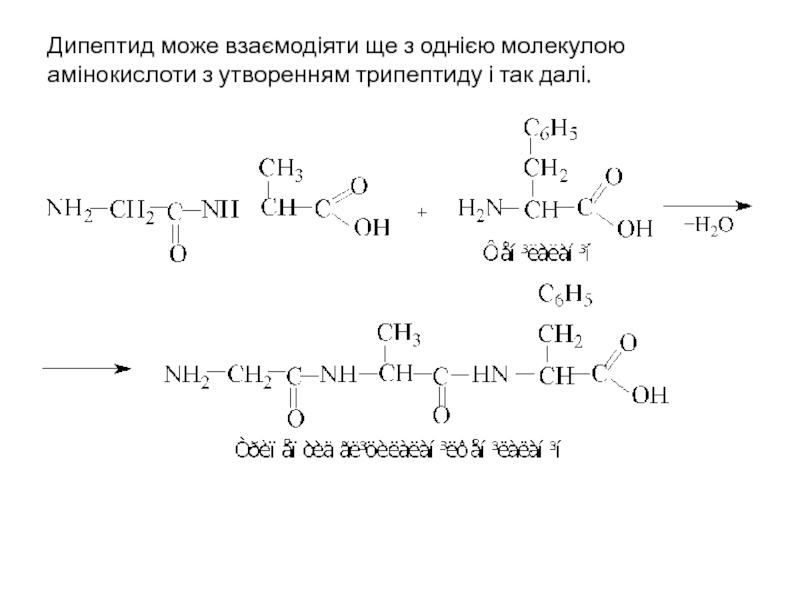
Слайд 20Дипептид може взаємодіяти ще з однією молекулою амінокислоти з утворенням трипептиду
Слайд 21Окремі представники
α-Амінокислоти є головним компонентом будови білків, у склад яких входить
Слайд 23Практичне значення має лактам ε-амінокапронової кислоти - капролактам, що застосовується для
Капрон також можна отримати реакцією поліконденсації ε-амінокапронової кислоти, аналогічно до процесу отримання найлону
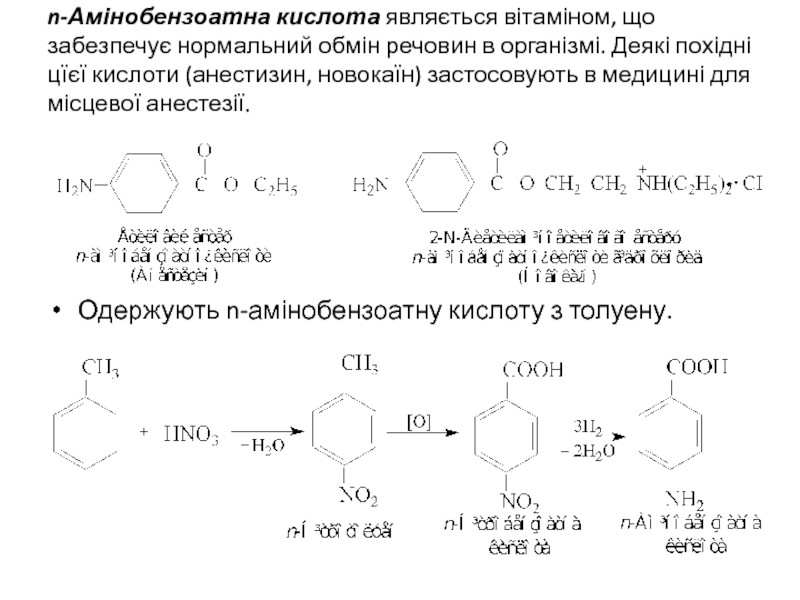
Слайд 24n-Амінобензоатна кислота являється вітаміном, що забезпечує нормальний обмін речовин в організмі.
Одержують n-амінобензоатну кислоту з толуену.
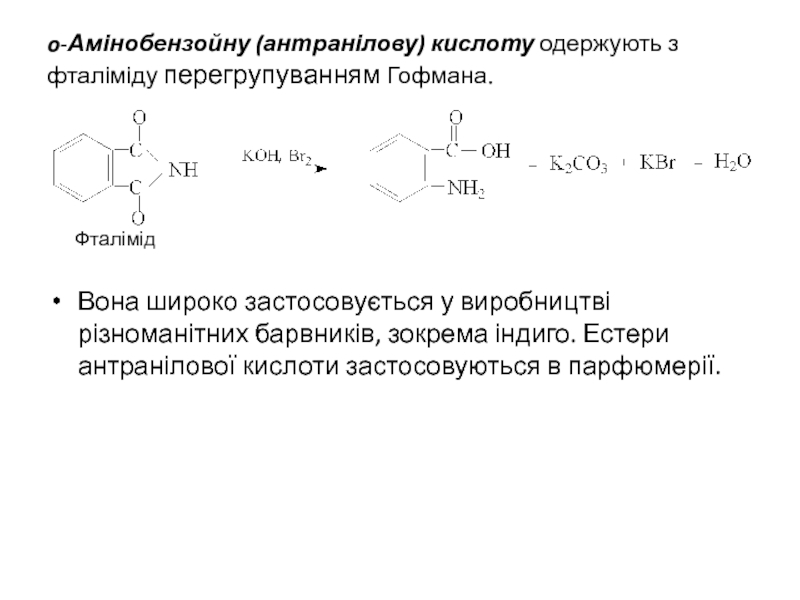
Слайд 25o-Амінобензойну (антранілову) кислоту одержують з фталіміду перегрупуванням Гофмана.
Фталімід
Вона
Слайд 26Комплексони.
Комплексонами називають групу α-амінокислот, що містять декілька фрагментів оцтової кислоти, зв’язаних
динатрієва сіль якої називається «Трилон Б».
«Трилон Б» широко використовується в технологічних процесах для «маскування» йонів металів в розчинах, а також в аналітичній хімії.
Слайд 27ПОЛІПЕПТИДИ ТА БІЛКИ
Білки - складні високомолекулярні сполуки біологічного походження, що побудовані
NHC(О) . За хімічною будовою – це поліпептиди.
Навіть найпростіші білки містять не менше 100 амінокислотних фрагментів. Речовини, що містять менше 100 ланок амінокислот, називаються поліпептидами. Поліпептиди, у свою чергу, бувають дипептиди, побудовані із залишків двох амінокислот, трипептиди, які складаються із залишків трьох амінокислот тощо. Таким чином ускладнення структури при переході від амінокислот до білків можна подати схемою:
амінокислота → дипептид → поліпептид → білок.
Слайд 28КЛАСИФІКАЦІЯ БІЛКІВ
Білки діляться на протеїни (прості) і протеїди (складні). Протеїни складаються
Протеїни поділяються залежно від розчинності на:
1. Альбуміни 4. Протаміни
2. Глобуліни 5. Гістони
3. Проламіни 6. Склеропротеїни
Слайд 29Протеїди класифікують залежно від природи небілкових складових. Відомі такі класи:
1. Нуклеопротеїди
2. Фосфорпротеїди - містять фрагменти фосфатних кислот
3. Глікопротеїди - містять фрагменти вуглеводів
4. Хромопротеїди - містять фрагменти барвників
У білковій макромолекулі можна виділити чотири рівні її організації.
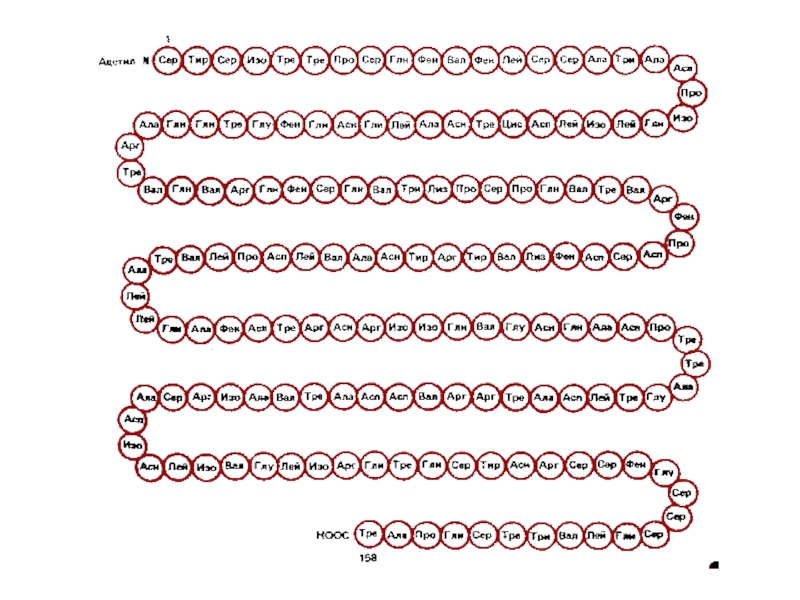
Унікальна послідовність амінокислотних залишків у поліпептидному ланцюзі називається первинною структурою білка. Її унікальність пролягає в тому, що вона є специфічною для кожного білка.
Слайд 31За рахунок утворення внутрішньомолекулярних водневих зв’язків між фрагментами білкової макромолекули остання
Поліпептидний ланцюг у вигляді спіралі
Слайд 32
Такі спіралі можуть згортатись в клубок (глобулу), або розтягуватись в ниткоподібні
а) Третинна
б) Четвертинна структури
білка
Слайд 34Глобулярну третинну структуру має гемоглобін крові, більшість ферментів. Фібрилярна третинна структура
Слайд 35
Інколи для виконання тої чи іншої біологічної функції необхідне об’єднання двох
При нагріванні білка або під дією деяких речовин (формальдегіду, фенолу, кислот, лугів) відбувається руйнуваня вторинної, третинної та четвертинної структури білка. Такий процес називається денатурацією білка. При цьому хімічний склад білка не змінюється, але він незворотньо втрачає свої біологічні функції.
Слайд 36СИНТЕЗ ПОЛІПЕПТИДІВ
Синтез поліпептидів і балків з амінокислот є складним завданням, але
Слайд 37Захист аміно- або карбоксильних груп.
Для захисту NH2-групи застосовують:
Карбобензоксигрупу,
яка вводиться за
Трифенілметильну групу (С6Н5)3С—, яка вводиться за
допомогою трифенілхлорометану (С6Н5)3С—СІ.
Трифторацетильну групу CF3C(O), яка вводиться за допомогою трифтороцтового ангідриду CF3C(O)OC(O)CF3
Слайд 38Якщо виникає потреба захисту —СООН-групи, то її переводять у трет-бутиловий естер
Наведемо модельну схему синтезу дипептиду - гліцилаланіну з α-гліцину та α-аланіну.
Слайд 40Для одержання гліцилаланіну треба сполучити цей захищений гліцин з аланіном, у
В цьому випадку карбоксильна група гліцину має можливість провзаємодіяти лише з незахищеною аміногрупою аланіну.
Утворення дипептиду. Для протікання реакції за мяких умов карбоксильну группу гліцину додатково активують. Для цього часто використовують дициклогексилкарбодіімід (ДЦГКДІ) або трифтороцтовий ангідрид, який утворює з карбоксильною групою змішаний ангідрид.
Слайд 42Активована в такий спосіб карбоксильна група легко реагує з аміногрупою іншої
Слайд 43Відщеплення захищаючих груп
Захист аміногрупи знімається шляхом гідрування на нікелевому каталізаторі або
Гліцилаланін
Вказану послідовність реакцій можна повторювати далі до утворення трипептиду, тетрапептиду тощо.
Слайд 44ЯКІСНІ РЕАКЦІЇ НА БІЛОК
1. Біуретова реакція - біурет з солями Си(ІІ)
Всі білки містять у своїй структурі пептидні угрупування, які є фрагментами біурету і, подібно до нього, також утворюють синьо-фіолетовий хелатний комплекс з йонами Cu2+.
Слайд 45
2. Ксантопротеїнова реакція - при взаємодії з нітратною кислотою (конц.) білки
3. Реакція Мілона - при взаємодії білків з розчином HgNO3 в нітратній кислоті з’являється червоне забарвлення
4. Дія солей свинцю. При нагріванні білків з лугом у присутності солей Pb (ІІ) випадає чорний осад PbS.