- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Аммиак. Физические и химические свойства аммиака презентация
Содержание
- 1. Аммиак. Физические и химические свойства аммиака
- 2. Строение молекулы Молекула аммиака имеет форму правильного
- 3. Физические свойства Аммиак при нормальных условиях —
- 4. ХИМИЧЕСКИЕ СВОЙСТВА Аммиак очень «общительный», взаимодействует со
- 5. Способы получения Способов получения аммиака достаточно много,
- 6. КАЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ АММИАКА То, что в
- 8. ПРИМЕНЕНИЕ АММИАКА Важнейшее применение аммиака – это
- 9. ТРИВИАЛЬНЫЕ НАЗВАНИЯ Индийская селитра
- 10. ДОМАШНЕЕ ЗАДАНИЕ ЗНАТЬ: - строение,
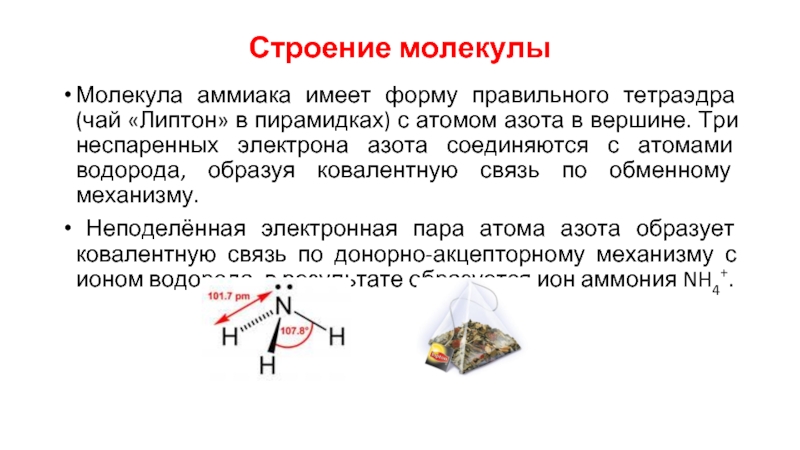
Слайд 2Строение молекулы
Молекула аммиака имеет форму правильного тетраэдра (чай «Липтон» в пирамидках)
с атомом азота в вершине. Три неспаренных электрона азота соединяются с атомами водорода, образуя ковалентную связь по обменному механизму.
Неподелённая электронная пара атома азота образует ковалентную связь по донорно-акцепторному механизму с ионом водорода, в результате образуется ион аммония NH4+.
Неподелённая электронная пара атома азота образует ковалентную связь по донорно-акцепторному механизму с ионом водорода, в результате образуется ион аммония NH4+.
Слайд 3Физические свойства
Аммиак при нормальных условиях — бесцветный газ с резким характерным
запахом (запах нашатырного спирта), почти вдвое легче воздуха, ядовит.
Пары аммиака вызывают обильное слезотечение, химический ожог роговицы глаза и, как следствие, потерю зрения, приступы кашля, покраснение и зуд кожи.
Сжижается при температуре -35°С.
Молекула аммиака обладает высокой полярностью, что приводит к хорошей растворимости аммиака в воде (в 1л воды при комнатной температуре растворяется 700л аммиака!). Поэтому при получении аммиака нельзя использовать воду!
Пары аммиака вызывают обильное слезотечение, химический ожог роговицы глаза и, как следствие, потерю зрения, приступы кашля, покраснение и зуд кожи.
Сжижается при температуре -35°С.
Молекула аммиака обладает высокой полярностью, что приводит к хорошей растворимости аммиака в воде (в 1л воды при комнатной температуре растворяется 700л аммиака!). Поэтому при получении аммиака нельзя использовать воду!
Слайд 4ХИМИЧЕСКИЕ СВОЙСТВА
Аммиак очень «общительный», взаимодействует со многими веществами.
Восстанавливает металлы из
их оксидов.
При взаимодействии с кислотами образует соли аммония NH4+. Я привела только один пример с азотной кислотой, а вы приведите другие примеры!
При растворении в воде образует нашатырный спирт NH4OH.
При взаимодействии с галогенами образуется молекулярный азот и галогеноводород (способ получения азота).
Аммиак легко сгорает в кислороде, образуя молекулярный азот и воду. Но если эту реакцию проводить в присутствии катализатора – платины, то образуется оксид азота (II) и вода.
Взаимодействие аммиака с пероксидом водорода приводит к образованию молекулярного азота и воды.
При взаимодействии с кислотами образует соли аммония NH4+. Я привела только один пример с азотной кислотой, а вы приведите другие примеры!
При растворении в воде образует нашатырный спирт NH4OH.
При взаимодействии с галогенами образуется молекулярный азот и галогеноводород (способ получения азота).
Аммиак легко сгорает в кислороде, образуя молекулярный азот и воду. Но если эту реакцию проводить в присутствии катализатора – платины, то образуется оксид азота (II) и вода.
Взаимодействие аммиака с пероксидом водорода приводит к образованию молекулярного азота и воды.
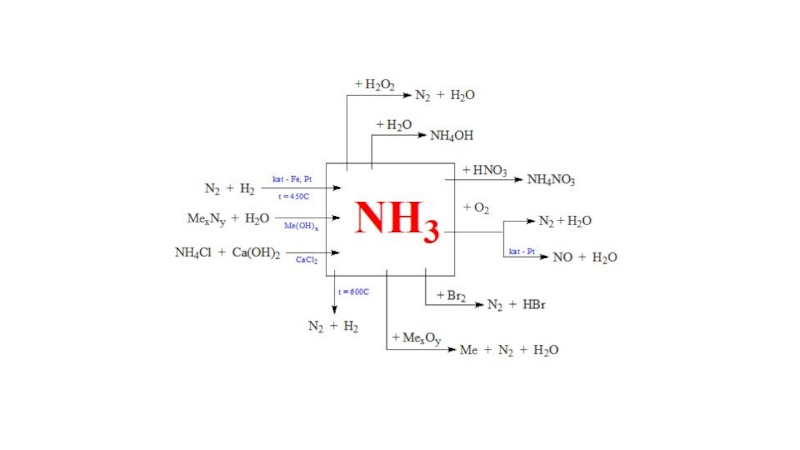
Слайд 5Способы получения
Способов получения аммиака достаточно много, рассмотрим только некоторые из них.
Прямой
синтез из водорода и азота протекает при температуре 400-450°С в присутствии катализатора – железа или платины. В промышленности используется железа, как более дешёвое.
Лабораторный способ получения аммиака – взаимодействие кристаллического хлорида аммония с кристаллическим гидроксидом кальция при нагревании.
Получить аммиак можно при растворении нитридов металлов в воде. Кроме аммиака в этом случае образуется ещё и гидроксид металла. Приведите свой пример!
Лабораторный способ получения аммиака – взаимодействие кристаллического хлорида аммония с кристаллическим гидроксидом кальция при нагревании.
Получить аммиак можно при растворении нитридов металлов в воде. Кроме аммиака в этом случае образуется ещё и гидроксид металла. Приведите свой пример!
Слайд 6КАЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ АММИАКА
То, что в ходе реакции выделяется аммиак, можно определить
двумя способами.
Первый: необходимо поднести к пробирке влажную лакмусовую бумажку. Выделяющийся аммиак будет реагировать с водой на поверхности бумажки, образуя гидроксид аммония. Бумажка посинеет, т.к. почувствует щелочную среду.
Второй: к пробирке надо поднести стеклянную палочку, смоченную концентрированной соляной (азотной, серной) кислотой, появится белый дым – это кристаллы хлорида аммония (нитрат аммония, сульфат аммония).
Первый: необходимо поднести к пробирке влажную лакмусовую бумажку. Выделяющийся аммиак будет реагировать с водой на поверхности бумажки, образуя гидроксид аммония. Бумажка посинеет, т.к. почувствует щелочную среду.
Второй: к пробирке надо поднести стеклянную палочку, смоченную концентрированной соляной (азотной, серной) кислотой, появится белый дым – это кристаллы хлорида аммония (нитрат аммония, сульфат аммония).
Слайд 8ПРИМЕНЕНИЕ АММИАКА
Важнейшее применение аммиака – это сырьё для производства азотной кислоты.
Непосредственно из аммиака получают соли аммония, которые являются минеральными удобрениями (нитрат и сульфат аммония, мочевина), взрывчатые вещества, полимеры и др.
Жидкий аммиак используют в качестве растворителя.
В холодильной технике аммиак используется как хладагент.
В медицине применяется раствор аммиака в воде, который известен как нашатырный спирт. Резкий запах нашатырного спирта помогает привести в чувство находящегося в обмороке человека.
Слайд 9ТРИВИАЛЬНЫЕ НАЗВАНИЯ
Индийская селитра КNO3
Чилийская селитра NaNO3
Аммиачная
вода (нашатырный спирт) – водный раствор NH3 (NH4OH)
Нашатырь – NH4Cl
Нашатырь – NH4Cl
Слайд 10ДОМАШНЕЕ ЗАДАНИЕ
ЗНАТЬ:
- строение, физические и химические свойства аммиака;
- качественное определение аммиака;
- области применения аммиака.
УМЕТЬ записывать уравнения реакций, характеризующих химические свойства и способы получения аммиака.
СДЕЛАТЬ конспект презентации.
- области применения аммиака.
УМЕТЬ записывать уравнения реакций, характеризующих химические свойства и способы получения аммиака.
СДЕЛАТЬ конспект презентации.