- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Физико-химия поверхностных явлений презентация
Содержание
- 1. Физико-химия поверхностных явлений
- 2. * Поверхностные явления (ПЯ) –
- 3. * Поверхности раздела подвижные ж-г, ж-ж
- 4. * Удельная поверхность Sуд
- 5. *
- 6. * Для молекул внутри жидкости равнодействующая
- 7. * Свободная поверхностная энергия GS –
- 8. * Поверхностное натяжение σ
- 9. * Капли воды на гидрофобной поверхности
- 10. * σ биологических жидкостей
- 11. * Недостаток сурфактанта в легких –
- 12. * Поверхностная активность g – это
- 13. * По способности изменять поверхностное
- 14. * 1. Поверхностно-активные вещества (ПАВ) (σр-ра<
- 15. * 2. Поверхностно-инактивные вещества (ПИВ) (σр-ра>
- 16. * 3. Поверхностно неактивные вещества (ПНВ)
- 17. * Изотерма поверхностного натяжения – это
- 18. * В состав организмов входит множество
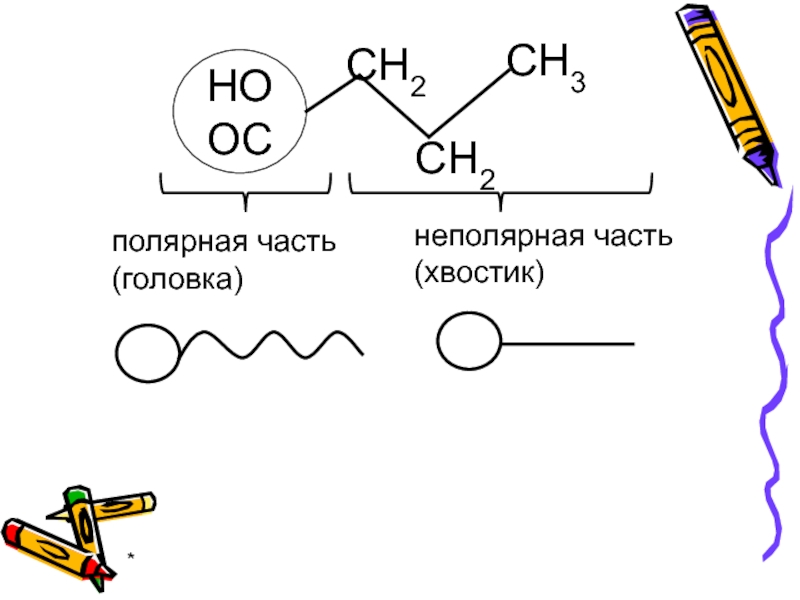
- 19. * ПАВ - дифильны полярная часть (головка) неполярная часть (хвостик)
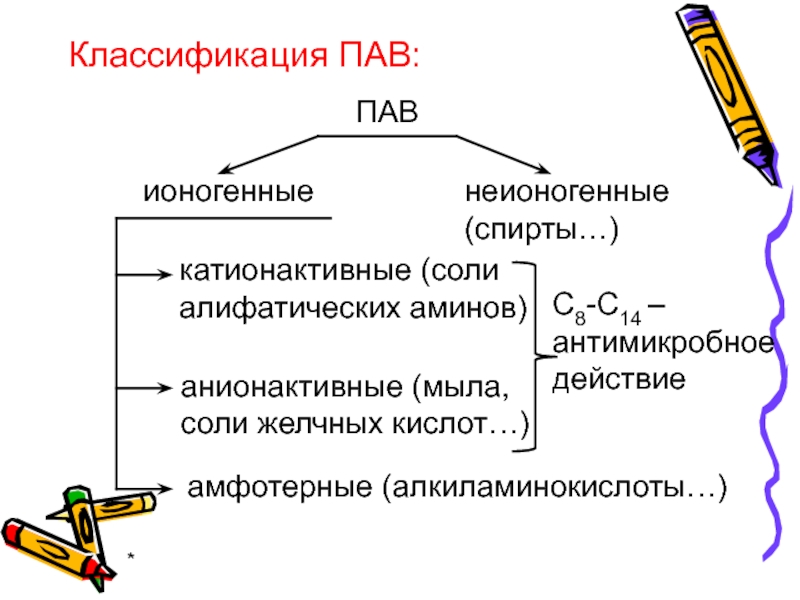
- 20. * Классификация ПАВ: ПАВ ионогенные неионогенные
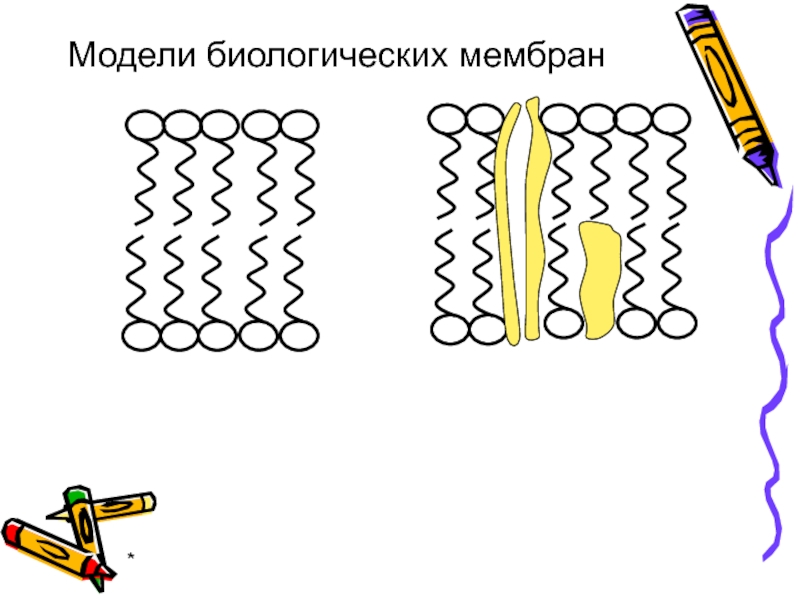
- 21. * Модели биологических мембран
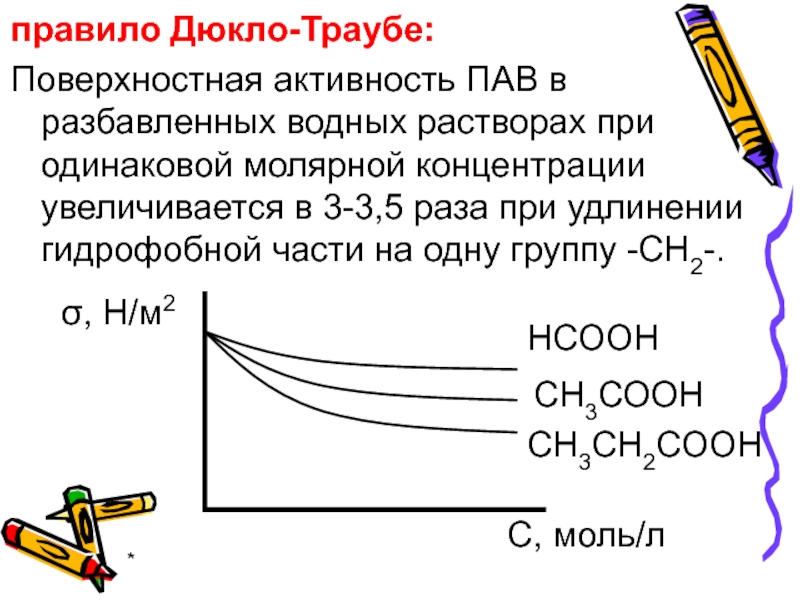
- 22. * правило Дюкло-Траубе: Поверхностная активность ПАВ
- 23. * ПЯ: физическая сорбция: абсорбция, адсорбция, десорбция, капиллярная конденсация хемосорбция
- 24. * Сорбция – поглощение газов, паров
- 25. * Капилярная конденсация – процесс сжижения
- 26. * Метод хемосорбции используется для создания
- 27. *
- 28. * Адсорбция молекул на твердых адсорбентах
- 29. * гидрофильные адсорбенты
- 30. * Влияние природы поглощаемого вещества
- 31. * правило Ребиндера (правило выравнивания полярностей
- 32. * С повышением температуры
- 33. * Изотерма адсорбции Гиббса
- 34. * При адсорбции ПАВ полярный фрагмент
- 35. * силикагель бензол полярная фаза неполярная фаза вода активированный уголь
- 36. * Ионная адсорбция - адсорбция ионов
- 37. * Особенности ионной адсорбции: на границе
- 38. * адсорбируемость иона увеличивается
- 39. * Правило Панета-Фаянса:
- 40. * При добавлении к раствору AgNO3
- 41. * Ионообменная адсорбция (ИА) - процесс
- 42. * H+ H+ H+ H+
- 43. * Иониты = аниониты + катиониты
- 44. * ИА используется для очистки
Слайд 2*
Поверхностные явления (ПЯ) – это особенности поведения веществ, которые наблюдаются
на поверхности раздела фаз, и обусловленные особенностями состава и строения поверхностного слоя.
Слайд 3*
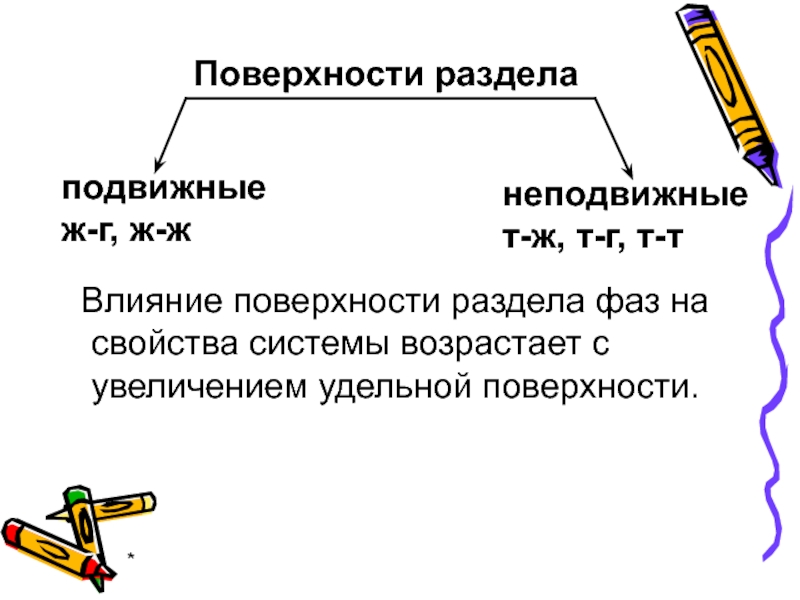
Поверхности раздела
подвижные
ж-г, ж-ж
неподвижные
т-ж, т-г, т-т
Влияние поверхности раздела фаз на свойства
системы возрастает с увеличением удельной поверхности.
Слайд 4*
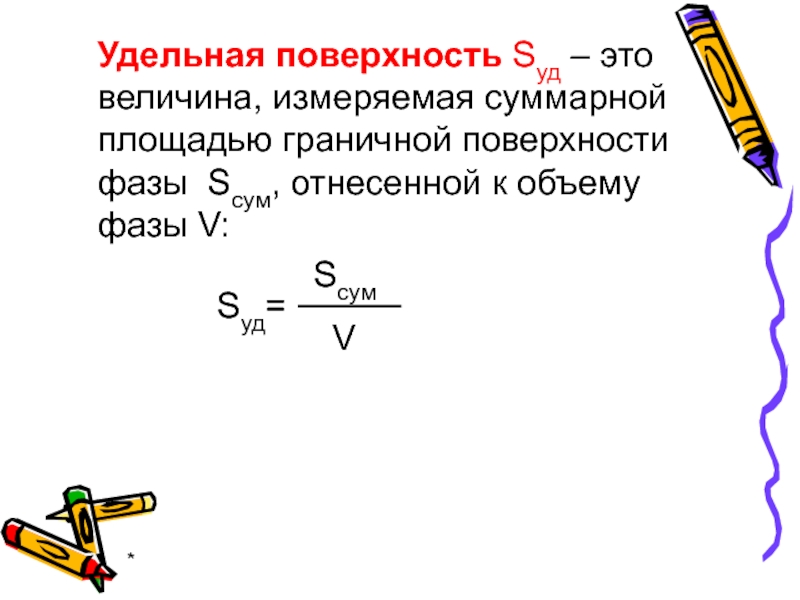
Удельная поверхность Sуд – это величина, измеряемая суммарной площадью
граничной поверхности фазы Scум, отнесенной к объему фазы V:
Sуд=
V
Sсум
Слайд 6*
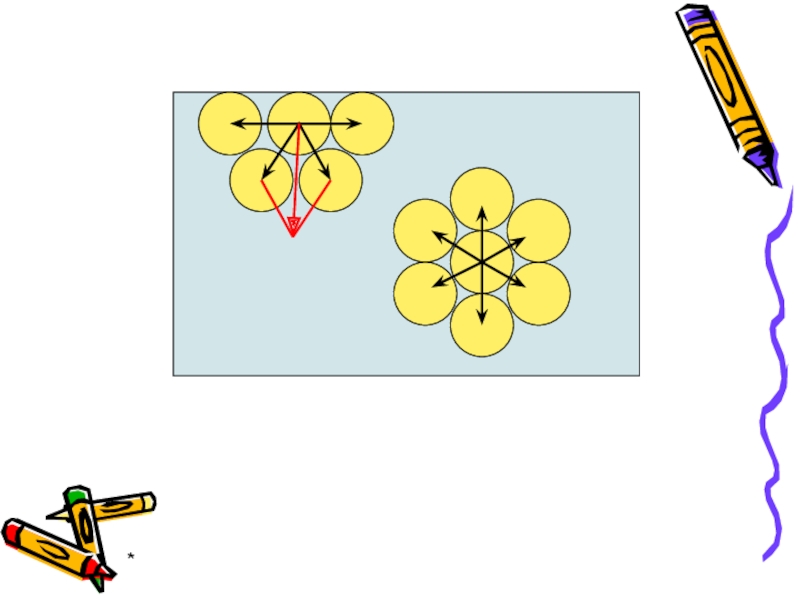
Для молекул внутри жидкости равнодействующая всех сил = нулю. Для молекул
на границе раздела фаз равнодействующая всех сил ≠ 0 и направлена вглубь жидкой фазы.
Отличия в энергетическом состоянии молекул поверхностного слоя характеризуются свободной поверхностной энергией.
Отличия в энергетическом состоянии молекул поверхностного слоя характеризуются свободной поверхностной энергией.
Слайд 7*
Свободная поверхностная энергия GS – термодинамическая функция, характеризующая энергию межмолекулярного взаимодействия
частиц на поверхности раздела фаз с частицами каждой из контактирующих фаз.
GS=σ·S
S – площадь раздела фаз,
σ – поверхностное натяжение
GS=σ·S
S – площадь раздела фаз,
σ – поверхностное натяжение
Слайд 8*
Поверхностное натяжение σ - это величина, численно равная работе,
которую необходимо совершить для образования единицы поверхности раздела фаз (Т=const)
- это сила, стремящаяся сократить свободную поверхность тела до наименьших возможных пределов
- это сила, стремящаяся сократить свободную поверхность тела до наименьших возможных пределов
Слайд 10*
σ биологических жидкостей используют в диагностике.
σ
плазмы крови различно при различных заболеваниях. С возрастом σ сыворотки крови уменьшается. σ играет значительную роль в процессе деления клеток, фагоцитозе, пиноцитозе, изменении проницаемости клеточных мембран и др.
Слайд 11*
Недостаток сурфактанта в легких – причина гибели недоношенных детей
(cурфактанты легких –
это фосфолипидно-белковые комплексы, которые выстилают поверхности альвеол, понижая σ и препятствуя спадению стенок альвеол при выдохе).
Слайд 12*
Поверхностная активность g – это способность растворенного вещества изменять поверхностное натяжение:
∆σ - изменение поверхностного натяжения при изменении концентраций ∆С.
g = -
∆σ
∆C
Слайд 13*
По способности изменять поверхностное натяжение растворов по сравнению с чистым
растворителем все вещества делятся на три типа:
Слайд 14*
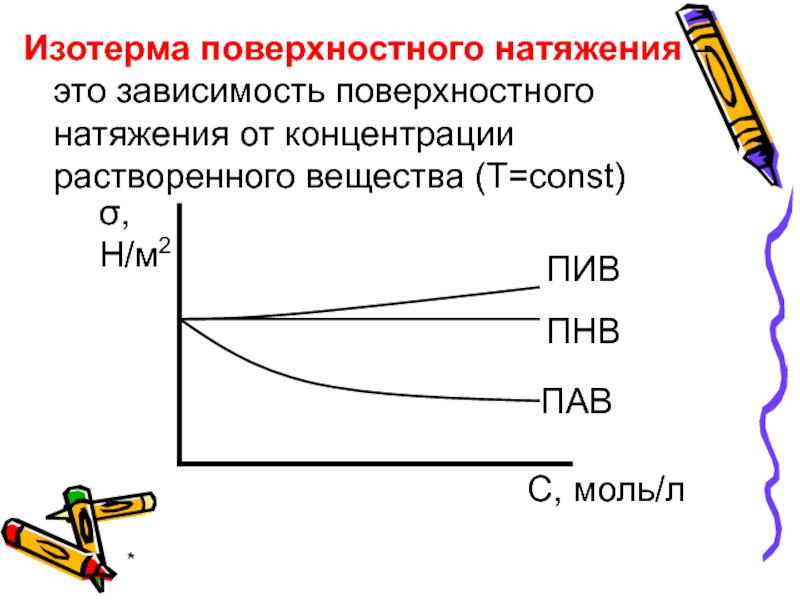
1. Поверхностно-активные вещества (ПАВ) (σр-ра< σ0), концентрация растворенных веществ в поверхностном
слое больше, чем в объеме раствора (спирты, кислоты алифатического ряда, сложные эфиры, белки);
Слайд 15*
2. Поверхностно-инактивные вещества (ПИВ) (σр-ра> σ0), концентрация растворенных веществ в поверхностном
слое меньше, чем в объеме раствора (неорганические кислоты, основания и соли, некоторые органические соединения, такие как глицерин, α-аминокислоты и др.);
Слайд 16*
3. Поверхностно неактивные вещества (ПНВ) практически не изменяют поверхностного натяжения растворителя
(σр-ра= σ0) (сахароза, и др.)
Слайд 17*
Изотерма поверхностного натяжения – это зависимость поверхностного натяжения от концентрации растворенного
вещества (Т=const)
σ,
H/м2
Слайд 18*
В состав организмов входит множество ПАВ: соли жирных кислот, желчные кислоты
и их соли, фосфолипиды…
Слайд 20*
Классификация ПАВ:
ПАВ
ионогенные
неионогенные
(спирты…)
катионактивные (соли
алифатических аминов)
анионактивные (мыла,
соли желчных кислот…)
амфотерные (алкиламинокислоты…)
С8-С14 –
антимикробное
действие
Слайд 22*
правило Дюкло-Траубе:
Поверхностная активность ПАВ в разбавленных водных растворах при одинаковой молярной
концентрации увеличивается в 3-3,5 раза при удлинении гидрофобной части на одну группу -СН2-.
Слайд 23*
ПЯ:
физическая сорбция: абсорбция, адсорбция, десорбция, капиллярная конденсация
хемосорбция
Слайд 24*
Сорбция – поглощение газов, паров или растворенных веществ (сорбатов) твердым телом
или жидкостью (сорбентом)
Абсорбция – поглощение сорбата всем объемом сорбента (поглощение аммиака водой)
Адсорбция – поглощение сорбата поверхностью сорбента (поглощение газов активированным углем)
Абсорбция – поглощение сорбата всем объемом сорбента (поглощение аммиака водой)
Адсорбция – поглощение сорбата поверхностью сорбента (поглощение газов активированным углем)
Слайд 25*
Капилярная конденсация – процесс сжижения пара в порах твердого сорбента при
снижении Т ниже критической для этого пара.
Хемосорбция – сорбция с образованием химических связей.
Десорбция – процесс обратный сорбции
Хемосорбция – сорбция с образованием химических связей.
Десорбция – процесс обратный сорбции
Слайд 26*
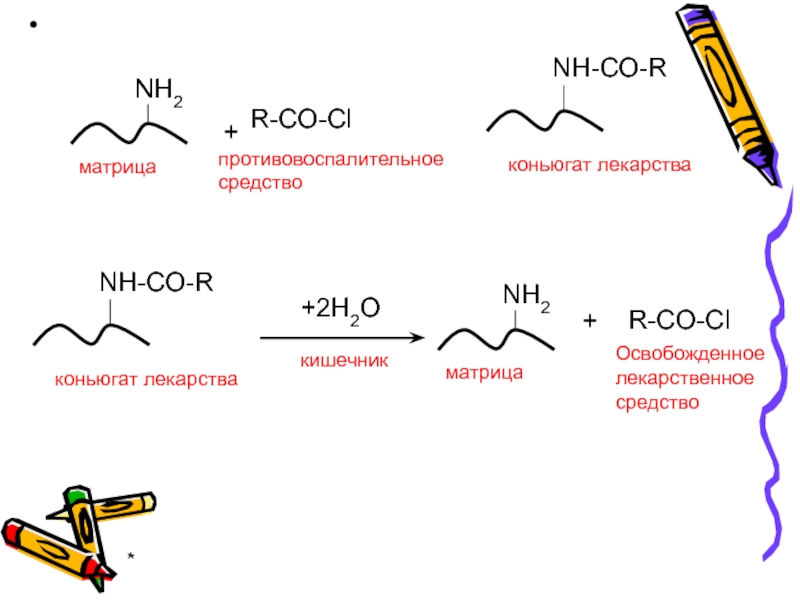
Метод хемосорбции используется для создания лекарственных форм с замедленным высвобождением активного
вещества (обеспечивает равномерное высвобождение лекарственного вещества, позволяет уменьшить число приёмов лекарства).
Слайд 28*
Адсорбция молекул на твердых адсорбентах зависит от:
природы адсорбента,
природы растворителя,
природы поглощаемого
вещества,
концентрации раствора,
температуры.
концентрации раствора,
температуры.
Слайд 29*
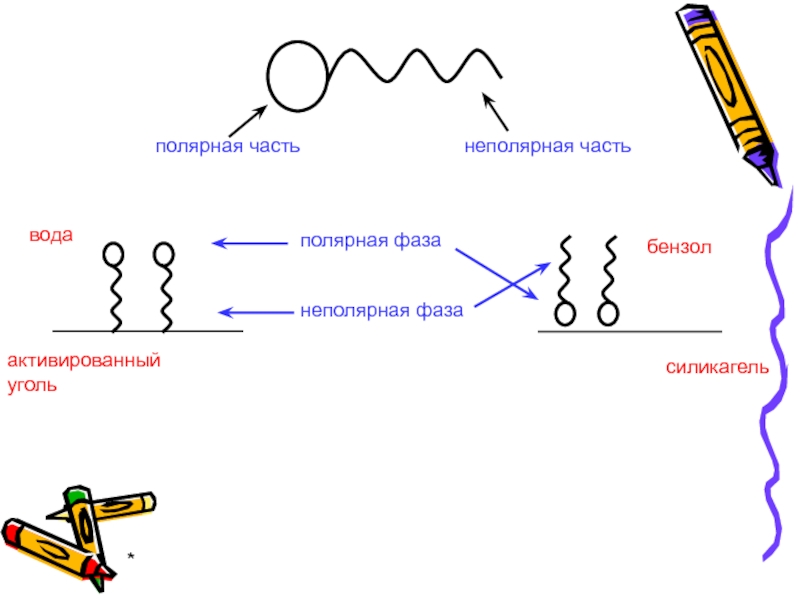
гидрофильные адсорбенты (силикагель, глины, пористые стекла) поглощают полярные
вещества
гидрофобные адсорбенты (сажа, активированный уголь) поглощают неполярные вещества
гидрофобные адсорбенты (сажа, активированный уголь) поглощают неполярные вещества
Слайд 30*
Влияние природы поглощаемого вещества определяется правилами:
«подобное взаимодействует с подобным»,
правило Шилова: чем больше растворимость вещества в данном растворителе, тем хуже оно адсорбируется на поверхности твердого адсорбента.
Слайд 31*
правило Ребиндера (правило выравнивания полярностей контактирующих фаз): на полярных адсорбентах лучше
адсорбируются полярные адсорбаты из малополярных растворителей; на неполярных адсорбентах – неполярные адсорбаты из полярных растворителей.
Слайд 32*
С повышением температуры адсорбция уменьшается.
Влияние концентрации растворенного
вещества на процесс адсорбции из раствора при Т=const описывается уравнениями изотермы адсорбции:
Слайд 33*
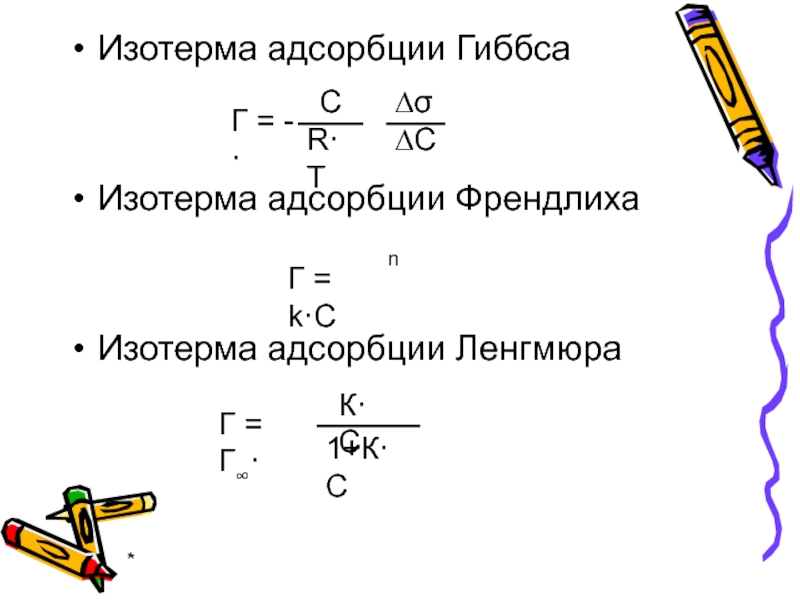
Изотерма адсорбции Гиббса
Изотерма адсорбции Френдлиха
Изотерма адсорбции Ленгмюра
Γ = Г∞·
К·С
1+К·С
Слайд 34*
При адсорбции ПАВ полярный фрагмент всегда обращен к полярной (гидрофильной) фазе
– к воде, силикагелю, а неполярный фрагмент – к неполярной (гидрофобной) фазе – активированному углю, маслу.
Слайд 36*
Ионная адсорбция - адсорбция ионов из растворов электролитов на полярных адсорбентах.
Ионнообменная + избирательная
Слайд 37*
Особенности ионной адсорбции:
на границе раздела фаз возникает ДЭС;
скорость ионной адсорбции
скорости молекулярной адсорбции;
ионная адсорбция не всегда обратима (хемосорбция);
ионная адсорбция не всегда обратима (хемосорбция);
Слайд 38*
адсорбируемость иона увеличивается с увеличением радиуса негидратированного иона и
увеличением абсолютной величины заряда иона (исключение катион водорода);
ионная адсорбция подчиняется правилу Панета-Фаянса.
ионная адсорбция подчиняется правилу Панета-Фаянса.
Слайд 39*
Правило Панета-Фаянса:
на поверхности кристалла преимущественно адсорбируются те ионы,
которые входят в состав кристаллической решетки адсорбента или изоморфны им по строению и могут достроить кристаллическую решетку.
Слайд 40*
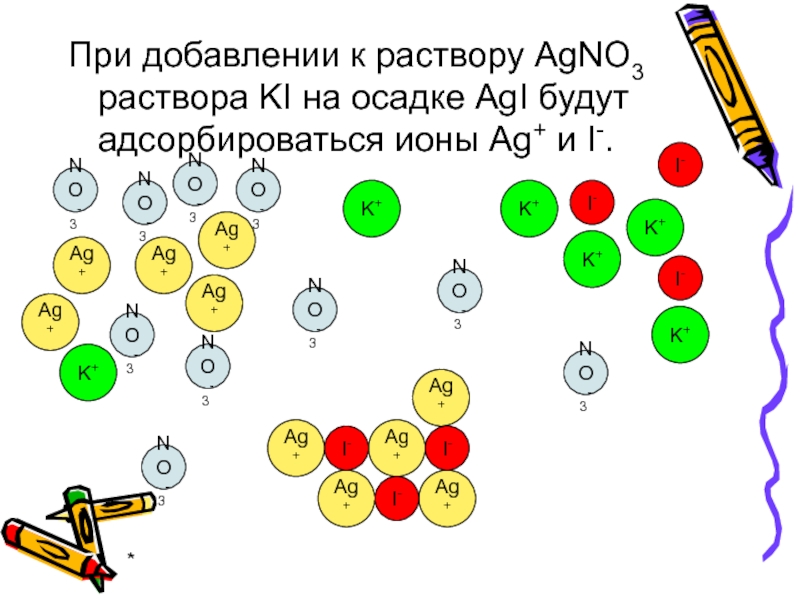
При добавлении к раствору AgNO3 раствора KI на осадке AgI будут
адсорбироваться ионы Ag+ и I-.
Ag+
Ag+
Ag+
Ag+
NO3-
NO3-
NO3-
NO3-
K+
K+
K+
I-
I-
I-
Ag+
Ag+
Ag+
Ag+
I-
I-
I-
Ag+
Ag+
NO3-
NO3-
NO3-
NO3-
NO3-
NO3-
K+
K+
K+
Слайд 41*
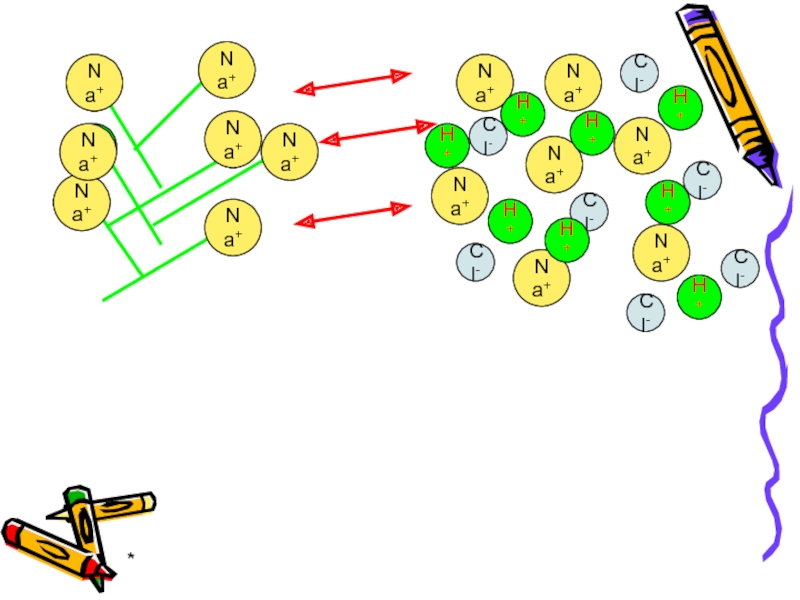
Ионообменная адсорбция (ИА) - процесс эквивалентного обмена собственных ионов нерастворимого адсорбента
(ионита), посылаемого в раствор, на другие ионы того же знака, находящиеся в растворе.
Слайд 42*
H+
H+
H+
H+
H+
H+
H+
катионит
раствор
Na+
Na+
Na+
Na+
Na+
Na+
Na+
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
H+
H+
H+
H+
H+
H+
H+
H+
Na+
Na+
Na+
Na+
Na+
Na+
Na+
Слайд 43*
Иониты = аниониты + катиониты
На ИА основана хроматография – метод определения
и разделения веществ
Слайд 44*
ИА используется для
очистки воды,
консервирования крови (удаление Са2+),
беззондовой диагностики
рН желудочного сока.
Аниониты –антацидные средства. Катиониты –предупреждение и лечение отеков, связанных с декомпенсацией сердечной деятельности, предотвращение ацидоза и др.
Аниониты –антацидные средства. Катиониты –предупреждение и лечение отеков, связанных с декомпенсацией сердечной деятельности, предотвращение ацидоза и др.