- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Амфотерность. Амфотерные соединения презентация
Содержание
- 1. Амфотерность. Амфотерные соединения
- 2. Все оксиды и гидроксиды по их
- 3. Если соединение реагирует с кислотой с образованием
- 4. Если соединение реагирует со щелочью с образованием
- 5. Но есть и вещества - «хамелеоны». При
- 6. К амфотерным соединениям относят оксиды и гидроксиды
- 7. Точно так же и при реакции гидроксида
- 8. Рассмотрим уравнения этих реакций. ZnO+2KOH=K2ZnO2+H2O Zn(OH)2+2KOH=K2ZnO2+2H2O Амфотерный
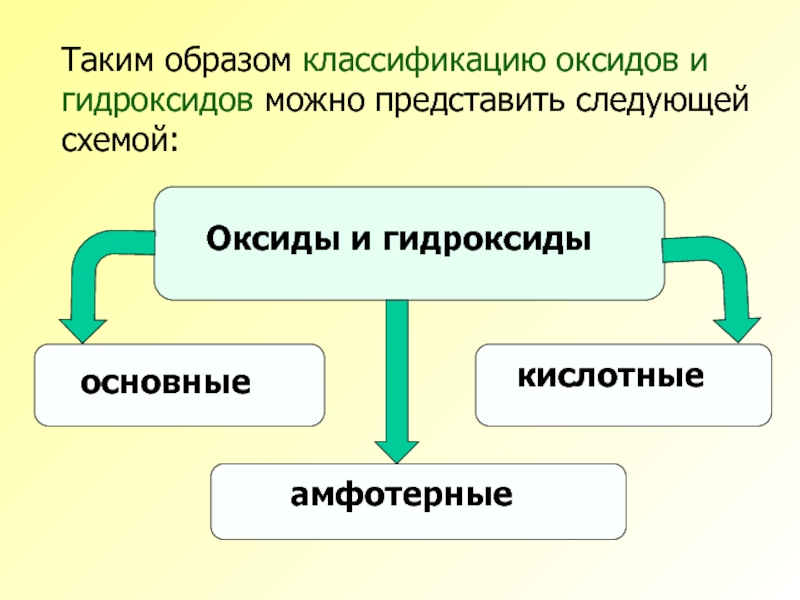
- 9. Таким образом классификацию оксидов и гидроксидов можно представить следующей схемой:
- 10. Так как кислотность, основность или амфотерность химических
- 11. Внимание! Если для нерастворимого основания не имел
- 12. Полученный осадок амфотерного гидроксида алюминия нужно разделить пополам.
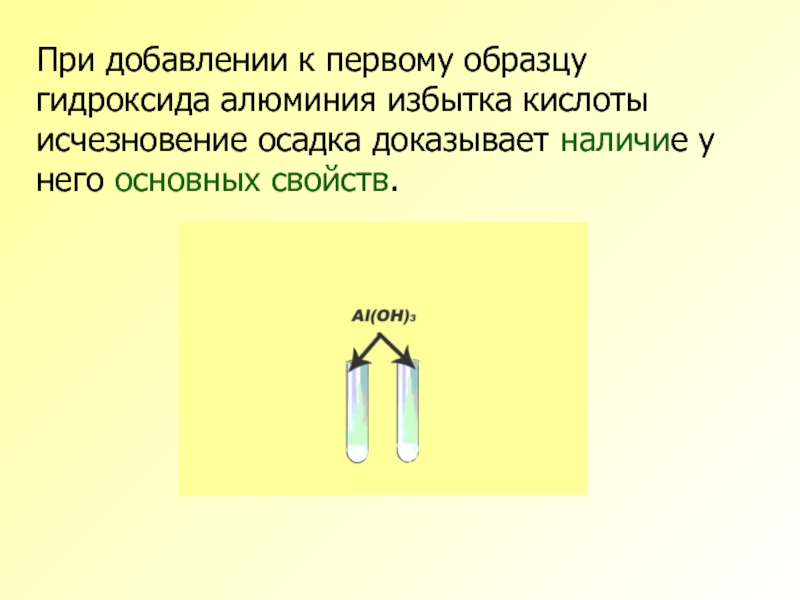
- 13. При добавлении к первому образцу гидроксида алюминия
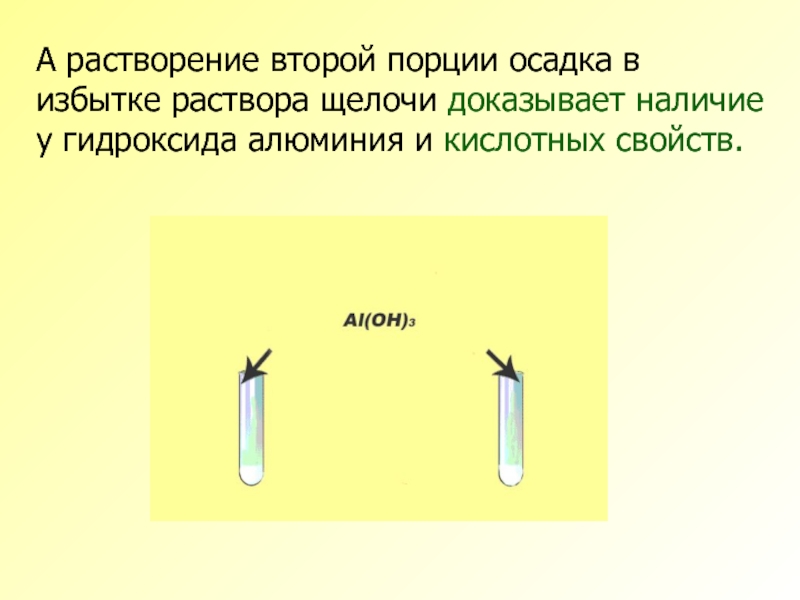
- 14. А растворение второй порции осадка в избытке
- 15. Таким образом это исследование доказало кислотно-основную двойственность
- 16. Реакция гидроксида алюминия с раствором кислоты: Al(OH)3+3HCl=AlCl3+3H2O
- 17. Спасибо за внимание! Успехов Вам в изучении химии!
Слайд 1Презентация учителя школы №383
Красносельского района
города Санкт-Петербурга
Виноградовой Натальи Васильевны
по теме:
«Амфотерность»
Слайд 2
Все оксиды и гидроксиды по их химическим свойствам можно разделить на
основные
амфотерные
кислотные
Принадлежность сложного вещества к одному из этих трех видов определяется по реакции с противоположным по характеру гидроксидом с образованием соли и воды.
Слайд 3Если соединение реагирует с кислотой с образованием соли и воды, то
Например:
CaO+H2SO4=CaSO4+H2O
Основный оксид кальция в реакции с кислотным гидроксидом серы(VI) – серной кислотой – образовал соль сульфат кальция и воду.
Ca(OH)2+H2SO4=CaSO4+2H2O
Основный гидроксид кальция в реакции с кислотным гидроксидом серы(VI) – серной кислотой – образовал соль сульфат кальция и воду.
Слайд 4Если соединение реагирует со щелочью с образованием соли и воды, то
Например:
SO3+2KOH=K2SO4+H2O
Кислотный оксид серы(VI) в реакции с основным гидроксидом– щелочью гидроксид калия – образовал соль сульфат калия и воду.
H2SO4+2KOH=K2SO4+2H2O
Кислотный гидроксид серы(VI) – серная кислота - в реакции с основным гидроксидом– щелочью гидроксид калия – образовал соль сульфат калия и воду.
Слайд 5Но есть и вещества - «хамелеоны».
При добавлении к таким веществам кислоты,
а при добавлении к ним щелочи –
кислотные свойства.
Такая кислотно-основная двойственность
химических свойств получила название
«Амфотерность».
Слайд 6К амфотерным соединениям относят
оксиды и гидроксиды некоторых металлов
(в них металл
Рассмотрим амфотерность на примере оксида и гидроксида цинка.
При реакции с соляной кислотой оксида цинка образуются соль хлорид цинка и вода:
ZnO+2HCl=ZnCl2+H2O
Слайд 7Точно так же и при реакции гидроксида цинка с соляной кислотой
Zn(OH)2+2HCl=ZnCl2+2H2O
Но стоит к этим же соединениям цинка добавить раствор щелочи, и произойдет противоположный процесс.
Получится соль и вода, но вместо катионов цинка в состав соли войдут анионы кислотного остатка цинковой кислоты H2ZnO2 (которая есть не что иное, как гидроксид цинка Zn(OH)2, формула которого записана так, чтобы подчеркнуть кислотность химических свойств) - анион ZnO22-
Слайд 8Рассмотрим уравнения этих реакций.
ZnO+2KOH=K2ZnO2+H2O
Zn(OH)2+2KOH=K2ZnO2+2H2O
Амфотерный оксид цинка в реакции со щелочью гидроксид
Амфотерный гидроксид цинка
в реакции со щелочью гидроксид калия образовал соль цинкат калия и воду.
На самом деле чаще образуются более сложные по строению комплексные соединения.
Слайд 10Так как кислотность, основность или амфотерность химических свойств определяют экспериментальным образом, рассмотрим
Для начала его требуется получить. Нерастворимые гидроксиды металлов получают реакцией ионного обмена между раствором соли, содержащей катион этого металла и раствором щелочи.
Слайд 11Внимание! Если для нерастворимого основания не имел значения порядок смешивания растворов,
Если налить в раствор соли избыток раствора щелочи, то пойдет следующая реакция – между щелочью и амфотерным гидроксидом, и мы можем не успеть увидеть осадок.
Итак, нужно взять раствор щелочи и добавлять раствор соли алюминия до получения неисчезающего осадка.
Слайд 13При добавлении к первому образцу гидроксида алюминия избытка кислоты исчезновение осадка
Слайд 14А растворение второй порции осадка в избытке раствора щелочи доказывает наличие
Слайд 15Таким образом это исследование доказало кислотно-основную двойственность
химических свойств гидроксида алюминия,
то
Уравнениями реакций, проделанных в опыте мы и закончим знакомство с амфотерностью:
получение гидроксида алюминия
3KOH+AlCl3=Al(OH)3↓+3KCl
Слайд 16Реакция гидроксида алюминия с раствором кислоты:
Al(OH)3+3HCl=AlCl3+3H2O
Реакция гидроксида алюминия с избытком раствора
Al(OH)3+KOH=K[Al(OH)4]
Полученный тетрагидроксоалюминат калия K[Al(OH)4] – это и есть уже упоминавшееся ранее комплексное соединение.












![Реакция гидроксида алюминия с раствором кислоты:Al(OH)3+3HCl=AlCl3+3H2OРеакция гидроксида алюминия с избытком раствора щелочи:Al(OH)3+KOH=K[Al(OH)4]Полученный тетрагидроксоалюминат калия K[Al(OH)4]](/img/tmb/1/87661/94a34647401562636f36ffd6a879f8d0-800x.jpg)






