- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Алкины презентация
Содержание
- 1. Алкины
- 2. Составьте уравнения указанных реакций, укажите условия их
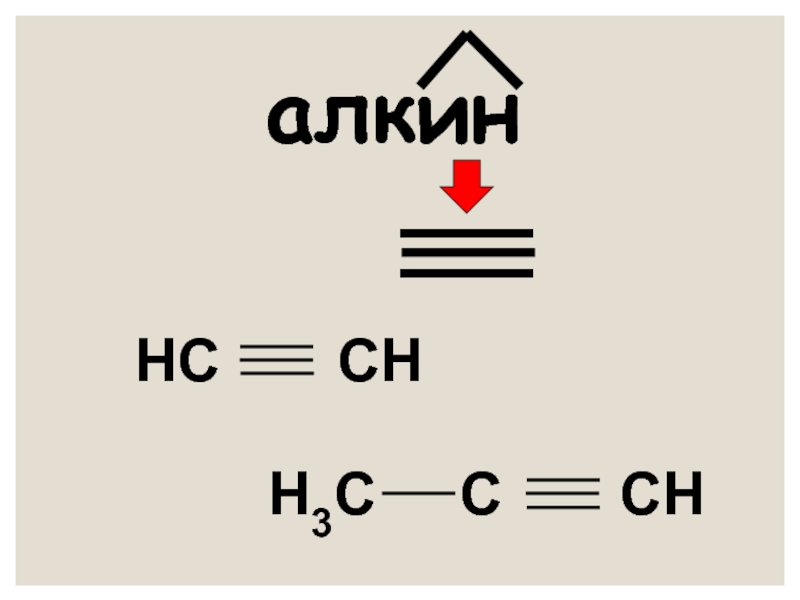
- 3. Понятие об алкинах АЛКИНЫ – непредельные углеводороды,
- 4. алкин НС СН Н3С С СН
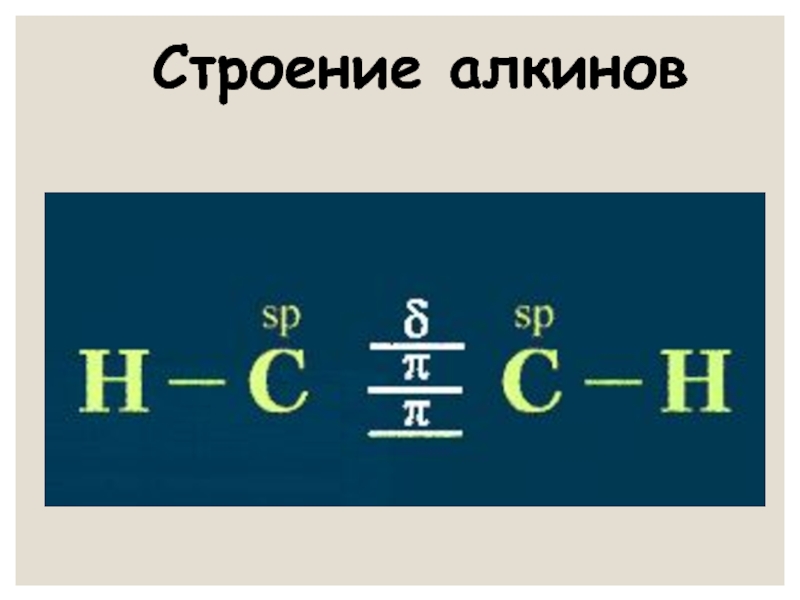
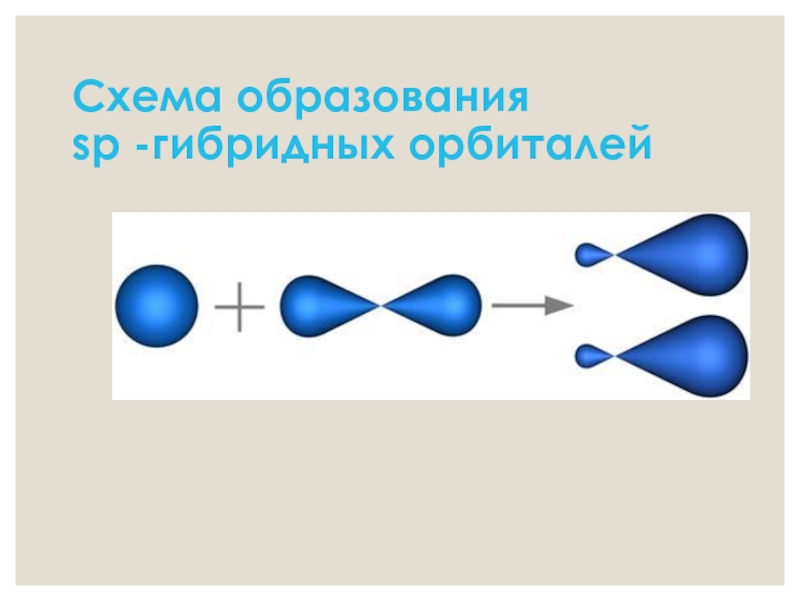
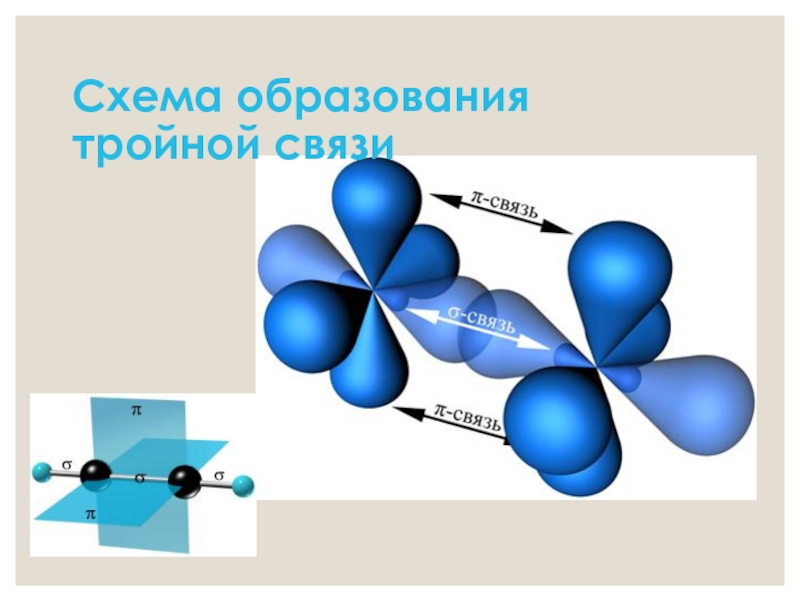
- 5. Характеристика тройной связи Вид гибридизации –
- 6. Строение алкинов
- 7. Схема образования sp -гибридных орбиталей
- 8. Схема образования тройной связи
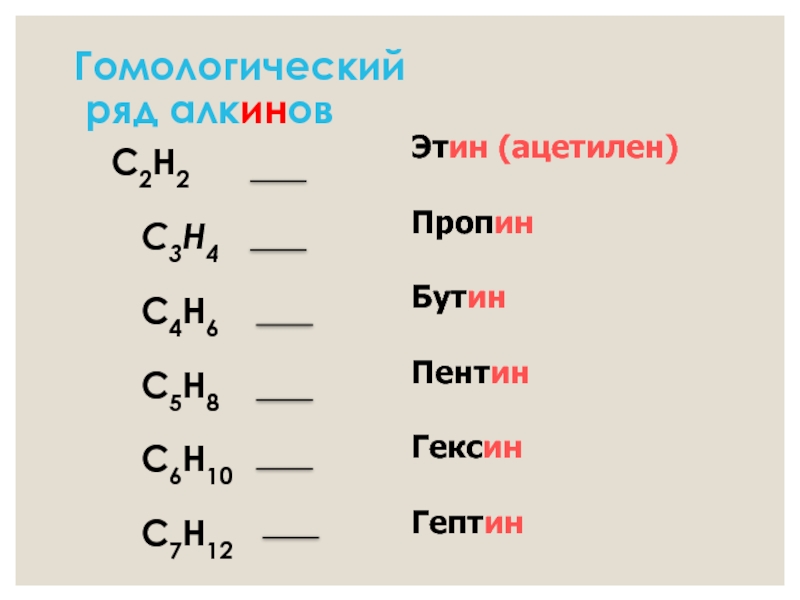
- 9. Гомологический ряд алкинов C2H2 C3H4
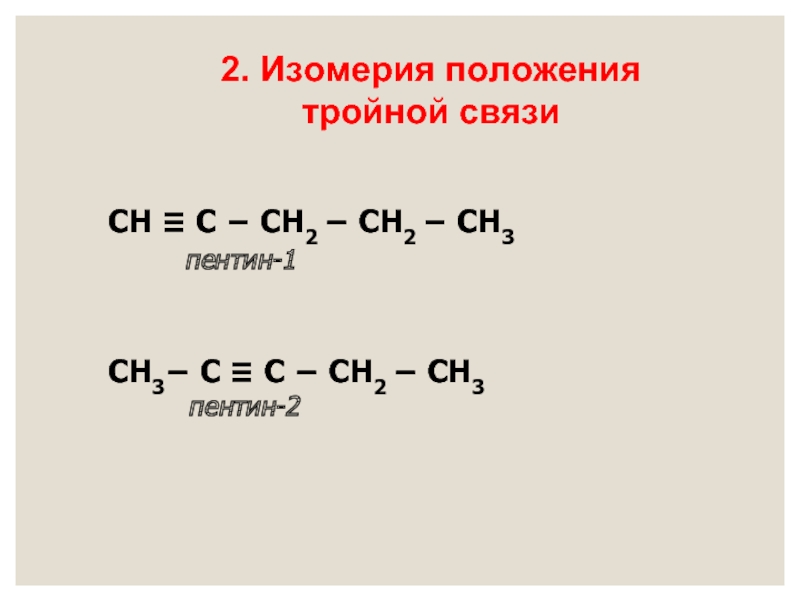
- 10. ВИДЫ ИЗОМЕРИИ СН ≡ С −
- 11. СН ≡ С − СН2 −
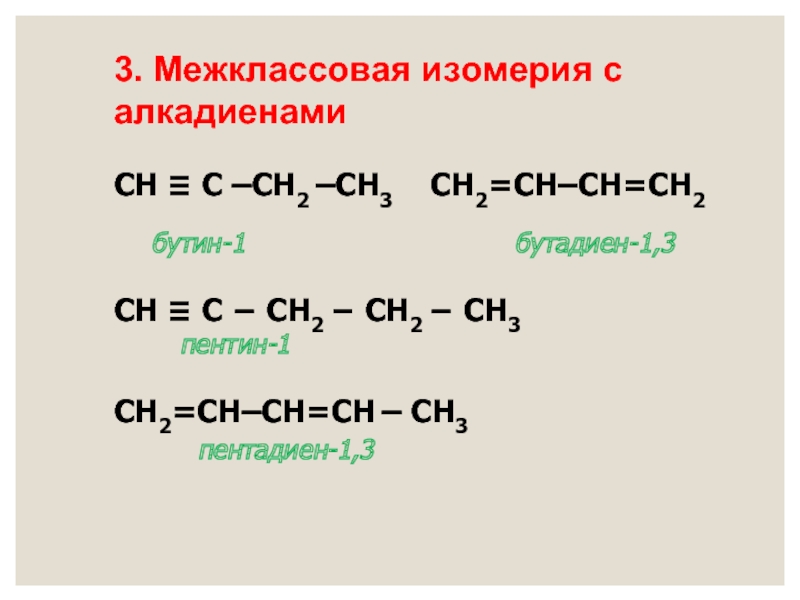
- 12. СН ≡ С –СН2 –СН3 СН2=СН–СН=СН2
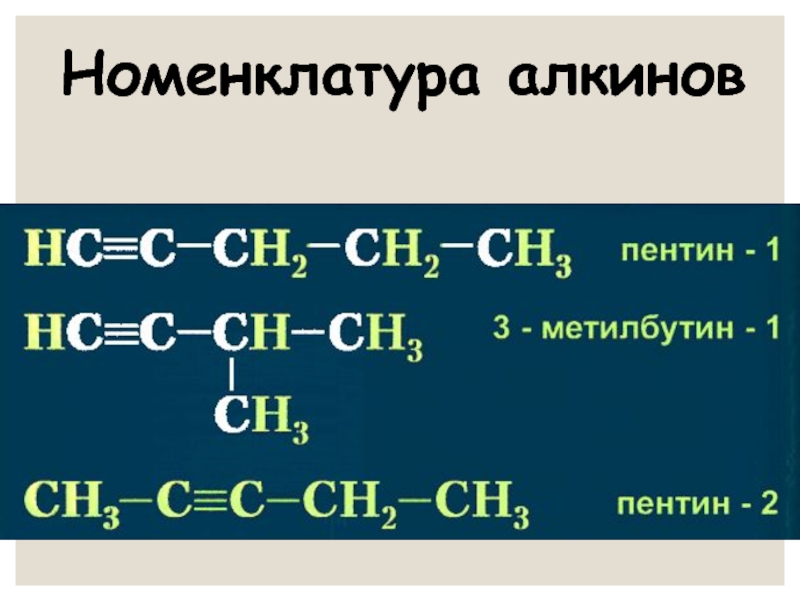
- 13. Номенклатура алкинов
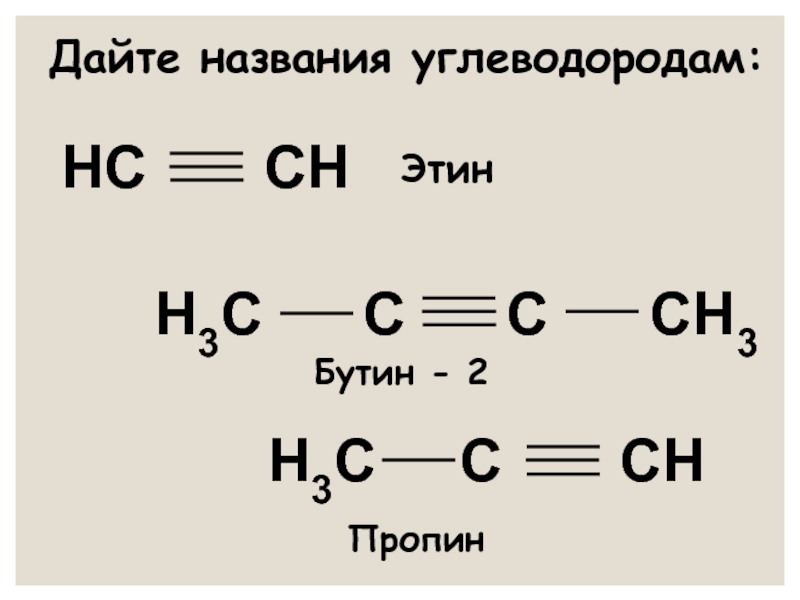
- 14. Дайте названия углеводородам: НС
- 15. Получение алкинов 1. Карбидный способ (гидролиз карбида
- 16. 2. Термический крекинг метана.
- 17. 3. Дегидрогалогенирование спиртовым раствором щёлочи:
- 18. Физические свойства алкинов
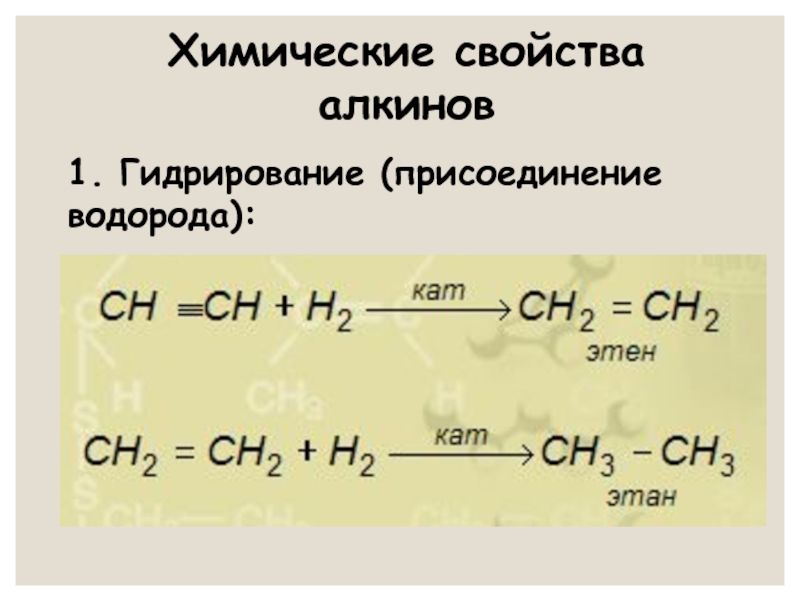
- 19. Химические свойства алкинов 1. Гидрирование (присоединение водорода):
- 20. 2) Галогенирование. Алкины обесцвечивают
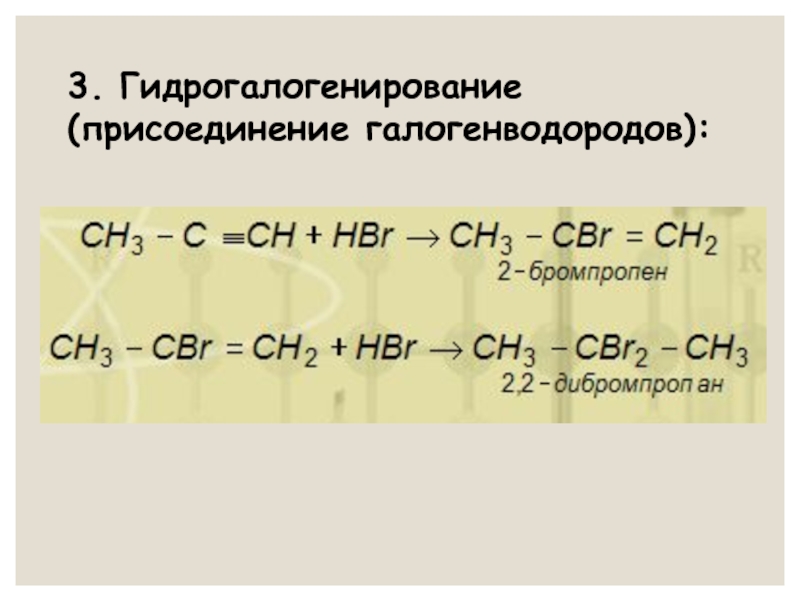
- 21. 3. Гидрогалогенирование (присоединение галогенводородов):
- 22. Правило В. В. Марковникова: водород
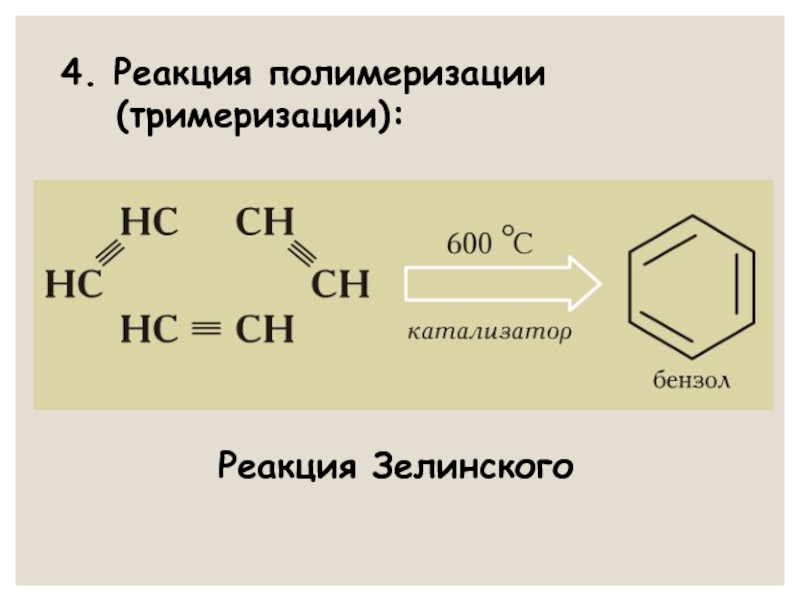
- 23. 4. Реакция полимеризации (тримеризации): Реакция Зелинского
- 24. 5. Реакция Кучерова
- 25. Горение (горят светящимся и коптящим пламенем с
- 26. Кислотные свойства. 7) Водородные
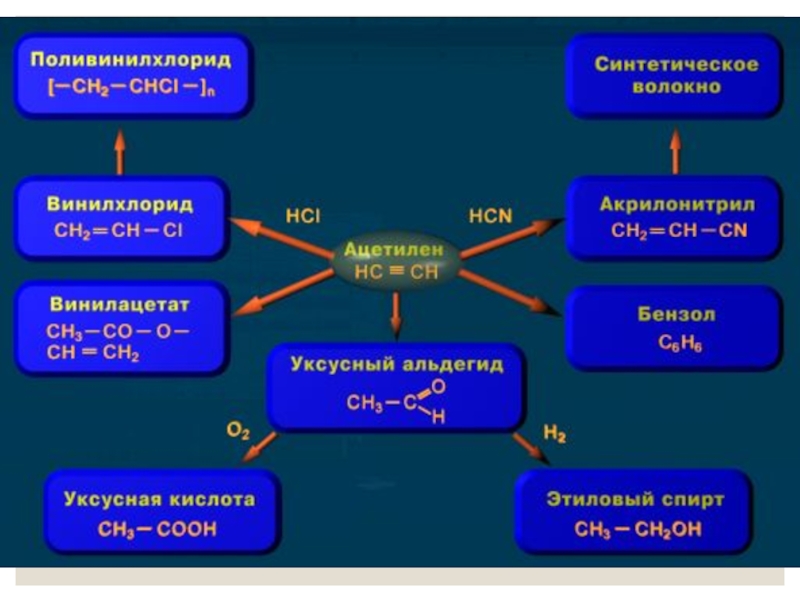
- 27. Применение алкинов
- 32. Выводы: Углеводороды с общей формулой СnH2n-2,
- 33. Источники информации 1. Петров А.А., Бальян
- 34. 5. Оганесян Э.Т. Руководство
Слайд 2Составьте уравнения указанных реакций, укажите условия их протекания, назовите полученные вещества
I
II и IV варианты: пропен
Слайд 3Понятие об алкинах
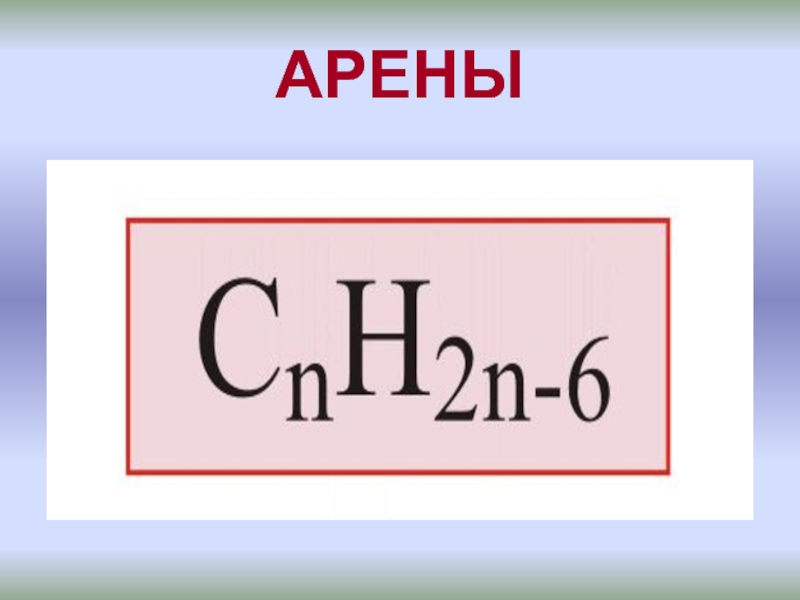
АЛКИНЫ – непредельные углеводороды, содержащие в молекуле одну тройную
СnН2n - 2
Слайд 5Характеристика
тройной связи
Вид гибридизации – sp
Вид связи – ковалентная полярная
По типу
Слайд 9Гомологический
ряд алкинов
C2H2
C3H4
C4H6
C5H8
C6H10
C7H12
Этин (ацетилен)
Пропин
Бутин
Пентин
Гексин
Гептин
Слайд 10ВИДЫ ИЗОМЕРИИ
СН ≡ С − СН2 − СН2 − СН3
СН ≡ С − СН − СН3
⏐
СН3
3-метилбутин-1
1. Изомерия углеродного скелета
Слайд 11
СН ≡ С − СН2 − СН2 − СН3
СН3− С ≡ С − СН2 − СН3
пентин-2
2. Изомерия положения
тройной связи
Слайд 12СН ≡ С –СН2 –СН3 СН2=СН–СН=СН2
бутин-1 бутадиен-1,3
СН ≡ С − СН2 − СН2 − СН3
пентин-1
СН2=СН–СН=СН – СН3
пентадиен-1,3
3. Межклассовая изомерия с алкадиенами
Слайд 15Получение алкинов
1. Карбидный способ (гидролиз карбида кальция):
Основной недостаток – большие затраты
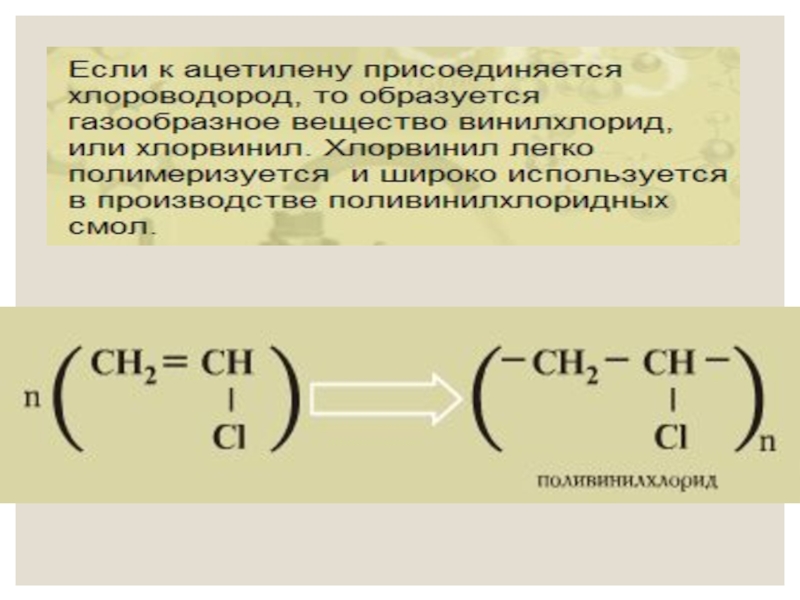
Слайд 20 2) Галогенирование. Алкины обесцвечивают бромную воду (качественная реакция
CHBr=CHBr + Br2 → CHBr2–CHBr2
Слайд 22Правило В. В. Марковникова:
водород присоединяется к наиболее гидрогенизированному атому
Слайд 245. Реакция Кучерова (присоединение воды к
этин
уксусный альдегид
Слайд 25Горение (горят светящимся и коптящим пламенем с выделением большого количества тепла)
2) Неполное окисление - обесцвечивают раствор марганцовки KMnO4, (качественная реакция)
6. Окисление алкинов
Слайд 26Кислотные свойства.
7) Водородные атомы ацетилена способны замещаться металлами
HC≡CH + 2Na → NaC≡CNa + H2
Ацетилениды серебра и меди получают взаимодействием с аммиачными растворами соответственно оксида серебра и хлорида меди. HC≡CH + Ag2O → AgC≡CAg↓+ H2O
(аммиачный р-р)
HC≡CH + CuCl2 → CuC≡CCu↓+ 2HCl
(аммиачный р-р)
Слайд 32Выводы:
Углеводороды с общей формулой СnH2n-2,
Наиболее характерной реакцией для алкинов является реакция присоединения.
Присоединение воды к ацетилену в присутствии солей ртути приводит к образованию альдегида и называется реакцией Кучерова.
Алкины применяются для синтеза галогенпроизводных, широко используются как растворители и для получения полимеров.
Слайд 33Источники информации
1. Петров А.А., Бальян Х.В., Трощенко А.Т.
Органическая химия.
ред. Петрова А.А. – М.: Высшая школа, 1981.
2. Хомченко Г.П. Пособие по химии для
поступающих в вузы. – М.: ООО «Издательство
Новая Волна», 2002.
3. Курмашева К.К. Химия в таблицах и схемах.
Серия «Школа в клеточку». – М.: «Лист», 1997.
4. Потапов В.М., Чертков И.Н. Строение и
свойства органических веществ. Пособие для
учащихся 10 кл. – М.: Просвещение, 1980.
Слайд 34 5. Оганесян Э.Т. Руководство по химии
поступающим в вузы.
Высшая школа,1991.
6. Иванова Р.Г., Осокина Г.Н. Изучение
химии в 9-10 классах. Книга для учителя. – М.:
Просвещение, 1983.
7. Денисов В.Г. Химия. 10 класс. Поурочные
планы. – Волгоград: Учитель, 2004.
8. Аргишева А.И., Задумина Э.А. Химия:
Подготовка к государственному
централизованному тестированию. – Саратов:
Лицей, 2002.