- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Термодинамика и теплопередача. Внутренняя энергия презентация
Содержание
- 1. Термодинамика и теплопередача. Внутренняя энергия
- 2. Внутренняя энергия: Кинетическая энергия Потенциальная энергия
- 3. Внутренняя энергия, U [Дж]
- 4. Удельная внутренняя энергия, u [Дж/кг] Внутренняя энергия
- 5. Теплота Теплота, Q – представляет собой переданное
- 6. Работа Работа, L [Дж] – в термодинамике
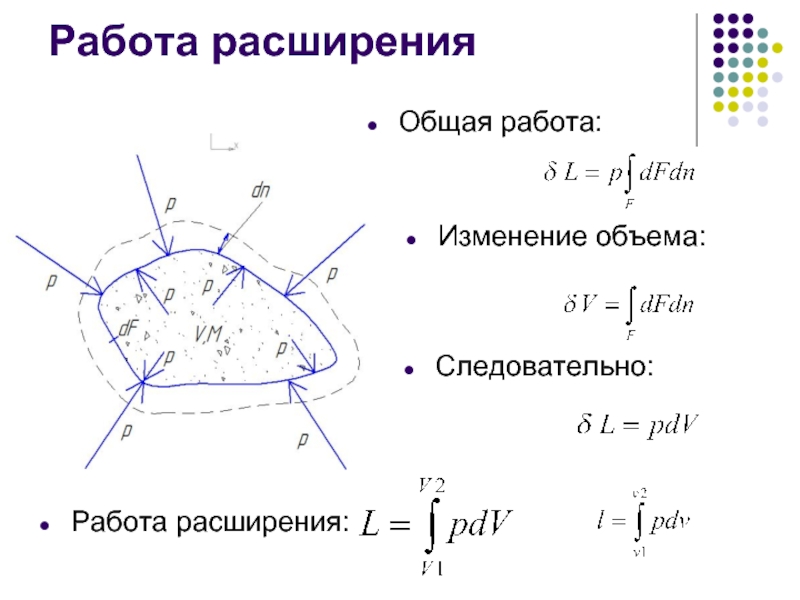
- 7. Работа расширения Масса М Объем V Площадь
- 8. Работа расширения Общая работа: Изменение объема: Следовательно: Работа расширения:
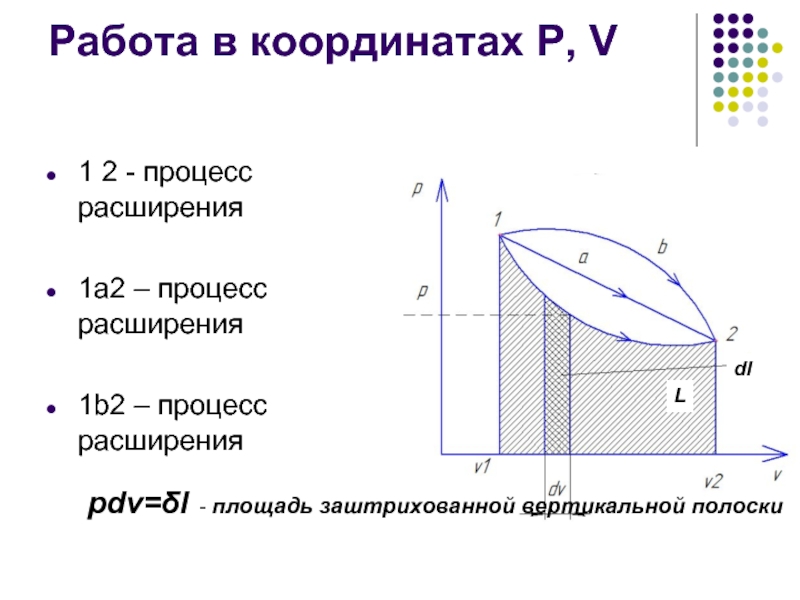
- 9. Работа в координатах Р, V 1 2
- 10. Энтальпия Энтальпия, Н [Дж] - термодинамический потенциал,
- 11. Удельная энтальпия – энтальпия системы содержащий 1
- 12. Уравнение первого начала термодинамики: С учетом
- 13. Теплоемкость Теплоемкость, с [Дж/кг*град] – количество тепла,
- 14. Теплоемкость в зависимости от единицы количества вещества:
- 15. Массовая теплоемкость Изобарная теплоемкость: Изохорная теплоемкость:
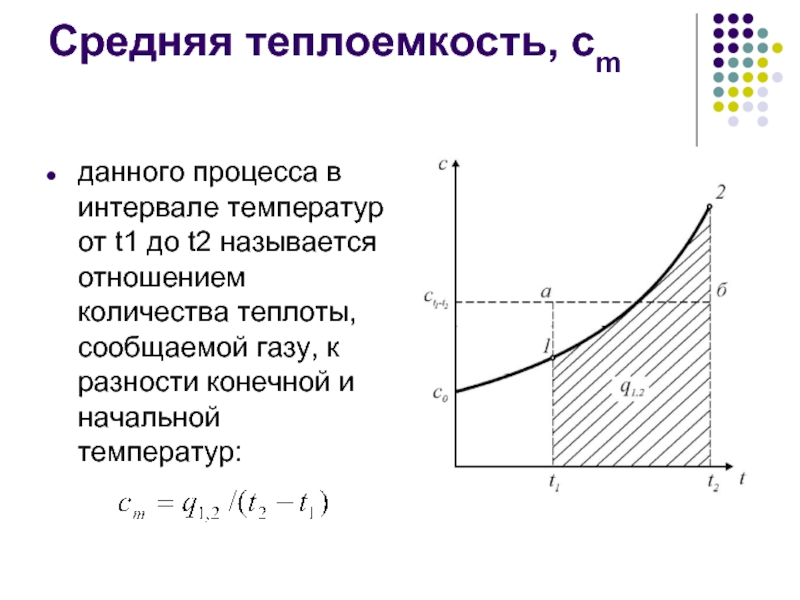
- 16. Средняя теплоемкость, сm данного процесса в интервале
- 17. Истинная теплоемкость Истинная теплоемкость соответствует бесконечно малому интервалу температур.
Слайд 2Внутренняя энергия:
Кинетическая энергия
Потенциальная энергия
Энергия электронных оболочек атомов
Внутриядерная энергия
Две последние в
Слайд 3Внутренняя энергия, U [Дж]
энергия хаотического движения молекул и
Слайд 4Удельная внутренняя энергия, u
[Дж/кг]
Внутренняя энергия функция состояния тела и может быть
Изменение внутренней энергии:
Слайд 5Теплота
Теплота, Q – представляет собой переданное от одного тела к другому
+ Q – подводимая теплота
- Q – отводимая теплота
Слайд 6Работа
Работа, L [Дж] – в термодинамике называется процесс превращения одного вида
Слайд 7Работа расширения
Масса М
Объем V
Площадь поверхности F
Элементарный элемент оболочки dF
Сила pdF
Элементарная работа
Слайд 9Работа в координатах Р, V
1 2 - процесс расширения
1а2 – процесс
1b2 – процесс расширения
L
dl
pdv=δl - площадь заштрихованной вертикальной полоски
Слайд 10Энтальпия
Энтальпия, Н [Дж] - термодинамический потенциал, характеризующий состояние термодинамической системы. Энергия,
Энтальпия – функция состояния:
Слайд 11Удельная энтальпия – энтальпия системы содержащий 1 кг вещества h [Дж/кг]:
Энтальпия
Изменение
Слайд 12Уравнение первого начала термодинамики:
С учетом очевидного соотношения:
Может быть записано в виде:
или
Если
или
Слайд 13Теплоемкость
Теплоемкость, с [Дж/кг*град] – количество тепла, которое нужно повести единице тела
Слайд 14Теплоемкость в зависимости от единицы количества вещества:
Удельная массовая теплоемкость, с [Дж/кг*К];
Удельная
Удельная мольная теплоемкость, см, [Дж/кмоль*К]
Слайд 15Массовая теплоемкость
Изобарная теплоемкость:
Изохорная теплоемкость:
Отношение теплоемкостей:
Уравнение Майера:
Слайд 16Средняя теплоемкость, сm
данного процесса в интервале температур от t1 до t2


![Внутренняя энергия, U [Дж] энергия хаотического движения молекул и атомов, включающую энергию поступательного, вращательного](/img/tmb/1/73530/f63fc6df1a3ab412376722df63a48ef2-800x.jpg)
![Удельная внутренняя энергия, u[Дж/кг] Внутренняя энергия функция состояния тела и может быть представлена в виде функции](/img/tmb/1/73530/30c9dc850d800d6a7b0309c5dc8f05ec-800x.jpg)

![РаботаРабота, L [Дж] – в термодинамике называется процесс превращения одного вида энергии в другой, при](/img/tmb/1/73530/ecdc6c17f68db95243e1ea00a8565095-800x.jpg)

![ЭнтальпияЭнтальпия, Н [Дж] - термодинамический потенциал, характеризующий состояние термодинамической системы. Энергия, которая доступна для преобразования](/img/tmb/1/73530/de7ccad5c71c4c933ecff16fb6036bd3-800x.jpg)
![Удельная энтальпия – энтальпия системы содержащий 1 кг вещества h [Дж/кг]:Энтальпия Изменение энтальпии в любом процессе](/img/tmb/1/73530/31d1917a75ab16098bbd542ef3145d1f-800x.jpg)

![ТеплоемкостьТеплоемкость, с [Дж/кг*град] – количество тепла, которое нужно повести единице тела для повышения его температуры](/img/tmb/1/73530/59be11719519229eed07548455000360-800x.jpg)
![Теплоемкость в зависимости от единицы количества вещества:Удельная массовая теплоемкость, с [Дж/кг*К];Удельная объемная теплоемкость, с/ [Дж/м3*К];Удельная](/img/tmb/1/73530/053ead8ffa18f2a3e0dcdc1642ad3bc3-800x.jpg)