- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Термодинамика и статистическая физика презентация
Содержание
- 1. Термодинамика и статистическая физика
- 2. Лекция № 5 Закон распределения Больцмана.
- 3. В отсутствие внешних сил средняя
- 4. концентрация молекул газа убывала с увеличением высоты.
- 6. Вес столба n mg dZ S
- 7. Физическая природа силового поля не имеет
- 8. закон распределения Больцмана
- 11. Пусть идеальный газ находится в поле консервативных
- 13. С уменьшением температуры число молекул на
- 14. Распределение Больцмана можно предста-вить в виде
- 15. Опытное определение постоянной Авогадро. Ж. Перрен воспользовался
- 16. Если и
- 18. Закон распределения Максвелла-Больцмана На
- 19. Закон Максвелла даёт распределение частиц по
- 20. Обозначим
- 21. В последнем выражении, потенциальная и кинетическая
- 22. где Ni – число частиц, находящихся в
- 23. Тогда, окончательное выражение распределения Масвелла-Больцмана для случая
- 24. Барометрическая формула
- 25. – плотность газа на высоте
- 26. Причём
- 27. Из барометрической формулы следует, что
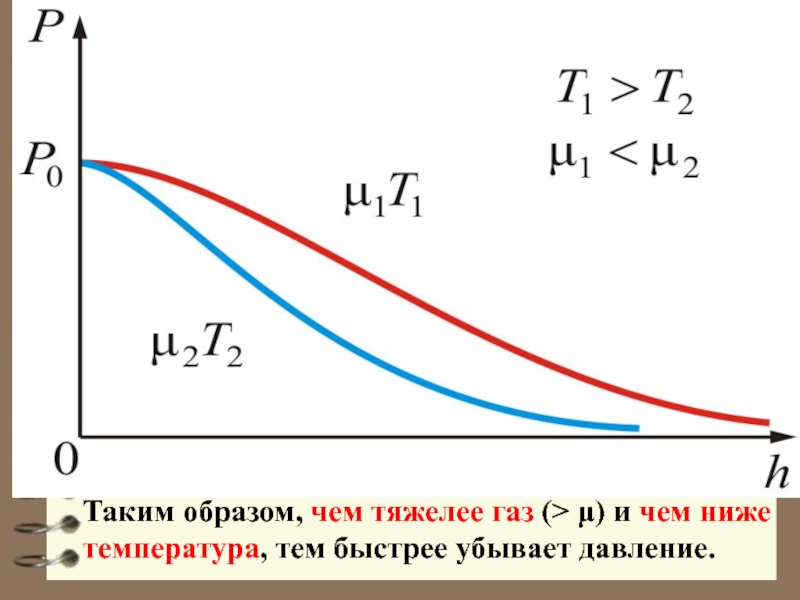
- 28. Таким образом, чем тяжелее газ (> μ) и чем ниже температура, тем быстрее убывает давление.
- 30. Атмосфера Земли
- 32. Строение атмосферы
- 33. Распределение Бозе-Эйнштейна и Ферми-Дирака
- 34. Основная задача квантовой статистики состоит в
- 35. распределение Бозе-Эйнштейна:
- 36. Первая формула описывает квантовые частицы с целым
- 37. Число независимых
- 38. Числом степени свободы называется
- 39. Необходимо учитывать вращательное движение молекул
- 40. Многоатомная молекула может ещё и
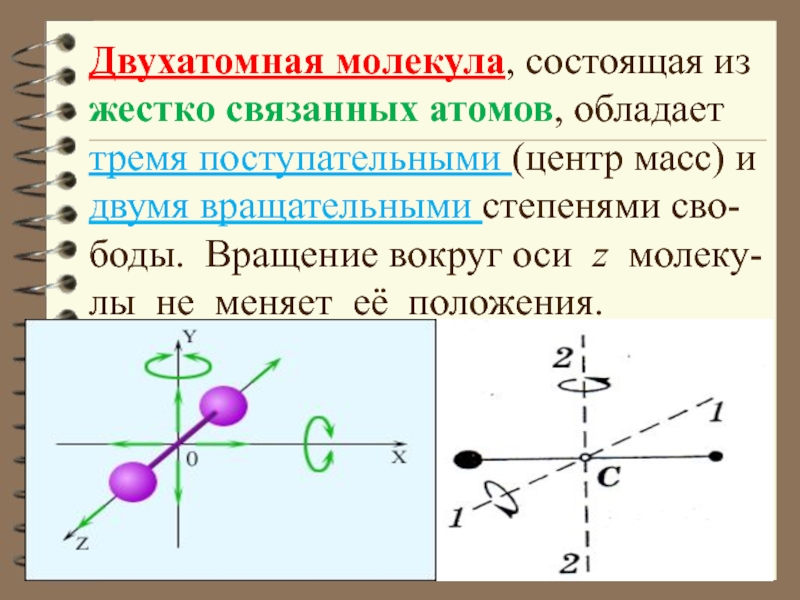
- 42. Двухатомная молекула, состоящая из жестко связанных атомов,
- 43. Трехатомная (многоатомная) моле-кула, состоящая из
- 44. У двухатомных молекул (с жёсткой
- 46. При взаимных столкновениях молекул возможен обмен
- 47. Средняя энергия поступательного движения молекулы равна:
- 48. Больцман доказал, что, средняя энергия
- 49. В классической статистической физике выводится
- 50. Колебательная степень "обладает" вдвое
- 51. Итак, средняя энергия
- 52. У одноатомной молекулы i = 3,
- 53. На среднюю кинетическую энер-гию молекулы, имеющей
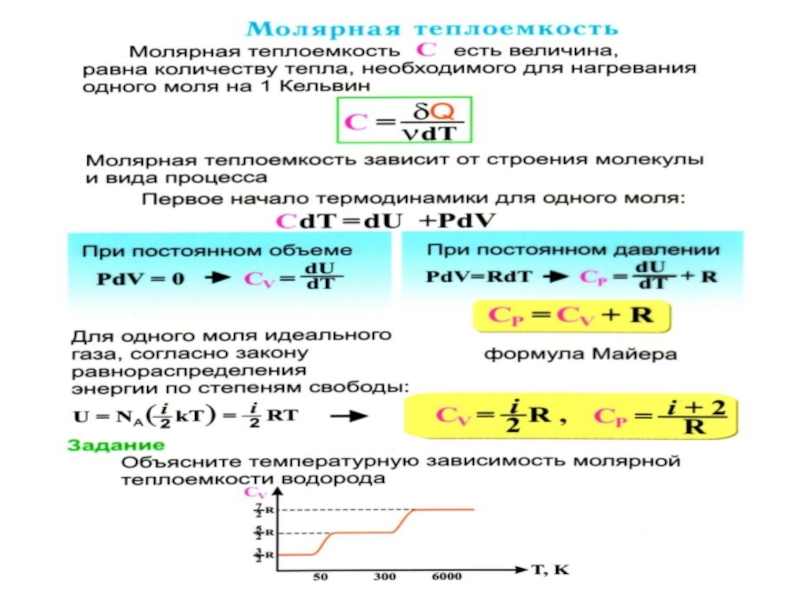
- 54. Теплоёмкости одноатомных и многоатомных газов Внутренняя энергия
- 55. То, что
- 56. Внутренняя энергия одного моля идеального газа c
- 58. Для одного моля
- 59. для трех и более атомных молекул:
- 61. В общем случае, для молярной массы газа
- 62. Для произвольного количества газов ( для ν
- 64. Для одноатомных газов это
- 65. При увеличении температуры, когда Т
- 66. Одна колебательная степень свободы несет
- 68. Из качественной экспериментальной зависимости молярной теплоёмкости
- 69. Это можно объяснить, предположив,
- 70. Расхождение теории и
- 71. к ней не применим закон равнораспределения энергии).
- 72. Лекция закончена !
Слайд 2 Лекция № 5
Закон распределения Больцмана.
1. Система частиц во внешнем силовом
2. Закон распределения Больцмана для равновесного состояния системы.
3. Барометрическая формула.
Теплоёмкость многоатомных газов.
1. Число степеней свободы. Равномерное
распределение средней кинетической энергии
теплового движения по степеням свободы.
2. Классическая теория теплоёмкости
многоатомных газов и её ограниченность.
“Замороженные” степени свободы.
Слайд 3 В отсутствие внешних сил средняя концентрация n молекул газа
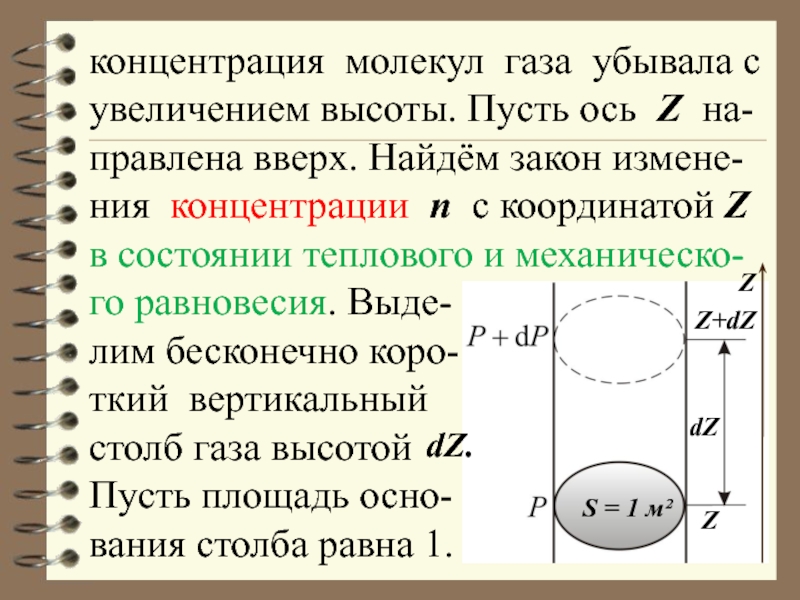
Слайд 4концентрация молекул газа убывала с увеличением высоты. Пусть ось Z на-правлена
лим бесконечно коро-
ткий вертикальный
столб газа высотой
Пусть площадь осно-
вания столба равна 1.
Z
dZ
Z+dZ
Z
dZ.
S = 1 м²
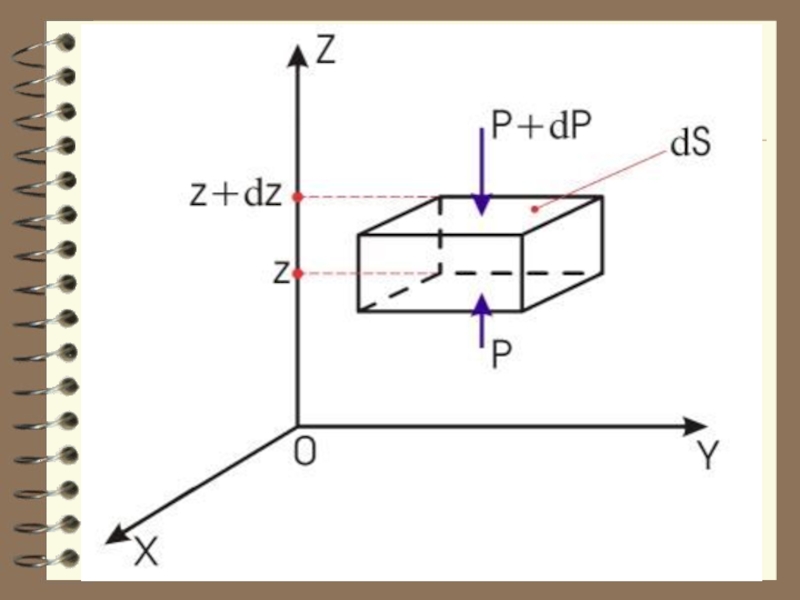
Слайд 6 Вес столба n mg dZ S должен уравно-вешиваться разностью давлений:
, т.к. S = 1 м²
т.к.
Z
dZ
Z+dZ
Z
S = 1 м²
Слайд 7 Физическая природа силового поля не имеет значения. Важно, чтобы поле
Слайд 8
закон
распределения
Больцмана
Закон распределения частиц по потенци-альным энергиям – распределение
Слайд 10 Больцман
Слайд 11 Пусть идеальный газ находится в поле консервативных сил, в условиях теплового
http://ido.tsu.ru/schools/physmat/data/res/models/text/molek2.htm
Слайд 13 С уменьшением температуры число молекул на высотах, отличных от нуля, убывает.
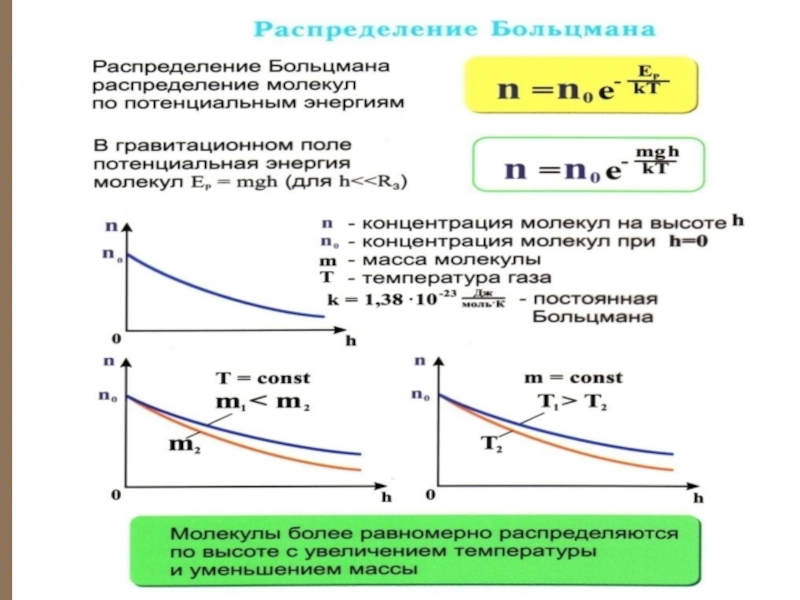
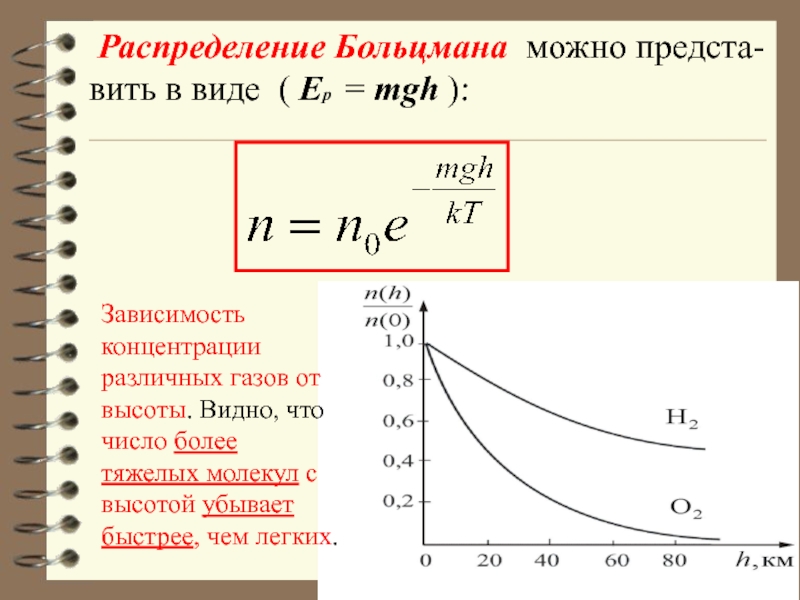
Слайд 14 Распределение Больцмана можно предста-вить в виде ( Ер = mgh
Зависимость концентрации различных газов от высоты. Видно, что число более тяжелых молекул с высотой убывает быстрее, чем легких.
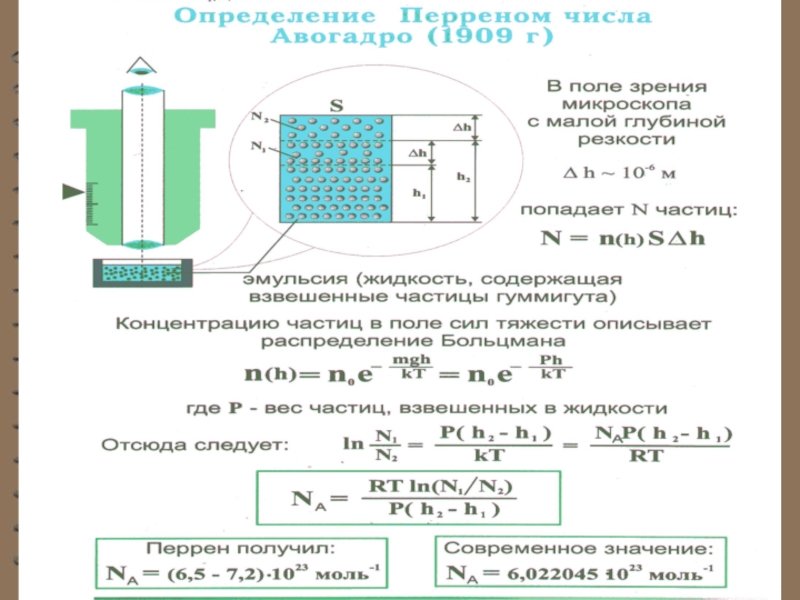
Слайд 15Опытное определение постоянной Авогадро. Ж. Перрен воспользовался идеей распределения молекул по
где - масса частицы,
масса вытесненной
ею жидкости;
- радиус частицы,
- плотность частицы,
- плотность жидкости.
Слайд 16Если и - концентрации частиц на
Значение , полученное из работ Ж. Перрена, соответствовало значениям, полученным в других опытах, что подтверждает применимость к броуновским частицам распределения Больцмана.
Слайд 18 Закон распределения Максвелла-Больцмана
На прошлой лекции мы получили выражение
Слайд 19 Закон Максвелла даёт распределение частиц по значениям кинетической энергии Екин,
Слайд 20 Обозначим
Слайд 21 В последнем выражении, потенциальная и кинетическая энергии, а следовательно и
Слайд 22где Ni – число частиц, находящихся в состоянии с энергией
Слайд 23 Тогда, окончательное выражение распределения Масвелла-Больцмана для случая дискретных значений будет иметь
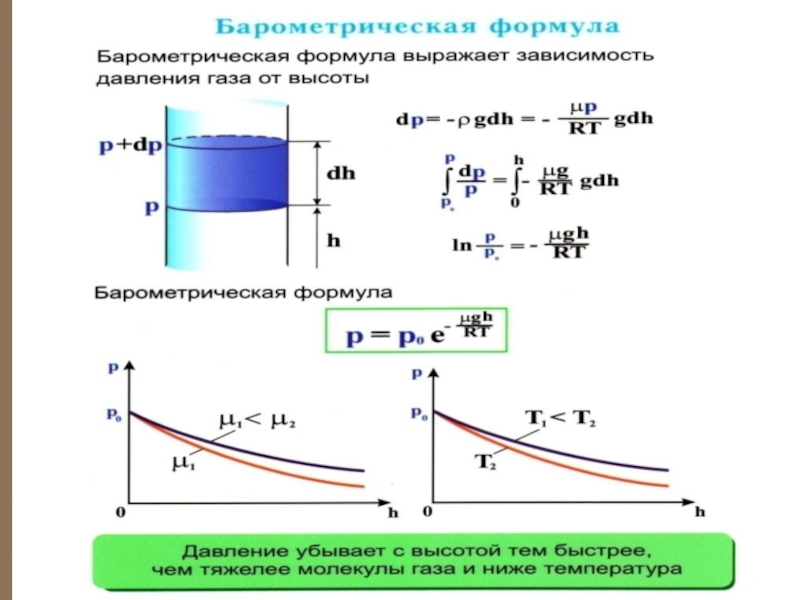
Слайд 24 Барометрическая формула
Атмосферное давление на какой-либо высоте
Пусть P – давление на высоте h, а – на высоте .
Выведем закон изменения давления с высо-той, предполагая, что 1) поле тяготения однородно, 2) температура постоянна и
3) масса всех молекул одинакова.
Слайд 25
– плотность газа на высоте h (
где С = Р0 – давление на высоте
.
- барометрическая
формула
Слайд 26 Причём , dР
- барометрическая
формула
Слайд 27 Из барометрической формулы следует, что P убывает с высотой
Слайд 33 Распределение Бозе-Эйнштейна
и Ферми-Дирака
Если у
Поведение такой системы описыва-ется квантовой статистикой, в осно-ве которой лежит принцип неразличи-мости тождественных частиц.
Слайд 34 Основная задача квантовой статистики состоит в определении среднего числа
Слайд 36 Первая формула описывает квантовые частицы с целым спином (собственный момент количетсва
Слайд 37
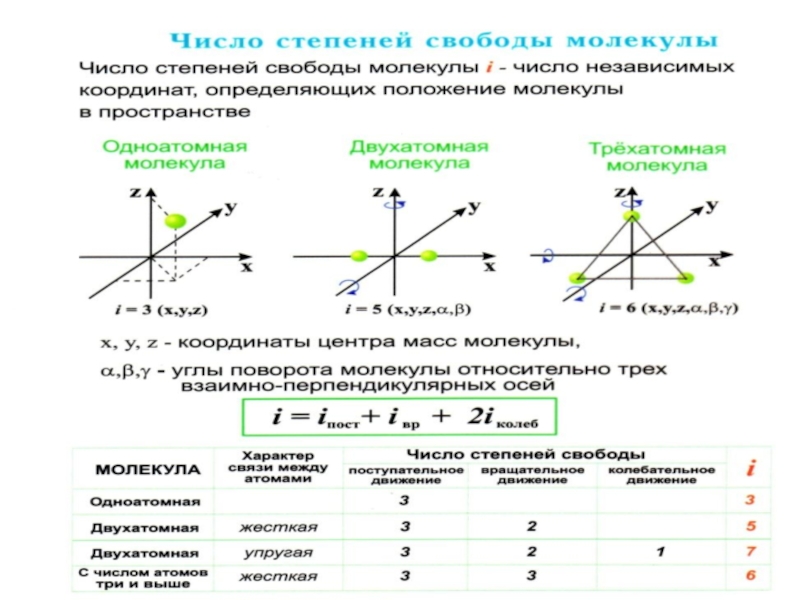
Число независимых координат, определяющих конфигурацию и положение
Одноатомный газ – система невзаимодействующих материальных точек. Атом обладает тремя
поступательными
степенями свободы.
Число степеней свободы
Слайд 38 Числом степени свободы называется число независимых переменных, опреде-ляющих
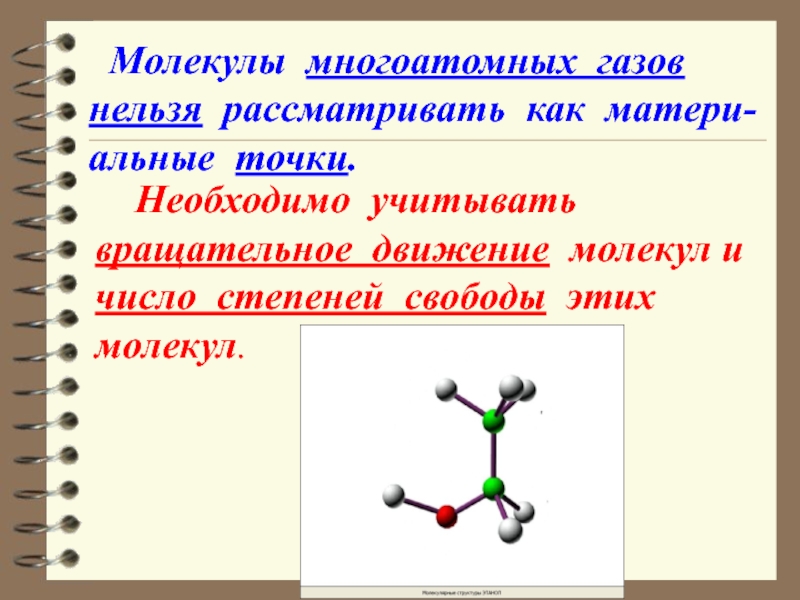
Слайд 39 Необходимо учитывать вращательное движение молекул и число степеней свободы
Молекулы многоатомных газов нельзя рассматривать как матери-альные точки.
Слайд 40 Многоатомная молекула может ещё и вращаться. Например, у двухатомных
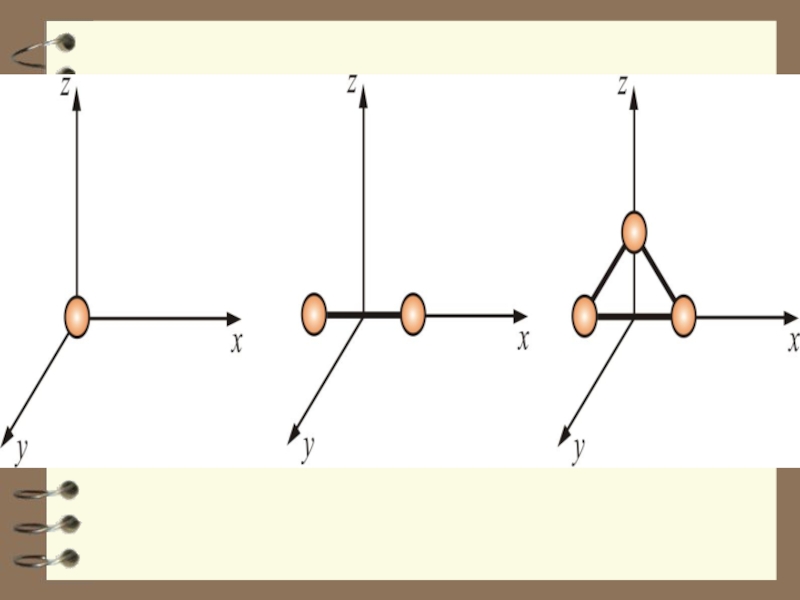
Слайд 42Двухатомная молекула, состоящая из жестко связанных атомов, обладает
тремя поступательными (центр
Слайд 43 Трехатомная (многоатомная) моле-кула, состоящая из жестко связанных атомов, обладает
Если возможны колебания атомов, то добавляется колебательная степень свободы.
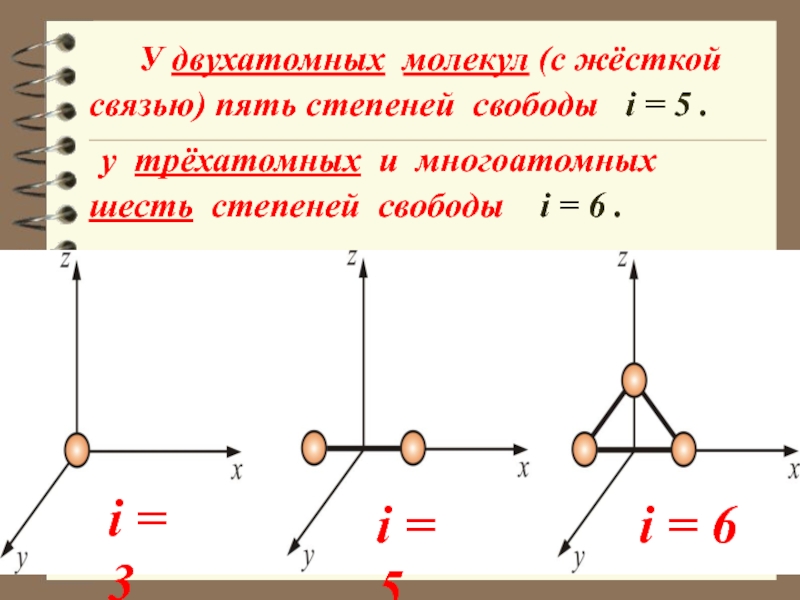
Слайд 44 У двухатомных молекул (с жёсткой связью) пять степеней свободы
у трёхатомных и многоатомных шесть степеней свободы i = 6 .
i = 6
i = 5
i = 3
Слайд 46 При взаимных столкновениях молекул возможен обмен их энергиями и превращение энергии
Слайд 47 Средняя энергия поступательного движения молекулы равна:
Независимо от общего числа
поэтому на каждую из них приходится в среднем одинаковая энергия, равная
1/3 значения Е, т.е.
Слайд 48 Больцман доказал, что, средняя энергия
Закон о равномерном распределении энергии по
степеням свободы
Слайд 49 В классической статистической физике выводится закон Больцмана о равномер-ном
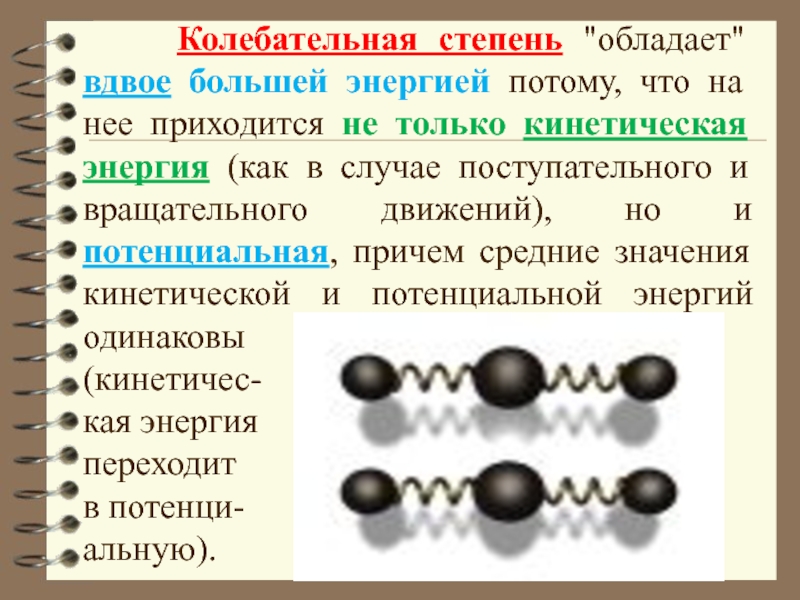
Слайд 50 Колебательная степень "обладает" вдвое большей энергией потому, что
(кинетичес-
кая энергия
переходит
в потенци-
альную).
Слайд 52У одноатомной молекулы i = 3, тогда
Слайд 53 На среднюю кинетическую энер-гию молекулы, имеющей i-степеней свободы приходится
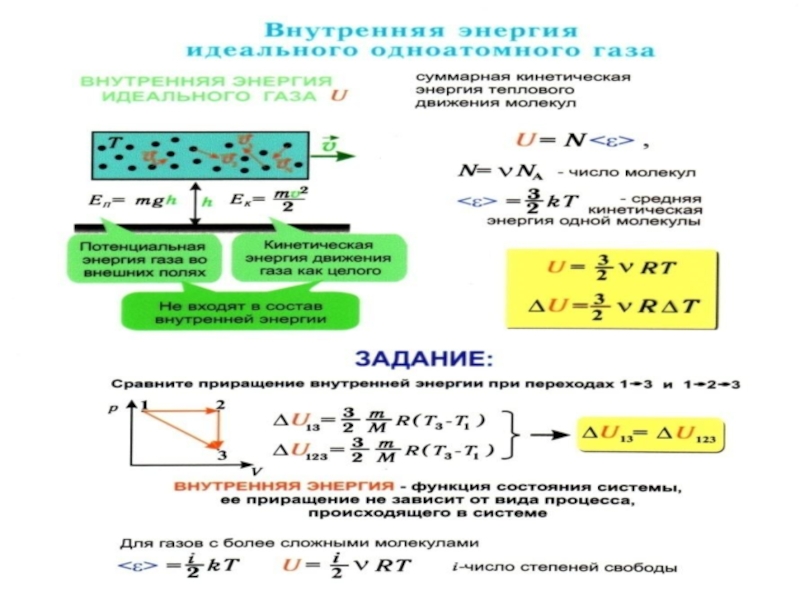
Слайд 54Теплоёмкости одноатомных и многоатомных газов
Внутренняя энергия одного моля одноатомного идеального газа
Слайд 56 Внутренняя энергия одного моля идеального газа c i степенями свободы равна:
молярная теплоёмкость при постоянном объеме СV – величина постоянная, от температуры не зависит.
Слайд 58
Для одного моля идеального газа с i
Постоянная адиабаты (коэффициент Пуассона) для идеального
газа:
Для одноатомного идеаль-
ного газа (i = 3):
Слайд 62 Для произвольного количества газов ( для ν молей ):
Слайд 64 Для одноатомных газов это выполняется в очень широких
Слайд 65 При увеличении температуры, когда
Т > 1000 К, начинают сказываться
Слайд 66Одна колебательная степень свободы несет энергии, так
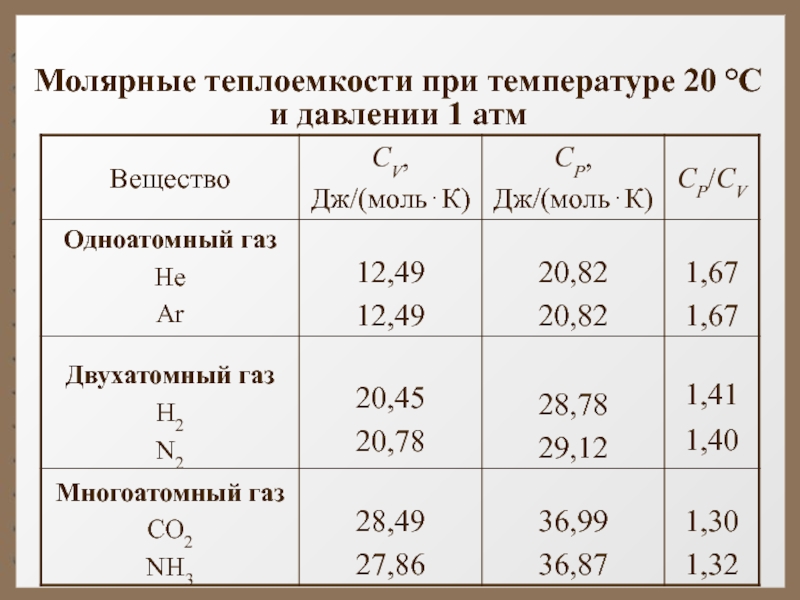
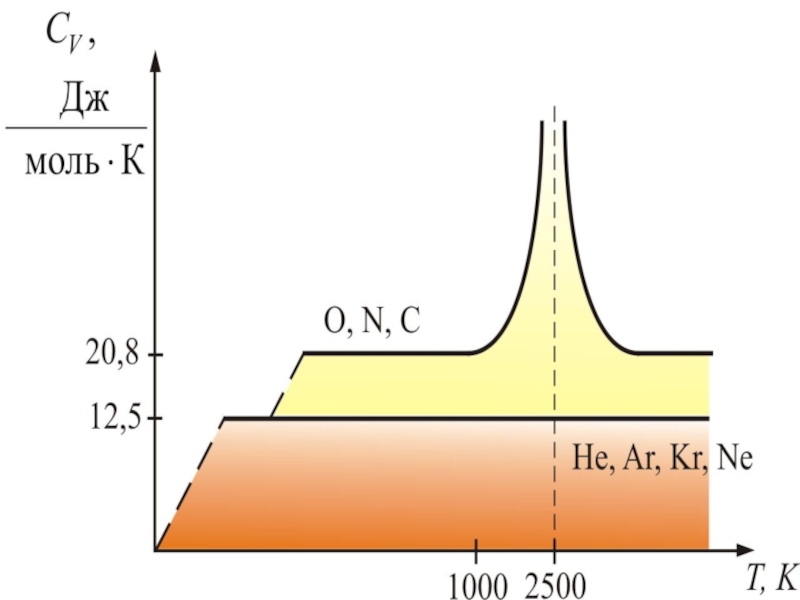
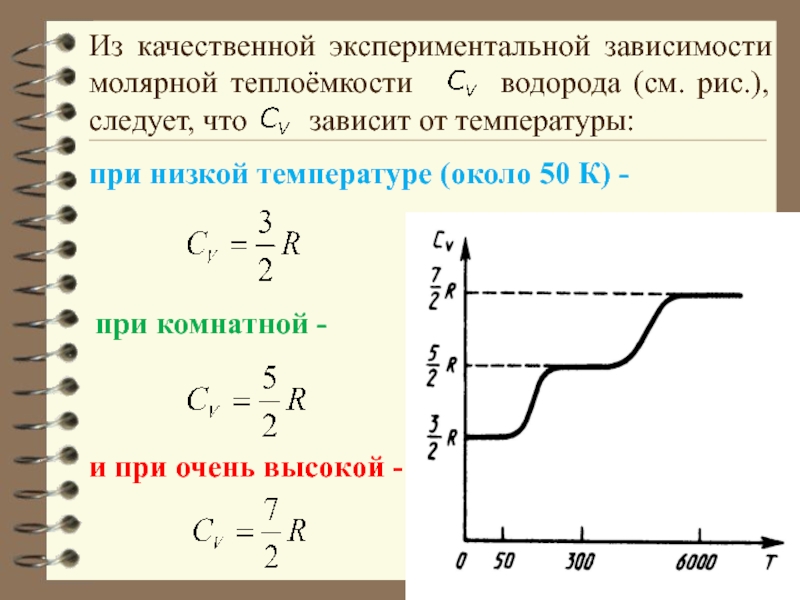
Слайд 68Из качественной экспериментальной зависимости молярной теплоёмкости водорода (см.
при низкой температуре (около 50 К) -
при комнатной -
и при очень высокой -
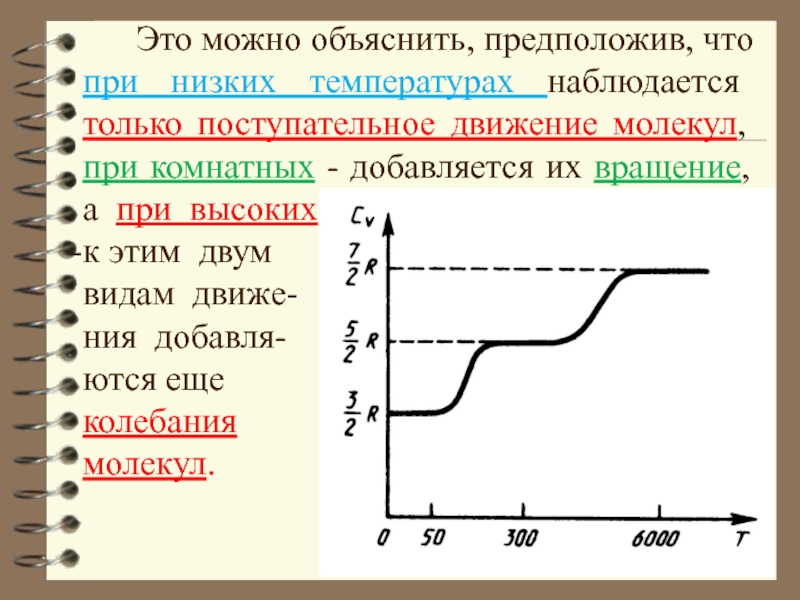
Слайд 69 Это можно объяснить, предположив, что при низких температурах
к этим двум
видам движе-
ния добавля-
ются еще
колебания
молекул.
Слайд 70 Расхождение теории и эксперимента нетрудно объяснить. Дело
Слайд 71к ней не применим закон равнораспределения энергии). Этим объясняется, что теплоемкость
вместо при высоких температурах.
Аналогично можно объяснить уменьшение теплоёмкости при низкой температуре ("замораживаются" вращательные степени свободы) и увеличение при высокой ("возбуждаются" колебательные степени свободы).