- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Анализ кинетической модели химических превращений. (Тема 4.4) презентация
Содержание
- 1. Анализ кинетической модели химических превращений. (Тема 4.4)
- 2. Тема 4.4 Анализ кинетической модели химических превращений: Необратимые реакции; Обратимые реакции.
- 3. Анализ кинетической модели химических превращений Простая
- 4. Анализ кинетической модели химических превращений Зависимость скорости
- 5. Анализ кинетической модели химических превращений
- 6. Анализ кинетической модели химических превращений Кинетическое уравнение газофазной необратимой реакции
- 7. Анализ кинетической модели химических превращений Сложнопараллельная реакция
- 8. Анализ кинетической модели химических превращений Дифференциальная селективность
- 9. Анализ кинетической модели химических превращений Дифференциальная
- 10. Анализ кинетической модели химических превращений
- 11. Анализ кинетической модели химических превращений
- 12. Анализ кинетической модели химических превращений Сложно-последовательная
- 13. Анализ кинетической модели химических превращений Простая
- 14. Анализ кинетической модели химических превращений
- 15. Анализ кинетической модели химических превращений Зависимость
- 16. Анализ кинетической модели химических превращений Зависимость
- 17. Анализ кинетической модели химических превращений Влияние
- 18. Анализ кинетической модели химических превращений Исходные
- 19. Анализ кинетической модели химических превращений Кинетическое
- 20. Анализ кинетической модели химических превращений
- 21. Анализ кинетической модели химических превращений Влияние
- 22. Анализ кинетической модели химических превращений Продукты
- 23. Анализ кинетической модели химических превращений Кинетическое
- 24. Анализ кинетической модели химических превращений
- 25. Анализ кинетической модели химических превращений
- 26. Анализ кинетической модели химических превращений Газофазные
- 27. Скорость тепловыделения Скорость тепловыделения q определяет
Слайд 2Тема 4.4
Анализ кинетической модели химических превращений:
Необратимые реакции;
Обратимые реакции.
Слайд 3Анализ кинетической модели химических превращений
Простая необратимая реакция
А = R
Кинетическое
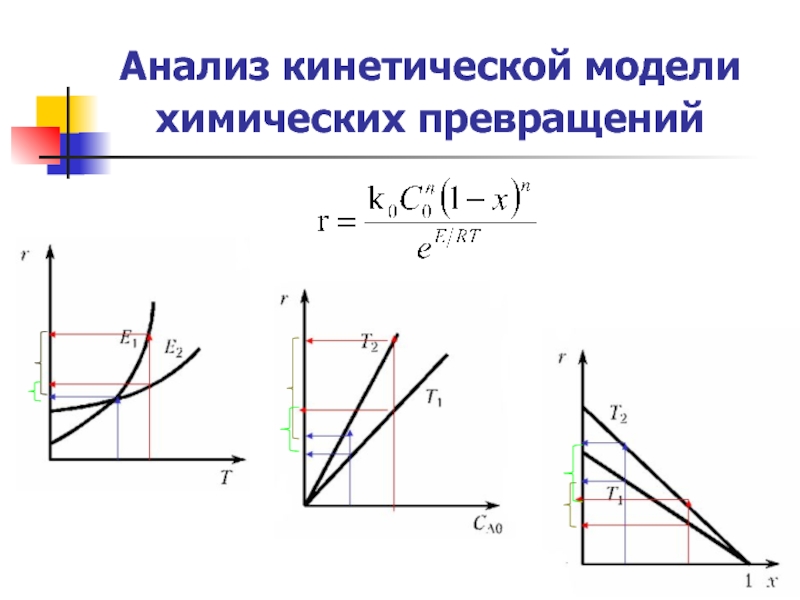
Слайд 4Анализ кинетической модели химических превращений
Зависимость скорости простой необратимой реакции r от
Слайд 6Анализ кинетической модели химических превращений
Кинетическое уравнение газофазной необратимой реакции
Слайд 8Анализ кинетической модели химических превращений
Дифференциальная селективность — отношение скорости превращения исходного
При составлении кинетической модели сложнопараллельной реакции необходима зависимость, связывающая дифференциальную селективность с влияющими параметрами реакции.
Слайд 9Анализ кинетической модели химических превращений
Дифференциальная селективность образования продуктов
Слайд 11Анализ кинетической модели химических превращений
Влияние температуры Т на дифференциальную селективность
Слайд 13Анализ кинетической модели химических превращений
Простая обратимая реакция
Если частные реакции в
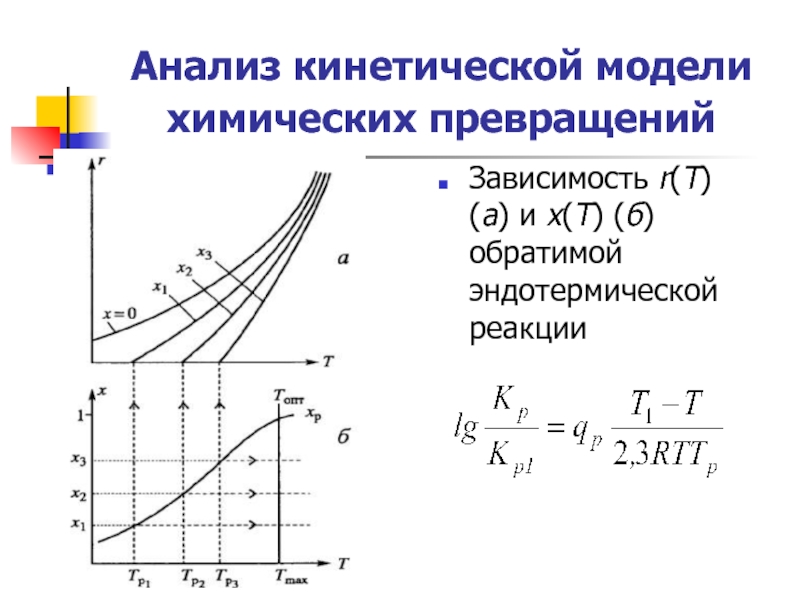
Слайд 15Анализ кинетической модели химических превращений
Зависимость r(Т) (а) и х(Т) (б)
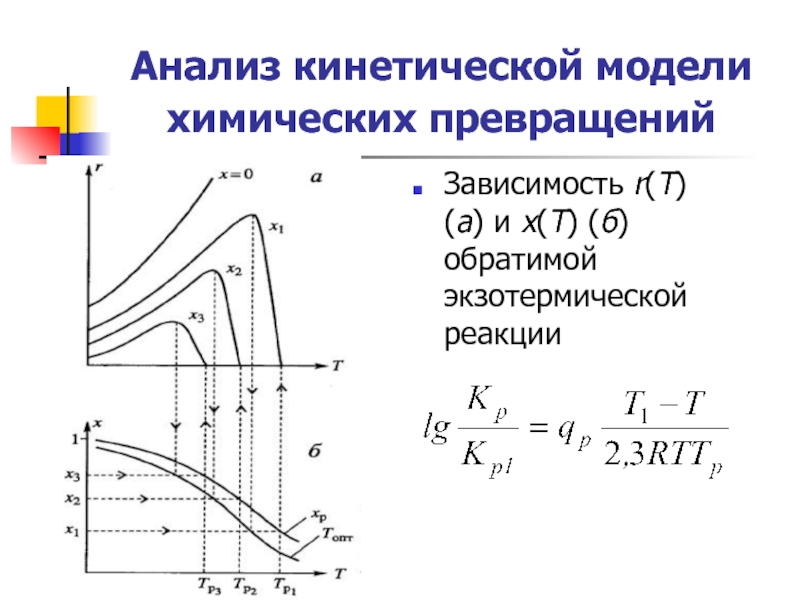
Слайд 16Анализ кинетической модели химических превращений
Зависимость r(Т) (а) и х(Т) (б)
Слайд 17Анализ кинетической модели химических превращений
Влияние давления на кинетику газофазной обратимой
Слайд 18Анализ кинетической модели химических превращений
Исходные реагенты взяты в равных мольных
Слайд 19Анализ кинетической модели химических превращений
Кинетическое уравнение газофазной обратимой реакции, протекающей
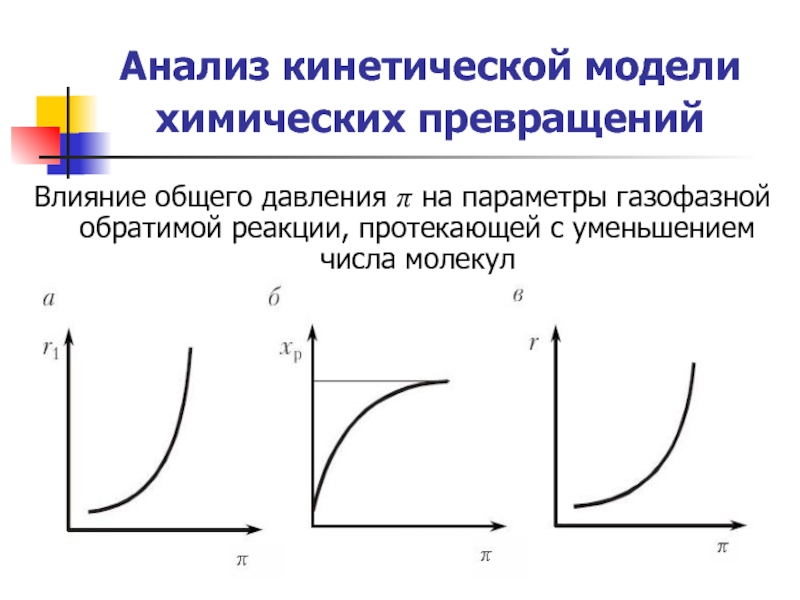
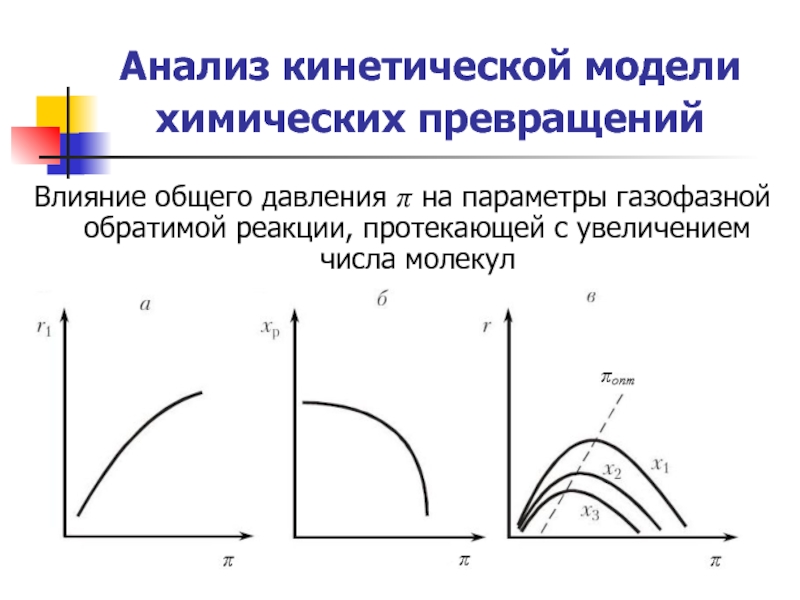
Слайд 20Анализ кинетической модели химических превращений
Влияние общего давления π на параметры
Слайд 21Анализ кинетической модели химических превращений
Влияние давления на кинетику газофазной обратимой
Слайд 22Анализ кинетической модели химических превращений
Продукты реакции образуются в эквимолярных количествах,
Слайд 23Анализ кинетической модели химических превращений
Кинетическое уравнение газофазной обратимой реакции, протекающей
Слайд 24Анализ кинетической модели химических превращений
Влияние общего давления π на параметры
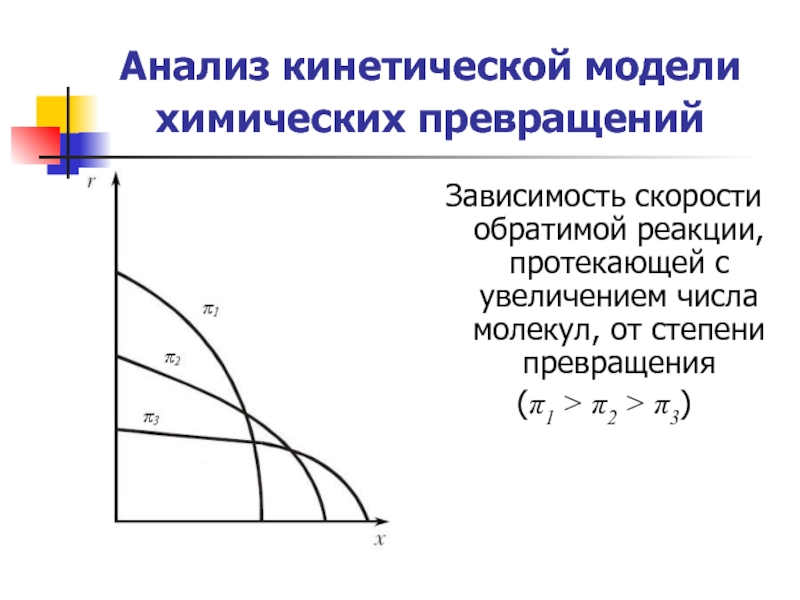
Слайд 25Анализ кинетической модели химических превращений
Зависимость скорости обратимой реакции, протекающей с
(π1 > π2 > π3)
Слайд 26Анализ кинетической модели химических превращений
Газофазные обратимые реакции: влияние давления на
ΔN = (νR – νS) – (νА – νВ).
При повышении давления равновесие смещается:
а) при ΔN < 0 вправо, в сторону получения целевого продукта;
б) при ΔN > 0 влево, в сторону исходных веществ;
в) при ΔN = 0 равновесие не изменяется.
Слайд 27Скорость тепловыделения
Скорость тепловыделения q определяет количество теплоты, выделяющейся в реакции,
q = qр·r
Скорость тепловыделения при протекании сложной реакции