- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Termodünaamika. Entroopia. (Loeng 8) презентация
Содержание
- 1. Termodünaamika. Entroopia. (Loeng 8)
- 2. Suurt ja olulist osa loodusenähtustest kirjeldatakse kui
- 3. Termodünaamika 1. seadus (energia jäävuse seadus): Energia
- 4. Seega - termodünaamika on teadus, mis uurib
- 5. NB! Loomulikult on ka kõik keemilised protsessid,
- 6. Kuid kõigepealt meeldetuletus sellest, mis on töö
- 7. Tööd mõõdetakse njuutonmeetrites (N×m). Tööühikuks on džaul
- 8. Kuna ajalooliselt on termodünaamika oma kujunemisperioodil suuresti
- 9. Seega realiseerib aurumasinana (konverteerib tööks) – kirjeldatav
- 10. Juhin tähelepanu asjaolule, et ka aine igasugune
- 11. Esimese töötava aurumasina ehitas prantslane Papin
- 12. Watti aurumasina (1778) võimsus, ή=(T-T')/T, on
- 13. Ühekordse auru paisumisega juba täiustatud aurumasina rakendus,
- 14. NB! Kolmekordse auru paisumisega aurumasinad (seega -
- 15. Kolmekordese paisumisega aurumasin – temperatuuride vahe soojendaja
- 16. Selgitus: kolvi käigul alla kõigis kolmes silindris
- 17. Jääksoojuse mõistest paremaks arusaamiseks juhin tähelepanu, et
- 18. Kolmandast silindrist väljuv aur ei ole enam
- 19. Kvaliteetne energia – energia, mis teeb tööd,
- 20. Jääkenergia – soojusenergia – ehk energia, mis
- 21. Tööd on võimalik teha vaid potentsiaalide vahe
- 22. Eelmisel slidel toodud valem annab ka vastuse
- 23. Turbinia (Suur-Britannia), 1894, esimene aruturbiinlaev – juba
- 24. Kasuteguri piiriväärtuse algtingimusteks on: 1 – T0/T1.
- 25. Soojusliikumine gaasides - jääksoojuses – tegemist on
- 26. Energia – soojendamisel katsutis olev materjal paisub
- 27. Töö – soojus – soojus konverteerub tööks
- 28. Põhimõtteliselt toimub analoogiliselt arumasinates ja sisepõlemismootorites energia
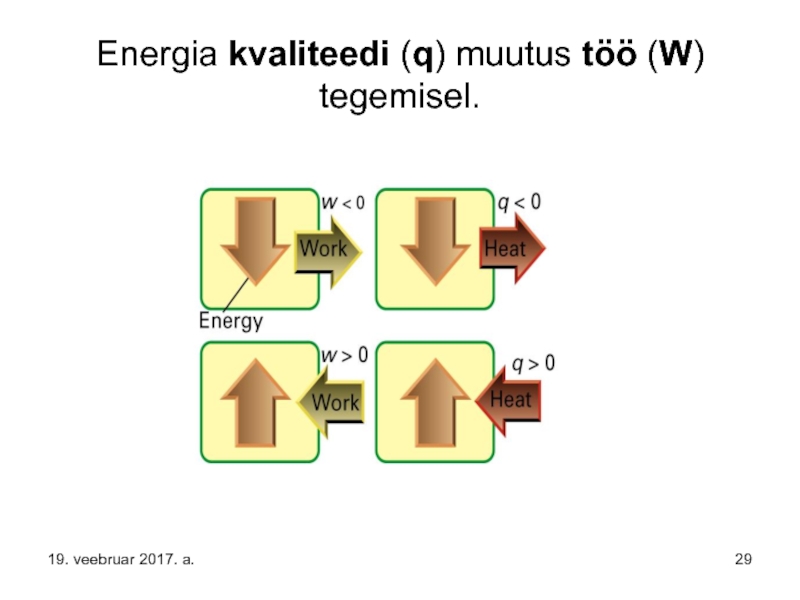
- 29. Energia kvaliteedi (q) muutus töö (W) tegemisel. 19. veebruar 2017. a.
- 30. Meeldetuletus järgneva paremaks mõistmiseks – Gaaside
- 31. Selgitus-meeldetuletus järgneva asjus. 1 cm3 gaasis on
- 32. Kuna keemia huvisfääris vaadeldakse osakesi (molekule, aatomeid),
- 33. Soojusliikumise juurde tagasi. Ideaalse gaasi rõhk on
- 34. Kusjuures k on BOTZMANNI KONSTANT. k
- 35. Selgitus Boltzmanni konstandi asjus. Iga kuupsentimeeter gaasi
- 36. Seega - R = 1,38x10-16 x
- 37. Keha siseenergia on molekulide mikroskoopilise liikumisega seotud
- 38. Mikrokoopiline energia ei pruugi muutuda, kui lisada
- 39. Teisalt aga kehade siseenergia, mis väljendub molekulide
- 40. Vannivees on aga osakeste liikumiskiirus jagunenud lihtsalt
- 41. Kui lämmastiku molekulid liiguksid ka suurima talvise
- 42. Järgneval slidedel on veel mõned suurused, mis
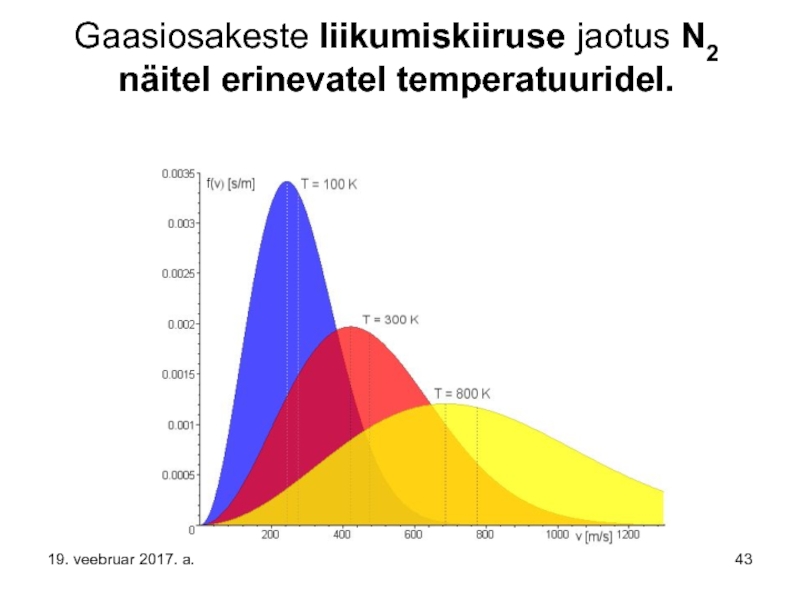
- 43. Gaasiosakeste liikumiskiiruse jaotus N2 näitel erinevatel temperatuuridel. 19. veebruar 2017. a.
- 44. Näide: Vee pumpamiseks ja soojendamiseks kuluva energia
- 45. Vabaenergia ja seotud energia. Kuna aga keha
- 46. Temperatuuur on aatomite ja molekulide mikroskoopilises skaalas
- 47. Kui lisandub ka osakeste pöördliikumine (nt. molekul
- 48. Soojusmahtuvuseks nimetatakse soojushulka, mis on vajalik antud
- 49. Mida rohkem on osakeste liikumise võimalikke vabadusastmeid,
- 50. Soojusmahtuvus sõltub nii aine olekust (mida võib
- 51. Süsteemi olekut iseloomustatakse olekuparameetritega ja olekufunktsioonidega; Olekuparameetrid
- 52. Soojusliikumine tahkises – osakeste liikumine on piiratud
- 53. Temperatuur ei iseloomusta kogu siseenergiat, vaid ainult
- 54. Soojuse mehhaaniline ekvivalent. Soojuse ülekanne ja
- 55. Soojus muudab keha siseenergiat ning soojuse arvel
- 56. Et asi oleks veidi selgem, siis sõnastame
- 57. Keha siseenergia (U) muutus on võrdne kehale
- 58. Seega, tulenedes eelnevast sõnastame töö mõiste veidi
- 59. Eelneva moraal tundub olevat kõige muu kõrval
- 60. Üks teeklaas bensiini kaalub 170 grammi, selle
- 61. Keemias – termodünaamika põhjendab ühe või teise
- 62. Üheski loodusnähtuses ei saa energia jäljetult kaduda
- 63. Märkus „energia tootmise“ kohta. Loodusteaduse mõttes on
- 64. Korrastatus ja korrastamatus kui loodusseadus. Täiendavalt mikroprotsessidele
- 65. Need kaks – kineetiline ja potentsiaalne energia
- 66. TERMODÜNAAMIKA 2. SEADUSE (Soojus ei saa iseenesest
- 67. Rudolf Julius Emanuel Clausius (2. jaanuar 1822
- 68. Ja veel termodünaamika 2-sest seadusest: Soojus ei
- 69. Energia kvaliteeti iseloomustab hästi ka Teile juba
- 70. Entroopia on termodünaamikas kasutatav ekstensiivne suurus, mis
- 71. Entroopia on üks termodünaamika (ja kogu loodusteaduste)
- 72. Protsessid, milles entroopia kahaneb, saavad toimuda vaid
- 73. Entroopia ja termodünaamika 2 seadus. Iseenesliku protsessi
- 74. kõik protsessid looduses toimuvad iseenesest ainult ühes
- 75. Spontaanne (iseeneslik) protsess – soojus läheb iseeneslikult
- 76. Töö – soojus – paisumisel gaas jahtub,
- 77. Seega on termodünaamika II seadus sõnastada ka
- 78. Tõenäosus, et gaasiga täidetud anuma mõlemas pooles
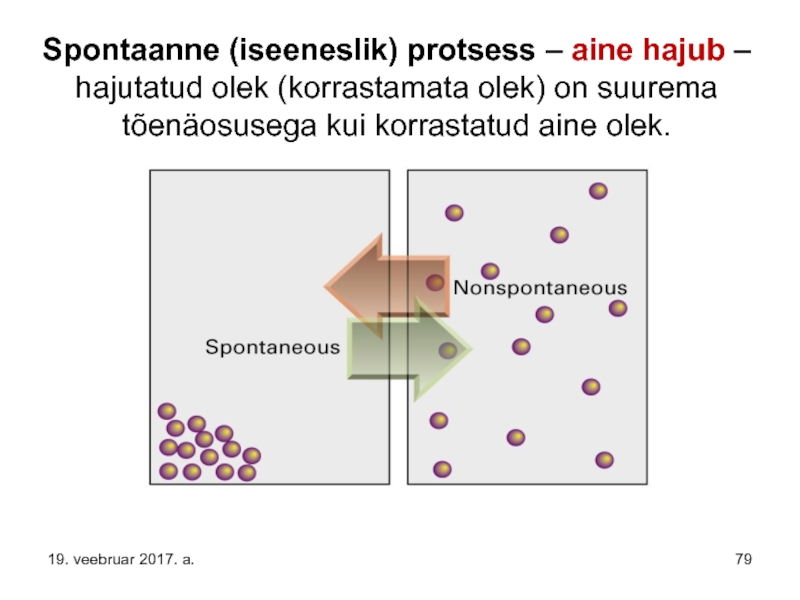
- 79. Spontaanne (iseeneslik) protsess – aine hajub –
- 80. Suurima tõenäosusega oleku saabumisel on tulemus universaalne:
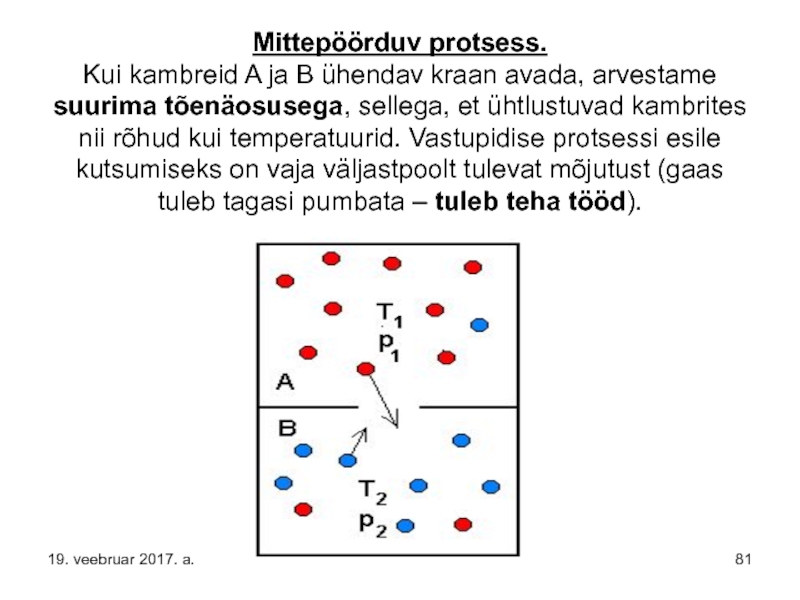
- 81. Mittepöörduv protsess. Kui kambreid A ja B
- 82. Seletus eelneva osas. Igasuguse molekulide jaotuse tõenäolisus
- 83. Eelneva illustreerimiseks – kujutage ette, et teil
- 84. Valgete ja mustade kuulikeste jaotumist kihiti võib
- 85. Entroopia määra põhivõrrand on: S = k×lnW,
- 86. Suurus W on aatomite ja molekulide
- 87. Boltzmanni valemi järgi arvutatud entroopiat nimetatakse statistiliseks
- 88. SEEGA määratletakse entroopiat tõenäosuse (mikroolekute) W (tegemist
- 89. Positsiooniline korrastatus-korrastamatus aines (CO). Kui aines on
- 90. L. Bolzmann’i (1844 -1906) hauasammas Viinis –
- 91. Miks muutub korrapärane mehhaaniline liikumine korrapäratuks soojusliikumiseks?
- 92. Entroopia kasvamise seadus on tähtsaim loodusseadus –
- 93. Töö – soojus – paisumisel gaas jahtub,
- 94. Gaasi paisumisel entroopia (korrastamatus) kasvab logaritmiliselt (lnW). 19. veebruar 2017. a.
- 95. Energia jäävuse seadus on mehhaanika seadus, sellele
- 96. Eelnevast tulenebki, et oma olemuselt on termodünaamika
- 97. Entroopia kasvamise seadus määrab protsesside kulgemise suuna.
- 98. Entroopia kasvu seadus tähendab süsteemide üleminekut maksimaalse
- 99. Viimane tõsiasi on aluseks olnud Maailma kujunemiseks
- 100. Just paljukomponendiliste süsteemide üleminek suurema statistilise tõenäosusega
- 101. Mida keerukam on süsteem, mida korrapärasem ta
- 102. Seega - jah, energiat on võimalik kontsentreerida,
- 103. Ja veel „energia tootmise“ asjus: teame eelnevast,
- 104. Siit ja seega saame sõnastada 4 ajatut
- 105. Printsiip C. Objekti aeg-ruumi omadused või sündmused
- 106. Näiteid entroopia muutumisest. Entroopia kasv ΔS >
- 107. Jää sulab ? korrastatus väheneb ? entroopia suureneb. 19. veebruar 2017. a.
- 108. Jääkentroopia jääs. Igal vee molekulil kaks pikka
- 109. Tahke aine sulamisel korrastatus väheneb – entroopia suureneb. 19. veebruar 2017. a.
- 110. Ja lisaks veel mõned Murphy seadustest,
- 111. Entroopia – kordame üle. Seotud energia moodustab
- 112. Tööd iseloomustab osakeste korrapärane kollektiivne liikumine, soojust
- 113. Mitte mingil juhul ei saa isoleeritud makrosüsteemi
- 114. Suletud ja avatud süsteemid. 19. veebruar 2017. a.
- 115. Entroopia. Seega – suletud süsteemis, milles
- 116. Maailm tunneb vaid üht süsteemi, kus toimub
- 117. Elu Maakeral, kogu fossiilkütuste põletamisel põhinev energeetika
- 118. Fotosüntees on suurim redoksreaktsioon mis Maal tema
- 119. Entroopia Päikesel suureneb ja negentoopia (korrastatus) kasvab
- 120. Fotosüntees (kreeka photo- 'valgus' + synthesis –
- 121. Fotosünteesi kindlustamisel ja meie elu aluseks olev
- 122. Fotosünteesi lihtsustatud üldvalemina: 6CO2 + 12H2O +
- 123. Aktivatsioonienergia barjäärid ja vabaenergia suurenemine↔vähenemine reaktsiooniproduktides. Eksotermiline
- 124. Fotosünteesi protsesside – fotosünteetilise oksüdeerimise - tulemusena
- 125. Kordame üle: fotosünteesi reaktsiooni tulemusena seotud CO2
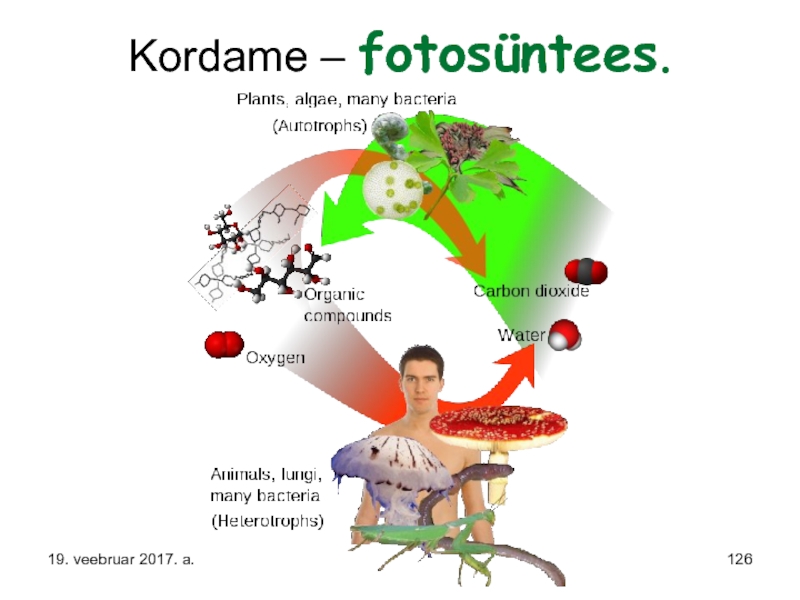
- 126. Kordame – fotosüntees. 19. veebruar 2017. a.
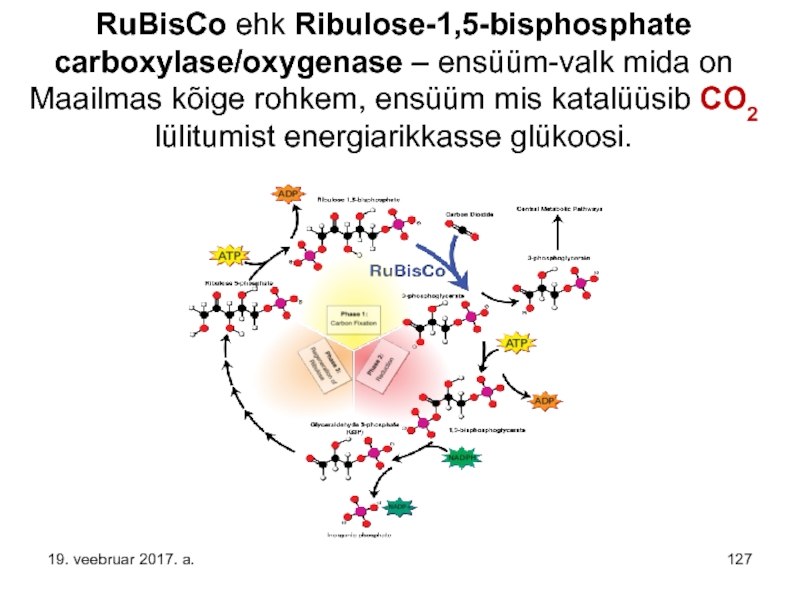
- 127. RuBisCo ehk Ribulose-1,5-bisphosphate carboxylase/oxygenase – ensüüm-valk mida
- 128. 19. veebruar 2017. a.
- 129. 19. veebruar 2017. a.
- 130. Juhin siinjuures tähelepanu asjaolule, et rohelistele taimedele
- 131. Loomsete organismide puhul on need kaks poolt
- 132. Maakera elustiku tagajaks - negentroopia allikaks
- 133. Kasuteguri piiriväärtus on: 1 – T0/T1. Oluline
- 134. Nii kehtib termodünaamika II seadus ka Maailmaruumis
- 135. Vaatleme veelkord eelpoolesitletud materjali veidi igapäevasemast, kuid
- 136. Kuid entroopia kasvu seadus on niisama fundamentaalne
- 137. Kordan veel – energia jäävuse seadus ütleb,
- 138. On ainult üks võimalus igasuguste muutumiste teostamiseks
- 139. Kuid NB! – palun mitte unustada, et
- 140. Toon eelneva illustreerimiseks veelkord näite elusloodusest –
- 141. Keskkonnakaitsega seoses tehakse pahatihti juttu jäätmevabast tootmisest.
- 142. Täpselt sama järeldus on kehtiv majanduslikult edukate
- 143. Kui süsteemi temperatuurid on ühtlustunud (kui kaob
- 144. Energia jäävuse seaduse seisukohalt on kõik kallihinnaline
- 145. Soojussurmas on isekulgev protsess maksimiseerinud oma korrastamatuse,
- 146. Universumi soojussurm (termodünaamiline paradoks) tekib siis kui
- 147. Soojus läheb alati üle soojemalt kehalt külmemale,
- 148. Kuna aga suure tõenäosusega pole Universum igavene,
- 149. …mille arvel ja klorofülli vahendusel konverteeritakse see
- 150. Kui Universum oleks igavene, siis peaks kogu
- 151. Kordame veelkord! See, et Maakeral midagi toimub
- 152. Seni kuni mateeria areng on tähtede faasis,
- 153. Üheks selliseks “saarekeseks” kus täht mille nimi
- 154. Paljud keemilised reaktsioonid kulgevad spontaanselt vaid ühes
- 155. Igas spontaanses protsessis peab süsteemi ja seda
- 156. Vedeliku keetmisel suureneb süsteemi entroopia, sest molekulide
- 157. Tõstes liikmed ümber Carnot protsessi kirjeldavas võrduses
- 158. A Termodünaamika II printsiibi mõned formuleeringud: 1)
- 159. 2) On võimatu selline protsess, mille ainus
- 160. Taoline masin – on sama võimatu kui
- 161. Kordame - Termodünaamika II seadus. Isoleeritud termodünaamlise
- 162. Entroopia iseloomustab mingi antud protsessi puhul energia
- 163. Elektripliidil vee keemajamisel soojuseks konverteeritud elektrienergia
- 164. Või kui ja veelkord - Teie liikuva
- 165. Entroopia ja seotud energia mõisted on seega
- 166. Seda suurust TS nimetakse seotud energiaks. Seega
- 167. Clausius formuleeris termodünaamika teise seaduse järgnevalt: igasuguse
- 168. Spontaanne (iseeneslik) protsess – soojus hajub – osakeste parameetrid ühtlustuvad. 19. veebruar 2017. a.
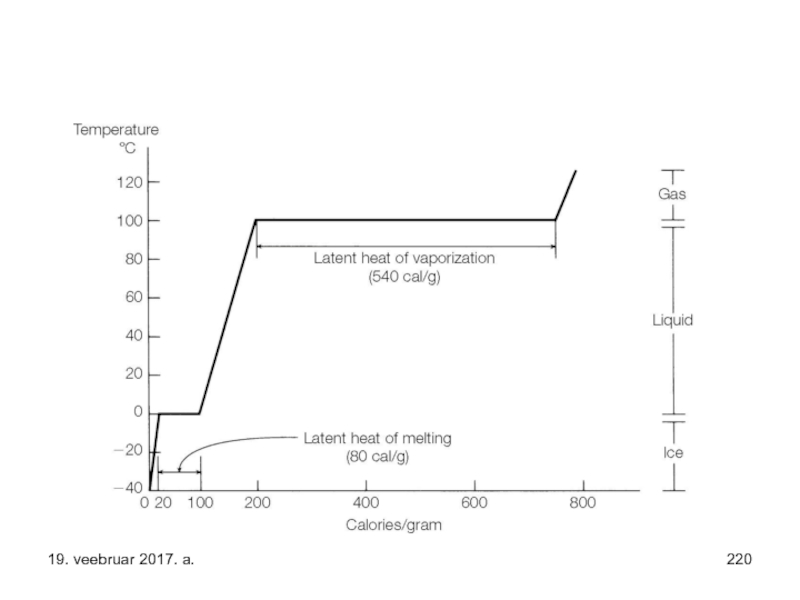
- 169. Seega – protsess on spontaanne (iseeneslik), kui
- 170. Kristallid, ideaalselt korrastatud struktuuriga temperatuuri absoluutse nulli
- 171. Lähtudes eelnevast võib sõnastada ka lause: temperatuuri
- 172. Seotud energia – siseenergia väärtusetu osa väljendamisel
- 173. Seega - siseenergiat U pole võimalik täielikult
- 174. Praktikas ei määrata U ja S väärtusi
- 175. Vabaenergiast lihtsalt. Vast kõige lihtsamal moel võib
- 176. Ja veel vabaenergiast – Te keerasite üles
- 177. Aktivatsioonienergia barjäärid ja vabaenergia suurenemine↔vähenemine reaktsiooniproduktides. Eksotermiline
- 178. Entroopia muutused on jälgitavad, kui panna soojuslikult
- 179. Seepärast on soojusenergia kõige madalamat, kõige kehvemat
- 180. ENTROOPIA (S) on energia kvaliteeti iseloomustav füüsikaline
- 181. Süsteemi siseenergia. Kui termodünaamiline süsteem ei võta
- 182. Süsteemi siseenergia. Termodünaamilisele süsteemile on omane teatav
- 183. Süsteemi siseenergia U koosneb süsteemi moodustavate ainete
- 184. Kui antud süsteemis märkida “kadumaminevat” (hajuvat) energiat
- 185. Süsteemi siseenergiast veel. SEEGA Isoleeritud süsteemis toimunud
- 186. Maxwelli’i deemon (Nature 1874). 19. veebruar 2017. a.
- 187. Maxwelli deemon. See on piltlik kujund
- 188. Kuidas on lood tegelikult, on probleem koos
- 189. Matemaatikud on näiteks seisukohal, et entroopia kasvu
- 190. "Deemon", kes veel sada aastat tagasi oli
- 191. Eelneva jätkuks seoses entroopia küsimustega sobib hästi
- 192. Soojusefekt - soojushulk, mis püsival temperatuuril eraldub
- 193. Hessi seadus selle klassikalisel näitel. Soojusefekt,
- 194. 19. veebruar 2017. a.
- 195. Näiteks soojusefekt reaktsioonis. C(grafiit) +
- 196. Hessi seadus kokkuvõtvalt. Muutus süsteemi energias, mis
- 197. Veel - näitena eelneva kohta: kui
- 198. Siseenergia juurde tagasi. Termodünaamika I seadus =
- 199. qv=ΔU, kus qv – püsival ruumalal toimuva
- 200. Protsessi koguenergia kannab nimetust entalpia. ΔH= ΔG
- 201. Keemilise reaktsiooni kulgemisel kas eraldub või neeldub
- 202. Entalpia. Gaasireaktsioonidel esineb süsteemi ruumala muutus, püsivaks
- 203. Termodünaamika I seaduse põhjal: qp – w
- 204. Vabaenergia mõiste praktilisemaks kasutamiseks võeti kasutusele uus
- 205. Mittepaisumistöö hõlmab ka lihaste töö ja närvisignaalide
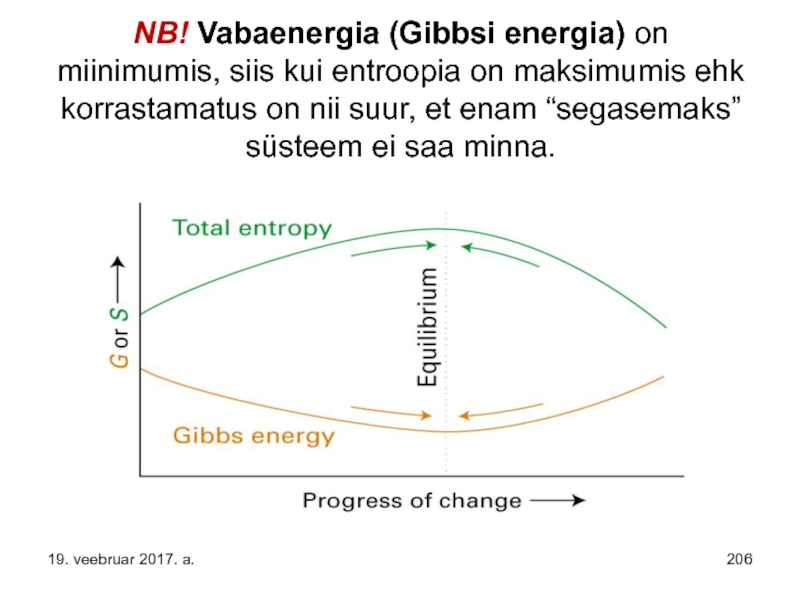
- 206. NB! Vabaenergia (Gibbsi energia) on miinimumis, siis
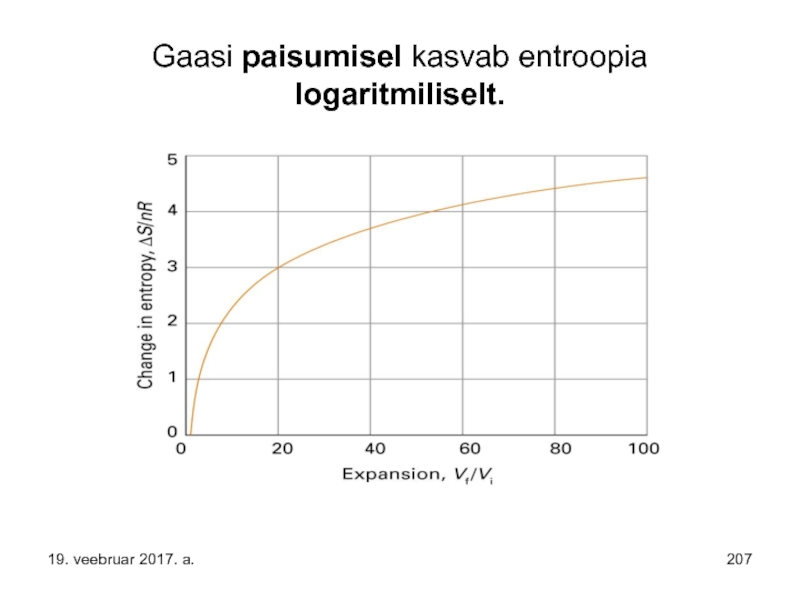
- 207. Gaasi paisumisel kasvab entroopia logaritmiliselt. 19. veebruar 2017. a.
- 208. Entalpia. Reaktsiooni energia ja reaktsiooni entalpia vahel
- 209. Hessi seaduse juurde. 19. veebruar 2017. a.
- 210. Endotermia – eksotermia. 19. veebruar 2017. a.
- 211. Selgitusi. Omavahel reageerivad ained on praktiliselt alati
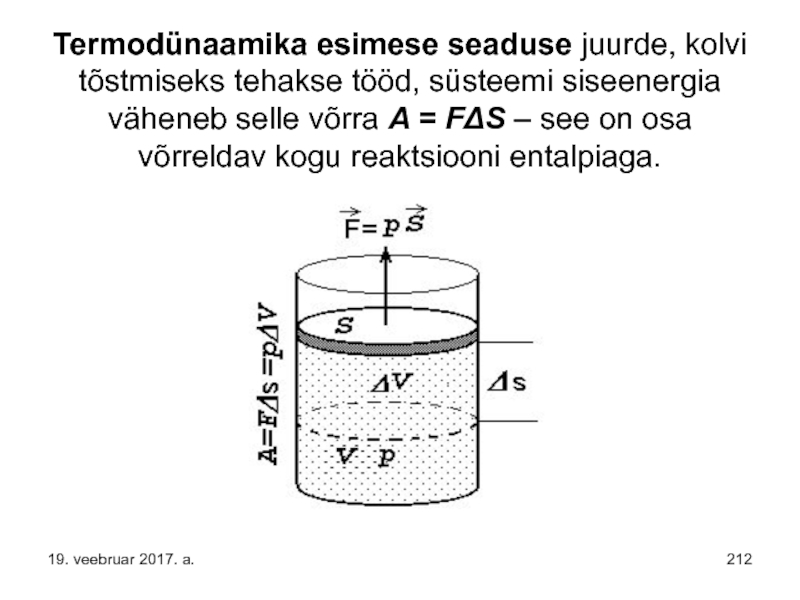
- 212. Termodünaamika esimese seaduse juurde, kolvi tõstmiseks tehakse
- 213. 2 H2 + O2 ? 2 H2O
- 214. 1 mooli metaani põlemisel CH4(g) + 2O2(g)
- 215. Reaktsiooni standardne entalpia. Soojusefekt (ΔH°) on entalpia
- 216. Näide: 4FeS2(s) + 11O2(g) = 2Fe2O3(s) +8SO2(g)
- 217. Soojenemiskõver. Sulamis- ja aurustumisentalpiad (aurustumise koguenergia) mõjutavad
- 218. Alles pärast jää sulamist hakkab temperatuur taas
- 219. Vedeliku soojenemiskõvera tõus on seda järsem, mida
- 220. f02-09-P088530 19. veebruar 2017. a.
- 221. Tekkesoojus - on 1 mooli ühendi tekkimisel
- 222. Aine põlemissoojuseks nimetatakse 1 mooli aine
- 223. Lisamaterjali loengule ja materjali loengus räägitu kordamiseks. 19. veebruar 2017. a.
- 224. Termodünaamika seadustele vastavalt toimub meie Maailmas kõik,
- 225. siis ühe või kahe valimisperioodi vältel jääb
- 226. „Rikastamise“ osas on aga enamasti selgitamata jäetud,
- 227. Olukorda, kus Maailmast on kadunud potentsiaalide vahe
- 228. Ja veel samal teemal, aga imeravimite kaudu
- 229. …eelduseks, nähtuseks, mille kaudu organismid väärindavad energiat,
- 230. …ehk organismi korrastamatus ei ole enam kokkusobiv
- 231. Ja veel – organismide kohastumine tagab mitte
- 232. Iga hälve, iga lihtsustus, mis tekitab selles
- 233. Ja nii vast ongi loodusseaduseks see, et
- 234. Kokkuvõtteks. Entroopia ja termodünaamika 2 seadus. Iseenesliku
- 235. ENTROOPIA (S) on energia kvaliteeti iseloomustav füüsikaline
- 236. Entroopia muut võimaldab otsustada, kas protsess on
- 237. Avatud süsteemides võib energia väheneda, kuid see
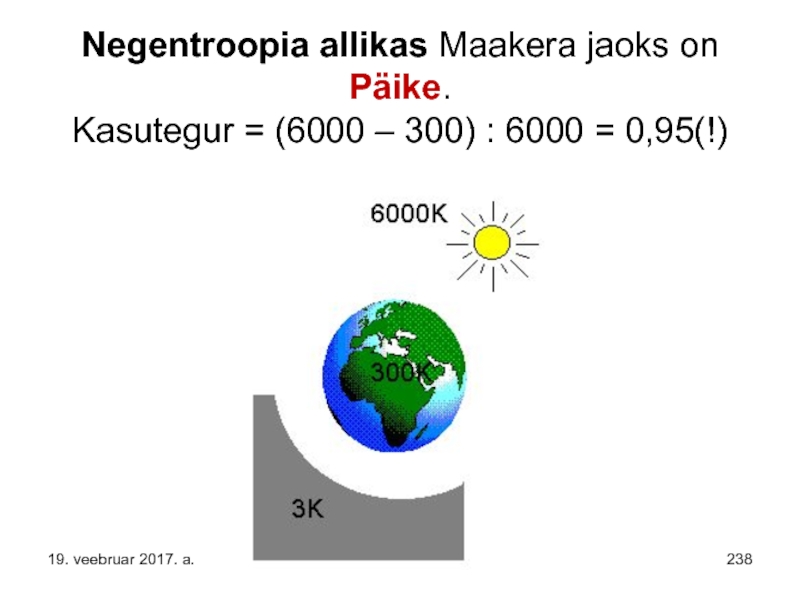
- 238. Negentroopia allikas Maakera jaoks on Päike. Kasutegur
- 239. Looduses põhiliselt endotermiliselt toimuv reaktsioonide võrgustik –
- 240. Külmkapi korral on jahutajaks külmkapis olev õhk,
- 241. Näiteid entroopia asjus. Kristallisatsioon – jahutatava vedeliku
- 242. Termodünaamika II seadusest EHK Soojus ei saa
- 243. Entroopia ja vabaenergia. 4 Fe(s) +
- 244. Metallide tootmisel maagist materjal korrastub, luuakse potentsiaalide
- 245. J.W.Gibbs (1839-1903) - ameerika füüsik-teoreetik, peam. tööd
- 246. Keemilise reaktsiooni suuna ja tasakaaluoleku kriteeriumid Gibbsi
- 247. Gibbsi energia muut ΔG avaldub reaktsioonientalpia ΔH
- 248. Iseeneslikud protsessid suletud süsteemis lõpevad alati tasakaaluolekuga.
- 249. G muutumine keemilise reaktsiooni käigus.
- 250. Iseeneslike protsesside puhul on alati ΔG 0)
- 251. Endotermilised reaktsioonid (ΔH > 0) saavad toimuda
- 252. Gaaside neeldumisega negatiivse ruumalaefektiga reaktsioonid (ΔS < 0) on entalpiafaktori mõju tõttu (kui ΔH
- 253. Aine tekke standartne Gibbsi energia (ΔGf0) –
- 254. Vabaenergia ja seotud energia. Eelnevast tuleneb omakorda,
- 255. Entroopia. Iga energiavorm (mehhaaniline, elektriline, keemiline jt.)
- 256. Tavatingimustes on molekulide kineetiline energia 2,5 kJ/mol
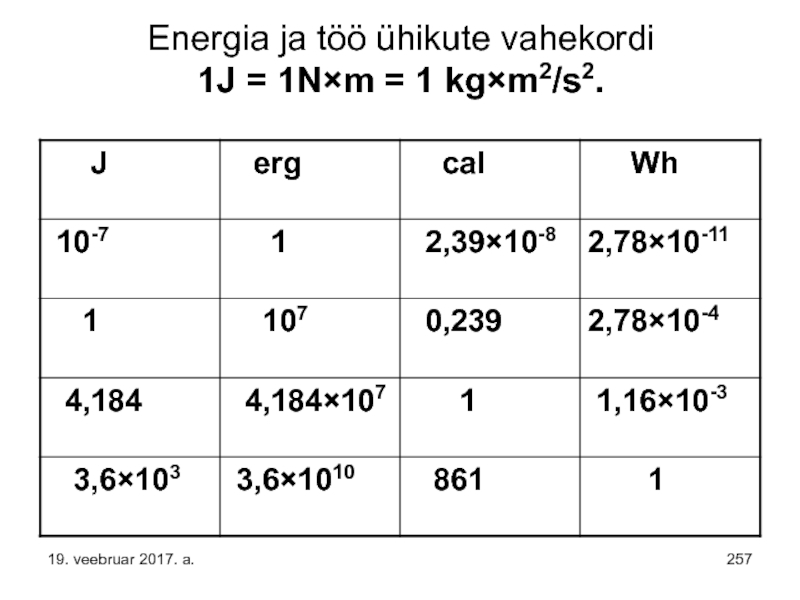
- 257. Energia ja töö ühikute vahekordi 1J
Слайд 2Suurt ja olulist osa loodusenähtustest kirjeldatakse kui soojusnähtusi – neist tuntumaid
Loodusteadustes vaadeldakse termodünaamikat kui makroskoopiliste soojusnähtustega toimuvaid muutusi. Eeldustena uurimistöö korrastamiseks on sõnastatud nn. termodünaamika seadused. Toome loengu alguseks need (neid on kolm) termodünaamika seadused või printsiibid siin ära nende ühel võimalikul kujul.
19. veebruar 2017. a.
Слайд 3Termodünaamika 1. seadus (energia jäävuse seadus):
Energia ei teki ega kao, vaid
Termodünaamika 2. seadus:
Soojus ei saa iseenesest minna külmemalt kehalt soojemale. On muidugi intuitiivne, et soojus kandub üle soojemalt kehalt külmemale. Entroopia määrabki soojusvahetuse suuna. See on vajalik, sest vastupidine protsess otseselt energia jäävuse põhimõtet ei riku.
Termodünaamika 3. seadus:
Absoluutne nulltemperatuur on saavutamatu.
19. veebruar 2017. a.
Слайд 4Seega - termodünaamika on teadus, mis uurib soojuse vahekorda teiste energialiikidega
s.t.
Termodünaamika alused kujunesid 19. sajandil eelkõige aurumasinate töö ja nendes masinates toimuvate protsesside tundmaõppimise baasil.
19. veebruar 2017. a.
Слайд 5NB! Loomulikult on ka kõik keemilised protsessid, milles toimub soojuse (pro
Ja ei toimuks neid protsesse seetõttu, sest puuduks ju potsentsiaalide vahe, millest osa protsessi toimumise kaudu degradeeruks soojuseks.
19. veebruar 2017. a.
Слайд 6Kuid kõigepealt meeldetuletus sellest, mis on töö loodus- ja insenerteadustes.
Tööd
A = Fss
ehk
töö = jõud × teepikkus
19. veebruar 2017. a.
Слайд 7Tööd mõõdetakse njuutonmeetrites (N×m). Tööühikuks on džaul (1 J)
1N×m = 1
Kõige üldisemalt, et teha vahet, mis on töö ja mis on energia võib lähtuda järgmisest instruktsioonist:
energia on võime teha tööd ja töö on liikumine vastandjõu vastu.
Viimane kehtib eriti näitlikult mehhaanikas. Keemias ja füüsikalises keemias vaadeldakse tööna kõiki nähtusi mille tulemusena tekib muutus potentsiaalide vahes.
19. veebruar 2017. a.
Слайд 8Kuna ajalooliselt on termodünaamika oma kujunemisperioodil suuresti tegelenud suhteliselt lihtsate inimese
Soojus levib soojendilt jahutile (mida pole animatsioonidel kõikjal näidatud) ja süsteem teeb selle käigus tööd – antud juhul paneb auru paisumine kolvi liikuma – aur teeb paisumistööd.
19. veebruar 2017. a.
Слайд 9Seega realiseerib aurumasinana (konverteerib tööks) – kirjeldatav termodünaamiline süsteem potentsiaalide vahe,
Aurumasina ülesandeks on konverteerida soojusenergia mehhaaniliseks tööks, selleks adsorbeeritakse soojus soojendajalt ja suunatakse see jahutajale – tööd tehakse temperatuuride vahe arvelt.
19. veebruar 2017. a.
Слайд 10Juhin tähelepanu asjaolule, et ka aine igasugune keemiline muutumine saab toimuda
NB! Sisepõlemismootorites genereeritakse vajalik temperatuuride vahe töötsükli jooksul silindris endas, mille arvel toimub jällegi paisumistöö.
19. veebruar 2017. a.
Слайд 11 Esimese töötava aurumasina ehitas prantslane Papin 1690. aastal. Aur tõstab paisudes
19. veebruar 2017. a.
Слайд 12 Watti aurumasina (1778) võimsus, ή=(T-T')/T, on samuti madal, kuid kasulikku
19. veebruar 2017. a.
Слайд 13Ühekordse auru paisumisega juba täiustatud aurumasina rakendus, kuid ka see on
19. veebruar 2017. a.
Слайд 14NB! Kolmekordse auru paisumisega aurumasinad (seega - masinast väljuva auru temperatuur
Aurumasinaid hakati kasutama nende leiutamise algusest reeglina mäetööstuses.
19. veebruar 2017. a.
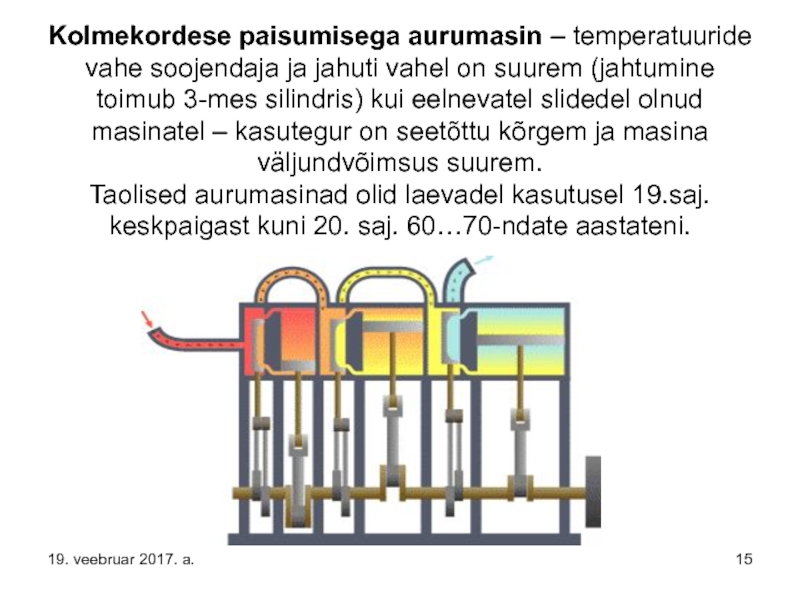
Слайд 15Kolmekordese paisumisega aurumasin – temperatuuride vahe soojendaja ja jahuti vahel on
19. veebruar 2017. a.
Слайд 16Selgitus:
kolvi käigul alla kõigis kolmes silindris toimub auru(vee)molekulide kollektiivne liikumine –
19. veebruar 2017. a.
Слайд 17Jääksoojuse mõistest paremaks arusaamiseks juhin tähelepanu, et kolmandast silindrist väljuvas aurus
19. veebruar 2017. a.
Слайд 18Kolmandast silindrist väljuv aur ei ole enam võimeline oma soojust tööks
Nõndanimetatud läbitöötanud aurus on kõikide osakeste liikumine kogu nende ruumalas ühesugune, suuresti samasugune nagu see on ka jahutajas – energia kvaliteet on langenud.
Järelikult puudub jahutaja ja töötava keha vahel potentsiaalide (pro temperatuuride) erinevus – erinevus mille lahendamise arvel on võimalik teha tööd ning mille tulemusel suureneb töötava keha – s.o. auru (vee) osakeste korrastamatus. Seega masinast väljuvad gaasid (aur), udu kannab endaga kaasas jääksoojust (viimane kõlbab küll aga laeva kajutite kütteks, aga mitte rohkemaks).
19. veebruar 2017. a.
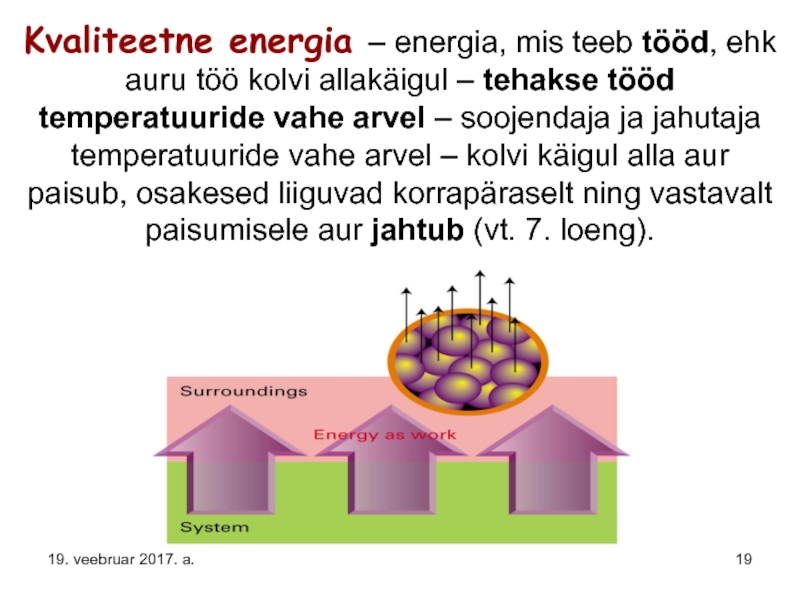
Слайд 19Kvaliteetne energia – energia, mis teeb tööd, ehk auru töö kolvi
19. veebruar 2017. a.
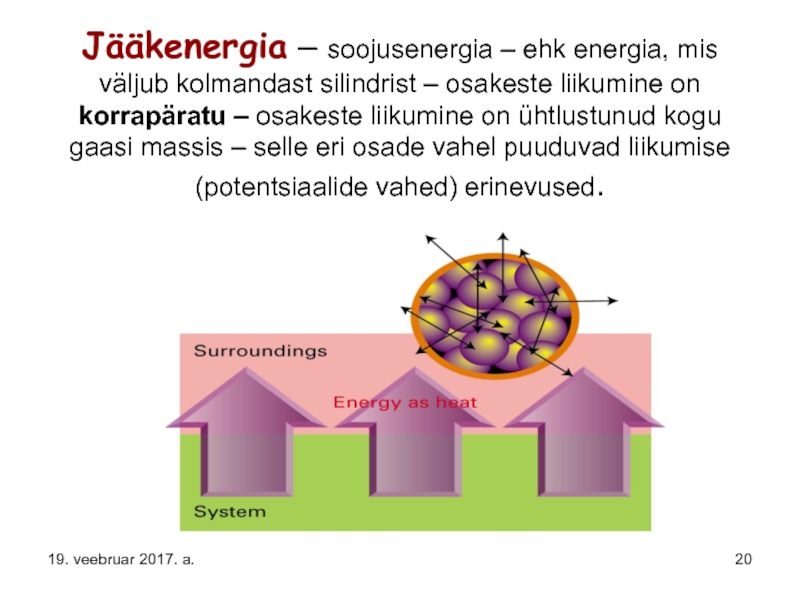
Слайд 20Jääkenergia – soojusenergia – ehk energia, mis väljub kolmandast silindrist –
19. veebruar 2017. a.
Слайд 21Tööd on võimalik teha vaid potentsiaalide vahe arvel, soojusmasinates on selleks
ή=(T-T')/T,
kus T- on soojendi temperatuur ja T' - on jahuti temperatuur ning
soojusmasina kasutegur on η ehk tööd tehakse energia kvaliteedi languse arvel ehk – kasutatakse ära temperatuuri (potentsiaalide) vahe
NB! Masina kasutegur ei saa kunagi olla 100% just sellepärast, et T' ei saa olla 00K, temperatuur mida on võimatu saavutada.
19. veebruar 2017. a.
Слайд 22Eelmisel slidel toodud valem annab ka vastuse küsimusele, miks on diiselmootori
Suurem soojendaja ja jahutaja temperatuuride vahe on ka põhjuseks, miks on kõrgema surveastmega sisepõlemismootorite (kõrgem kütuse põlemise temperatuur silindris) võimsus ja kasutegur suurem ja miks on suurem ka auruturbiini võimsus kui see on kolbide süsteemiga aurumasinal.
19. veebruar 2017. a.
Слайд 23Turbinia (Suur-Britannia), 1894, esimene aruturbiinlaev – juba ainuüksi pildilt on näha
19. veebruar 2017. a.
Слайд 24Kasuteguri piiriväärtuse algtingimusteks on:
1 – T0/T1.
Masina töös on oluline temperatuuride
pro
Aurumasinas on temperatuuride vahe suhteliselt väike võrreldes sellega, mis ta on diiselmootoris, gaasi- ja auruturbiinides jt.
See ongi olnud põhjuseks, miks aurumasinad tõrjuti välja masinate poolt kus töötemperatuur ja jahutaja temperatuuride vahe (pro potentsiaalide vahe) on suurem.
19. veebruar 2017. a.
Слайд 25Soojusliikumine gaasides - jääksoojuses – tegemist on madalakvaliteedilise energiaga, osakeste liikumine
19. veebruar 2017. a.
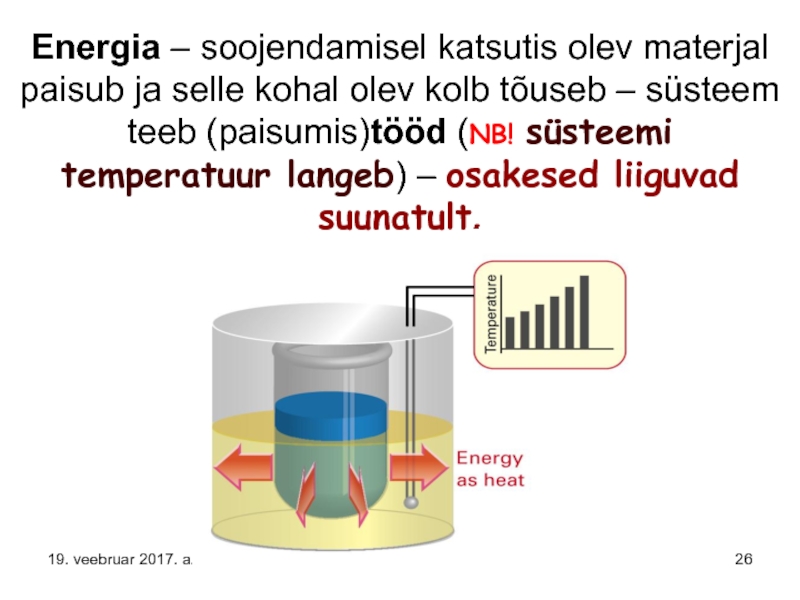
Слайд 26Energia – soojendamisel katsutis olev materjal paisub ja selle kohal olev
19. veebruar 2017. a.
Слайд 27Töö – soojus – soojus konverteerub tööks just sellisel määral, kui
19. veebruar 2017. a.
Слайд 28Põhimõtteliselt toimub analoogiliselt arumasinates ja sisepõlemismootorites energia kvaliteedi langus ka vesiratta
19. veebruar 2017. a.
Слайд 30Meeldetuletus järgneva paremaks mõistmiseks –
Gaaside põhiseadused:
R- universaalne gaasikonstant
R =
R = 0.082 atm× L/mol× K
R = 62400 mm Hg× cm3/mol× K
Kui ühikuteks on rõhk P [Pa]; mass m [g]; moolide arv n [mol], ruumala V [m3]; temperatuur T [K] siis R = 8.314 J/mol× K ja kehtib seos:
P V = n R T so. ideaalgaasi olekuvõrrand ka Clapeyroni-Mendelejevi võrrand
ehk
19. veebruar 2017. a.
Слайд 31Selgitus-meeldetuletus järgneva asjus.
1 cm3 gaasis on normaaltingimustel 2,68x1019 molekuli. See on
gramm-molekul – ehk üks mool gaasi.
19. veebruar 2017. a.
Слайд 32Kuna keemia huvisfääris vaadeldakse osakesi (molekule, aatomeid), siis on lihtsam tegeleda
7. loengu üks teemadest) – saame gaaside universaalkonstandi R.
19. veebruar 2017. a.
Слайд 33Soojusliikumise juurde tagasi.
Ideaalse gaasi rõhk on võrdeline molekulide kulgliikumise keskmise kineetilise
E = 2/3 k×T
ja
seega on gaasimolekuli keskmine energia võrdeline absoluutse temperatuuriga.
19. veebruar 2017. a.
Слайд 34Kusjuures k on
BOTZMANNI KONSTANT.
k on universaalse gaasikonstandi (R) ja Avogadro
Definitsioonivalem, k = R/NA. Botzmanni konstandi SI-ühik on üks džaul kelvini kohta.
[k] = 1 J/K.
SI ühikutes:
K = 1,38×10-23J/K.
Boltzmanni konstant seob energiaühikutes mõõdetavat temperatuuri Kelvinites mõõdetava temperatuuriga ehk töö hulga, mida tehakse ühe osakese kohta temperatuuri tõstmisel10 võrra.
19. veebruar 2017. a.
Слайд 35Selgitus Boltzmanni konstandi asjus.
Iga kuupsentimeeter gaasi sisaldab 30 miljardit molekuli. Boltzmanni
1,38x10-16 erg/kraad.
Ja molekulide liikumisenergia vastavalt eelnevale on:
E= 2/3 K×T.
19. veebruar 2017. a.
Слайд 36Seega -
R = 1,38x10-16 x 6,02x1023 = J/kraad x mool
see on kõikide gaaside jaoks universaalne konstant – kui palju muutub 1 mooli gaasi kõigi molekulide keskmine soojusliikumise energia gaasi temperatuuri muutumisel 1o võrra.
Seega on Boltzmanni konstant vaadeldav universaalse gaasi konstandina ühe molekuli kohta. See ühendab ja üldistab Boyle-Mariotte, Gay-Lussaci ja Charlesi seadused Claperont-Mendelejevi võrrandiks.
Ja nii lihtne see asi ongi.
19. veebruar 2017. a.
Слайд 37Keha siseenergia on molekulide mikroskoopilise liikumisega seotud energia. Erinevalt mehaanilisest energiast,
19. veebruar 2017. a.
Слайд 38Mikrokoopiline energia ei pruugi muutuda, kui lisada vedelikule kineetilist energiat –
Kuid lisandunud energia on jällegi madalakvaliteediline (kuigi vedeliku temperatuur võib tõusta), osakeste liikumine oli ja jääb kaootiliseks (korrastamatuks) just nii nagu see on jääksoojuseski.
Kehade siseenergia U moodustub molekulide liikumise kineetilisest energiast ja molekulide vastastikusest mõjust tingitud potentsiaalsest energiast.
19. veebruar 2017. a.
Слайд 39Teisalt aga kehade siseenergia, mis väljendub molekulide liikumises suure kiirusega, seletab
Näiteks ühe vannitäie sooja vee saamiseks tuleks teha nädal aega kõva metsamehe tööd, sellist tööd mida vanasti tehti kirve ja saega. Eelnevat näidet saab iseloomustada ka võrdlusega – selleks, et saada vannitäis sooja vett on vajaliku töö hulk võimalik ümber arvestatud kineetilisele energiale
(E = mv2/2), mis tuleks anda vanniäie vee massile saavutamaks reaktiivlennuki kiirust. Ja see nõuab tõesti palju energiat – energia, aga see ongi ju võime teha tööd.
19. veebruar 2017. a.
Слайд 40Vannivees on aga osakeste liikumiskiirus jagunenud lihtsalt paljude erinevate osakeste vahel,
Energiat, aga mis on vajalik vee temperatuuri tõstmiseks, võib ette kujutada kui tööd vannivee kui keha liikumise kiirendamiseks reaktiivlennuki kiiruseni. Ja see on muidugi “kõva töö”. NB! Kui vee osakesed liiguksid aga kõik ühes suunas, oleks tegemist kõrgekvaliteedilise energiaga - osakeste korrastatud liikumisega.
19. veebruar 2017. a.
Слайд 41Kui lämmastiku molekulid liiguksid ka suurima talvise külma ajal suunatult (korrapäraselt)
Muidugi, taoline hüpoteetiline võimalus annab ettekujutuse energiahulgast, mida soojus endaga potentsiaalset kaasas kannab ja tööks vajalikust korrastatuse määras, et tegevus (töö) saaks olla suunatud. Teisalt annab see ka ettekujutuse energia kvaliteedi (osakeste liikumise korrastatusest) olulisusest meie keskkonna kujunemisel.
Seega edu aluseks igas tegevuses on kord ja korrastatus.
19. veebruar 2017. a.
Слайд 42Järgneval slidedel on veel mõned suurused, mis iseloomustavad eelpooltoodut soojuse ja
Lämmastiku temperatuuri tõstmiseks 100 kelvinilt 800 kelvinile on vajalik osakestele lisada liikumiskiirust pea kilomeeter sekundis (3600 km/h) – muidugi kulub selleks palju tööd, et genereerida niisuguseid kiirusi meile igati hoomatavale massile.
19. veebruar 2017. a.
Слайд 43
Gaasiosakeste liikumiskiiruse jaotus N2 näitel erinevatel temperatuuridel.
19. veebruar 2017. a.
Слайд 44Näide: Vee pumpamiseks ja soojendamiseks kuluva energia võrdlus
Võib tunduda, et
19 km kõrgusele!
Ehk vee kukkumisel 420 meetri kõrguselt tõuseks tema temperatuur vaid ühe kraadi võrra.
19. veebruar 2017. a.
Слайд 45Vabaenergia ja seotud energia.
Kuna aga keha siseenergia väljendub osakeste korrastamata liikumise
Järelikult
võib siseenergiat vaadelda koosnevana kahest osast – vabast ja seotud energiast
U = Energiavaba + Energiaseotud
Ainult vabaenergia moodustab selle osa siseenergia varust, mida saab täielikult muuta tööks – selle kasutamine on tehniliselt teostatav.
Vabaenergiaga seotud küsimusi vaatleme veidi veel käesoleva loengu lõpus.
19. veebruar 2017. a.
Слайд 46Temperatuuur on aatomite ja molekulide mikroskoopilises skaalas toimuva juhusliku liikumise keskmise
Temperatuur iseloomustab kineetilist energiat molekulide liikumise ühe vabadusastme kohta (üles, alla, vasakule-paremale – kokku kolm).
Kulgliikumise korral on osakesel vabadusastmeid 3, pöördliikumine lisab veel ühe vabadusastme (jätke palun meelde, – see on oluline vedela ja tahke vee – jää -, soojusmahtuvuse erinevuse mõistmisel).
19. veebruar 2017. a.
Слайд 47Kui lisandub ka osakeste pöördliikumine (nt. molekul koosneb kahest ja rohkemast
Seda iseloomustab makroskoopiliselt aine soojusmahtuvus.
19. veebruar 2017. a.
Слайд 48Soojusmahtuvuseks nimetatakse soojushulka, mis on vajalik antud ainekoguse temperatuuri tõstmiseks
1
SI-süsteemi mõõtühik on J×K−1. Soojusmahtuvust võib väljendada ka ühikulise ainekoguse kohta, olgu selleks siis mass, ainehulk vms. Soojusmahtuvust moolides väljendatud ainehulga kohta nimetatakse ka moolsoojuseks. Soojusmahtuvust massiühiku kohta nimetatakse ka erisoojuseks.
19. veebruar 2017. a.
Слайд 49Mida rohkem on osakeste liikumise võimalikke vabadusastmeid, seda suurem on ka
NB! Jää (tahke vee) soojusmahtuvus(0,51 cal/g) on poole väiksem kui vedelal veel (1,0 cal/g) just seetõttu, et jääs pole võimalik veemolekulide pöördliikumine – molekulid on fikseeritud molekulaarvõresse vesiniksidemete kaudu.
Nii on ka metallide soojusmahtuvused suhtelised väikesed (metallides pole ju võimalik osakeste pöördliikumine), kohe kõvasti väiksemad kui on näit. on vee soojusmahtuvus.
19. veebruar 2017. a.
Слайд 50Soojusmahtuvus sõltub nii aine olekust (mida võib määratleda nt. temperatuuri ja
19. veebruar 2017. a.
Слайд 51Süsteemi olekut iseloomustatakse olekuparameetritega ja olekufunktsioonidega;
Olekuparameetrid on mõõdetavad suurused, temp. T,
Olekufunktsioon on suurus, mis sõltub ainult süsteemi olekust (olekuparameetritest), mitte selle oleku saavutamise viisist (protsessi teest).
Olekufunktsiooni U (siseenergia) muut ΔU arvutatakse süsteemi alg- ja lõppolekule vastavatest olekufunktsiooni väärtustest, ei arvestata protsessi iseloomu.
19. veebruar 2017. a.
Слайд 52Soojusliikumine tahkises – osakeste liikumine on piiratud (osakeste pöördliikumist ei toimu
19. veebruar 2017. a.
Слайд 53Temperatuur ei iseloomusta kogu siseenergiat, vaid ainult siseenergia üht osa -
(E = mv2/2). Sama temperatuuriga kehad võivad seega omada erinevat siseenergiat. Seda iseloomustavad kehade erinevad erisoojused.
NB! Vee erisoojused.
Temperatuuri mõõtmiseks kasutatakse erinevaid skaalasid: Celsiuse, Kelvini, Fahrenheiti jt.
19. veebruar 2017. a.
Слайд 54Soojuse mehhaaniline ekvivalent.
Soojuse ülekanne ja töö on mõlemad seotud energia
Klassikalises eksperimendis aastal 1843 näitas James Joule töö ja soojuse ekvivalentsust, mõõtes vee soojenemist segamisel ja vee segamiseks kulutatud mehhaanilist energiat. Joule sai järgmise seose tol ajal kasutusel olnud soojuse ühiku kalor ja energiaühiku Joule vahel:
1 cal = 4,1868 J
19. veebruar 2017. a.
Слайд 55Soojus muudab keha siseenergiat ning soojuse arvel saab teha tööd, mida
ΔU = Q - A ,
ehk ja veelkord
energia ei teki ega kao, vaid muutub ühest liigist teise s.t. muutub vaid energia kvaliteet.
19. veebruar 2017. a.
Слайд 56Et asi oleks veidi selgem, siis sõnastame eelneva lause (Energia ei
gaasile antav soojushulk on võrdne siseenergia juurdekasvu ning paisumisel tehtava töö summaga –
Q = ΔU + A
NB! Avaldis väljendub sisuliselt ka gaaside universaalkonstandi R kaudu
19. veebruar 2017. a.
Слайд 57Keha siseenergia (U) muutus on võrdne kehale juurdeantud soojuse (Q) ja
Termodünaamika esimene seadus väljendab üldist energia jäävuse seadust, mis ütleb, et energia ei teki ega kao, ta võib vaid üle minna ühest vormist teise.
Termodünaamika esimene seadus rakendab energia jäävuse soojuslikele ja termodünaamilistele protsessidele.
19. veebruar 2017. a.
Слайд 58Seega, tulenedes eelnevast sõnastame töö mõiste veidi üldisemalt järgmisel moel:
töö on
See protsess on ekvivalentne raskuse tõstmise või langetamisega. Süsteemi siseenergia muutub vastavalt süsteemi poolt tehtud tööga. Kui teisi muutusi ei toimu, siis
∆U = A
19. veebruar 2017. a.
Слайд 59Eelneva moraal tundub olevat kõige muu kõrval ka selles, et energiamajanduses
Võrrelge palun veelkord soojuse ja töö ekvivalente (1 cal = 4,1868 J).
19. veebruar 2017. a.
Слайд 60Üks teeklaas bensiini kaalub 170 grammi, selle põlemisel vabaneb 1870 kilokalorit
Seega 170 grammi bensiini põlemisel vabanev vastav tööhulk on 798490 kilogramm-meetrit. Järelikult saaks 170 grammi bensiini põlemisel saadava energia abil tõsta 798 tonnise raskuse tõsta 1 meetri kõrgusele.
Bensiini maht suureneb põlemisel 13000 korda.
Moodustunud gaasid paisuvad – jahtuvad paisumisel, “kaduma läinud” soojus, muutub (konverteeritakse) tööks.
19. veebruar 2017. a.
Слайд 61Keemias – termodünaamika põhjendab ühe või teise protsessi võimalikkust või mittevõimalikkust
Termodünaamika aluseks on energia jäävuse printsiip ?? erinevate energialiikide ekvivalentsuse printsiip, lisades siia juurde erinevate energialiikide kvaliteedi printsiibi.
19. veebruar 2017. a.
Слайд 62Üheski loodusnähtuses ei saa energia jäljetult kaduda või eimillestki tekkida. Energia
See on loengu järgneva osa teemaks.
19. veebruar 2017. a.
Слайд 63Märkus „energia tootmise“ kohta. Loodusteaduse mõttes on energia tootmine (täpselt samuti
19. veebruar 2017. a.
Слайд 64Korrastatus ja korrastamatus kui loodusseadus.
Täiendavalt mikroprotsessidele liigub keha kui tervik teiste
Vastasmõju tõttu teiste kehadega on vaadeldaval kehal kui tervikul veel potentsiaalne energia (näit. Maa gravitatsioonivälja suhtes).
19. veebruar 2017. a.
Слайд 65Need kaks – kineetiline ja potentsiaalne energia moodustavad keha tavalise (makroskoopilise)
Mehhaaniline energia võib täielikult üle minna soojusenergiaks.
Ka soojusenergia võib omakorda üle minna mehhaaniliseks energiaks, kuid NB!, mitte kunagi täielikult.
Keha võib küll jahtuda, kuid saada jahtumise arvelt 100% mehhaanilist energiat ei ole võimalik.
Osa soojusenergiast jääbki soojuseks (nn. jääksoojuseks) - seda postuleeribki termodünaamika 2. seadus.
19. veebruar 2017. a.
Слайд 66TERMODÜNAAMIKA 2. SEADUSE (Soojus ei saa iseenesest minna külmemalt kehalt soojemale.)
Energeetiliste üleminekute pöördumatuse astme hindamiseks kasutatakse mõistet ENTROOPIA (kreeka keelest en – sees, trope – pööre, muundus) mõiste looja-kasutuselevõtja on
Clausius 1854. a.
19. veebruar 2017. a.
Слайд 67Rudolf Julius Emanuel Clausius (2. jaanuar 1822 – 24. august 1888)
19. veebruar 2017. a.
Слайд 68Ja veel termodünaamika 2-sest seadusest:
Soojus ei saa iseenesest minna külmemalt kehalt
Tunneme muidugi intuitiivselt, et soojus kandub üle soojemalt kehalt külmemale, aga just entroopia määrabki soojusvahetuse suuna. Seda tuleb looduses toimuva mõistmiseks alati arvestada. Kuigi-kuigi vastupidine protsess otseselt energia jäävuse põhimõtet ei riku – seetõttu eeldabki soojusvahetuse suund veel mõningate seaduspärasuste olemasolu.
19. veebruar 2017. a.
Слайд 69Energia kvaliteeti iseloomustab hästi ka Teile juba hästi tuntud lühike käesoleva
Energia jäävuse seaduse nõuded on täidetud, kuid tekkinud soojuse abil kivi tagasiupitamine üle tõkke on võimatu. Energia kvaliteedi vahe peaks olema sellest videost hästi ettekujutatav – millal liiguvad kivi osakesed korrapäraselt (kivi üle tõkke lükates) ja kuidas liiguvad osakesed temperatuuri tõustes, liiguvad kiiremini seetõttu, et osa kivi potentsiaalsest energiast konverteerub soojuseks kui kivi üle tõkke kukkudes.
19. veebruar 2017. a.
Слайд 70Entroopia on termodünaamikas kasutatav ekstensiivne suurus, mis kirjeldab vaadeldava süsteemi erinevate
Tihti öeldakse, et entroopia mõõdab "korratust". Protsessidele, milles entroopia kasvab, vastavad pöördumatud muutused süsteemis, mis vähendavad süsteemi võimet teha tööd, sest osa energiast on pöördumatult muundunud soojuseks ehk ebakorrapäraseks liikumiseks (ehkki liikumine pro energia ei kao).
19. veebruar 2017. a.
Слайд 71Entroopia on üks termodünaamika (ja kogu loodusteaduste) põhimõistetest. Selle muudab oluliseks
Seega saavad iseeneslikud protsessid isoleeritud süsteemis toimuda vaid entroopia kasvamise suunas ehk
süsteemi korrastatus ei saa tekkida iseenesest.
19. veebruar 2017. a.
Слайд 72Protsessid, milles entroopia kahaneb, saavad toimuda vaid siis, kui süsteem teeb
Nii saab soojus iseeneslikult kanduda vaid soojemalt kehalt külmemale.
Selleks, et käivitada vastupidine protsess, kus soojus kandub külmemalt kehalt soojemale, tuleb teha tööd (vaadake palun töö ja energia määratlust
1. loengust).
19. veebruar 2017. a.
Слайд 73Entroopia ja termodünaamika 2 seadus.
Iseenesliku protsessi toimumise tulemus looduses on protsessi
Protsesside toimumise võimalikkuse, nende võimalikkuse puhul nende suuna ja tasakaaluolekud määratlebki termodünaamika
2 seadus:
19. veebruar 2017. a.
Слайд 74kõik protsessid looduses toimuvad iseenesest ainult ühes suunas, soojus läheb iseenesest
korrastamatus suureneb.
ΔS ? max,
kus S on korrastamatuse ehk entroopia määr.
19. veebruar 2017. a.
Слайд 75Spontaanne (iseeneslik) protsess – soojus läheb iseeneslikult üle soojemalt kehalt külmemale,
19. veebruar 2017. a.
Слайд 76Töö – soojus – paisumisel gaas jahtub, tehes tööd – keha
19. veebruar 2017. a.
Слайд 77Seega on termodünaamika II seadus sõnastada ka järgneval moel:
soojus ei saa
EHK
energia kandub alati kõrgema potentsiaaliga süsteemilt üle madalama potentsiaaliga süsteemile, kusjuures see ülekandumine kestab seni, kuni saabub termodünaamiline tasakaal.
19. veebruar 2017. a.
Слайд 78Tõenäosus, et gaasiga täidetud anuma mõlemas pooles on ühepalju osakesi, on
L. Boltzmann seostas taolise olukorra kirjelduse entroopia väärtusega ja väljendas vastava oleku tõenäosust matemaatiliselt, millest tulenes sellest, et
maksimaalse entroopiaga olekule vastab alati suurima tõenäosusega olek.
19. veebruar 2017. a.
Слайд 79Spontaanne (iseeneslik) protsess – aine hajub – hajutatud olek (korrastamata olek)
19. veebruar 2017. a.
Слайд 80Suurima tõenäosusega oleku saabumisel on tulemus universaalne: see kehtib nii erinevate
Selle tõttu toimub temperatuuride ühtlustumine ja soojuse üleminek kuumemalt kehalt külmemale, erinevate kehade liikumishulkade ühtlustumine.
Ka vastupidised protsessid on statistiliselt võimalikud, kuid molekulide väga suure arvu tõttu ülimalt väikese tõenäosusega.
19. veebruar 2017. a.
Слайд 81Mittepöörduv protsess. Kui kambreid A ja B ühendav kraan avada, arvestame suurima
19. veebruar 2017. a.
Слайд 82Seletus eelneva osas.
Igasuguse molekulide jaotuse tõenäolisus on võrdne. Kuid neid tõenäosusi
Aga kui 1 cm3 õhus on 2,68 x 1019 molekuli, siis on kaotab mõtte teha vahet sõnadel “äärmiselt ebatõenäoline “ ja “võimatu”.
19. veebruar 2017. a.
Слайд 83Eelneva illustreerimiseks – kujutage ette, et teil on anumatäis musti ja
Kui arukas oleks loota, et kuulikeste segamisel moodustuks eelneva pöördjaotus - kõik valged kuulid oleksid all ja mustad nende peal.
19. veebruar 2017. a.
Слайд 84Valgete ja mustade kuulikeste jaotumist kihiti võib vaadelda kui kõrge korrastusastmega
19. veebruar 2017. a.
Слайд 85Entroopia määra põhivõrrand on:
S = k×lnW,
kus
k on Boltzmann’i konstant
Kui suureneb W, suureneb ka S (entroopia), kuid nende seos on logaritmiline.
19. veebruar 2017. a.
Слайд 86
Suurus W on aatomite ja molekulide võimalike paiknemiste arv, mis kõik
19. veebruar 2017. a.
Слайд 87Boltzmanni valemi järgi arvutatud entroopiat nimetatakse statistiliseks entroopiaks.
NB! Kui süsteemis molekulide
ja entroopia k×lnW-st ? k×lnW2-ks
(või 2k×lnW-ks)
19. veebruar 2017. a.
Слайд 88SEEGA
määratletakse entroopiat tõenäosuse (mikroolekute) W (tegemist on korrastatuse-mittekorrastatusega) kaudu Boltzmanni võrrandi
S= R/NA × lnW,
kus R on universaalne gaasikonstant,
NA - Avogadro arv,
R/NA =1,38.10-23 J/K×mol -
ongi entroopia mõõtühik.
19. veebruar 2017. a.
Слайд 89Positsiooniline korrastatus-korrastamatus aines (CO). Kui aines on N molekuli, siis on
19. veebruar 2017. a.
Слайд 90L. Bolzmann’i (1844 -1906) hauasammas Viinis – tähelepanu entroopia määratlusele valemina
19. veebruar 2017. a.
Слайд 91Miks muutub korrapärane mehhaaniline liikumine korrapäratuks soojusliikumiseks?
Põhjus on oleku tõenäolisuses –
Loodusseadus - termodünaamika teine seadus ütleb: kõik looduslikud protsessid kulgevad nende olekute tõenäosuse kasvamise suunas. Eelnevat võib sõnastada kui entroopia iseenesliku kasvamise seadust ehk jällegi – suurima tõenäosusega oleku saavutamist.
19. veebruar 2017. a.
Слайд 92Entroopia kasvamise seadus on tähtsaim loodusseadus – temast järeldub ka see,
kehad püüdlevad iseenesest tasakaaluolekusse (st ei ole võimalik luua tasakaalustamatust - potentsiaalide vahet - ilma väljastpoolt süsteemile energiat lisamata).
Entroopia (korrastamatuse) iseenesliku kasvamise seadus ongi termodünaamika teine seadus.
Esimene on energia jäävuse seadus, mis toimib sõltumatult termodünaamika teisest seadusest.
19. veebruar 2017. a.
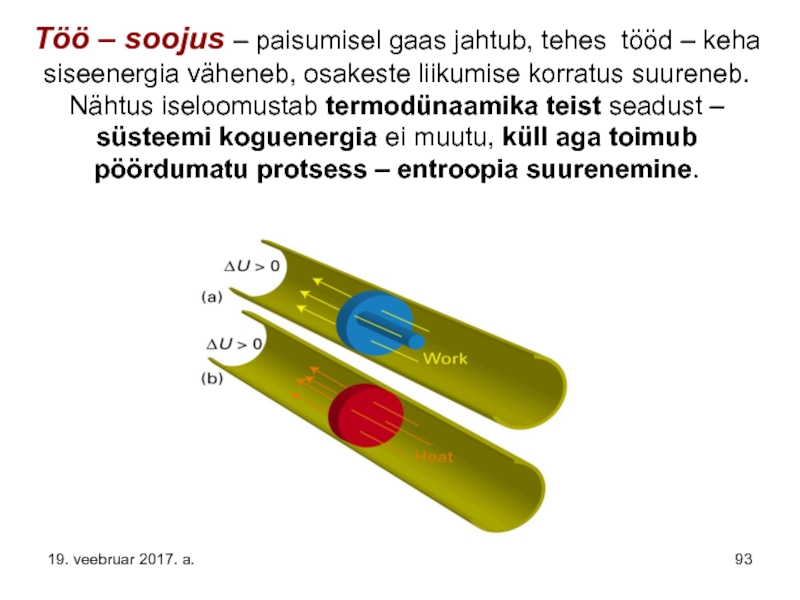
Слайд 93Töö – soojus – paisumisel gaas jahtub, tehes tööd – keha
19. veebruar 2017. a.
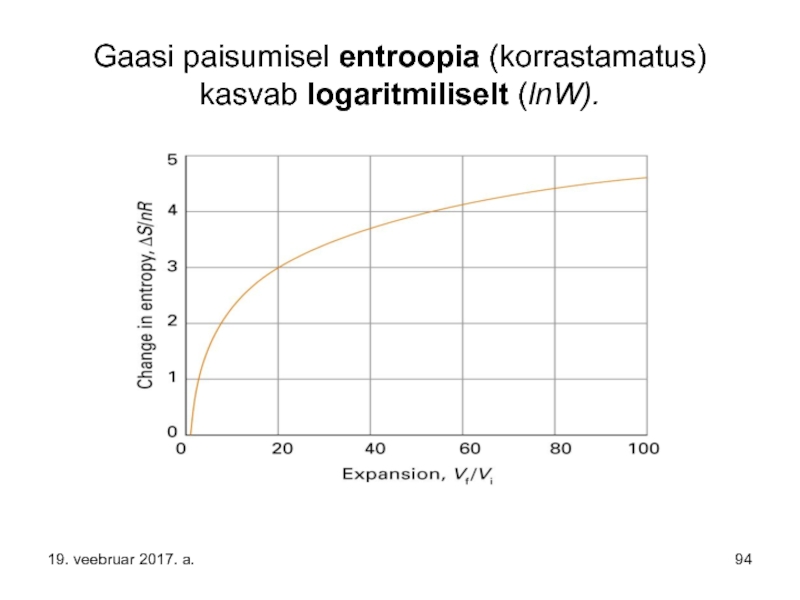
Слайд 94Gaasi paisumisel entroopia (korrastamatus) kasvab logaritmiliselt (lnW).
19. veebruar 2017. a.
Слайд 95Energia jäävuse seadus on mehhaanika seadus, sellele alluvad tingimusteta nii suured
Seega - termodünaamika teine seadus on statistilise iseloomuga (see märgibki tema seost suure osakeste hulgaga), aga see ei vähenda mingil määral tema tähtsust ega täpsust.
19. veebruar 2017. a.
Слайд 96Eelnevast tulenebki, et oma olemuselt on termodünaamika seaduspärasustest – vaid termodünaamika
Termodünaamika II seadus ja III seadus (viimase lihtsaim formuleering - temperatuuri absoluutne nullpunkt on saavutamatu) on oma loomult statistilised, neist viimane veel kvantteoreetilise päritoluga.
19. veebruar 2017. a.
Слайд 97Entroopia kasvamise seadus määrab protsesside kulgemise suuna.
Selles mõttes on entroopia looduslike
(entroopia – töö mõõt)
19. veebruar 2017. a.
Слайд 98Entroopia kasvu seadus tähendab süsteemide üleminekut maksimaalse tõenäosusega olekusse. Selles seisnebki
Selles seisneb ka loodusteaduste jaoks fundamentaalne tõsiasi – aeg on asümmeetriline.
19. veebruar 2017. a.
Слайд 99Viimane tõsiasi on aluseks olnud Maailma kujunemiseks selliseks nagu ta on
19-nda saj. keskel - Ch. R. Darwin – tema peateos “Liikide tekkimine…” 1859. aastal.
19. veebruar 2017. a.
Слайд 100Just paljukomponendiliste süsteemide üleminek suurema statistilise tõenäosusega olekusse määrabki
aja kulgemise
sümmeetria
puudumisele fundamentaalsetes protsessides ehk kõik süsteemides toimuvad muutused on suunatud suurima tõenäosuse saavutamisele.
19. veebruar 2017. a.
Слайд 101Mida keerukam on süsteem, mida korrapärasem ta on, seda väiksem on
Keerulised süsteemid ei teki iseenesest (õigemini - nende iseenesliku tekke tõenäosus on kaduvväike), neid saab ehitada-luua ainult ümbritseva keskkonna entroopia kasvu arvel.
19. veebruar 2017. a.
Слайд 102Seega - jah, energiat on võimalik kontsentreerida, koguda kokku ruumis hajutatud
Kütuse põletamise kaudu – soojusenergia – tekitatud potentsiaalide vahe arvel tehakse tööd (s.o. korrastatuse loomise kaudu) luuakse näiteks elektronide korrastatud jaotus ehk igapäevakeeles - soojuselektrijaam „toodab“ elektrienergiat – elektronide (laengute) korrastatust mida tuleb ja saab tõkete, „elektronide tammide“ (isolaatorite abil) ka koguda. Loomulikult on selleks ka teisi viise.
19. veebruar 2017. a.
Слайд 103Ja veel „energia tootmise“ asjus:
teame eelnevast, et Maailm koosneb mateeriast ja
mateeria erinevaid vorme nimetatakse aineteks.
Aine ja energia on aga loodusteaduste jaoks ühe ja sama materjali kaks vormi.
Ainet saab iseloomustada massi kaudu (ainet saab kaaluda), mass aga on rangelt võrdeline energiaga (E = m×c2).
Seega „toota“ ei saa me ühte ega teist – me vaid saame neid kontsenteerida ja muuta nende kvaliteeti.
19. veebruar 2017. a.
Слайд 104Siit ja seega saame sõnastada 4 ajatut printsiipi, mis tulenevad ajast
Printsiip A. Aeg on fundamentaalne suurus. Aja toime on kõige elementaarsem protsess looduse, mille kaudu luuakse olemasolevatest sündmustest uued sündmused. Põhjuslikkus tuleneb otseselt aja pöördumatust olemusest.
Printsiip B. Ajal on fundamentaalne suund. Tulevik areneb oleviku olemisest, puuduvad põhjuslikud silmused või piirkonnad, kus aeg „edeneb tagurpidi“. Fundamentaalsed seadused, mis arendavad tulevikku olevikust, on pöördumatud – minevikku seisundeid ei saa konstrueerida oleviku seisunditest.
19. veebruar 2017. a.
Слайд 105Printsiip C. Objekti aeg-ruumi omadused või sündmused tulenevad selle suhetest teiste
Printsiip D. Energia on fundamentaalne. Energia ja liikumishulk (moment) ei ilmu välja aegruumist, pigem on tõene vastupidine. Aegruum ilmub välja fundamentaalsemast põhjuslikust ja dünaamilisest olekust, kus energia ja moment on algsed.
19. veebruar 2017. a.
Слайд 106Näiteid entroopia muutumisest.
Entroopia kasv ΔS > 0 toimub
sulamisel, aurustumisel, lahustumisel, temperatuuri
Entroopia kahanemine ΔS < 0 toimub
gaasi veeldumisel, tahkestumisel, gaasiliste ainete mahu vähenemisel.
Korrastatuse suurenemine ja vähenemine reaktsioonide käigus:
C(s) + O2(g) → 2CO(g) ΔS > 0
3H2(g)+ N2(g)→ 2NH3(g) ΔS < 0
19. veebruar 2017. a.
Слайд 108Jääkentroopia jääs. Igal vee molekulil kaks pikka ja kaks lühikest vesiniksidet
19. veebruar 2017. a.
Слайд 110 Ja lisaks veel mõned Murphy seadustest, seadused, mille kehtivust, elu
Ja järgnevalt tuletis sellest: Kui midagi ei saa untsu minna, siis midagi ikka läheb.
Sealt siis Murphy filosoofia: Naeratage... homme on veel hullem.
Ja edasi - Murphy konstant: Asjad purunevad võrdelises seoses nende väärtusega.
19. veebruar 2017. a.
Слайд 111Entroopia – kordame üle.
Seotud energia moodustab süsteemi siseenergia selle osa, mis
Vabaenergia sisaldub süsteemis potentsiaalse energiana – kui süsteem teeb tööd, siis vabaenergia hulk väheneb (spontaanselt - iseeneslikult) – entroopia on vaadeldav tehtud töö mõõduna.
Näide:
gaas on suurema rõhu all võimeline tegema rohkem tööd kui gaas väiksema rõhu all.
19. veebruar 2017. a.
Слайд 112Tööd iseloomustab osakeste korrapärane kollektiivne liikumine, soojust aga kaootiline liikumine.
Töö
Entroopiat võib vaadelda kui osakeste soojusliikumise kaootilisuse mõõtu ja vabaenergiat kui “kättesaadavat” energiat.
Näide: lõhkeaine plahvatas – moodustunud osakesed on stabiilsemad, paiknevad korratult, lõhkeaines olev energia oli aga kergesti “kättesaadav”. Keerate kella ülesse – vedrus elev energia on kergesti „kättesaadav“.
19. veebruar 2017. a.
Слайд 113Mitte mingil juhul ei saa isoleeritud makrosüsteemi entroopia iseeneslikult väheneda.
Siiski
19. veebruar 2017. a.
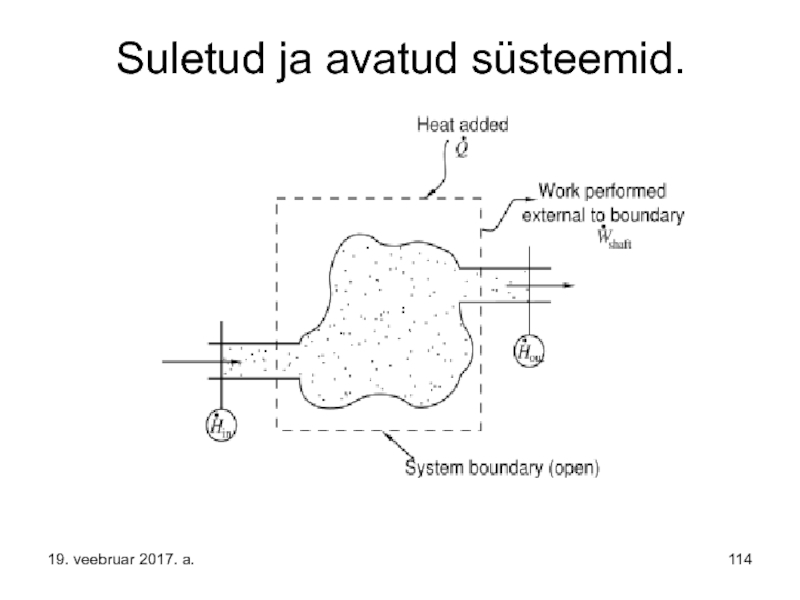
Слайд 115Entroopia.
Seega – suletud süsteemis, milles
T = const ja V =
saavad toimuda ainult protsessid, mille puhul vabaenergia väheneb, s.o. entroopia suureneb - sellised protsessid on pöördumatud.
Järelikult
on entroopia muutus isoleeritud süsteemis protsessi pöördumatuse kvalitatiivseks mõõduks.
19. veebruar 2017. a.
Слайд 116Maailm tunneb vaid üht süsteemi, kus toimub struktuuri “iseeneslik“ üleminek lihtsamalt
See süsteem on elusloodus.
Termodünaamika seaduste ilmne rikkumine eluslooduses on tänapäeva teaduse seisukohalt tingitud informatsiooni kogumisele ja kasutamisele programmeeritud juhtsüsteemist, mis, töötades molekulaarsel tasemel, säilitab (arenemisvõimeliste liikide kujul) just madalama entroopiaga seisundeid.
19. veebruar 2017. a.
Слайд 117Elu Maakeral, kogu fossiilkütuste põletamisel põhinev energeetika on võimalik vaid fotosünteesi
19. veebruar 2017. a.
Слайд 118Fotosüntees on suurim redoksreaktsioon mis Maal tema ajaloo jooksul on toimunud.
Maa sisekihid vulkanismi kaudu toovad esile seda, mida mis elukeskkonda vastandab ning rahva müütides kannab nimetust „põrgu“, kohta kus puudub elu.
19. veebruar 2017. a.
Слайд 119Entroopia Päikesel suureneb ja negentoopia (korrastatus) kasvab seal, kus see on
Looduses toimubki termodünaamika vaatepunktist vastupidine protsess – fotosünteesi kaudu negentroopia (negatiivne entroopia = korrastatuse) loomine.
19. veebruar 2017. a.
Слайд 120Fotosüntees (kreeka photo- 'valgus' + synthesis – ühendamine, liitmine) on looduses
Fotosünteesi lähteaineteks on süsinikdioksiid, vesi ja mineraalained (energiaallikaks on päikeseenergia), lõpp-produktiks ehk saaduseks on süsivesikud, peamiselt glükoos, fruktoos ja tärklis ning kõrvalsaaduseks hapnik.
19. veebruar 2017. a.
Слайд 121Fotosünteesi kindlustamisel ja meie elu aluseks olev protsess on väga õnnestunud
Teisalt Maailmaruum oma madala (3 kraadi absoluutsel temperatuuriskaalal) temperatuuriga on suurepärane „prügikast“ madalakvaliteetse (läbitöötatud) jääksoojuse paigutamiseks.
19. veebruar 2017. a.
Слайд 122Fotosünteesi lihtsustatud üldvalemina:
6CO2 + 12H2O + footonid → C6H12O6 + 6O2
EHK
süsihappegaas + vesi + valgusenergia(footonid) → glükoos + hapnik + vesi
19. veebruar 2017. a.
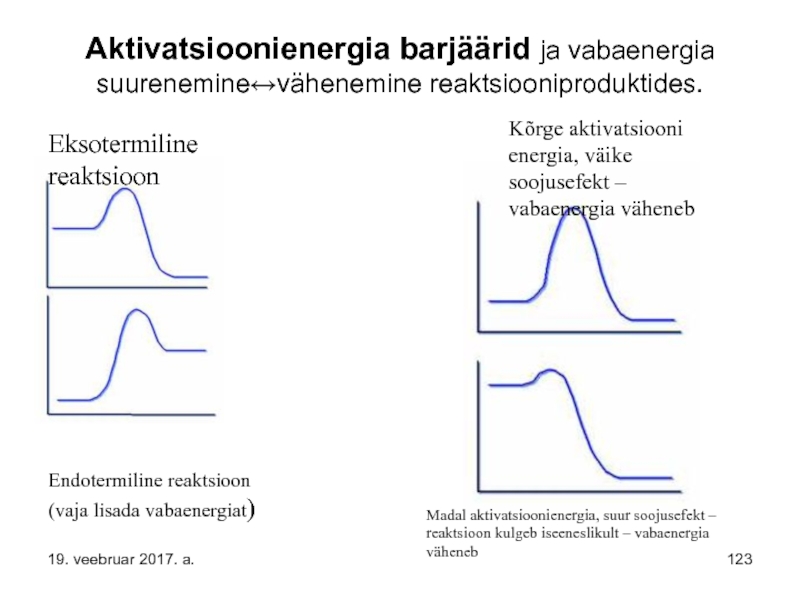
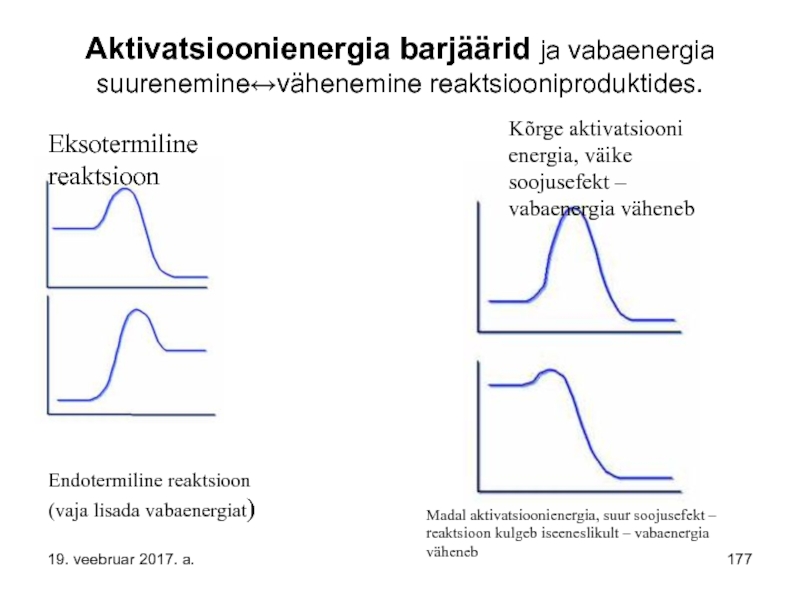
Слайд 123Aktivatsioonienergia barjäärid ja vabaenergia suurenemine↔vähenemine reaktsiooniproduktides.
Eksotermiline reaktsioon
Endotermiline reaktsioon (vaja lisada vabaenergiat)
Kõrge
Madal aktivatsioonienergia, suur soojusefekt – reaktsioon kulgeb iseeneslikult – vabaenergia väheneb
19. veebruar 2017. a.
Слайд 124Fotosünteesi protsesside – fotosünteetilise oksüdeerimise - tulemusena on võimalik nende organismide
„CH2O“ + O2 ↔ CO2 + H2O
19. veebruar 2017. a.
Слайд 125Kordame üle:
fotosünteesi reaktsiooni tulemusena seotud CO2 lülitab süsiniku uuesti globaalsesse ringlusesse.
Elu
Fotosünteesi poolt genereeritud potentsiaalide vahe ongi vaadeldav negentroopiana (korrastatusega), päikeseenergia arvel loodud potentsiaalide vahega.
19. veebruar 2017. a.
Слайд 127RuBisCo ehk Ribulose-1,5-bisphosphate carboxylase/oxygenase – ensüüm-valk mida on Maailmas kõige rohkem,
19. veebruar 2017. a.
Слайд 130Juhin siinjuures tähelepanu asjaolule, et rohelistele taimedele vajalikud toitelemendid – valgus
Toitumiseks vajaliku „teine pool“ - oma keha ülesehitamiseks vajalik energia pärineb loomulikult Päikeselt, selle kaudu toimub taime „ehitusplokkide„ korrastamine – toimub negentroopia – korrastatuse – loomine, footonite vahendusel.
19. veebruar 2017. a.
Слайд 131Loomsete organismide puhul on need kaks poolt omavahel ühendatud – oma
Seega – fotosünteesi käigus toimub lõppkokkuvõttes endotermiline reaktsioon – energia salvestatakse. Meie aga - eelkõige aeroobid – toimetame eksotermiliste reaktsioonide vallandamise kaudu – universaalse taandaja ja universaalse hapendaja vahelise reaktsiooni vallandamise kaudu – tulemuseks on loomulikult roheliste taimede poolt tekitatud korrastatuse (negentroopia) asendamine korrastamatusega – entroopiaga.
19. veebruar 2017. a.
Слайд 132 Maakera elustiku tagajaks - negentroopia allikaks on Päike. Temperatuuride vahe võimaldab selle
19. veebruar 2017. a.
Слайд 133Kasuteguri piiriväärtus on:
1 – T0/T1.
Oluline on temperatuuride (potentsiaalide) vahe.
Aurumasinas on temperatuuride
See ongi olnud põhjuseks miks aurumasinad tõrjuti välja masinate poolt kus töötemperatuur ja jahutaja temperatuuride vahe on olnud suurem.
Päikese (soojendaja 60000 K ) ja Maa (3000 K ) temperatuuride vahe on veelgi suurem – sellest ka suurem kasutegur.
19. veebruar 2017. a.
Слайд 134Nii kehtib termodünaamika II seadus ka Maailmaruumis ja meie Päikesesüsteemis –
Aga igas spontaanses protsessis peab süsteemi ja ümbritseva keskkonna summaarne entroopia kasvama.
DSuniversum = DSsüsteem + DSkeskkond > 0
puu → põlemine → CO2+ soojus (hajub universumis).
Entroopia muutus reaktsioonides.
Standardne entroopia muut
ΔS° = Σνi S°(produktid) - Σνi S°(lähteained)
νi- ainete koefitsiendid reaktsioonivõrrandis
19. veebruar 2017. a.
Слайд 135Vaatleme veelkord eelpoolesitletud materjali veidi igapäevasemast, kuid ühtlasi ka natuke üldisemast
Hästituntud energia jäävuse seadusega ollakse harjunud ning väga vähe kohtame (kuigi ikka kohtame kah) soovi seda seadust ignoreerida ehk projekteerida igiliikurit.
19. veebruar 2017. a.
Слайд 136Kuid entroopia kasvu seadus on niisama fundamentaalne ja kindel loodusseadus kui
Aga ei ole!
Viimasest tekibki sageli süvaraskus keskkonnakaitses. Entroopia kasvu seadus keskkonnakaitse kontekstis tähendab seda, et kõikide protsesside käigus muutuvad energia ja aine kvaliteedilt halvemaks, et energia ja aine kvaliteet on pärast protsessi madalamad (s.t. kehvemad) kui enne.
19. veebruar 2017. a.
Слайд 137Kordan veel – energia jäävuse seadus ütleb, et energia pärast pole
Entroopia kasvu seadusest järeldub, et kasutada saame üksnes kõrge kvaliteediga energiat (ainet) ja kasutamise käigus muutub see ilmtingimata madalama kvaliteediga energiaks (aineks): ning meile vajalikud tulemused saame ainuüksi selliste muundumiste käigus ja tulemusel.
19. veebruar 2017. a.
Слайд 138On ainult üks võimalus igasuguste muutumiste teostamiseks – see toimub alati
19. veebruar 2017. a.
Слайд 139Kuid NB! – palun mitte unustada, et kõik termodünaamika seadused on
19. veebruar 2017. a.
Слайд 140Toon eelneva illustreerimiseks veelkord näite elusloodusest – kui oleks olnud võimalik
19. veebruar 2017. a.
Слайд 141Keskkonnakaitsega seoses tehakse pahatihti juttu jäätmevabast tootmisest. Termodünaamika seisukohalt on see
Eelnevast tuleneb Maailma arengu dialektiline vastuolu: vajame puhast elukeskkonda, aga evolutsiooni laine kannab edasi just neid, kes seda keskkonda kõige enam rikuvad.
19. veebruar 2017. a.
Слайд 142Täpselt sama järeldus on kehtiv majanduslikult edukate ühiskondade kohta. Ka kliima
Seega meie tehnoloogiline eduks, meie tarkus on kergitanud meie ette globaalprobleemid, mis seotud meie keskkonna kvaliteediga, millest ilmseim nn. kliimasoojenemine – sellest aga lähemalt
10. Loengus.
19. veebruar 2017. a.
Слайд 143Kui süsteemi temperatuurid on ühtlustunud (kui kaob potentsiaalide vahe) ja entroopia
19. veebruar 2017. a.
Слайд 144Energia jäävuse seaduse seisukohalt on kõik kallihinnaline energia alles, kuid, et
Soojussurma tingimustes ei toimu mitte midagi - süsteemis puudub potentsiaalide vahe – süsteem on täielikult töövõimetu – võimetu igasuguseks muutuseks.
19. veebruar 2017. a.
Слайд 145Soojussurmas on isekulgev protsess maksimiseerinud oma korrastamatuse, ehk energia on jõudnud
Midagi võib toimuma hakata ainult negatiivse entroopia (negentroopia) – korrastatuse - lisandumisel süsteemi. Ja see saab toimuda ainult selle lisandumisel väljastpoolt vaadeldavat süsteemi.
19. veebruar 2017. a.
Слайд 146Universumi soojussurm (termodünaamiline paradoks) tekib siis kui termodünaamika seaduspärasused rakenduvad kogu
Et midagi üldse toimuda saaks, peab alati olemas olema temperatuuride vahe. Elu Maalgi on võimalik seetõttu, et on olemas kuum keha (Päike), jahutav keha (külm Maailmaruum) ning töötav keha (Maa).
Kui peaksid kaduma kõik temperatuurierinevused, kui kaovad kõik potentsiaalide erinevused, saabub soojussurm – süsteem muutub töövõimetuks.
19. veebruar 2017. a.
Слайд 147Soojus läheb alati üle soojemalt kehalt külmemale, mistõttu soojem keha jahtub
SEEGA - Igaveses Universumis peaks juba olema saabunud soojussurm, kuid kuna see nii ei ole, pole Universum igavene.
Paradoksi sõnastas 1865. aastal üks termodünaamika rajajaid, Rudolf J. E. Clausius. Paisuva lõpliku Universumi puhul see paradoks kaob.
19. veebruar 2017. a.
Слайд 148Kuna aga suure tõenäosusega pole Universum
igavene, Universumis olevad ained on pidevas
Meie siin Päikesesüsteemis, planeedil Maa kasutame korrastatuse (negentroopia) loomiseks Päikeselt saabuvat kiirgust (energiat),…
19. veebruar 2017. a.
Слайд 149…mille arvel ja klorofülli vahendusel konverteeritakse see siin keerukamateks struktuurideks (korrastatuseks)
Seetõttu võib termodünaamika teist seadust vaadelda (analoogiliselt ajanoolega) kui entroopia noolt ja Universumi asümmeetriat
kirjeldavaks seaduseks.
19. veebruar 2017. a.
Слайд 150Kui Universum oleks igavene, siis peaks kogu taevas olema tähtede poolt
19. veebruar 2017. a.
Слайд 151Kordame veelkord!
See, et Maakeral midagi toimub – moodustuvad uued keerukad struktuurid,
Kokkuvõttes toimub see kõik Päikesel toimuvate protsesside arvel – entroopia suurenemine Päikesel on selleks allikaks, mis võimaldab entroopiat Maal vähendada.
19. veebruar 2017. a.
Слайд 152Seni kuni mateeria areng on tähtede faasis, seni kuni tähtedes on
Ja kõige selle taga on Universumi “ülemjagaja” – korrastatuse-korrastamatuse vahekord, see mille toimet kirjeldab lihtne termodünaamika teine seadus.
19. veebruar 2017. a.
Слайд 153Üheks selliseks “saarekeseks” kus täht mille nimi on Päike korrastub Päikese
“Vahendajaks” Päikese ja meie Maa vahel on klorofüll ja edasi tuleb kõik see mida me naudime – hapnik atmosfääris, meri täis elusorganisme ja sellel sõitvaid laevu, meie ise, Mereakadeemia ja veel palju muud ehk kõik see mis sai võimalikuks Maa ajaloo suurima redoksprotsessi – fotosünteetilise oksüdeerimise tulemusena.
19. veebruar 2017. a.
Слайд 154Paljud keemilised reaktsioonid kulgevad spontaanselt vaid ühes suunas (näiteks teemati ärapõletamine,
Cteemant(S) + O2(g) ? CO2(g)
Neid protsesse saab küll pöörata, kuid selleks peab tegema tööd.
Isoleeritud süsteemis kulgeb protsess spontaanselt kui suureneb süsteemi korrapäratus.
19. veebruar 2017. a.
Слайд 155Igas spontaanses protsessis peab süsteemi ja seda ümbritseva keskkonna korrapäratus suurenema.
Süsteemi
Erinevalt entalpiast (reaktsiooni koguenergiast) on entroopia otseselt eksperimentaalselt määratav suurus.
19. veebruar 2017. a.
Слайд 156Vedeliku keetmisel suureneb süsteemi entroopia, sest molekulide liikumine muutub korrapäratumaks.
Entroopia
ΔS = Q : T
(Q – aurustumissoojus cal/mool; T – vedeliku keemistemperatuur)
Seega entroopia kui olekufunktsiooni suurus on määratud soojuse ja temperatuuri suhtega – see on tuletatav Carnot ringprotsessist (Carnot' ringprotsess koosneb isotermilisest paisumisest-töötav keha on kokkupuutes soojusallikaga vt. koolifüüsika kursusest).
19. veebruar 2017. a.
Слайд 157Tõstes liikmed ümber Carnot protsessi kirjeldavas võrduses
Q0 : Qi = T0
saame olekufunktsioonid mis peegeldavad muutusi korrastatuses ehk entroopias
∆S0 = Q0 : T0
∆Si = Qi : Ti,
19. veebruar 2017. a.
Слайд 158A Termodünaamika II printsiibi mõned formuleeringud:
1) Ei ole võimalik selline protsess,
Soojuse ülekandmine külmemalt kehalt soojemale on võimalik, kuid sel juhul peab mingi masin
tegema tööd soojuse ära võtmiseks külmemalt kehalt, st ümbritsevates kehades toimub muutus -
lõpptulemuseks on soojuse ülekandmine külmemalt kehalt soojemale ja masina poolt ümbritsevas
keskkonnas teostatud muutus.
Selliselt toimivad näiteks külmkapp ja soojapump.
19. veebruar 2017. a.
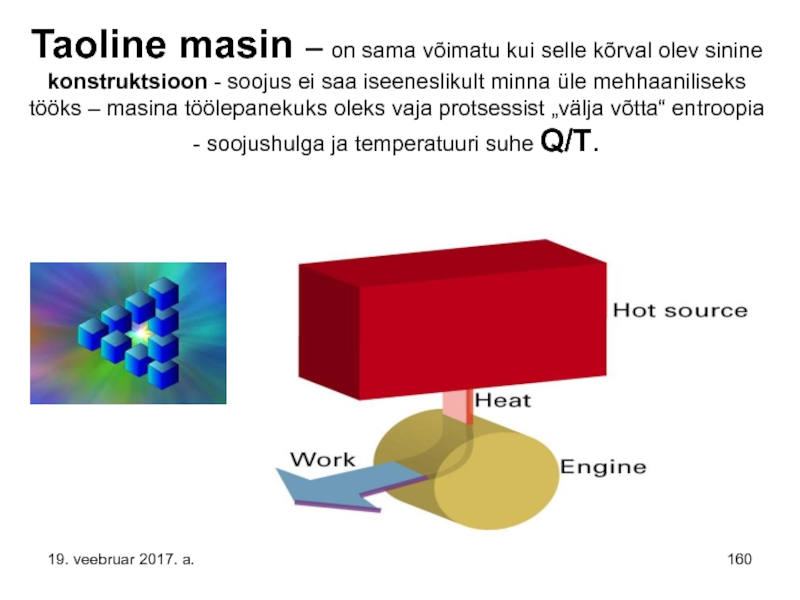
Слайд 1592) On võimatu selline protsess, mille ainus lõpptulemus oleks soojuse võtmine
selle täielik muundamine tööks.
Ideaalne gaas paisub soojendamisel ning teeb seejuures tööd - kogu juurdeantav soojushulk võib
minna paisumisel tehtud tööks, kuid - gaasi ruumala on suurenenud, st juurdeantava soojushulga
muutmine tööks ei ole protsessi ainus lõpptulemus.
Teisalt, kui soojusmasin töötab tsükli alusel, siis toimub
vahepeal soojushulga Q2 andmine külmemale kehale, st kogu juurdeantav soojushulk ei muundu tööks.
Seega – iga masin saab teha tööd ainult väliskeskkonnalt saadud soojushulga Q ja oma siseenergia ∆U kahanemise arvel.
19. veebruar 2017. a.
Слайд 160Taoline masin – on sama võimatu kui selle kõrval olev sinine
19. veebruar 2017. a.
Слайд 161Kordame - Termodünaamika II seadus.
Isoleeritud termodünaamlise süsteemi entroopia muut mistahes protsessi
ΔS ≥ 0
Entroopia muut protsessi käigus on võrdne nulliga vaid pööratavate protsesside korral. Iga süsteem,
mis läheb mittetasakaalulisest olekust üle tasakaalulisse olekusse suurendab entroopiat ehk korrastamatust.
19. veebruar 2017. a.
Слайд 162Entroopia iseloomustab mingi antud protsessi puhul energia üleminekut sellisse vormi, millest
19. veebruar 2017. a.
Слайд 163 Elektripliidil vee keemajamisel soojuseks konverteeritud elektrienergia võiks ilma energia jäävuse
Sellist energia konverteerumise võimatust määratleb termodünaamika teine seadus ja arusaam energia kvaliteedist, mida kirjeldab entroopia mõiste ja mõisted vabaenergiast ning seotud energiast - viimast ei ole võimalik konverteerida kasulikuks tööks.
19. veebruar 2017. a.
Слайд 164Või kui ja veelkord -
Teie liikuva auto kineetiline energia konverteerub pidurdamisel
Kuid soojenenud piduriklotsid ei suuda Teie autot pärast rohelise fooritule süttimist uuesti liikuma panna.
Kuigi kui see ka nii juhtuks, ei oleks energia jäävuse printsiipi rikutud. Rikutud oleks aga termodünaamika teine printsiip.
19. veebruar 2017. a.
Слайд 165Entroopia ja seotud energia mõisted on seega väga lähedased
∆S0 =
Entroopiat tähistatakse S. Tema väärtus oleneb absoluutsest temperatuurist: see osa siseenergiast, mis pole suuteline muutuma kasulikuks tööks ja antakse ära soojuse näol, võrdub keha absoluutse temperatuuri ja entroopia korrutisega TS.
19. veebruar 2017. a.
Слайд 166Seda suurust TS nimetakse seotud energiaks.
Seega
SEOTUD ENERGIA = TS
Eelnevast tuleneb –
Seega – loengu alguses näidatud aurumasinad – mida kõrgem on silindrist väljuva jääkauru temperatuur ja mida kaootilisem osakeste liikumine, seda madalam on masina kasutegur.
19. veebruar 2017. a.
Слайд 167Clausius formuleeris termodünaamika teise seaduse järgnevalt: igasuguse isoleeritud süsteemi entroopia püüab
See tähendab, et protsess kulgeb iseeneslikult ainult süsteemi sellise olekuni, mille puhul entroopia saavutab antud tingimustes oma maksimaalse võimaliku väärtuse.
Seetõttu on süsteemi püsiva tasakaalu oleku eelduseks:
ΔS = max
19. veebruar 2017. a.
Слайд 168Spontaanne (iseeneslik) protsess – soojus hajub – osakeste parameetrid ühtlustuvad.
19. veebruar
Слайд 169Seega – protsess on spontaanne (iseeneslik), kui tal on kalduvus toimuda
JA
Entroopia on korrapärasuse mõõt; vastavalt termodünaamika teisele seadusele kaasneb isoleeritud süstemis iga spontaanse protsessiga entroopia kasv ehk entroopia on mittekahanev suurus.
19. veebruar 2017. a.
Слайд 170Kristallid, ideaalselt korrastatud struktuuriga temperatuuri absoluutse nulli juures, on entroopia väikseim.
Näide infovallast – korrastatusest tähtede järjestusest sünnib loengu konspekt. Selleks, et nii juhtuks on vaja teha tööd.
19. veebruar 2017. a.
Слайд 171Lähtudes eelnevast võib sõnastada ka lause: temperatuuri absoluutne null saavutamiseks on
Viimast lauset on vaadeldakse ka kui termodünaamika kolmandat seadust.
19. veebruar 2017. a.
Слайд 172Seotud energia – siseenergia väärtusetu osa väljendamisel soojusühikutes (kalorites-joulides mooli kohta):
Q = T × ΔS
ja edasi entroopia muutus (vt. slide 122)
ΔS = Q : T
Kuna, mida kõrgem on temperatuur, seda suurem on osakeste KORRASTAMATUS.
Entroopiat saab järelikult kasutada energia seotuse (väärtusetuse) iseloomustamiseks antud temperatuuril – entroopia mõõtühikuks on: J×(deg×mool) -1
19. veebruar 2017. a.
Слайд 173Seega - siseenergiat U pole võimalik täielikult muuta tööks.
Siseenergia koosneb kahest
Vabaenergia on see osa siseenergia varust, mida saab muuta täielikult tööks
F = U – TS
Seega – mida suurem on TS, seda väiksem on süsteemi vabaenergia osa – selle energia osa, mis on süsteemist “kättesaadav”. Seega veelkord – mida kõrgem on temperatuur ja mida suurem on korrastamatus, seda vähem on süsteemis vabaenergiat.
19. veebruar 2017. a.
Слайд 174Praktikas ei määrata U ja S väärtusi otse, vaid nad on
Seotud energia – see osa mida ei saa muuta tööks:
Δ(TS) = T × ΔS
ehk seotud energia osa süsteemis on seda suurem, mida kõrgem on temperatuur ja mida suurem on süsteemi korrastamatus.
19. veebruar 2017. a.
Слайд 175Vabaenergiast lihtsalt.
Vast kõige lihtsamal moel võib vabaenergiat määratleda kui energiat “mis
Toon eelneva kohta näite: kui teil on täispuhutud õhupall, siis on õhupallis olev gaas nõrgalt kokku surutud, selleks on tehtud tööd – selles on mingi hulk energiat. Kui pall katki torgata, vabaneb energia - vabaneb kohe – see ongi vabaenergia. Pallis olev energia “jagunes” palli lõhkemise hetkel kaheks. “Kasutamata” jääb aga laiali paiskunud gaasi siseneergia – osakeste mikroliikumised – vabaenergia lennutas aga palli tükid laiali vabaenergia tegi tööd.
19. veebruar 2017. a.
Слайд 176Ja veel vabaenergiast – Te keerasite üles oma mehhaanilise kella –
Ülesanne isemõtlemiseks – Te lahustasite happes üleskeeratud vedruga kella – kuhu jäi kella vedrusse talletatud energia? Ja milline oleks ning kuidas muutus kella vedrusse talletatud energia kvaliteet?
19. veebruar 2017. a.
Слайд 177Aktivatsioonienergia barjäärid ja vabaenergia suurenemine↔vähenemine reaktsiooniproduktides.
Eksotermiline reaktsioon
Endotermiline reaktsioon (vaja lisada vabaenergiat)
Kõrge
Madal aktivatsioonienergia, suur soojusefekt – reaktsioon kulgeb iseeneslikult – vabaenergia väheneb
19. veebruar 2017. a.
Слайд 178Entroopia muutused on jälgitavad, kui panna soojuslikult isoleeritud anumasse kokku erinevatel
nende temperatuurid võrdsustuvad - süsteem läheb üle tasakaaluolekusse.
Entroopia (süsteemi korrastamatus) on selle
protsessi käigus suurenenud.
Entroopia on protsesside pööratavuse mõõt, näitab protsesside toimumise iseeneslikku suunda – korrastamatusest ei sünni iseenesest korrastatust – selleks et see toimuks, on vaja teha tööd.
19. veebruar 2017. a.
Слайд 179Seepärast on soojusenergia kõige madalamat, kõige kehvemat liiki energia.
Mehhaaniline energia
Ja ka kallimad – elekter (kõrgeima kvaliteediga energia) kallineb meil pidevalt!
Kahjuks ei odavne aga meie elus ka madalaimat liiki energia - hind – selle energia hind, mis on kasutusel meie tubade kütmiseks!
19. veebruar 2017. a.
Слайд 180ENTROOPIA (S) on energia kvaliteeti iseloomustav füüsikaline suurus: mida suurem on
ΔS = Q : T.
Entroopia SI-ühik on üks joule kelvini kohta,
[ΔS] = 1 (J : K).
Entroopia muut ΔS ei olene tingimustest, millistel süsteem läheb algolekust lõppolekusse; oleneb vaid alg- ja lõppolekut iseloomustavatest suurustest.
19. veebruar 2017. a.
Слайд 181Süsteemi siseenergia.
Kui termodünaamiline süsteem ei võta osa energiavahetusest ümbritseva keskkonnaga, on
Ligikaudu isoleerituks võib lugeda süsteeme, kus protsessid toimuvad väga kiiresti (plahvatused).
19. veebruar 2017. a.
Слайд 182Süsteemi siseenergia.
Termodünaamilisele süsteemile on omane teatav kindel energiavaru.
Liikuval autol on teatav
Kogu süsteemi täielikku energiavaru nimetatakse siseenergiaks ja tähistatakse:
U
19. veebruar 2017. a.
Слайд 183Süsteemi siseenergia U koosneb süsteemi moodustavate ainete aatomisisesest energiast, osakeste liikumisenergiate
Isoleeritud süsteemis toimuvad kõik energeetilised protsessid nii, et teatavat ühte liiki energia mingi koguse kadumisega mõne füüsikalise või keemilise protsessi tulemusel, kaasneb samas süsteemis, mingi teist liiki energia ekvivalentse koguse tekkimine.
19. veebruar 2017. a.
Слайд 184Kui antud süsteemis märkida “kadumaminevat” (hajuvat) energiat negatiivse suurusena ja asemele
ΔU = 0
19. veebruar 2017. a.
Слайд 185Süsteemi siseenergiast veel.
SEEGA
Isoleeritud süsteemis toimunud füüsikaliste või keemiliste protsesside puhul võrdub
Isoleeritud süsteemis on kõikide energialiikide summa püsiv suurus:
Σ E = U = const,
kuid erinevused tekivad on need energia kvaliteedis.
19. veebruar 2017. a.
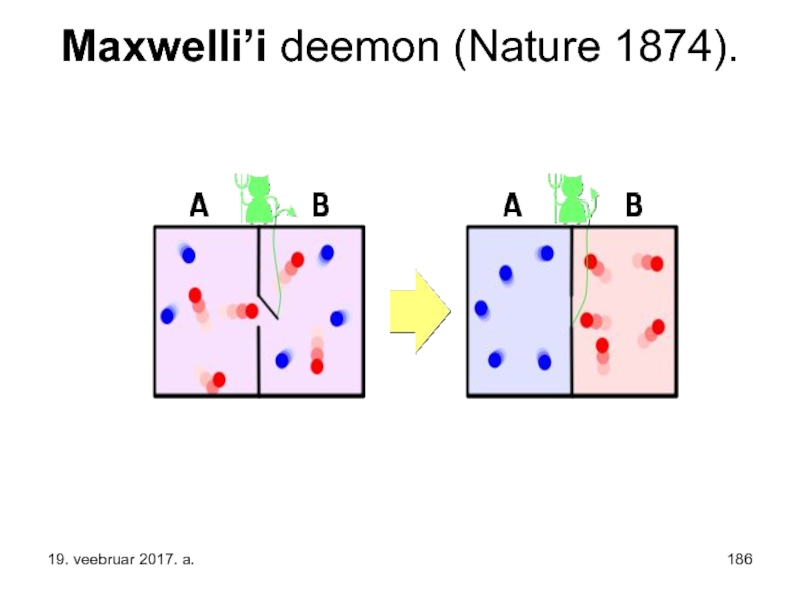
Слайд 187 Maxwelli deemon. See on piltlik kujund entroopia kasvu seaduse rikkumise
Kujutame, et meie kahekambrilise ruumi vaheseinas on uks, mida avab ja sulgeb molekulaarsete mõõtmetega "deemon", avades ukse, kui madalama temperatuuriga ruumist läheneb kiire (või kõrgema temperatuuriga ruumist aeglane) molekul. Eeldades, et ukse avamine ei nõua energiat, saame sel teel tekitada ühes ruumipooles kõrgema temperatuuri teise ruumi temperatuuri languse arvel - seega vähendada summaarset entroopiat.
Ainus vajalik tingimus sellise "II liiki perpetum mobile valmistamiseks on "informatsiooni kasutav deemon".
19. veebruar 2017. a.
Слайд 188Kuidas on lood tegelikult, on probleem koos oma filosoofilise-kvantloodusteadusliku taustaga. Kuid
19. veebruar 2017. a.
Слайд 189Matemaatikud on näiteks seisukohal, et entroopia kasvu seadus kehtib ka informatsioonivoogude
Toon näite: teadmiste mahu plahvatuslik kasv viimase viiekümne aasta vältel on viinud äärmiselt madalale tõenäosuse, et üks indiviid (või grupp) suudaks kontrollida saabuva info kvaliteeti. Ja raskusi selles vallas näikse olevat isegi USA NSA-l.
Tuntud on ka II Maailmasõja ajal liitlaste dessandiga Prantsusmaale maabumise ettevalmistamine, kus nn
D-day kohta oli liikvel nii palju erinevat informatsiooni, et selle tõelised asjaolud jäidki sakslastele, vaatamata nende luure ja sakslaste teenistuses olevate prantsuse kollaborantide laialdasele võrgustikule, saladuseks.
19. veebruar 2017. a.
Слайд 190"Deemon", kes veel sada aastat tagasi oli võimeline eristama tõde valest
Kokkuvõttes on ikka nii, nagu elektroni käitumist muudab vaatleja olemasolu (vt. 2. loengu video – elektronide käitumine kahepilu katses vaatleja olemasolul ja selle puudumisel), on ka siin vaatlejapoolse protsessi mõjutava jõuga tegemist.
19. veebruar 2017. a.
Слайд 191Eelneva jätkuks seoses entroopia küsimustega sobib hästi näide keemiliste sidemete tekkimisest-lagunemisest.
Teatavasti on keemiline reaktsioon keemiliste sidemete ümberkujunemise protsess, millega kaasneb energia neeldumine, või vabanemine soojusena, kiirgus- või elektrienergia kujul.
Keemiliste reaktsioonide käigus kas neeldub või vabaneb soojust- energiaefektidest on tähtsaim soojusefekt.
19. veebruar 2017. a.
Слайд 192Soojusefekt - soojushulk, mis püsival temperatuuril eraldub või neeldub ainete mittepöörataval
Soojuslike muutuste uurimisega tegeleb termokeemia.
Termodünaamika on ka õpetus mitmesuguste protsesside energeetilistest efektidest.
19. veebruar 2017. a.
Слайд 193Hessi seadus selle klassikalisel näitel.
Soojusefekt, olles võrdne reaktsioonisaaduste ja lähteainete entalpiate
Analoogia füüsikalise tööga on siin täielik – füüsikalises mõttes ei sõltu tehtud töö hulk sellest millist teed mööda me mäe otsa ronisime – ronimisel tehtud töö sõltub vaid mäe kõrgusest.
19. veebruar 2017. a.
Слайд 195Näiteks soojusefekt reaktsioonis.
C(grafiit) + O2(g) → CO2(g) ΔH° =
Kui me saame aga grafiidist enne süsinikoksiidi:
C(grafiit) + 1/2 O2(g) → CO(g) ΔH° = -110.5 kJ
ja põletame CO seejärel edasi süsinikdioksiidiks:
CO(g) + 1/2 O2(g) → CO2(g) ΔH°= -283.0 kJ
on summaarne eralduv soojushulk ikka sama
-110.5 + (-283.0) = -393.5 kJ
19. veebruar 2017. a.
Слайд 196Hessi seadus kokkuvõtvalt.
Muutus süsteemi energias, mis kaasneb süsteemi üleminekuga algolekust lõppolekusse
Isoleeritud süsteemi energia on konstantne suurus.
vesi → jää = vesi → aur → jää
19. veebruar 2017. a.
Слайд 197Veel - näitena eelneva kohta:
kui võtta
100 g vett temperatuuriga
60-ne kraadini.
19. veebruar 2017. a.
Слайд 198Siseenergia juurde tagasi.
Termodünaamika I seadus = energia jäävuse printsiip- energia vabanemine
Siseenergia- kehade sisemine energiavaru U;
Eksotermiline reaktsioon- soojus vabaneb U vähenemise arvelt;
Endotermiline reaktsioon- soojus neeldub U kasvab.
19. veebruar 2017. a.
Слайд 199qv=ΔU,
kus qv – püsival ruumalal toimuva reaktsiooni soojusefekt;
Siseenergia on süsteemis olevate aineosakeste ja nende vastastikuse toime summaarne energia. Siseenergia - süsteemi koguenergiast eraldame süsteemi kui terviku kineetilise ja potentsiaalse energia.
Süsteemi siseenergia absoluutväärtust mõõta ei saa, on võimalik vaid määrata ΔU väärtusi (tähendab on võimalik mõõta vaid muutust).
19. veebruar 2017. a.
Слайд 200Protsessi koguenergia kannab nimetust entalpia.
ΔH= ΔG + TΔS
s.t. protsessi koguenergia ehk
NB! Entalpia mõõtühik on J (joule).
19. veebruar 2017. a.
Слайд 201Keemilise reaktsiooni kulgemisel kas eraldub või neeldub soojust.
Konstantsel rõhul kulgeva reaktsiooni
Reaktsioonid kulgevad entalpia vähenemise (ΔH <0) ja entroopia kasvu
(ΔS >0) suunas (ehk energia kulub (hajub) ära ja kaob algproduktide korrastatus).
19. veebruar 2017. a.
Слайд 202Entalpia.
Gaasireaktsioonidel esineb süsteemi ruumala muutus, püsivaks loetakse välisrõhku P. Vastavat isobaarset
Gaaside eraldumisega toimuvas reaktsioonis peab süsteem kulutama osa oma energiast paisumistööks. Püsiva välisrõhu ületamisega seotud paisumistöö W:
W = PΔV,
kus ΔV on reaktsiooni ruumalaefekt.
19. veebruar 2017. a.
Слайд 203Termodünaamika I seaduse põhjal:
qp – w =ΔU, siit
qp = ΔU +
ΔH - olekufunktsioon entalpia muut.
Soojusefekt on võrdne süsteemi entalpiamuuduga.
ΔH = ΔU+ ΔnRT,
Δn - gaaside moolide arvu muut keemilises reaktsioonis.
19. veebruar 2017. a.
Слайд 204Vabaenergia mõiste praktilisemaks kasutamiseks võeti kasutusele uus olekufunktsioon mis kirjeldaks seda
19. veebruar 2017. a.
Слайд 205Mittepaisumistöö hõlmab ka lihaste töö ja närvisignaalide edasikandumist ning on seega
Seega Gibbs`i energia muutus on süsteemi ja tema väliskeskkonna summaarne energiamuut konstantsel rõhul ja temperatuuril. Konstantsel temperatuuril ja rõhul toimuva iseenesliku protsessi Gibbs`i energia väheneb.
19. veebruar 2017. a.
Слайд 206NB! Vabaenergia (Gibbsi energia) on miinimumis, siis kui entroopia on maksimumis
19. veebruar 2017. a.
Слайд 208Entalpia.
Reaktsiooni energia ja reaktsiooni entalpia vahel on järgmine seos:
ΔH = ΔU
Näide:
Zn + H2SO4 ? ZnSO4 + H2
ΔU = -145,5kJ×mol-1
ΔH = -143,2kJ×mol-1
pΔV = 2,3kJ×mol-1
Kuna vedelike ja tahkete ainete mooliruumalad on palju väiksemad gaasi mooliruumalast, siis oleneb ΔV väärtus peamiselt gaaside tekkimisest ja kadumisest reaktsiooni vältel.
19. veebruar 2017. a.
Слайд 211Selgitusi.
Omavahel reageerivad ained on praktiliselt alati molekulidena.
Nende omavahelisel reageerimisel, reaktsiooni esimesel
Endotermilise reaktsiooni puhul aga kulub lähteainetes olevate keemiliste sidemete lõhkumiseks rohkem energiat kui eraldub uute moodustumisel (välgu toimel lämmastikoksiidide moodustumisel atmosfääris).
19. veebruar 2017. a.
Слайд 212Termodünaamika esimese seaduse juurde, kolvi tõstmiseks tehakse tööd, süsteemi siseenergia väheneb
19. veebruar 2017. a.
Слайд 2132 H2 + O2 ? 2 H2O + DH (DH =
Entalpia muutus protsessis (DH) võrdub protsessis (reaktsioonis) neelduva või eralduva soojushulgaga.
Kui protsessis eraldub energiat nimetatakse seda eksotermiliseks protsessiks (ΔH < 0).
Kui energiat tuleb süsteemi juurde anda on tegemist endotermilise protsessiga (ΔH > 0).
1 mooli jää sulamisel
H2O(s) → H2O(l)
ΔH = +6.01 kJ
süsteemi entalpia kasvab.
19. veebruar 2017. a.
Слайд 2141 mooli metaani põlemisel
CH4(g) + 2O2(g) → CO2(g)+ 2H2O(g)
ΔH
süsteemi entalpia väheneb (miinusmärk).
Entalpia muut mingis protsessis võrdub saaduste ja lähteainete entalpiate vahega:
ΔH = ΣH(saadused) - ΣH(lähteained)
19. veebruar 2017. a.
Слайд 215Reaktsiooni standardne entalpia.
Soojusefekt (ΔH°) on entalpia muut
reaktsiooni läbiviimisel standardtingimustel.
ΔH° leidmiseks
ΔH° = Σνi ΔHf°298 (produktid) - Σνi ΔHf°298 (lähteained)
Üldkujul reaktsioonile
aA + bB → cC + dD
ΔH°= [c×ΔHf°298(C) + d×ΔHf°298(D)] - [a×ΔHf°298(A) + b×ΔHf°298 (B)]
19. veebruar 2017. a.
Слайд 216Näide:
4FeS2(s) + 11O2(g) = 2Fe2O3(s) +8SO2(g)
reaktsiooni soojusefekt ΔH0 on:
(ekso,
19. veebruar 2017. a.
Слайд 217Soojenemiskõver.
Sulamis- ja aurustumisentalpiad (aurustumise koguenergia) mõjutavad soojenemiskõverate kuju. Soojenemiskõver on graafik,
Järgneval slidel on toodud külma jää soojenemine – esialgu tõused jää temperatuur ühtlase kiirusega – vee molekulid on suletud tahkisesse ja vibreerivad temperatuuri tõustes üha kiiremini kuni vibreerimine muutub piisavalt tugevaks, et üksteisest eraldada. Temperatuuri tõstes kasutatakse kogu lisatav energia molekulidevaheliste tõmbejõudude ületamiseks.
19. veebruar 2017. a.
Слайд 218Alles pärast jää sulamist hakkab temperatuur taas tõusma ning see jätkub
19. veebruar 2017. a.
Слайд 219Vedeliku soojenemiskõvera tõus on seda järsem, mida madalam on vedeliku soojusmahtuvus.
Vedela vee suur soojusmahtuvus on tingitud seal säilinud vesiniksidemete võrgust. Molekulid on seotud vesiniksidemetega ning nende sidemete võnkumine ja sidemete lõhkumine tarvitab rohkem energiat kui aatomitevaheliste jäikade sidemete võnkumine.
19. veebruar 2017. a.
Слайд 221Tekkesoojus
- on 1 mooli ühendi tekkimisel lihtainetest vabanev või neelduv soojushulk.
Arvutamisel
Standardtingimustes püsivate lihtainete (grafiit, rombiline S, vedel broom jt.) tekkeentalpiad võrduvad 0.
19. veebruar 2017. a.
Слайд 222Aine põlemissoojuseks nimetatakse
1 mooli aine täielikul põlemisel vabanevat
soojushulka.
Täieliku põlemise produktideks on mittepõlevad ained - CO2, H2O, N2 ja SO2.
19. veebruar 2017. a.
Слайд 224Termodünaamika seadustele vastavalt toimub meie Maailmas kõik, mis siin Maailmas üldse
19. veebruar 2017. a.
Слайд 225siis ühe või kahe valimisperioodi vältel jääb tõepoolest nn. moodsatele demokraatlikele
Olen kindel, et kõik on kuulnud praegu sageli korratavat väidet, et mitmekesisus rikastavat, pidades selle all sagedasti silmas nihkunud seksuaalsuhteid ja muidki inimeste eluvõimetuid veidrusi (mis muidugi on inimkonna minevikus alati mingil moel olemas olnud ning pole seega mingiks kaasaegseks „avastuseks“).
19. veebruar 2017. a.
Слайд 226„Rikastamise“ osas on aga enamasti selgitamata jäetud, et mis-kes ja mida
19. veebruar 2017. a.
Слайд 227Olukorda, kus Maailmast on kadunud potentsiaalide vahe kannab nimetust soojussurm (vaata
19. veebruar 2017. a.
Слайд 228Ja veel samal teemal, aga imeravimite kaudu – teatavasti on viimasel
19. veebruar 2017. a.
Слайд 229…eelduseks, nähtuseks, mille kaudu organismid väärindavad energiat, muudavad selle kasutatavaks –
19. veebruar 2017. a.
Слайд 230…ehk organismi korrastamatus ei ole enam kokkusobiv eluks vajaliku korrastatusega ehk
Ja veel - teatavasti toimivad kütuseelemendid täpselt samal põhimõttel nagu elusorganismidki – nende tööks on vajalik membraan, mis laseb läbi prootoneid ja ei lase läbi elektrone, just nii nagu rakumembraanidki – selektiivse läbilaskvuse kadumisel lõpetab element töö (küttelementidest lähemalt
13. Loeng).
19. veebruar 2017. a.
Слайд 231Ja veel – organismide kohastumine tagab mitte ainult nende ellujäämise, vaid
Konkurents, mis on paljudele isenditele hävitav, kuid liigi jaoks möödapääsematult vajalik. Enamasti on konkurentsi mehhanismiks suguline valik – erineva „konstruktsiooniga“ (mehed-naised kui soovite) sama liigi isendid, erinevate „ülesannetega“ oma eluteel peavad kohtuma ja moodustama keeruka elu võrgustiku ehk struktuuri.
19. veebruar 2017. a.
Слайд 232Iga hälve, iga lihtsustus, mis tekitab selles segadust, süsteemi entroopia suurenemist
19. veebruar 2017. a.
Слайд 233Ja nii vast ongi loodusseaduseks see, et kõik, mis inimesed siin
Ning veel – inimpopulatsioonis (ja ka loomapopulatsioonides) on alati meeste varieeruvus suurem kui naistel – kui mees on loll, siis on hästi loll, aga kui tark, ka siis on sageli ka hästi tark. Meie, meeste peal evolutsioon eksperimenteeribki. Aga kullaga ei riskita, seda hoitakse näguripäevadeks. Ärgem siis saatkem naisi sinna kuhu peavad minema mehed. Siis ehitavad naised-mehed koos üles selle mille aeg (mehed naiste pärast?) lõhkunud on.
19. veebruar 2017. a.
Слайд 234Kokkuvõtteks.
Entroopia ja termodünaamika 2 seadus.
Iseenesliku protsessi toimumise tulemus looduses on protsessi
kõik protsessid looduses toimuvad iseeneslikult ainult ühes suunas, soojus läheb iseenesest ainult kõrgema temperatuuriga kehalt madalama temperatuuriga kehale ehk
ΔS ? max
19. veebruar 2017. a.
Слайд 235ENTROOPIA (S) on energia kvaliteeti iseloomustav füüsikaline suurus: mida suurem on
ΔS = Q : T.
Entroopia SI-ühik on üks joule kelvini kohta,
[ΔS] = 1 (J : K).
Entroopia muut ΔS ei olene tingimustest, millistel süsteem läheb algolekust lõppolekusse; oleneb vaid alg- ja lõppolekut iseloomustavatest suurustest.
19. veebruar 2017. a.
Слайд 236Entroopia muut võimaldab otsustada, kas protsess on pöörduv või pöördumatu. Kui
Protsessid, milles entroopia väheneb ΔS > 0 on võimalikud ainult täiendava energia lisamisel süsteemi – elu on süsteem, mis vähendab iseenda entroopiat Päikese energia arvel.
19. veebruar 2017. a.
Слайд 237Avatud süsteemides võib energia väheneda, kuid see saab toimuda vaid keskkonna
Entroopia on ka süsteemi korrastamatuse mõõt: mida suurem on entroopia, seda suurem on süsteemi korrastamatus ehk kaos. Süsteemi entroopia võrdub Boltzmanni konstandi ja oleku tõenäosuse naturaallogaritmi korrutisega,
S = k×lnW.
19. veebruar 2017. a.
Слайд 238Negentroopia allikas Maakera jaoks on Päike. Kasutegur = (6000 – 300) :
19. veebruar 2017. a.
Слайд 239Looduses põhiliselt endotermiliselt toimuv reaktsioonide võrgustik – fotosüntees – on allikaks
Puidu põlemine ja meie elutegevus – on võimalik vaid endotermiliselt tekkinud ühendite ebastabiilsuse tõttu.
19. veebruar 2017. a.
Слайд 240Külmkapi korral on jahutajaks
külmkapis olev õhk, esemed kapis; ning soojendajaks väliskeskkond.
koos gaasisüsteemiga. Gaasiga tehakse tööd (näiteks Joule'i-Thomsoni efekti kasutades), mille
tulemusena võetakse tsükliliselt külmkapi sisemusest energiat Q2 ning soojendajale antakse
soojushulk Q1=A+Q2 .
Samamoodi - soojapumba korral võetakse sooja kas välisõhust või Maa
sisemusest, temperatuuriga T2, ning antakse edasi toaõhule, temperatuuriga T1, kusjuures T 1>T 2 .
Külmkapi korral arvestatakse külmkapi efektiivsust - mitu korda ületab külmkapilt ara võetav
soojushulk äravõtmiseks vajaliku töö.
19. veebruar 2017. a.
Слайд 241Näiteid entroopia asjus.
Kristallisatsioon – jahutatava vedeliku või amorfse aine kristalliseerimise protsessis
Plancki postulaat: kui T =00K, siis S = 0
19. veebruar 2017. a.
Слайд 242Termodünaamika II seadusest
EHK
Soojus ei saa iseenesest üle minna külmemamalt kehalt kuumemale,
EHK
energia kandub alati kõrgema potentsiaaliga süsteemilt üle madalama potentsiaaliga süsteemile, kusjuures see ülekandumine kestab seni, kuni saabub termodünaamiline tasakaal.
19. veebruar 2017. a.
Слайд 243Entroopia ja vabaenergia.
4 Fe(s) + 3 O2(g) → 2 Fe2O3(s)
ΔH
S°(Fe) = 27.3 J/K×mol
S°(O2) = 205.0 J/K×mol
S°(Fe2O3) = 87.4 J/mol×K
ja entroopia muut kogu reaktsioonis:
ΔS° = 2×87.4 - [4×27.3 + 3×205.0] = -549.4 J/K < 0
Süsteemi (antud reaktsiooni) entroopia seega kahaneb
(ΔS < 0), üldine (summaarne)
entroopia aga vastavalt termodünaamika II seadusele ilmselt kasvab (eksotermiline
protsess - soojus hajub ümbritsevasse keskkonda).
19. veebruar 2017. a.
Слайд 244Metallide tootmisel maagist materjal korrastub, luuakse potentsiaalide vahe – saadakse puhas
Looduses rauas olev vabaenergia vabaneb – raud oksüdeerub (roostetab = korrodeerub), raua vabaenergia hajub soojusena ning hästikorrastatud raua asemel jääb alles väiksema korrastusastmega rooste.
Ning looduses leidubki raud vaid maagina (roostena), kust seda tuleb välja sulatada, suurendades produkti vabaenergiat (ja nii luues eelduse raua roostetamiseks).
19. veebruar 2017. a.
Слайд 245J.W.Gibbs (1839-1903) - ameerika füüsik-teoreetik, peam. tööd keemil. termodünaamika ja statistil.
Keemiliste protsesside termodünaamilise tasakaalu väljendamine Gibbsi energia kaudu.
Püsival rõhul ja temperatuuril sõltub G väärtus ainult süsteemi koostisest (keemil. reaktsiooni toimumisest).
Keemilise reaktsiooni käigus G väheneb, → Gmin (tasakaaluolek):
G = Gminvõi G = 0
Püsivat tasakaalu iseloomustab Gibbsi energia miinimum.
19. veebruar 2017. a.
Слайд 246Keemilise reaktsiooni suuna ja tasakaaluoleku kriteeriumid
Gibbsi energia (vabaenergiat) - entalpiat ja
G = H - TS
on Gibbsi energia definitsioonavaldis
kus G - Gibbsi energia
H - entalpia
S - entroopia
19. veebruar 2017. a.
Слайд 247Gibbsi energia muut ΔG
avaldub reaktsioonientalpia ΔH ja reaktsioonientroopia ΔS kaudu :
ΔG
tasakaalu (selles on tema kasutamise mõte)
ΔG saab arvutada
- ΔH ja ΔS kaudu
- reaktsioonis osalevate ainete tekkereaktsioonide ΔG väärtuste
kaudu (algebraline liitmine nagu tekke-entalpiate puhul)
19. veebruar 2017. a.
Слайд 248Iseeneslikud protsessid suletud süsteemis lõpevad alati tasakaaluolekuga.
Püsiva P ja T korral
ΔG < 0
alusel iseloomustab G vähenemine ainete reaktsioonivõimet, G konstantsus - süsteemi tasakaaluolekut (kui P ja T on püsivad) ja reaktsioon saab toimuda ainult eksotermilises (ΔH < 0) suunas (soojus eraldub).
19. veebruar 2017. a.
Слайд 249 G muutumine keemilise reaktsiooni käigus.
G ja aine koostise
Keemilise reaktsiooni teostatavus.
Kõik iseeneslikud füüsikal. ja keemil. protsessid toimuvad Gibbsi energia
ΔG = ΔH - TΔS
vähenemise suunas.
Entalpia ja entroopia võivad protsessi jooksul kas väheneda või suureneda, kuid Gibbsi energia (vabaenergia) väheneb alati.
19. veebruar 2017. a.
Слайд 250Iseeneslike protsesside puhul on alati ΔG
Reaktsioonid, kus ΔG < 0, on võimalikud (liiguvad suunas:
lähteained (reagendid) → produktid.
Kuid see tingimus ei osuta reaktsioonide toimumise kiirusele (seda külge käsitleb keemiline kineetika).
Toodud avaldiste alusel on termodünaamiliselt alati võimalikud eksotermilised reaktsioonid (ΔH < 0), millede puhul tekivad gaasid (ΔS > 0).
19. veebruar 2017. a.
Слайд 251Endotermilised reaktsioonid (ΔH > 0) saavad toimuda ainult entroopiafaktori mõjul, kui
TΔS >> 0.
See tingimus osutab, et
- temperatuur peab olema suhteliselt kõrge
- gaase peab eralduma rohkem, kui neid reaktsiooni astub.
19. veebruar 2017. a.
Слайд 252 Gaaside neeldumisega negatiivse ruumalaefektiga reaktsioonid (ΔS < 0) on entalpiafaktori
Kui gaasiliste ainete hulgad reaktsiooni käigus (ei muutu osakeste arv) ei muutu (Δn = 0) või kui reaktsioonis osalevad ainult vedelad ja tahked ained, siis ΔS ≈ 0
19. veebruar 2017. a.
Слайд 253Aine tekke standartne Gibbsi energia (ΔGf0) – standard Gibbs free energy
19. veebruar 2017. a.
Слайд 254Vabaenergia ja seotud energia.
Eelnevast tuleneb omakorda, et süsteemi siseenergiat U pole
Järelikult
võib siseenergiat vaadelda koosnevana kahest osast – vabast ja seotud energiast
U = Energiavaba + Energiaseotud
Ainult vabaenergia moodustab selle osa siseenergia varust, mida saab täielikult muuta tööks – selle kasutamine on tehniliselt teostatav.
19. veebruar 2017. a.
Слайд 255Entroopia.
Iga energiavorm (mehhaaniline, elektriline, keemiline jt.) võib täielikult üle minna soojusenergiaks.
Vastassuunaline
See tähendab,
et toimub energia osaline degradatsioon (kvaliteedi alanemine). Lähtudes selle kasutatavuse seisukohalt on kütmine elektriga mitte eriti arukas tegevus - (kontsentreeritud energia) elektrienergia degradeeritakse soojuseks (Gibbsi energia vabaneb), mis hajub ja entroopia maksimaliseerub.
Seega kütmine elektrienergiaga tulemuseks saame soojuse, kuid suurendame entroopiat.
19. veebruar 2017. a.
Слайд 256Tavatingimustes on molekulide kineetiline energia 2,5 kJ/mol ja aeg kahe omavahelise
Molekulide energia jaotub sarnaselt Gaussi kõveraga (tegelikult log-normaalse kõveraga, mille erijuhuks on Gaussi kõver) ning põrkumisel reageerivad eelkõige suurema energiaga molekulid – suurima keemiline aktiivsusega molekulid (näit. valentselektronid asuvad kõrgematel orbitaalidel).
19. veebruar 2017. a.