- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Розчинник презентация
Содержание
- 1. Розчинник
- 2. Розчини - однорідна багатокомпонентна система, що складається
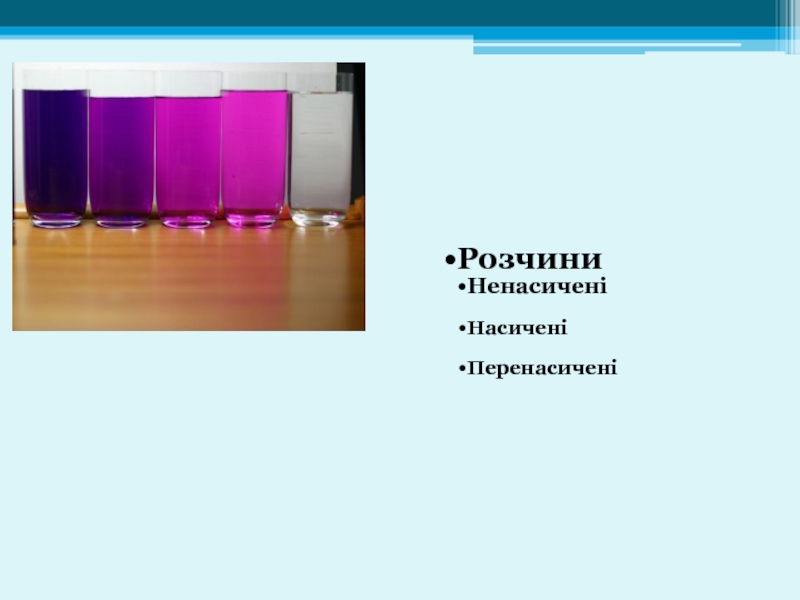
- 3. Розчини Ненасичені Насичені Перенасичені
- 4. Процес взаємодії розчинника і розчиненої речовини
- 5. Процеси, що поглинають тепло: Руйнування кристалічної
- 6. Розчинністю - називається здатність речовини розчинятися
- 7. Р – добре розчинні речовини Наприклад:
- 8. Чинники, що впливають на розчинність Природа розчинника Зміна температури Зміна тиску
- 9. Концентрація розчинів Масова частка розчиненої речовини -
- 10. Дисперсні системи – це системи, в яких
- 11. Суспензії - це дисперсні системи, в яких
- 12. Емульсії - це дисперсні
- 13. Колоїдні розчини - це високодисперсні двофазні
- 14. Властивості колоїдних розчинів Наявність різного забарвлення
- 15. Для осадження золю необхідно, щоб його частинки
- 16. Колігативні властивості— властивості розчинів, які залежать від
- 17. Зниження тиску насиченої пари розчину описується законом
- 18. Щоб кількісно оцінити збільшення температури кипіння і
- 19. Осмос— це спонтанний перехід чистого розчинника у
- 20. Причини застосування розчинів Ідеальне середовище для підведення
- 21. Дякуємо за увагу!
Слайд 2Розчини - однорідна багатокомпонентна система, що складається з розчинника, розчинених речовин
Розчини - це молекулярні суміші, які за агрегатним станом можуть бути рідкими - морська вода, газоподібними – повітря ,або твердими - багато сплавів металів.
Слайд 4
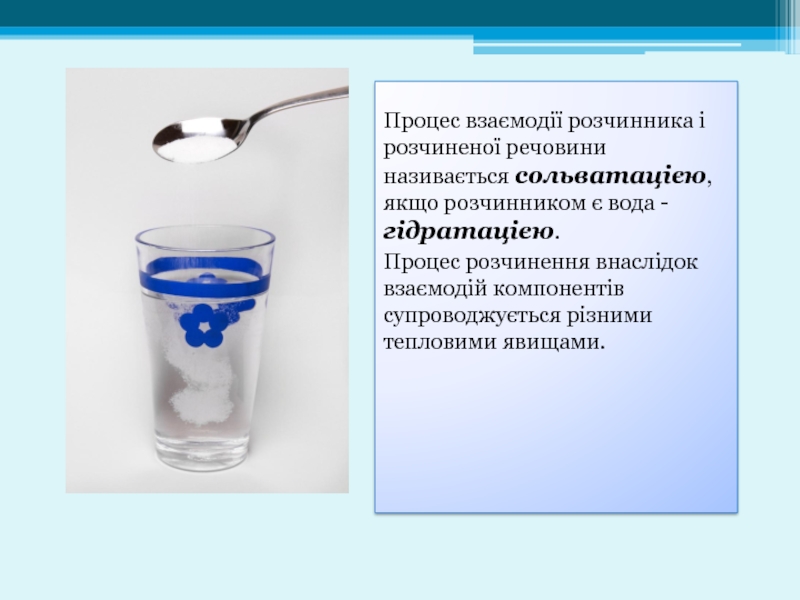
Процес взаємодії розчинника і розчиненої речовини називається сольватацією, якщо розчинником є
Процес розчинення внаслідок взаємодій компонентів супроводжується різними тепловими явищами.
Слайд 5Процеси, що поглинають тепло:
Руйнування кристалічної решітки, розриви хімічних зв'язків у
Процеси, що виділяють тепло:
Утворення продуктів взаємодії розчиненої речовини з розчинником.
Слайд 6
Розчинністю - називається здатність речовини розчинятися в тому чи іншому розчиннику.
Розчинність залежить від природи речовини і розчинника,температури і тиску.
Слайд 7Р – добре розчинні речовини
Наприклад: цукор, мідний купорос, гідроксид натрію, спирт,
М - малорозчинні речовини
Наприклад: гіпс, сульфат свинцю, діетиловий ефір , бензол, метан, азот, кисень.
Н – нерозчинні речовини
Наприклад: скло, срібло, золото,олія, благородні гази.
Слайд 9Концентрація розчинів
Масова частка розчиненої речовини - це безрозмірна величина,що дорівнює відношенню
Молярна концентрація показує, скільки моль розчиненої речовини міститься в 1 літрі розчину.
Слайд 10Дисперсні системи – це системи, в яких одна речовина рівномірно розподілено
До дисперсних систем відносяться звичайні (справжні) розчини, колоїдні розчини, а також суспензії та емульсії.
Слайд 11Суспензії - це дисперсні системи, в яких дисперсної фазою є тверда
Слайд 12 Емульсії - це дисперсні системи, в яких і дисперсна фаза і
Слайд 13
Колоїдні розчини - це високодисперсні двофазні системи, що складаються з дисперсійного
Колоїдні розчини інакше називають золями.
Слайд 14Властивості колоїдних розчинів
Наявність різного забарвлення
Розсіювання світла частками - ефект Тиндаля
Наявність
Слайд 15Для осадження золю необхідно, щоб його частинки з'єдналися в більш великі
Значення золів виключно велике, тому що вони більш поширені, ніж істинні розчини: протоплазма живих клітин, кров, соки рослин.
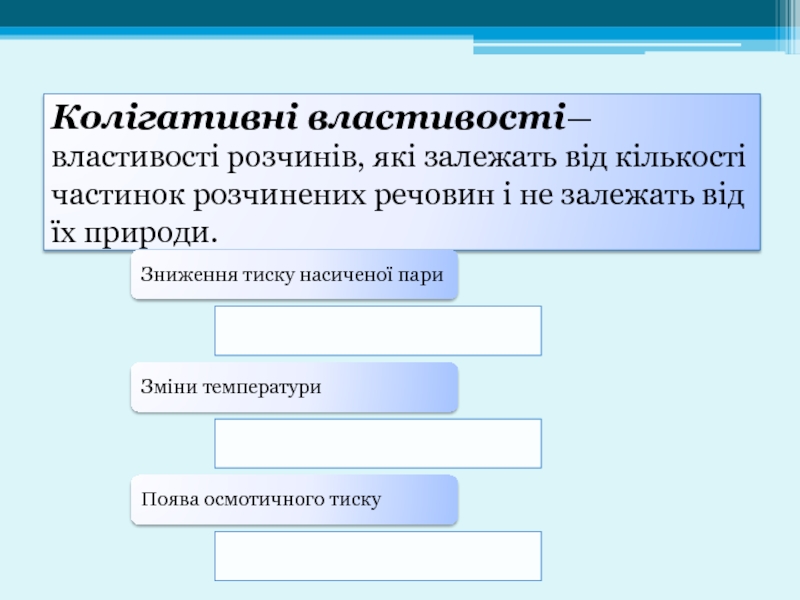
Слайд 16Колігативні властивості— властивості розчинів, які залежать від кількості частинок розчинених речовин
Зниження тиску насиченої пари
Зміни температури
Поява осмотичного тиску
Слайд 17Зниження тиску насиченої пари розчину описується законом Рауля: відносне зниження тиску
Слайд 18Щоб кількісно оцінити збільшення температури кипіння і зменшення температури плавлення розчину,
Слайд 19Осмос— це спонтанний перехід чистого розчинника у розчин, відділений від нього
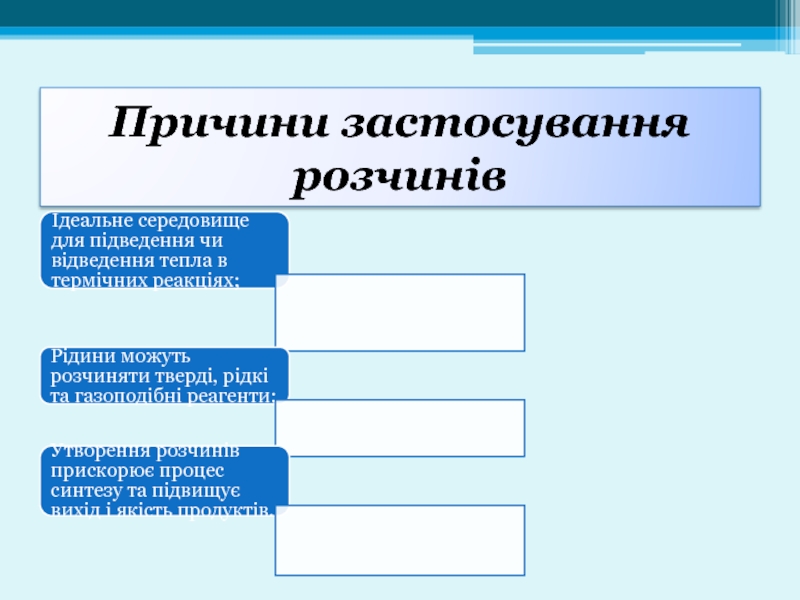
Слайд 20Причини застосування розчинів
Ідеальне середовище для підведення чи відведення тепла в термічних
Рідини можуть розчиняти тверді, рідкі та газоподібні реагенти;
Утворення розчинів прискорює процес синтезу та підвищує вихід і якість продуктів.