- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Растворы. Классификация растворов. (Лекция 5) презентация
Содержание
- 1. Растворы. Классификация растворов. (Лекция 5)
- 2. Растворы. Классификация растворов Растворитель – компонент,
- 3. Газообразные растворы (Смесь газов) Жидкие растворы По
- 4. Твёрдые растворы сплавы металлов латунь – твёрдый
- 5. Растворы. Классификация растворов По относительным количествам растворенного
- 6. Растворы. Классификация растворов Истинный раствор – однофазная
- 7. Физические и химические процессы при растворении Физическая
- 8. Физические и химические процессы при растворении Механическая
- 9. Физические и химические процессы при растворении Тепловой
- 10. Способы выражения концентрации Концентрация – соотношение между
- 11. Растворимость веществ. Факторы, влияющие на растворимость
- 12. Растворимость веществ. Факторы, влияющие на растворимость
- 13. Растворимость твердых веществ в жидкостях от
- 14. Растворимость жидкостей в жидкостях от природы
- 15. Растворимость газов в жидкостях Растворимость газов
- 16. Закон распределения 1 2 c1
- 17. Законы Рауля Первый закон Рауля связывает
- 18. Законы Рауля Относительное понижение парциального давления пара
- 19. Законы Рауля Понижение температуры замерзания раствора и
- 20. Одинаковы при
- 21. Растворы электролитов Электролиты – вещества, которые в
- 22. Растворы электролитов Степень диссоциации – доля растворенного
- 23. Растворы электролитов Сильные электролиты Слабые электролиты Электролиты
- 24. Состояние сильных электролитов в растворе
- 25. Водородный показатель Можно принять концентрацию недиссоциированных
- 26. Водородный показатель Ионное произведение воды моль/л -
- 27. Водородный показатель
- 28. Водородный показатель Среда
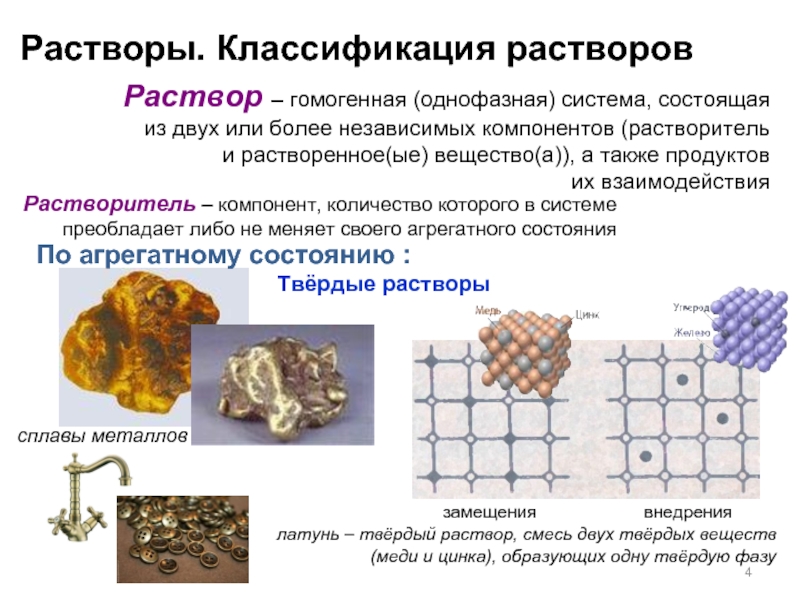
Слайд 2Растворы. Классификация растворов
Растворитель – компонент, количество которого в системе
преобладает
Раствор – гомогенная (однофазная) система, состоящая
из двух или более независимых компонентов (растворитель
и растворенное(ые) вещество(а)), а также продуктов
их взаимодействия
Компоненты растворов сохраняют свои уникальные свойства
и не вступают в химические реакции между собой
с образованием новых соединений
2H2+O2→2H2O
t
Слайд 3Газообразные растворы
(Смесь газов)
Жидкие растворы
По агрегатному состоянию:
воздух – это раствор кислорода, паров
растворы твердых веществ в жидкостях:
соль+Н2О, сахар+Н2О , йод+Н2О
растворы газообразных веществ в жидкостях: лимонады, нашатырный спирт
растворы жидкостей в жидкостях:
уксус, водка
Растворы. Классификация растворов
Раствор – гомогенная (однофазная) система, состоящая
из двух или более независимых компонентов (растворитель
и растворенное(ые) вещество(а)), а также продуктов
их взаимодействия
Растворитель – компонент, количество которого в системе
преобладает либо не меняет своего агрегатного состояния
Слайд 4Твёрдые растворы
сплавы металлов
латунь – твёрдый раствор, смесь двух твёрдых веществ (меди
По агрегатному состоянию :
Растворы. Классификация растворов
Раствор – гомогенная (однофазная) система, состоящая
из двух или более независимых компонентов (растворитель
и растворенное(ые) вещество(а)), а также продуктов
их взаимодействия
замещения
внедрения
Растворитель – компонент, количество которого в системе
преобладает либо не меняет своего агрегатного состояния
Слайд 5Растворы. Классификация растворов
По относительным количествам растворенного вещества:
Насыщенный раствор – это раствор,
По соотношению преобладания частиц,
переходящих в раствор и удаляющихся из раствора:
ненасыщенные, насыщенные и пересыщенные
Пересыщенный раствор - раствор,
в котором при данной температуре
содержится бОльшее количество растворенного вещества, чем возможно в насыщенном растворе
Раствор концентрация которого ниже концентрации насыщенного раствора называется ненасыщенным
разбавленные и концентрированные
Слайд 6Растворы. Классификация растворов
Истинный раствор – однофазная система, образованная
не менее чем двумя
при пропускании через него луча света образуется светящаяся дорожка – конус
Коллоидный раствор – тонкодисперсная (гетерогенная) система с размерами частиц
от 500 до 1 нм
Эмульсия – дисперсная система, состоящая
из микроскопических капель жидкости (дисперсной фазы), распределенных
в другой жидкости (дисперсионной среде
Суспензия или взвесь – это грубодисперсная система с твёрдой дисперсной фазой и жидкой дисперсионной средой
По размеру частиц:
Слайд 7Физические и химические процессы при растворении
Физическая теория растворов – идея индифферентности
Процесс растворения является результатом диффузии, т.е. проникновением растворенного вещества в промежутки между молекулами растворителя, т.е. физическое явление
(Вант-Гофф, Аррениус, Оствальд)
Химическая теория (Д.И.Менделеев)
Растворение является результатом химического взаимодействия растворенного вещества с молекулами растворителя, т.е. химическое явление
Якоб Хендрик
Вант-Гофф
Дмитрий Иванович
Менделеев
Сольватация – процесс взаимодействия растворителя и растворённого вещества
Слайд 8Физические и химические процессы при растворении
Механическая смесь
Раствор
Химическое соединение
переменность состава
непрерывная, плавная
зависимость
однородность состава по всей фазе
наличие теплового эффекта
при образовании
Физико-химическая теория растворов
Слайд 9Физические и химические процессы
при растворении
Тепловой эффект, сопровождающий процесс растворения, относящийся к
молярной теплотой растворения ∆Нраств.
∆Н1 > 0 – количество теплоты, затраченной на распределение частиц растворяемого вещества среди молекул растворителя (процесс эндотермический)
∆Н2 < 0 – количество теплоты, выделяющейся при взаимодействии растворенного вещества с молекулами растворителя и образование связей между ними (тепловой эффект сольватации, процесс экзотермический)
В зависимости от преобладания первой или второй составляющих, процесс растворения может быть экзотермическим или эндотермическим:
если │∆Н2│> │∆Н1│, процесс экзотермический и ∆Нраств. < 0
если │∆Н2│< │∆Н1│, процесс эндотермический и ∆Нраств. > 0
для твёрдого вещества:
∆Н1 > 0 – энергия, необходимая для разрушения кристаллической решетки и энергия необходимая для разрыва связей между молекулами растворителя (процесс эндотермический)
NH4NO3
∆Нраств. = 26.48 кДж/моль
KOH
∆Нраств. = –55.65 кДж/моль
Слайд 10Способы выражения концентрации
Концентрация – соотношение между количеством растворенного вещества и растворителя
Способы выражения концентрации растворов
Массовая доля (ω) – отношение массы растворенного
вещества к массе раствора
Объемная доля (ϕ) – отношение объема растворенного вещества к объему раствора
Молярная доля (X) – отношение числа молей растворенного
вещества к сумме числа молей всех компонентов раствора
Молярная концентрация (молярность) (См, моль/л) – число моль растворенного вещества в одном литре раствора
Нормальная концентрация или молярная концентрация эквивалента (нормальность) (Сн, моль экв/л) – число моль эквивалентов растворенного вещества, содержащихся
в одном литре раствора
1 м р-р H2SO4 = 2 н р-р H2SO4
Титр (СТ, мг/мл или г/мл) – масса растворенного вещества, содержащаяся в одном миллилитре раствора
Моляльность (Сm, моль/кг) – число моль растворенного вещества,
приходящееся на 1 кг растворителя
Слайд 11Растворимость веществ.
Факторы, влияющие на растворимость
коэффициент поглощения газа – наибольший объем
Так при 20°С коэффициенты поглощения водой азота и кислорода, молекулы которых неполярны, составляют соответственно 0.016 и 0.031
Для газов, молекулы которых полярны, коэффициент их поглощения водой значительно выше, например для HCI – 500, NH3 – 1300
Растворимость – количественная характеристика
соотношения компонентов насыщенного раствора
коэффициент растворимости вещества (Р) – наибольшая масса вещества, способная при данной температуре
раствориться в 100 г растворителя
Например, при 20°С в 100 г воды с образованием насыщенного раствора растворяется 36.0 г NaCI, значит Р(NaCI) = 36
молярная растворимость вещества (S) – число молей вещества, способное при данной температуре раствориться в 1 л указанного растворителя с образованием насыщенного раствора
Пример: S(NaCI) = 6.154 моль/л
Слайд 12Растворимость веществ.
Факторы, влияющие на растворимость
Растворимость веществ зависит:
от природы реагирующих
от концентрации раствора
от температуры
присутствия других веществ в растворе
от давления (для газообразных веществ)
Слайд 13Растворимость твердых веществ
в жидкостях
от природы реагирующих веществ
от температуры
Для идеальных
N1 – растворимость твердого вещества
ΔHраствор. – энтальпия растворения 1 моль вещества
в почти насыщенном растворе
1. Плавление твердого вещества
Процесс растворения
2. Смешение жидкого вещества с идеальным раствором
для идеального раствора
так как
то
Идеальная растворимость твердого вещества увеличивается с температурой
Слайд 14Растворимость жидкостей в жидкостях
от природы реагирующих веществ
от температуры
от
Неограниченная растворимость – жидкости смешиваются в любых пропорциях
Растворимость до известного предела – имеет место расслаивание
Качественная зависимость:
ПОДОБНОЕ РАСТВОРЯЕТСЯ В ПОДОБНОМ
Слайд 15Растворимость газов в жидкостях
Растворимость газов в жидкостях при повышении температуры
Закон Генри
при постоянной температуре растворимость газа в данной жидкости
прямо пропорциональна давлению этого газа над раствором
Растворимость газов в жидкостях зависит от давления под которым он находится над жидкостью
k – константы скорости
p – давление газа над раствором
c – концентрация
Закон пригоден лишь для идеальных растворов и невысоких давлений
Г – константа Генри
Закон Дальтона
в случае растворения смеси газов в жидкости
каждый из них растворяется пропорционально
своему парциальному давлению
Уильям Генри
Джон Дальтон
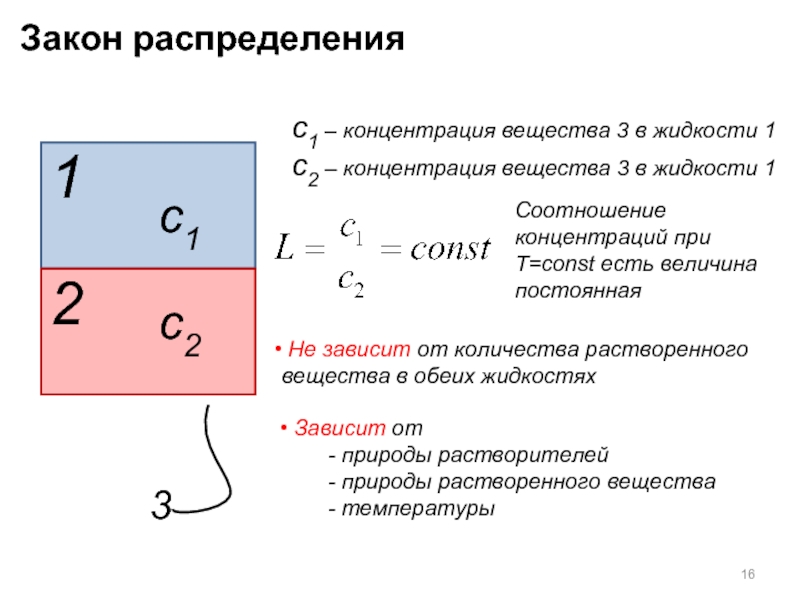
Слайд 16Закон распределения
1
2
c1
c2
c1 – концентрация вещества 3 в жидкости 1
c2 – концентрация
3
Соотношение концентраций при T=const есть величина постоянная
Не зависит от количества растворенного вещества в обеих жидкостях
Зависит от
- природы растворителей
- природы растворенного вещества
- температуры
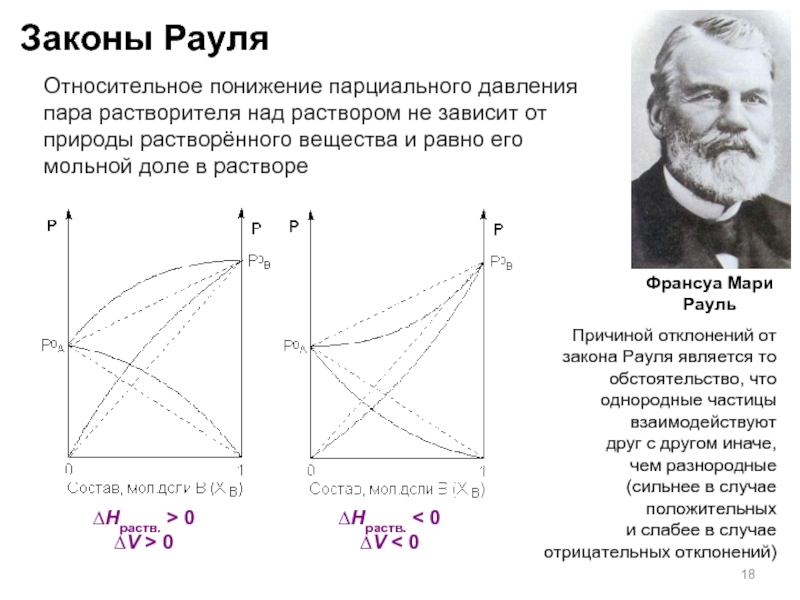
Слайд 17Законы Рауля
Первый закон Рауля
связывает давление
насыщенного пара над раствором с его
Для бинарного раствора, состоящего
из компонентов А и В, где компонент А – растворитель, удобнее использовать другую формулировку:
Относительное понижение парциального давления пара растворителя над раствором
не зависит от природы растворённого вещества и равно его мольной доле
в растворе
Франсуа Мари
Рауль
Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причём коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом
Слайд 18Законы Рауля
Относительное понижение парциального давления пара растворителя над раствором не зависит
Франсуа Мари
Рауль
∆Нраств. > 0
∆V > 0
∆Нраств. < 0
∆V < 0
Причиной отклонений от закона Рауля является то обстоятельство, что однородные частицы взаимодействуют
друг с другом иначе,
чем разнородные
(сильнее в случае положительных
и слабее в случае отрицательных отклонений)
Слайд 19Законы Рауля
Понижение температуры замерзания раствора
и повышение температуры его кипения
прямо пропорционально
моляльной концентрации раствора
KЭ
ΔT не зависит от природы растворенного вещества,
а определяется природой растворителя и моляльностью,
т.е. числом молекул, растворенных в определенном количестве растворителя
Повышение температуры кипения
Понижение температуры замерзания
Эти свойства разбавленных растворов зависят только от числа частиц растворенного вещества, но не от их природы
Поэтому эти свойства назвали коллигативными
(в том смысле, что они «зависят от количества»)
Франсуа Мари
Рауль
Второй закон Рауля
Слайд 20
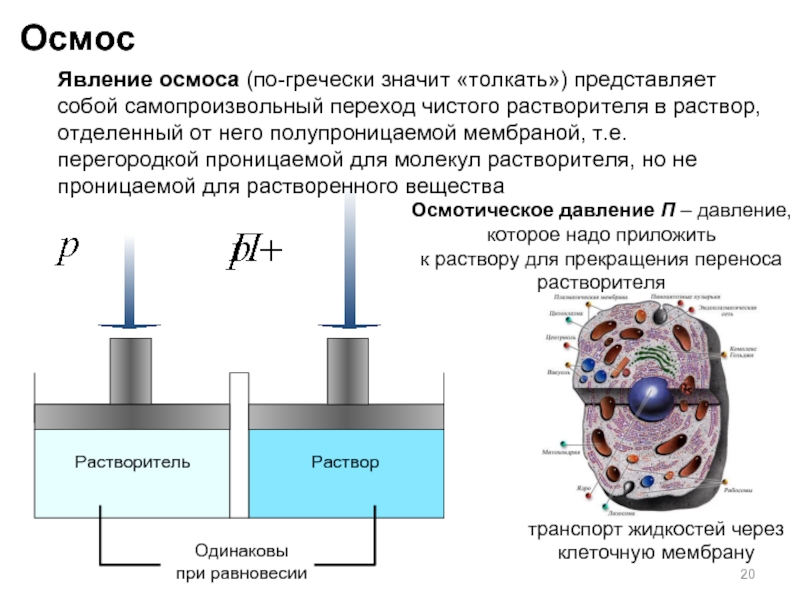
Одинаковы
при равновесии
Осмотическое давление П – давление, которое надо приложить
к раствору
Осмос
Растворитель
Раствор
Явление осмоса (по-гречески значит «толкать») представляет собой самопроизвольный переход чистого растворителя в раствор, отделенный от него полупроницаемой мембраной, т.е. перегородкой проницаемой для молекул растворителя, но не проницаемой для растворенного вещества
транспорт жидкостей через клеточную мембрану
Слайд 21Растворы электролитов
Электролиты – вещества, которые в растворе или в расплаве состоят
Электролиты – проводники второго рода
(с ионной проводимостью)
Электролиты – НЕ ПОДЧИНЯЮТСЯ законам Рауля
Сильные электролиты при растворении в воде практически полностью диссоциируют на ионы независимо от их концентрации в растворе, поэтому
в уравнениях диссоциации сильных электролитов ставят знак равенства (=)
К сильным электролитам относятся:
- растворимые соли
- многие неорганические кислоты: HNO3, H2SO4, HCl, HBr, HI
- основания, образованные щелочными (LiOH, NaOH, KOH и т.д.)
и щелочно-земельными металлами (Ca(OH)2, Sr(OH)2, Ba(OH)2)
Слабые электролиты в водных растворах лишь частично (обратимо) диссоциируют на ионы. Поэтому в уравнениях диссоциации слабых электролитов ставят знак обратимости (⇄)
К слабым электролитам относятся:
- почти все органические кислоты и вода
- некоторые неорганические кислоты: H2S, H3PO4, H2CO3, HNO2, H2SiO3 и др.;
- нерастворимые гидроксиды металлов: Mg(OH)2, Fe(OH)3, Zn(OH)2 и др.
Слайд 22Растворы электролитов
Степень диссоциации – доля растворенного электролита,
которая распалась на ионы
В растворах
В растворах слабых электролитов
Константа диссоциации в одном и том же растворителе при постоянной температуре – величина постоянная, свойственная данному электролиту
Степень диссоциации – характеризует состояние электролита в растворе
только данной концентрации
и меняется с ее изменением
Закон разбавления Оствальда – с разбавлением раствора его степень диссоциации увеличивается
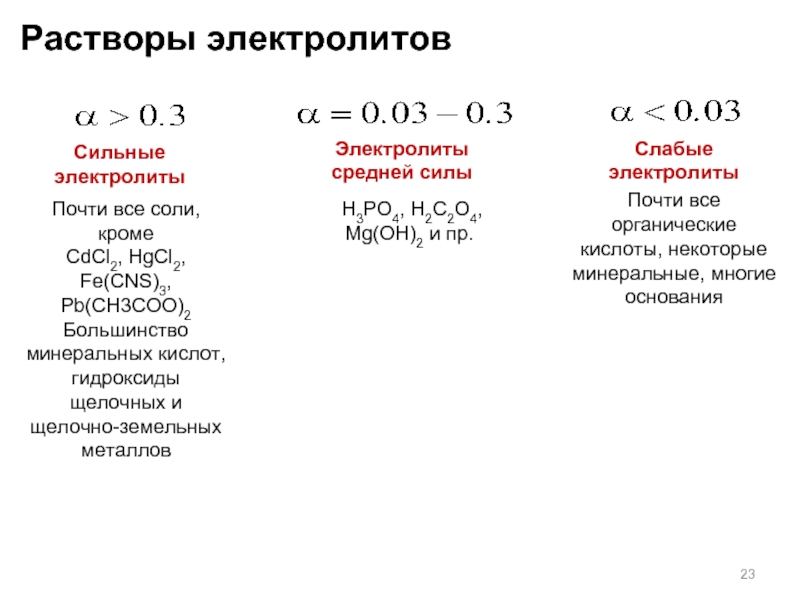
Слайд 23Растворы электролитов
Сильные электролиты
Слабые электролиты
Электролиты
средней силы
Почти все соли, кроме
CdCl2, HgCl2,
Большинство минеральных кислот, гидроксиды щелочных и щелочно-земельных металлов
Почти все органические кислоты, некоторые минеральные, многие основания
H3PO4, H2C2O4, Mg(OH)2 и пр.
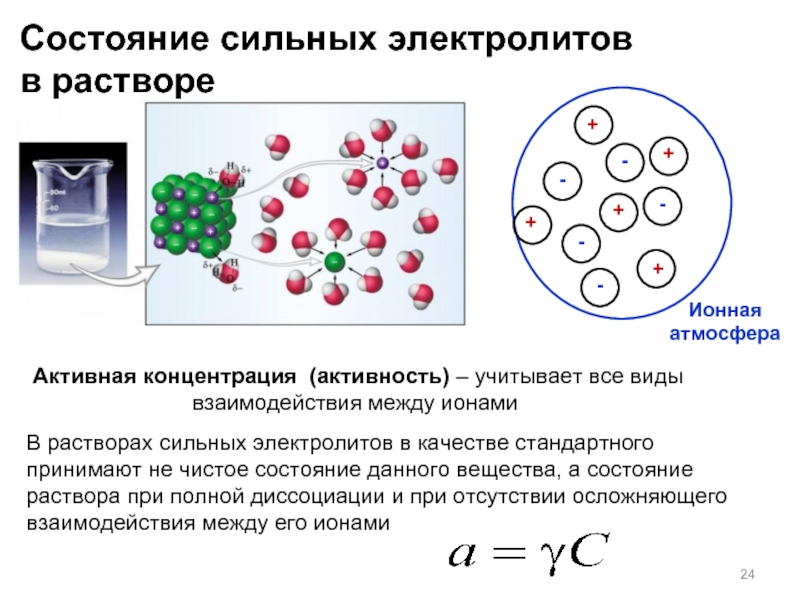
Слайд 24Состояние сильных электролитов
в растворе
+
+
+
+
+
-
-
-
-
-
Ионная атмосфера
Активная концентрация (активность) – учитывает все виды
В растворах сильных электролитов в качестве стандартного принимают не чистое состояние данного вещества, а состояние раствора при полной диссоциации и при отсутствии осложняющего взаимодействия между его ионами
Слайд 25Водородный показатель
Можно принять концентрацию недиссоциированных молекул воды постоянной
Ионное произведение воды
В чистой
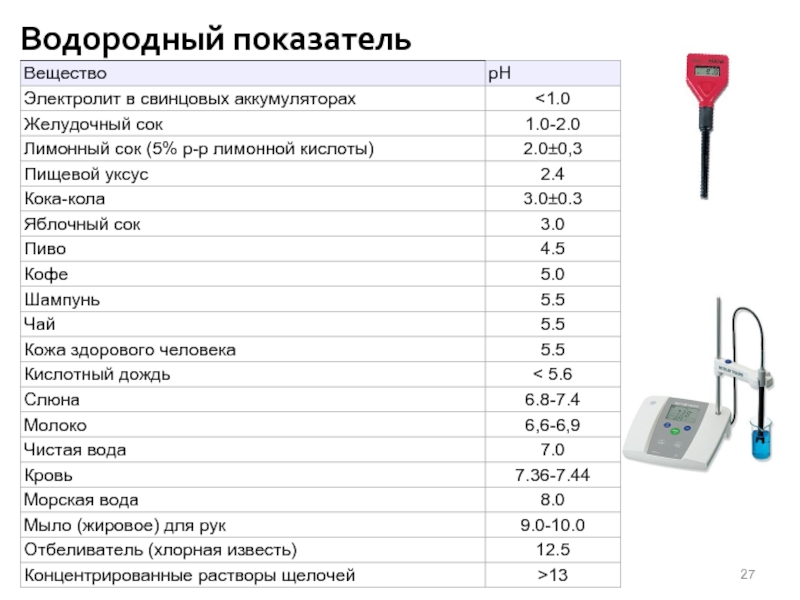
Слайд 26Водородный показатель
Ионное произведение воды
моль/л
- СРЕДА КИСЛАЯ
моль/л
- СРЕДА ОСНОВНАЯ
- СРЕДА НЕЙТРАЛЬНАЯ
моль/л
- Водородный
Слайд 28
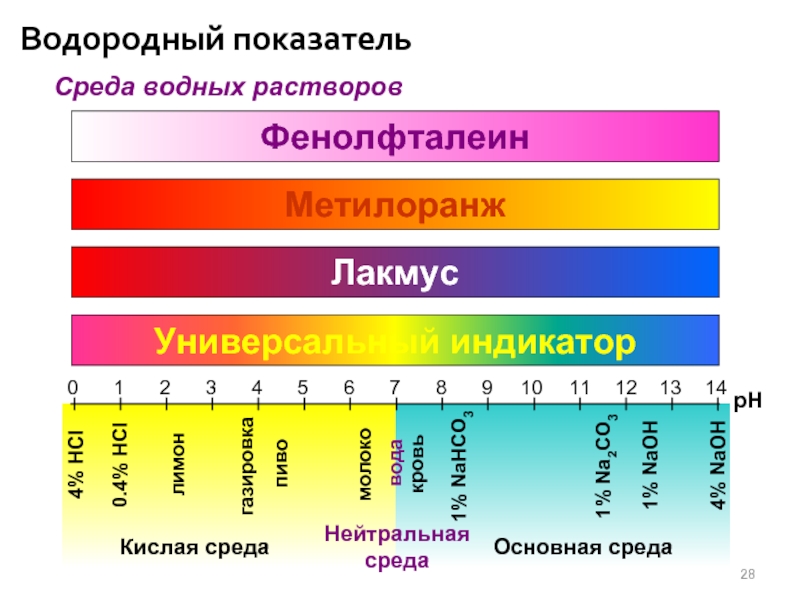
Водородный показатель
Среда водных растворов
Фенолфталеин
Метилоранж
Лакмус
Универсальный индикатор
0
1
2
3
4
5
6
7
8
9
10
11
12
13
14
pH
4% HCl
0.4% HCl
лимон
газировка
пиво
молоко
вода
кровь
1% NaHCO3
1% Na2CO3
1% NaOH
4% NaOH
Кислая
Основная среда
Нейтральная
среда