- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Первый закон термодинамики и основные законы идеального газа презентация
Содержание
- 1. Первый закон термодинамики и основные законы идеального газа
- 2. Термодинамический процесс Изменение состояния термодинамической системы во
- 3. Термодинамический процесс Система, выведенная из состояния равновесия,
- 4. Равновесный термодинамический процесс Термодинамический процесс называется равновесным,
- 5. Равновесный процесс состоит из непрерывного ряда последовательных
- 6. Неравновесные термодинамические процессы Процессы, не удовлетворяющие условию
- 7. 2. Внутренняя энергия и работа расширения и сжатия рабочего тела
- 8. Основы термодинамики Внутренняя энергия идеального газа -это
- 9. Внутреняя энергия – функция состояния, зависит от
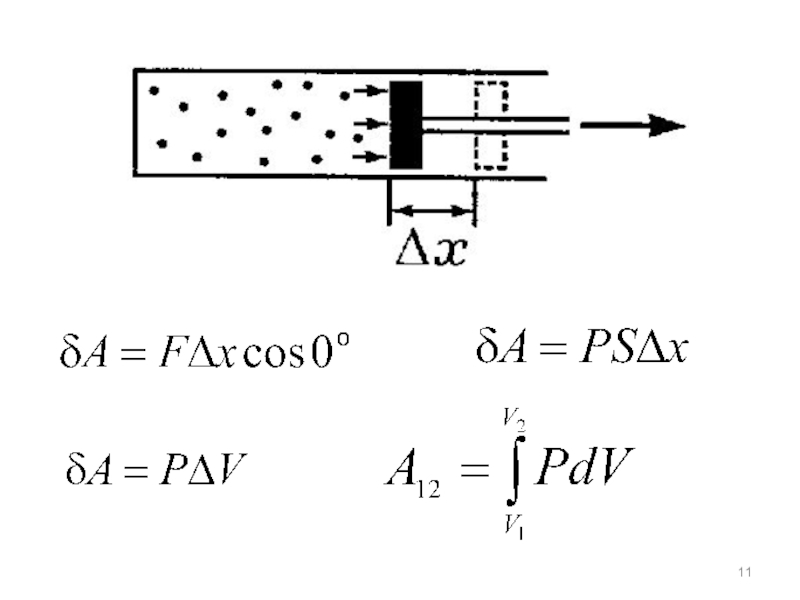
- 10. Внутренняя энергия изменяется путём совершения работы
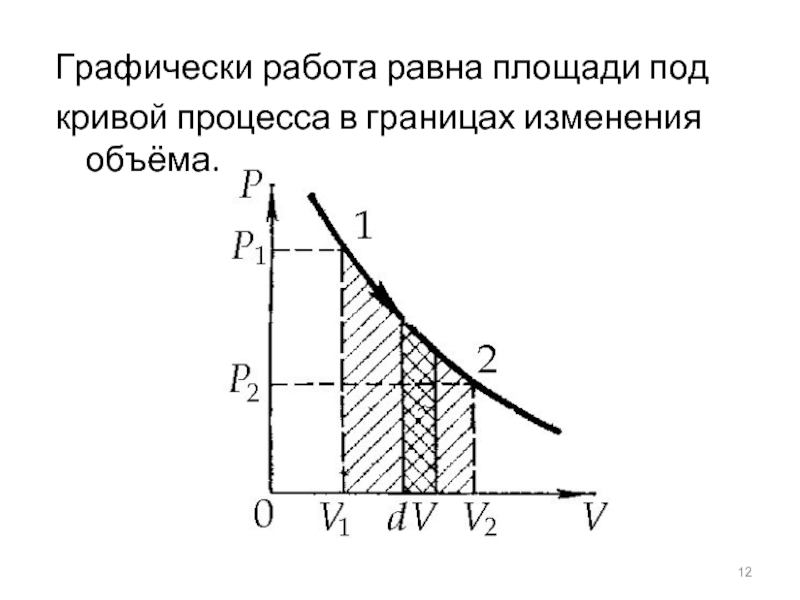
- 12. Графически работа равна площади под кривой процесса в границах изменения объёма.
- 13. Приращение внутренней энергии в процессе чистого
- 14. 3. Первый закон термодинамики. Энтальпия газа
- 15. Первое начало термодинамики Количество теплоты,
- 16. В более общем случае:
- 17. Энтальпия В термодинамике важную роль играет сумма
- 18. Энтальпия Величина , называемая удельной энтальпией
- 19. Энтальпия Если давление системы сохраняется неизменным, т.
- 20. 4. Процессы изменения состояния идеального газа
- 21. Применение 1 закона термодинамики к изопроцессам Изотермический.
- 22. Изохорный процесс. Р/Т =
- 23. Адиабатическим называется процесс,
- 24. Адиабатный процесс.
- 25. Уравнение адиабатического процесса в переменных Т и V :
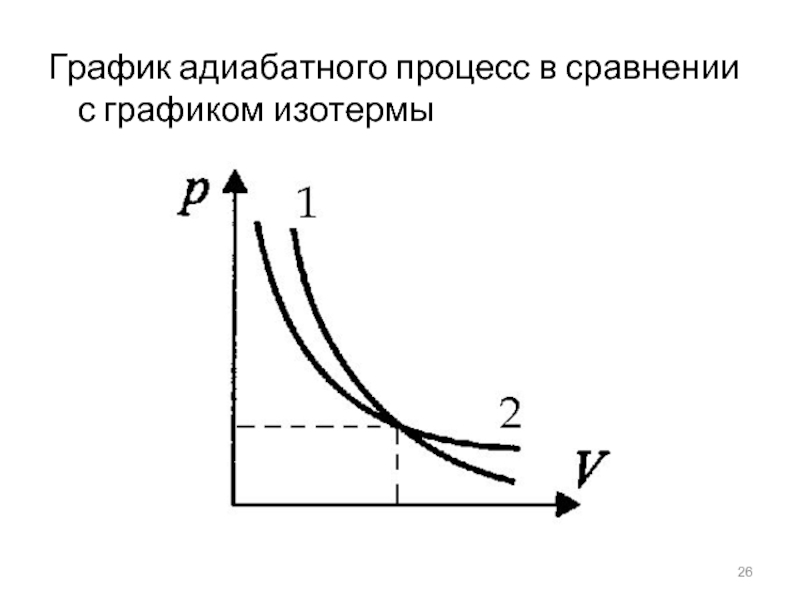
- 26. График адиабатного процесс в сравнении с графиком изотермы
- 27. Работа при адиабатном процессе
- 28. Политропный процесс Все процессы – частный
- 29. Политропный процесс Уравнение процесса: Первый закон
Слайд 1Первый закон термодинамики и основные законы идеального газа
Понятие термодинамического процесса.
Внутренняя энергия
Первый закон термодинамики. Энтальпия газа.
Процессы изменения состояния идеального газа.
Слайд 2Термодинамический процесс
Изменение состояния термодинамической системы во времени называется термодинамическим процессом.
Слайд 3Термодинамический процесс
Система, выведенная из состояния равновесия, и предоставленная при постоянных параметрах
называется релаксацией, а промежуток времени, в течение которого система возвращается в состояние равновесия, называется временем релаксации.
Слайд 4Равновесный термодинамический процесс
Термодинамический процесс называется равновесным, если все параметры системы при
Чтобы процесс был равновесным, скорость изменения параметров системы должна удовлетворять соотношению
где А — параметр, наиболее быстро изменяющийся в рассматриваемом процессе; срел — скорость изменения этого параметра в релаксационном процессе; τрел — время релаксации.
Слайд 5 Равновесный процесс состоит из непрерывного ряда последовательных состояний равновесия, поэтому в
Равновесный термодинамический процесс
Слайд 6Неравновесные термодинамические процессы
Процессы, не удовлетворяющие условию
протекают с нарушением равновесия, т. е. являются неравновесными. Если, например, быстро увеличит температуру окружающей среды, то газ в цилиндре будет постепенно прогреваться через его стенки, релаксируя к состоянию равновесия, соответствующему новым параметрам окружающей среды. В процессе релаксации газ не находится в равновесии с окружающей средой и его нельзя характеризовать уравнением состояния хотя бы потому, что в разных точках объема газа температура имеет различные значения.
Слайд 8Основы термодинамики
Внутренняя энергия идеального газа -это кинетическая энергия хаотического
(теплового) движения молекул.
Среднее
Энергия N молекул:
Слайд 9 Внутреняя энергия – функция состояния, зависит от температуры.
Температура – мера
Изменение внутренней энергии:
Слайд 10 Внутренняя энергия изменяется путём совершения работы и путём теплообмена.
Работа
Слайд 13 Приращение внутренней энергии в процессе чистого теплообмена называется количеством теплоты
Теплота – это процесс изменения внутренней энергии за счет хаотического (неупорядоченного) движения молекул.
Слайд 15Первое начало термодинамики
Количество теплоты, которое система получает в процессе
Для равновесных процессов:
Слайд 16 В более общем случае:
– бесконечно малое изменение внутренней энергии.
Слайд 17Энтальпия
В термодинамике важную роль играет сумма внутренней энергии системы U и
Так как входящие в нее величины являются функциями состояния, то и сама энтальпия является функцией состояния. Так же как внутренняя энергия, работа и теплота, она измеряется в джоулях (Дж).
Энтальпия обладает свойством аддитивности.
Слайд 18Энтальпия
Величина
,
называемая удельной энтальпией (h = H/M), представляет собой энтальпию системы, содержащей
Поскольку энтальпия есть функция состояния, то она может быть представлена в виде функции двух любых параметров состояния:
; ; ,
а величина dh является полным дифференциалом.
Изменение энтальпии в любом процессе определяется только начальным и конечным состояниями тела и не зависит от характера процесса.
Слайд 19Энтальпия
Если давление системы сохраняется неизменным, т. е. осуществляется изобарный процесс (dp=0),
и
т. е. теплота, подведенная к системе при постоянном давлении, идет только на изменение энтальпии данной системы.
Слайд 21Применение 1 закона термодинамики к изопроцессам
Изотермический.
dT = 0), (dU = 0).
Слайд 28Политропный процесс
Все процессы – частный случай политропного.
Изохорный –
Изобарный –
Изотермический
Адиабатный -
p1V1m= p2V2m
V = const, m= ∞
Q = 0, m= ϒ
Слайд 29Политропный процесс
Уравнение процесса:
Первый закон термодинамики:
Теплоемкость:
Изменение внутренней энергии:
Работа:
Энтропия:
Энтальпия:
p1V1m= p2V2m
Q =
ΔU = cV ΔT