- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Первое начало термодинамики презентация
Содержание
- 1. Первое начало термодинамики
- 2. Лекция № 2 Первое
- 3. Внутренняя энергия
- 4. В термодинамических процессах изменяется только кинетическая энергия
- 5. Внутренняя энергия U одного
- 6. В каждом состоянии система
- 7. Внутренняя энергия U ν
- 10. Работа
- 13. При переходе из состояния 1 в состояние
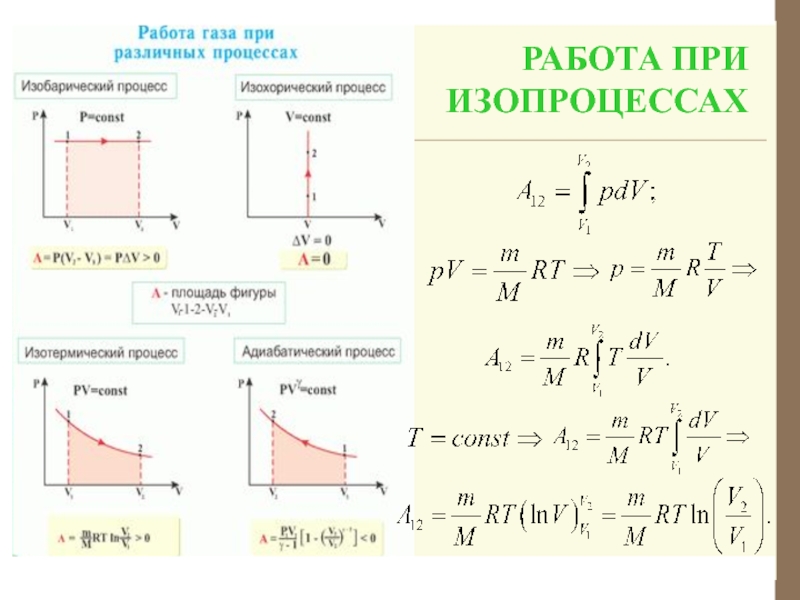
- 14. РАБОТА ПРИ ИЗОПРОЦЕССАХ
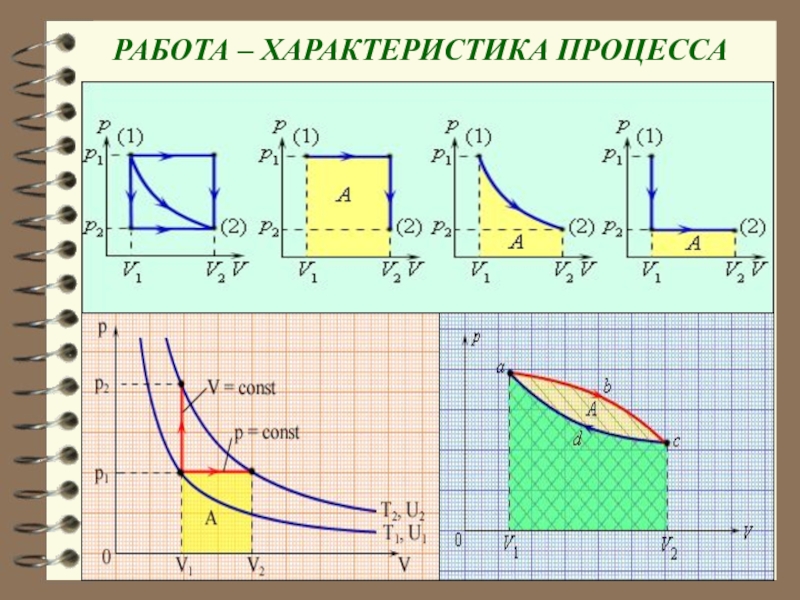
- 15. РАБОТА – ХАРАКТЕРИСТИКА ПРОЦЕССА
- 16. Количество теплоты Q , представляет
- 18. Первое начало термодинамики (закон
- 19. Закон сохранения энергии для малого изменения состояния
- 20. Теплота Q и работа А зависят от
- 21. Теплотой называется энергия, передаваемая от
- 22. Если идеальный газ, получив теплоту, изотермически
- 23. Если
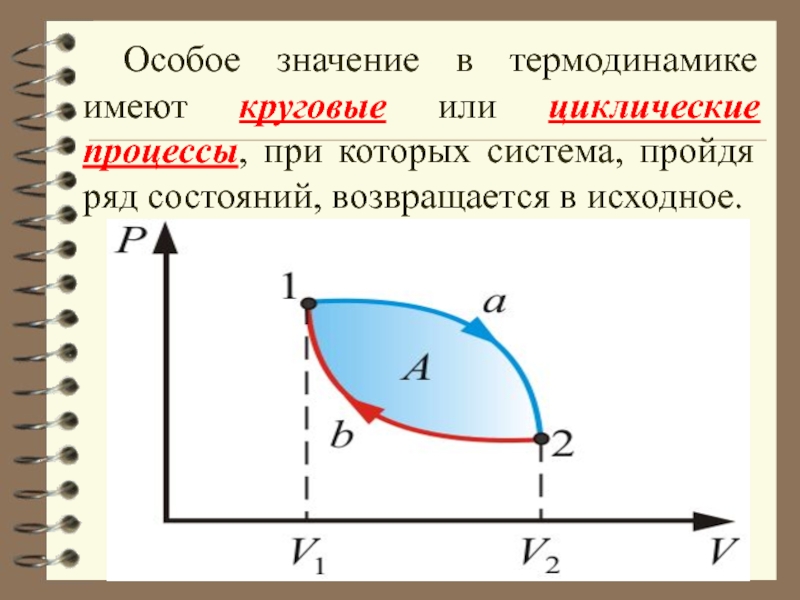
- 24. Особое значение в термодинамике имеют круговые или
- 25. Цикл, совершаемый идеальным газом, можно разбить на
- 26. Если за цикл совершается положительная работа
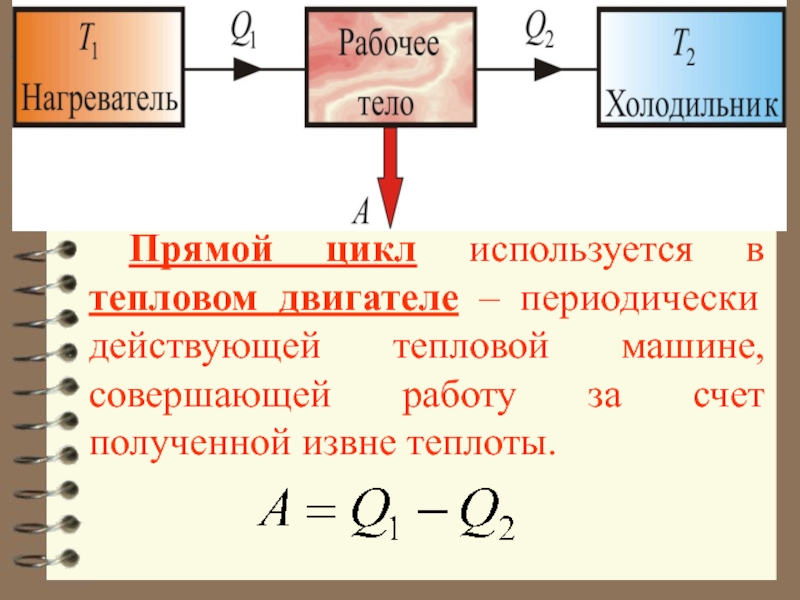
- 28. Прямой цикл используется
- 29. Т.о. работа, совершаемая за цикл, равна
- 30. Термический коэффициент полезного действия ( КПД
- 31. Термический процесс называется обратимым,
- 32. Реальные процессы сопровождаются диссипацией энергии (из-за
- 33. При адиабатическом расширении газа условие теплоизолированности системы
- 35. Любая тепловая машина работает по принципу кругового (циклического) процесса, т.е. возвращается в исходное состояние.
- 36. Но чтобы при этом была
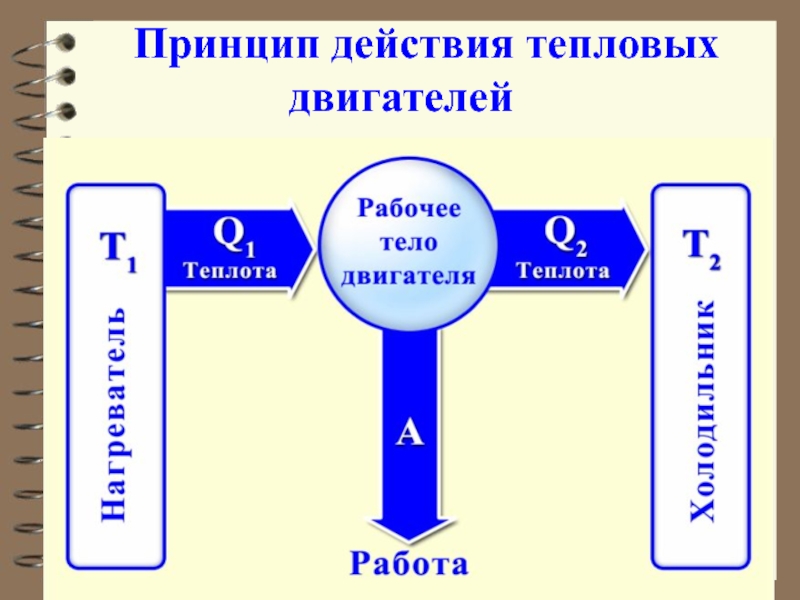
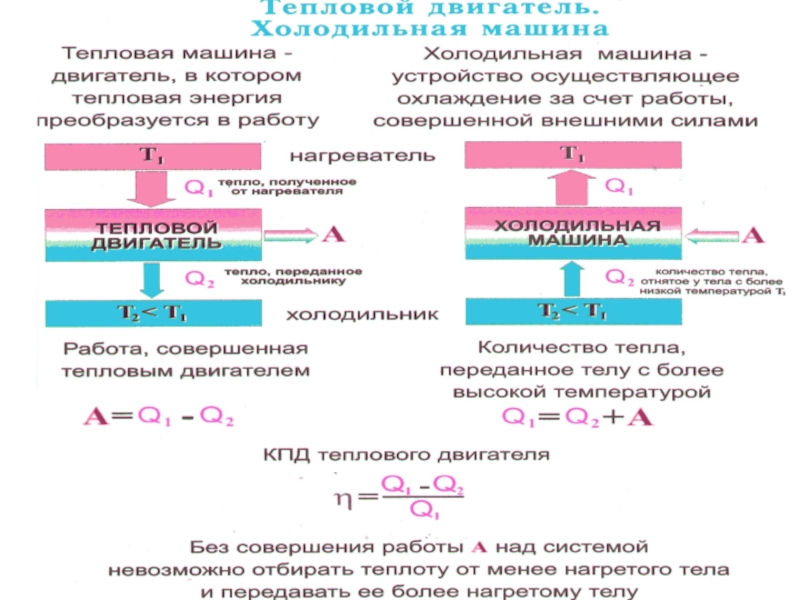
- 38. Принцип действия тепловых двигателей
- 39. Зачем холодильник? Так как
- 40. Прямой цикл используется в тепловом двигателе –
- 41. От термостата с более высокой температурой Т1,
- 42. КПД тепловых двигателей
- 43. КПД тепловых двигателей
- 44. КПД тепловых двигателей
- 45. КПД тепловых двигателей
- 46. КПД тепловых двигателей
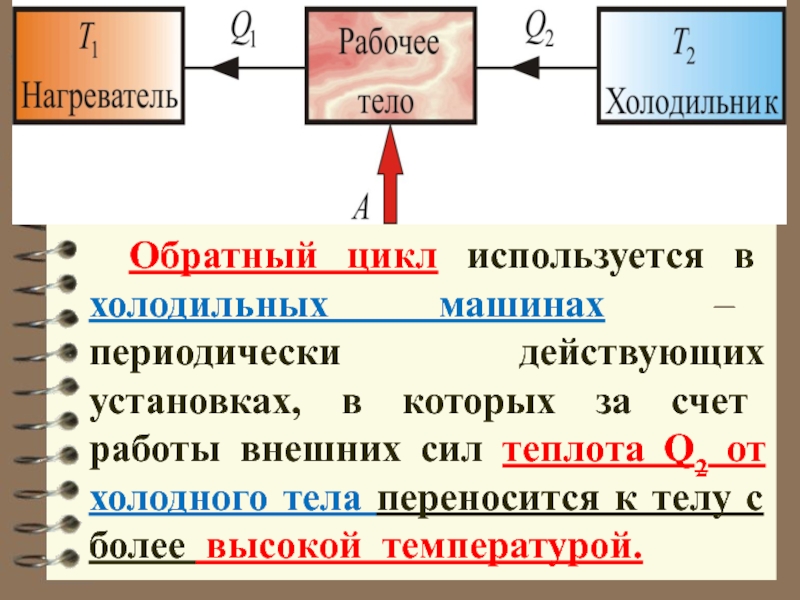
- 47. Обратный цикл используется в холодильных машинах –
- 50. Цикл Карно (обратимый).
- 52. Цикл Карно является самым
- 54. ТЕОРЕМА КАРНО
- 55. Поэтому количество теплоты , полученное
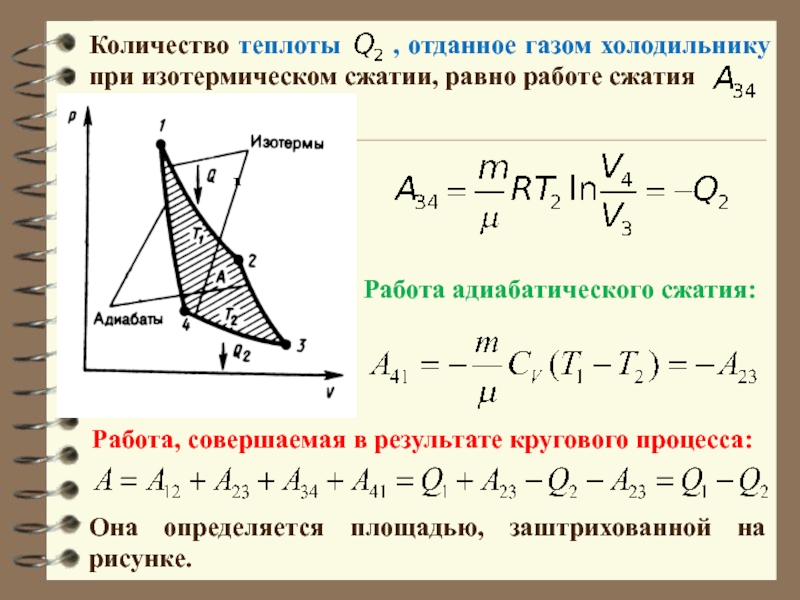
- 56. Количество теплоты , отданное газом
- 57. Применив уравнение для адиабат 2-3 и
- 58. Видно, что η < 1 и
- 60. Холодильная машина Эта машина,
- 61. Обратный цикл Карно можно рассмотреть
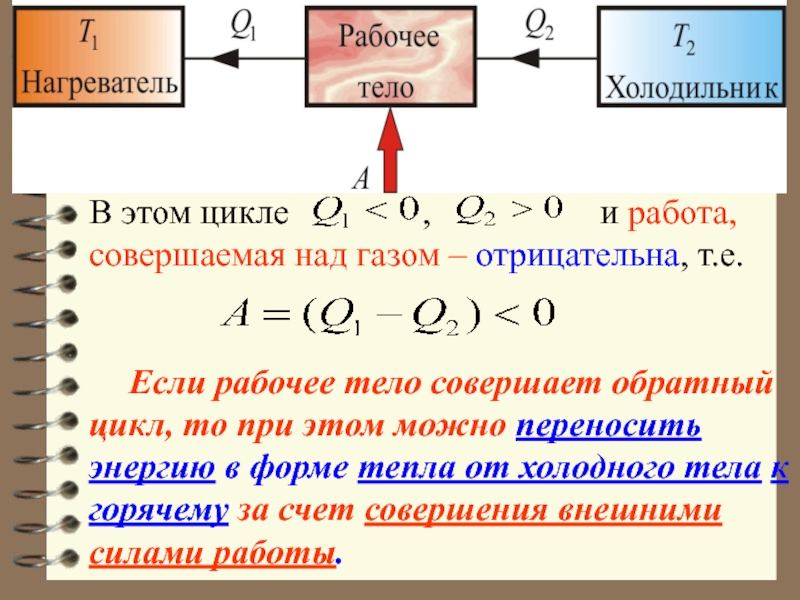
- 62. В этом цикле
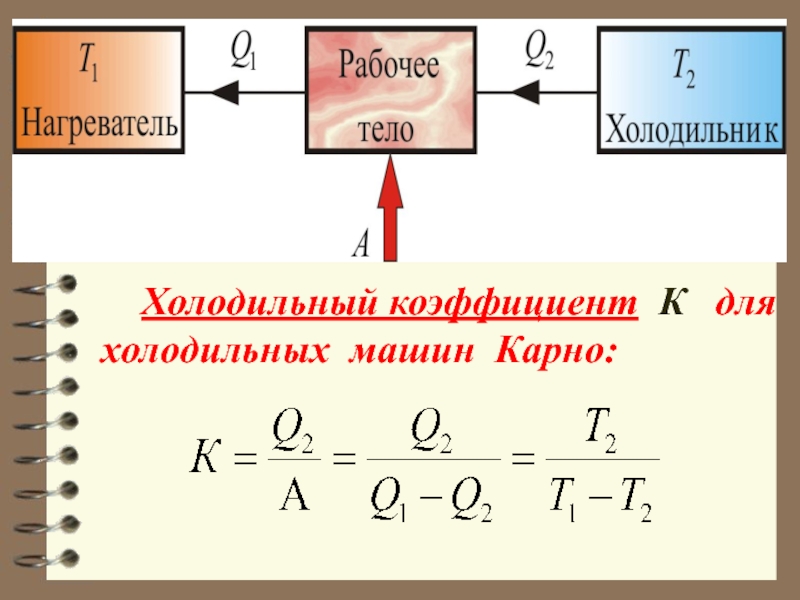
- 63. Холодильный коэффициент К для холодильных машин
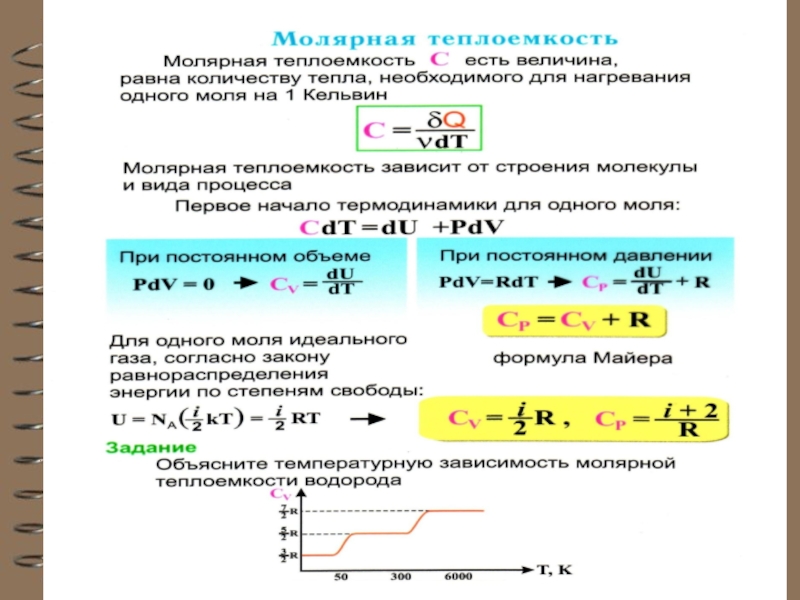
- 64. Теплоёмкость идеального газа
- 65. Удельная теплоёмкость Суд – есть количество
- 66. Теплоёмкость термодинамической системы зависит от того, как
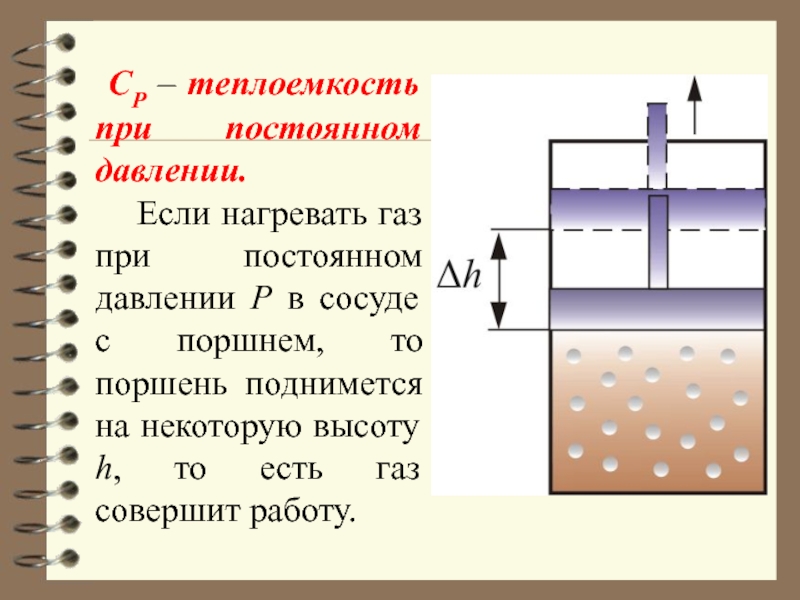
- 67. СР – теплоемкость при постоянном давлении.
- 68. Следовательно, проводимое тепло затрачивается и на нагревание
- 69. При изобарическом процессе
- 70. Это уравнение Роберта Майера для одного моля
- 71. В общем случае
- 72. Внутренняя энергия идеального газа является только функцией
- 73. Внутренняя энергия одного моля идеального одноатомного газа
- 74. Внутренняя энергия одного моля идеального газа c
- 75. Учитывая физический смысл R
- 78. Адиабатный (адиабатический) процесс Это процесс, происходящий
- 79. Подставляя dT в уравнение:
- 80. уравнение Пуассона или уравнение адиабаты для идеального
- 82. Здесь уместно рассмотреть еще и политропный процесс
- 83. С помощью показателя n можно
- 84. 4. Адиабатический процесс ΔQ = 0,
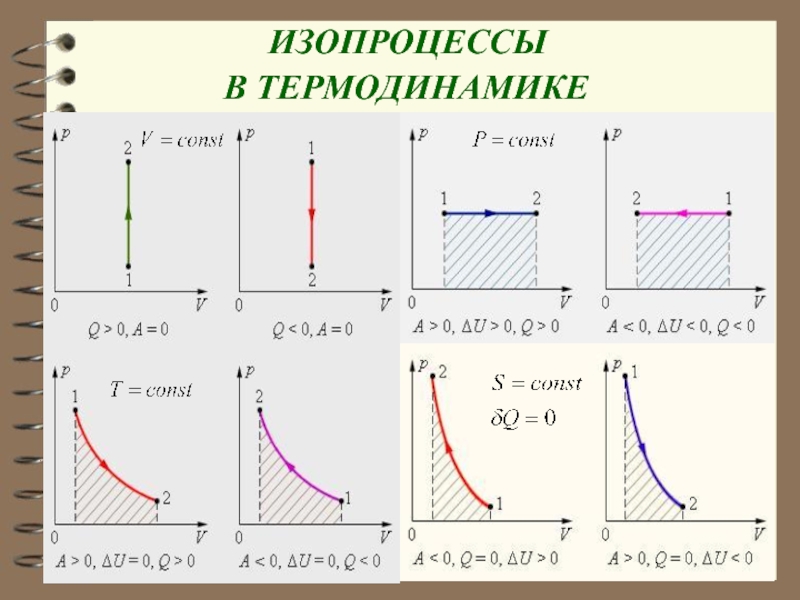
- 86. ИЗОПРОЦЕССЫ В ТЕРМОДИНАМИКЕ
- 89. ЛЕКЦИЯ ЗАКОНЧЕНА!
Слайд 2 Лекция № 2
Первое начало термодинамики
1. Внутренняя энергия. Макроскопическая
2. Первое начало термодинамики.
3. Условия преобразования теплоты в работу.
4. Основные элементы тепловой машины. Цикл Карно. Максимальный КПД тепловых машин.
5. Теплоёмкость. Молярная теплоёмкость
идеального одноатомного газа при постоянном объёме и постоянном давлении.
6. Адиабатический процесс. Уравнение адиабаты.
Слайд 3 Внутренняя энергия
Наряду
Она складывается из:
- теплового хаотического движения молекул,
- потенциальной энергии их взаимодей-
ствия (для реального газа),
- кинетической и потенциальной энергии электронов в атомах, нуклонов в ядрах и так далее.
Слайд 4 В термодинамических процессах изменяется только кинетическая энергия движущихся молекул (тепловой энергии
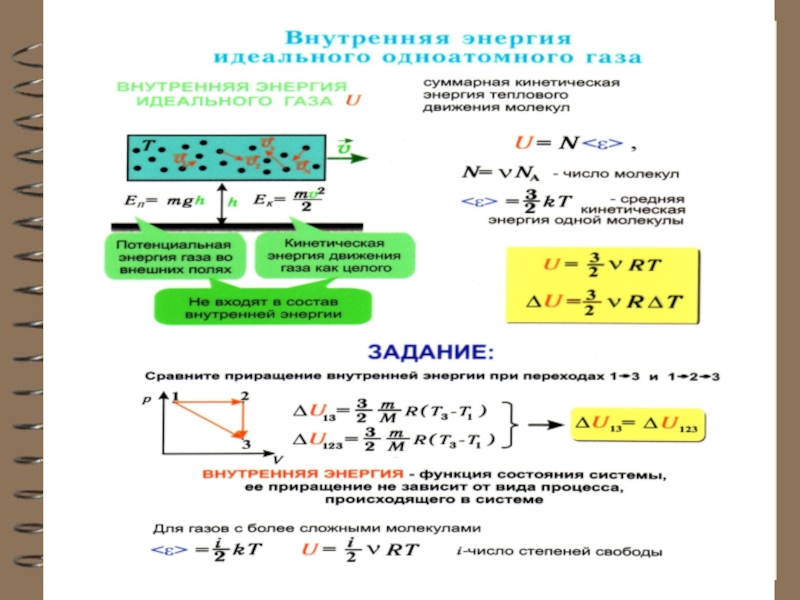
В термодинамике важно знать не абсолютное значение внутренней энергии,
а её изменение.
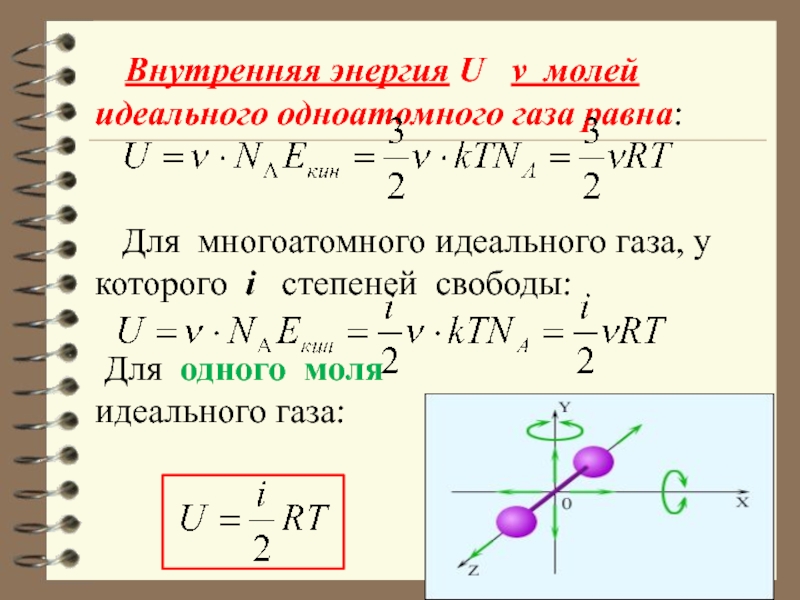
Слайд 5 Внутренняя энергия U одного моля идеального одноатомного газа равна:
Слайд 6 В каждом состоянии система обладает определенным и только
Так как U – функция состояния, то
Этот справедливо для любой функции состояния.
Слайд 7 Внутренняя энергия U ν молей идеального одноатомного газа
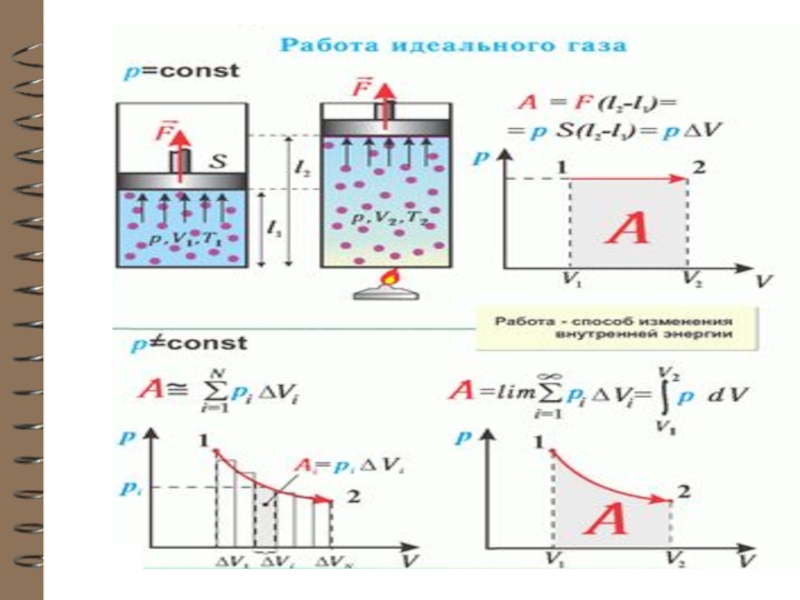
Слайд 10 Работа и теплота
Механическая энергия может перехо-дить в тепловую энергию и обратно.
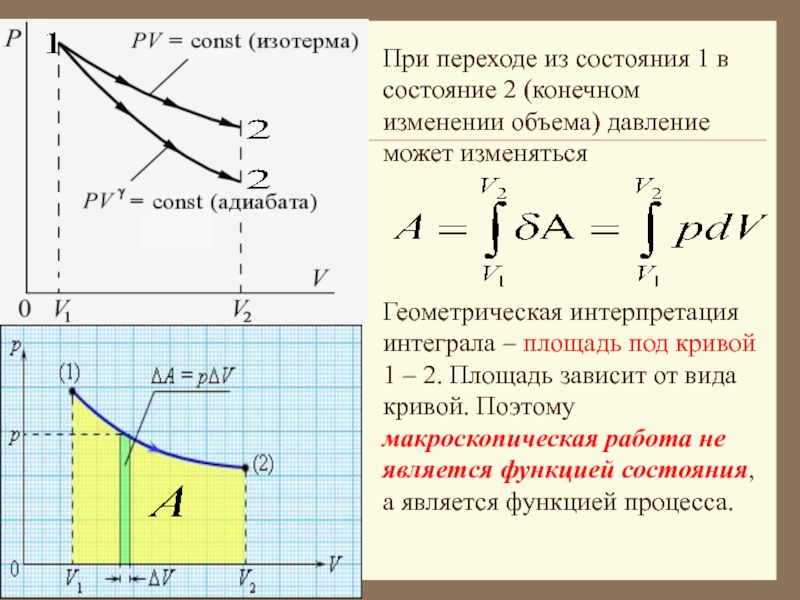
Слайд 13При переходе из состояния 1 в состояние 2 (конечном изменении объема)
Геометрическая интерпретация интеграла – площадь под кривой 1 – 2. Площадь зависит от вида кривой. Поэтому макроскопическая работа не является функцией состояния, а является функцией процесса.
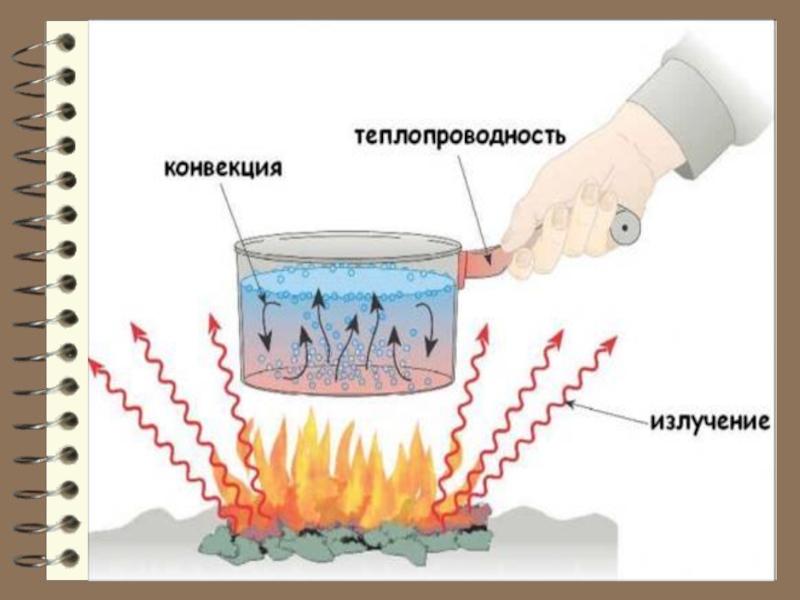
Слайд 16 Количество теплоты Q , представляет собой энергию, которая передаётся
путём излучения. Количество тепла (теп-лота) – мера изменения внутренней энергии системы в процессе теплопередачи: тепло-проводность, тепловое
излучение, конвекция
(перенос теплоты, обус-
ловленный различием
температур в разных ме-
стах жидкости или газа).
Слайд 18 Первое начало термодинамики
(закон сохранения энергии при тепловых процессах)
Количество
– это и есть первое начало термодинамики или закон сохранения энергии в термодинамике.
– изменение внутренней энергии тела равно разности сообщаемой телу теплоты и произведённой телом работы.
Слайд 19 Закон сохранения энергии для малого изменения состояния системы будет иметь вид:
Слайд 20 Теплота Q и работа А зависят от того, каким образом совершен
Слайд 21 Теплотой называется энергия, передаваемая от
тела с более высокой температурой
шей температурой при контакте (или путём из-
лучения). Такая передача энергии не сопровож-
дается совершением работы, а приводит только
к увеличению внутренней энергии. Но если тепло
передаётся телу, которое при этом может расши-
ряться, то оно может совершать работу (I нач.ТД):
Наибольшая работа совершается при изотер-мическом процессе, когда внутренняя энергия не изменяется ( ), тогда:
Слайд 22 Если идеальный газ, получив теплоту, изотермически расширится от объёма V1
Слайд 23 Если
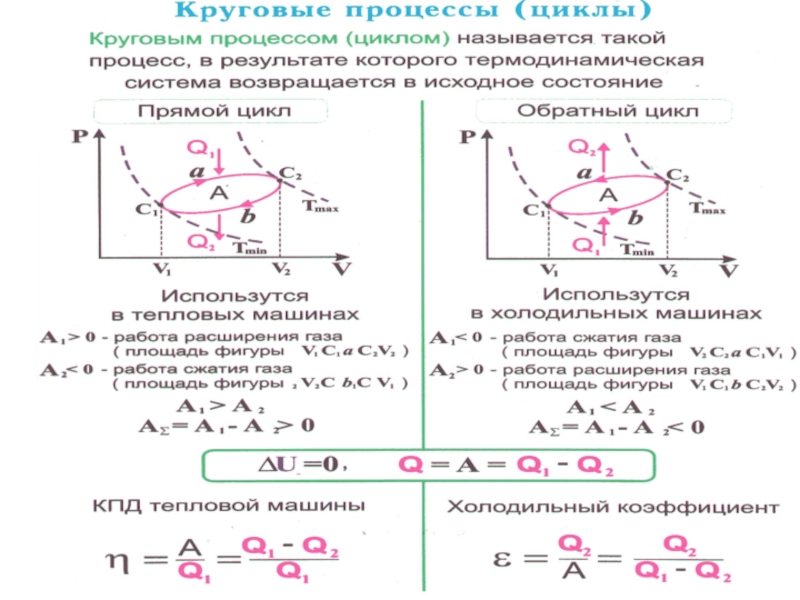
Слайд 24 Особое значение в термодинамике имеют круговые или циклические процессы, при которых
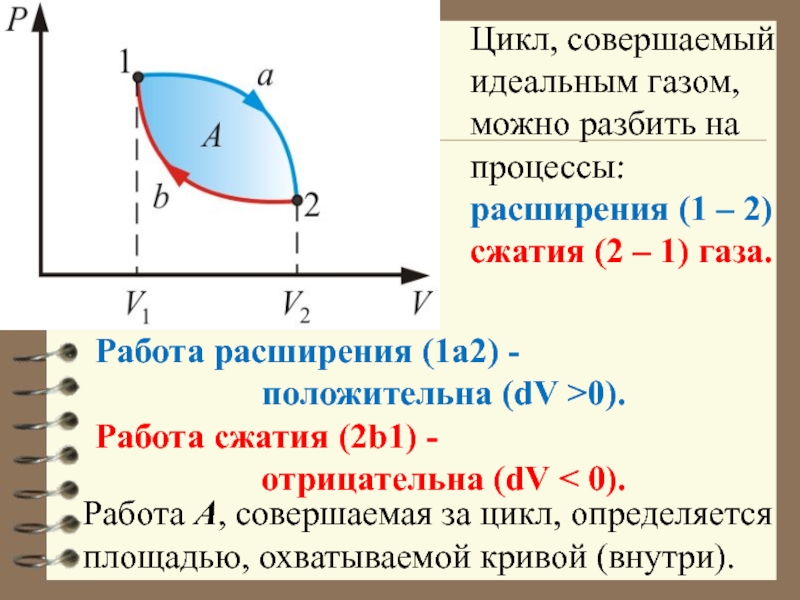
Слайд 25Цикл, совершаемый идеальным газом, можно разбить на процессы:
расширения (1 –
сжатия (2 – 1) газа.
Работа расширения (1a2) -
положительна (dV >0).
Работа сжатия (2b1) -
отрицательна (dV < 0).
Работа А, совершаемая за цикл, определяется площадью, охватываемой кривой (внутри).
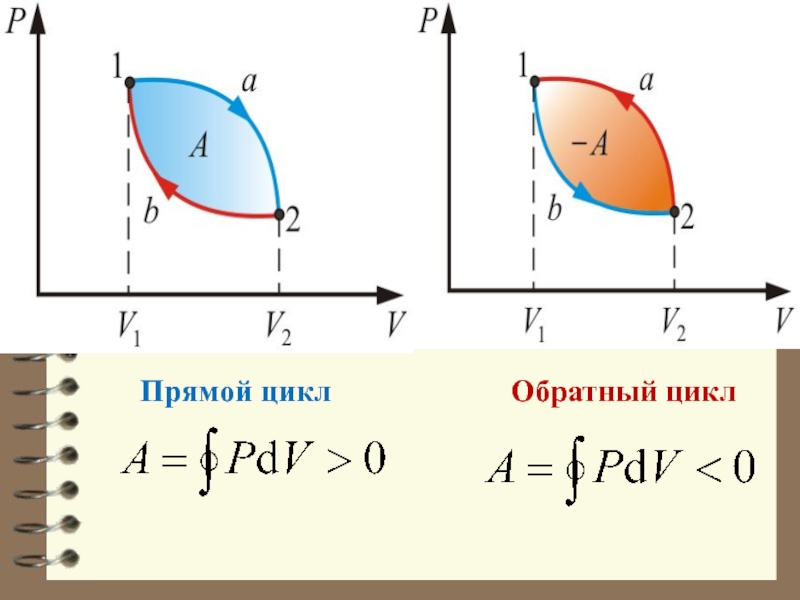
Слайд 26 Если за цикл совершается положительная работа
Слайд 28
Прямой цикл используется в тепловых двигателях – периодически
В результате кругового процесса система возвращается в исходное состояние и, следовательно, полное изменение внутренней энергии газа равно нулю ( ). Поэтому первое начало термодинамики для кругового процесса:
т.е. работа, совершаемая за цикл, равна количеству полученной извне теплоты.
Слайд 29 Т.о. работа, совершаемая за цикл, равна количеству полученной извне теплоты.
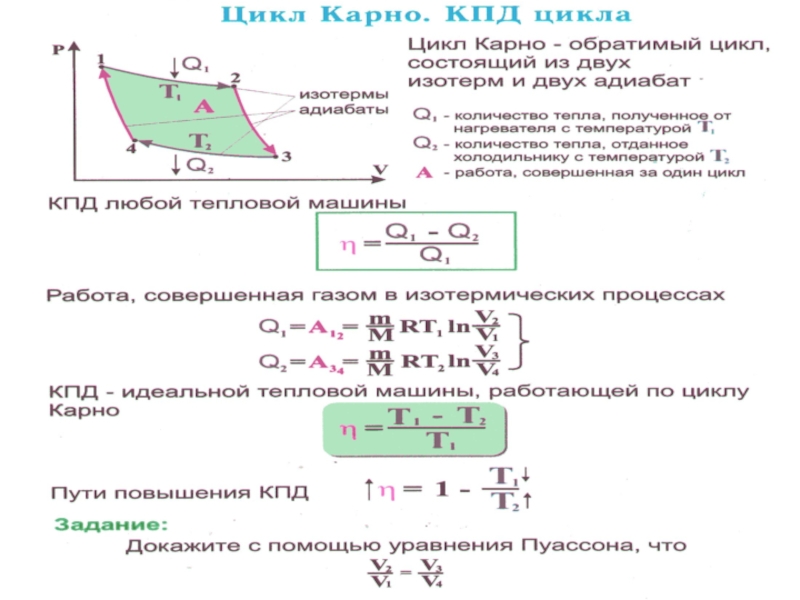
Слайд 30 Термический коэффициент полезного действия ( КПД ) для кругового процесса:
Слайд 31 Термический процесс называется обратимым, если он может происходить
Всякий процесс, не удовлетворяющий этим условиям, является необратимым.
Любой равновесный процесс является обратимым.
Обратимость равновесного процесса, происхо-
дящего в системе, следует из того, что ее любое
промежуточное состояние есть состояние термоди-
намического равновесия; для него "безразлично",
идет процесс в прямом или обратном направлении.
Слайд 32 Реальные процессы сопровождаются диссипацией
энергии (из-за трения, теплопроводности и т.д.) и
являются
Обратимые процессы - это идеализация реальных
процессов.
Их рассмотрение важно по двум причинам:
многие процессы в природе и технике практически обратимы;
обратимые процессы являются наиболее экономичными;
Они имеют максимальный термический коэффи-
циент полезного действия, что позволяет указать
пути повышения КПД реальных тепловых
двигателей.
Слайд 33 При адиабатическом расширении газа условие теплоизолированности системы исключает непосредственный теплообмен между
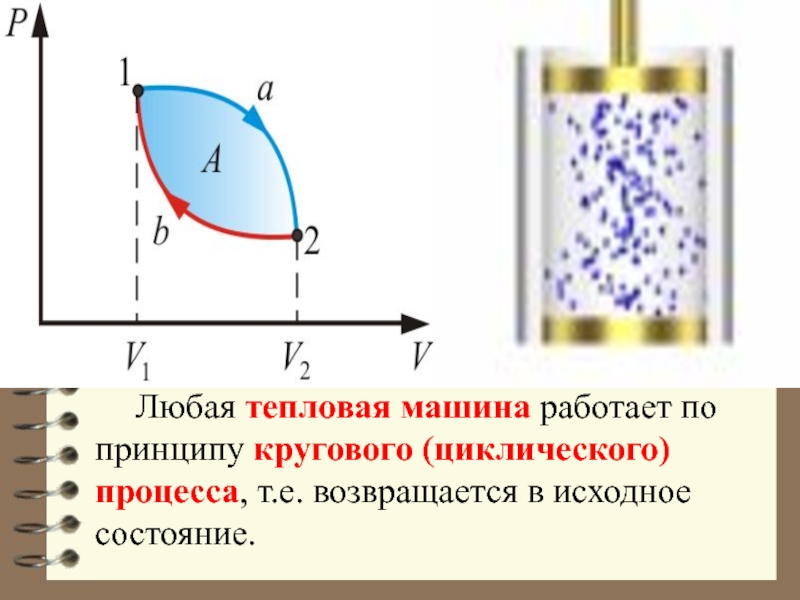
Слайд 34 Тепловые машины
Тепловой машиной
Слайд 35 Любая тепловая машина работает по принципу кругового (циклического) процесса, т.е. возвращается
Слайд 36 Но чтобы при этом была совершена полезная работа, возврат
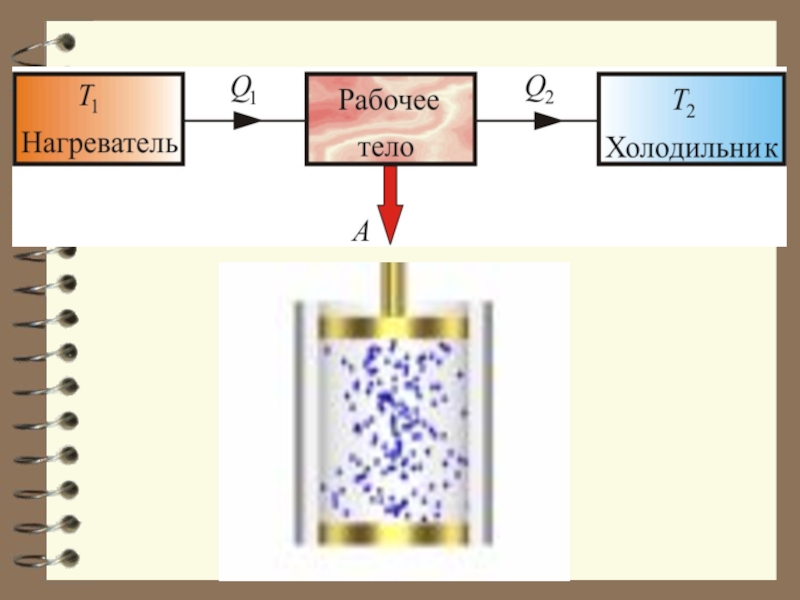
Слайд 39 Зачем холодильник? Так как в тепловой машине реализуется
Слайд 40 Прямой цикл используется в тепловом двигателе – периодически действующей тепловой машине,
Слайд 41 От термостата с более высокой температурой Т1, называемого нагревателем, за цикл
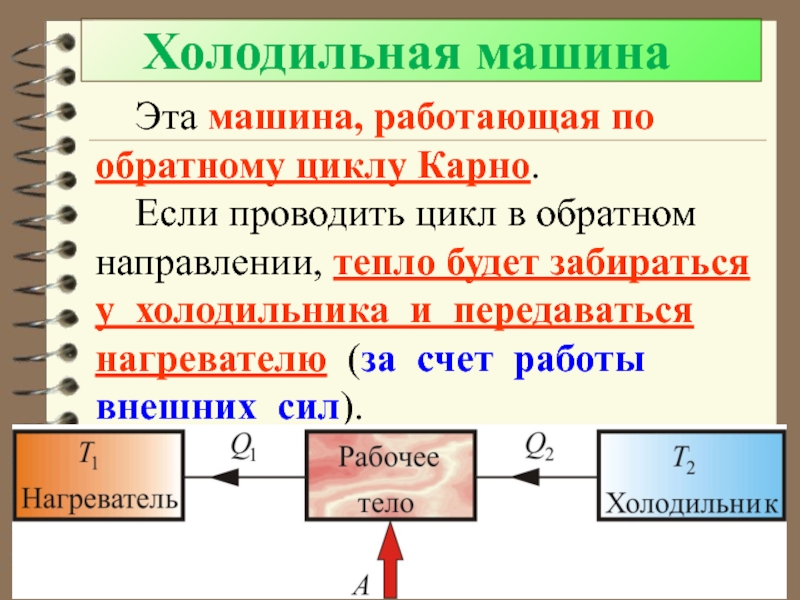
Слайд 47 Обратный цикл используется в холодильных машинах – периодически действующих установках, в
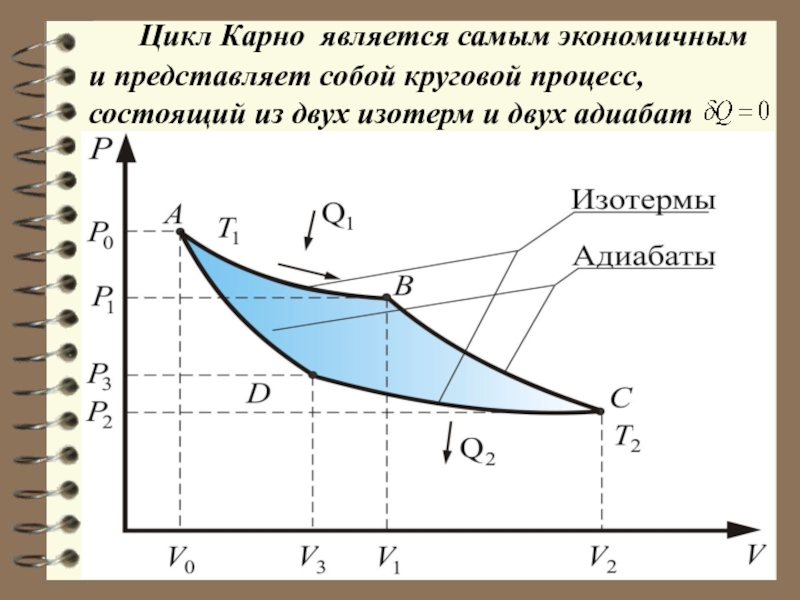
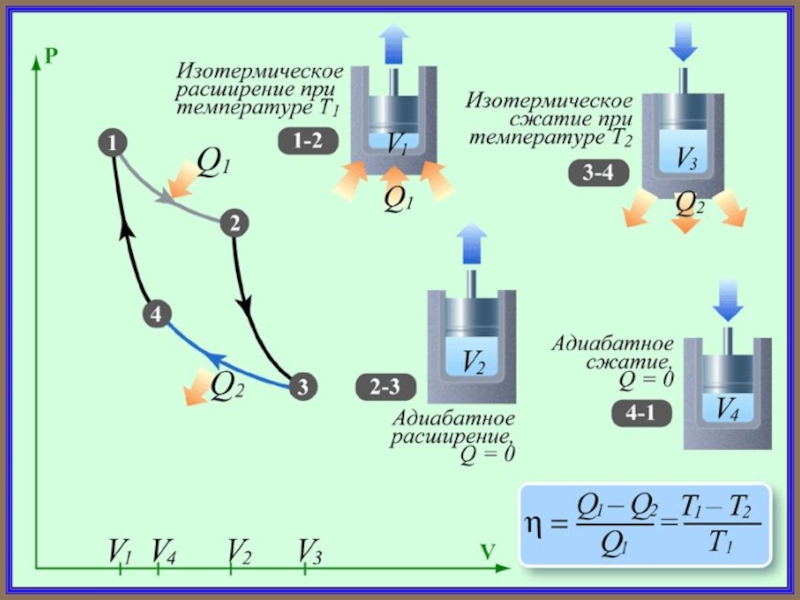
Слайд 50 Цикл Карно (обратимый).
Карно теоретически про-анализировал обратимый наиболее
Прямой цикл Карно в качестве рабочего тела использует идеальный газ, заключенный в сосуд с подвижным поршнем.
Слайд 51
Слайд 52 Цикл Карно является самым экономичным и представляет собой
Слайд 54
ТЕОРЕМА КАРНО
Из всех периодически
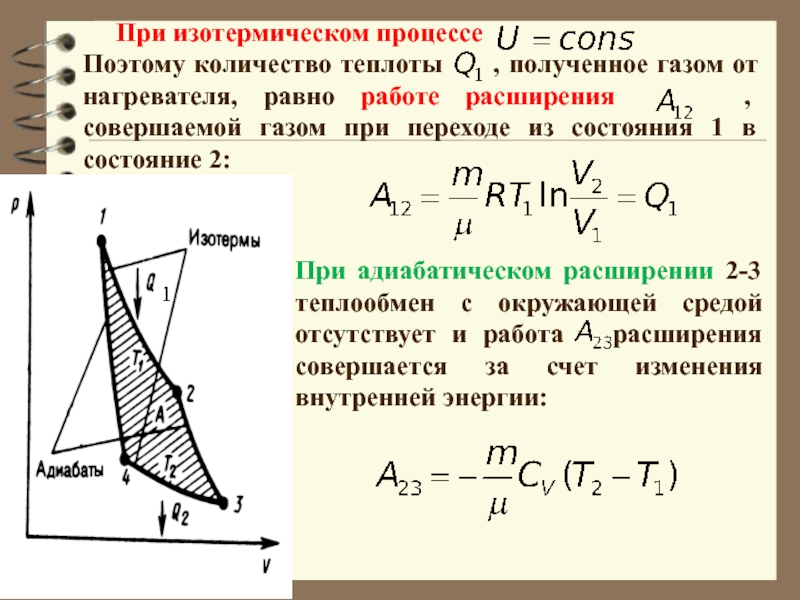
Слайд 55Поэтому количество теплоты , полученное газом от нагревателя, равно
При изотермическом процессе
При адиабатическом расширении 2-3 теплообмен с окружающей средой отсутствует и работа расширения совершается за счет изменения внутренней энергии:
Слайд 56Количество теплоты , отданное газом холодильнику при изотермическом сжатии,
Она определяется площадью, заштрихованной на рисунке.
Работа, совершаемая в результате кругового процесса:
Работа адиабатического сжатия:
Слайд 58 Видно, что η < 1 и зависит
Слайд 60 Холодильная машина
Эта машина, работающая по обратному циклу Карно.
Если
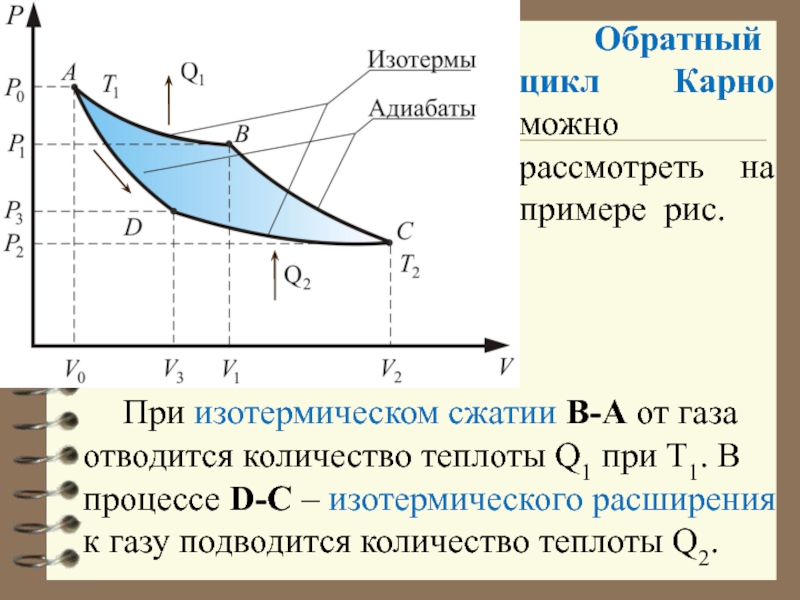
Слайд 61 Обратный цикл Карно можно рассмотреть на примере рис.
При изотермическом сжатии В-А от газа отводится количество теплоты Q1 при Т1. В процессе D-С – изотермического расширения к газу подводится количество теплоты Q2.
Слайд 62В этом цикле ,
Слайд 64 Теплоёмкость идеального газа
Теплоёмкость тела характеризуется количеством
Размерность теплоемкости: [C] = Дж/К.
Теплоёмкость – величина неопределённая, поэтому пользуются понятиями удельной и молярной теплоёмкости.
Слайд 65 Удельная теплоёмкость Суд – есть количество теплоты, необходимое для нагревания
Слайд 66 Теплоёмкость термодинамической системы зависит от того, как изменяется состояние системы при
Слайд 67 СР – теплоемкость при постоянном давлении. Если нагревать газ
Слайд 68 Следовательно, проводимое тепло затрачивается и на нагревание и на совершение работы.
Слайд 69 При изобарическом процессе кроме увеличения внутренней энергии происходит
Слайд 70Это уравнение Роберта Майера для одного моля газа. Из него следует,
Слайд 71 В общем случае так как внутренняя энергия U может
Слайд 72 Внутренняя энергия идеального газа является только функцией температуры (и не зависит
Слайд 73 Внутренняя энергия одного моля идеального одноатомного газа равна:
- молярная теплоемкость при постоянном объеме СV – величина постоянная, от температуры не зависит.
Слайд 74 Внутренняя энергия одного моля идеального газа c i степенями свободы равна:
молярная теплоемкость при постоянном объеме СV – величина постоянная, от температуры не зависит.
Слайд 75 Учитывая физический смысл R для изобарических процессов можно
(для одного моля). Отсюда для одноатомного:
Тогда,
молярная теплоемкость при постоянном давлении для одноатомных газов:
Слайд 76
Для одного моля идеального газа:
Постоянная адиабаты (коэффициент Пуассона) для идеального
газа:
Для одноатомного идеаль-
ного газа (i = 3):
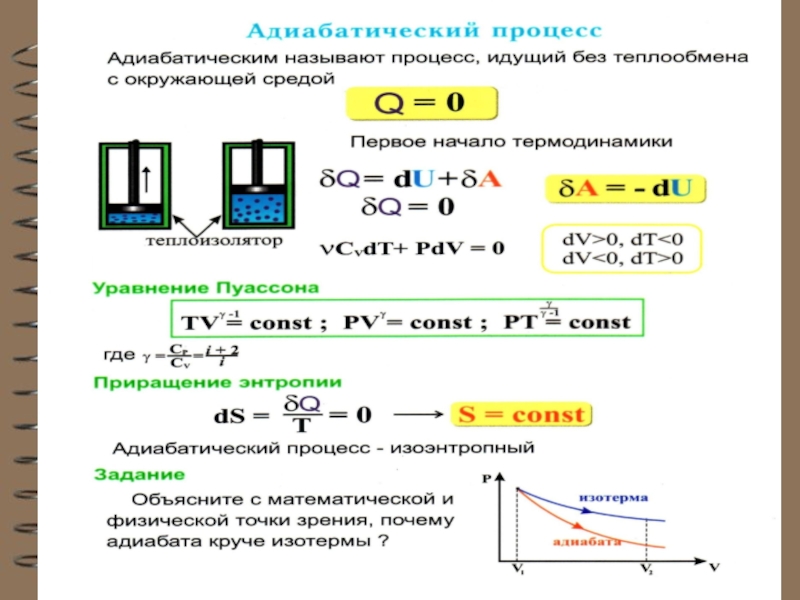
Слайд 78 Адиабатный (адиабатический) процесс
Это процесс, происходящий без теплообмена с окружающей средой,
При адиабатном процессе работа системы (или над системой) совершается за счет изме-нения внутренней энергии газа:
(из I начала ТД: при ).
Вывод уравнения адиабаты.
и δA = PdV :
Для 1 моля идеального газа:
Слайд 79 Подставляя dT в уравнение:
Делим на
где
Т.к. γ = const ( для одноатомного газа γ = 5/3 ), то
Слайд 80уравнение Пуассона или уравнение адиабаты для идеального газа
Или
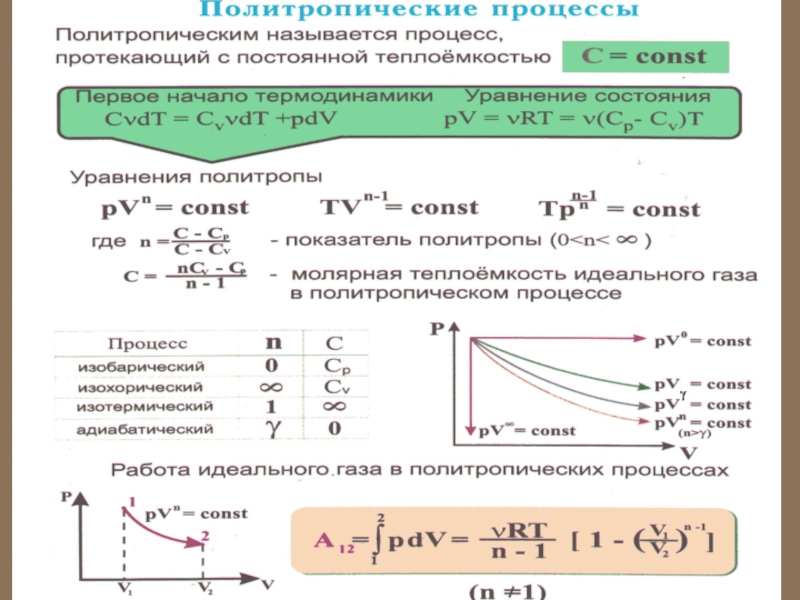
Слайд 82 Здесь уместно рассмотреть еще и политропный процесс – такой процесс, при
Слайд 83 С помощью показателя n можно легко описать любой изопроцесс: 1.
Слайд 844. Адиабатический процесс ΔQ = 0, n =