- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Основы молекулярно-кинетической теории презентация
Содержание
- 1. Основы молекулярно-кинетической теории
- 2. Левкип и Демокрит – 400 лет до
- 3. Молекулярно-кинетической теорией называют учение о
- 4. 1. Все вещества – жидкие, твердые
- 6. 3. Частицы взаимодействуют друг с другом силами,
- 7. 1. Закон кратных отношений: при образовании из
- 8. 7 г азота, соединяясь с 4 г
- 9. 2. Молекулы наблюдаются с помощью ионного
- 10. Опытные обоснования МКТ Взаимодействие молекул Силы притяжения и отталкивания действуют одновременно. Силы электромагнитной природы.
- 11. r < r0 Fпр< Fот
- 12. Опытные обоснования МКТ Хаотическое движение молекул Наиболее
- 13. Фотография броуновского движения Опытные обоснования МКТ Хаотическое движение молекул
- 14. 1. Броуновское движение. 2. Диффузия.
- 15. Беспорядочное хаотическое движение молекул называется тепловым движением.
- 16. Основы МКТ
- 17. В твердых телах молекулы совершают беспорядочные колебания
- 18. В жидкостях молекулы имеют значительно большую свободу
- 19. В газах расстояния между молекулами обычно значительно
- 20. Простейшей моделью молекулярно-кинетической теории является модель идеального
- 21. Модель идеального газа достаточно хорошо описывает поведение
- 22. T = t + 273,15 Температурная шкала Кельвина называется абсолютной
- 23. Температура
- 24. Температура Понятие температуры тесно связано с понятием
- 25. Макроскопические параметры: давление,
- 26. Газовые законы
- 27. ИЗОПРОЦЕССЫ В ГАЗАХ (газовые законы) Процессы,
- 28. Изотермический процесс (закон Бойля-Мариотта) Для данной
- 29. p V T1 T2 >
- 30. При T = const;
- 31. Изобарный процесс (закон Гей-Люссака) Изобарным процессом
- 32. где V0 – объем газа при температуре
- 33. Изобарный процесс (закон Гей-Люссака) p V
- 34. Изобарный процесс (закон Гей-Люссака) Условие процесса
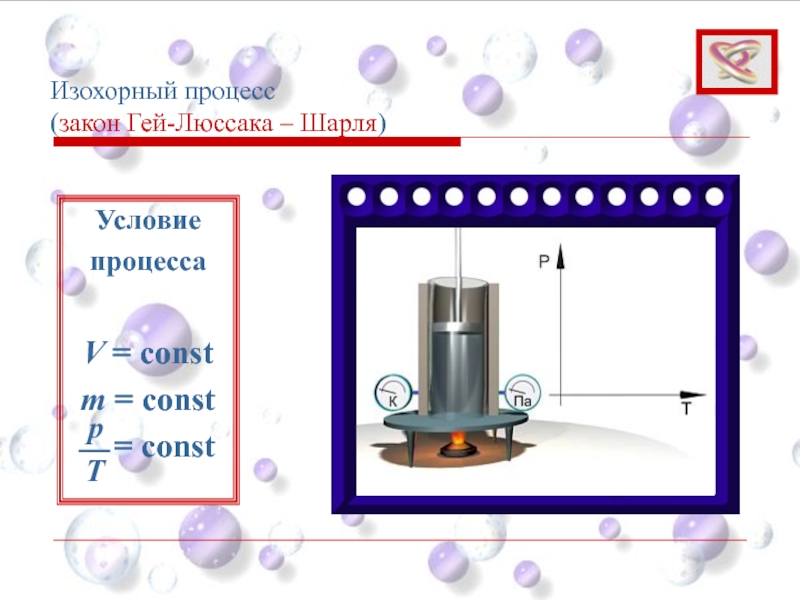
- 35. Изохорный процесс (закон Гей-Люссака – Шарля)
- 36. Изохорный процесс (закон Гей-Люссака – Шарля)
- 37. Изохорный процесс (закон Гей-Люссака – Шарля)
- 38. Изохорный процесс (закон Гей-Люссака – Шарля)
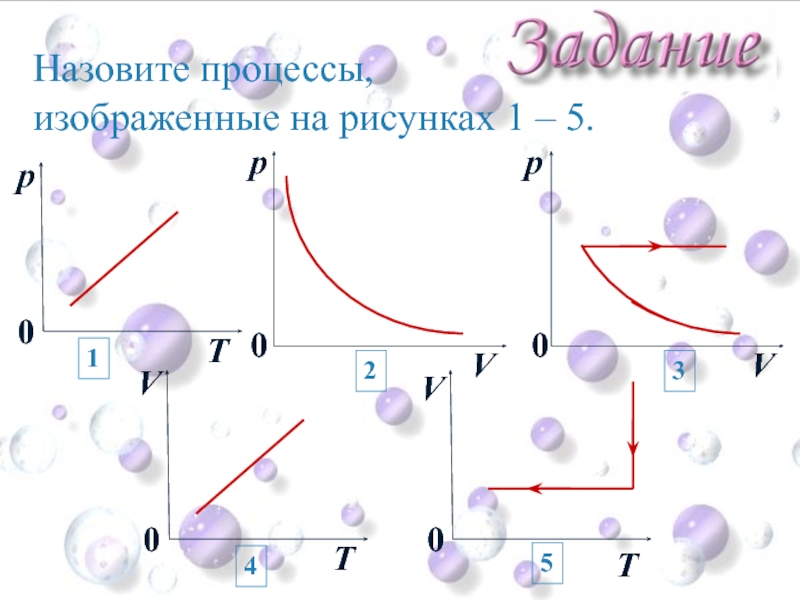
- 39. Назовите процессы, изображенные на рисунках 1 –
- 40. p V 0 1 1′ 2
- 41. p V 0 1 1′ 2
- 42. 2 2 2 1 1 1
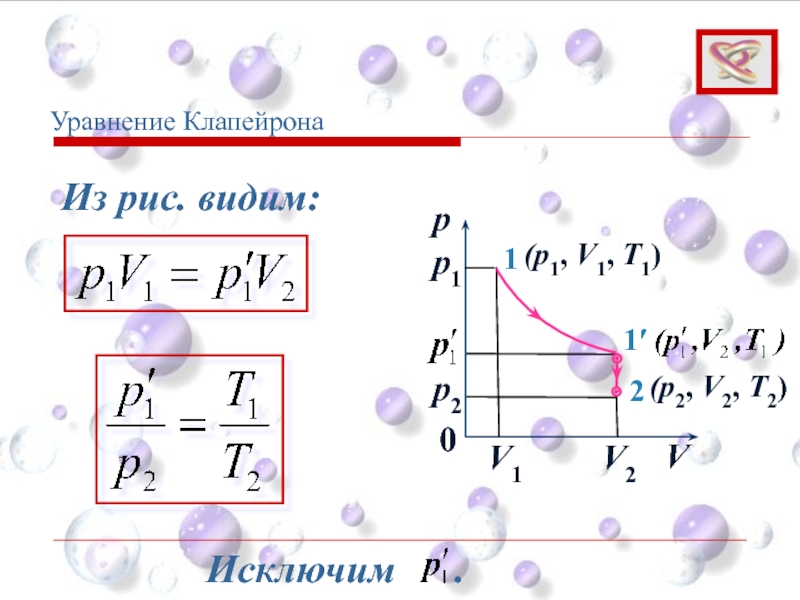
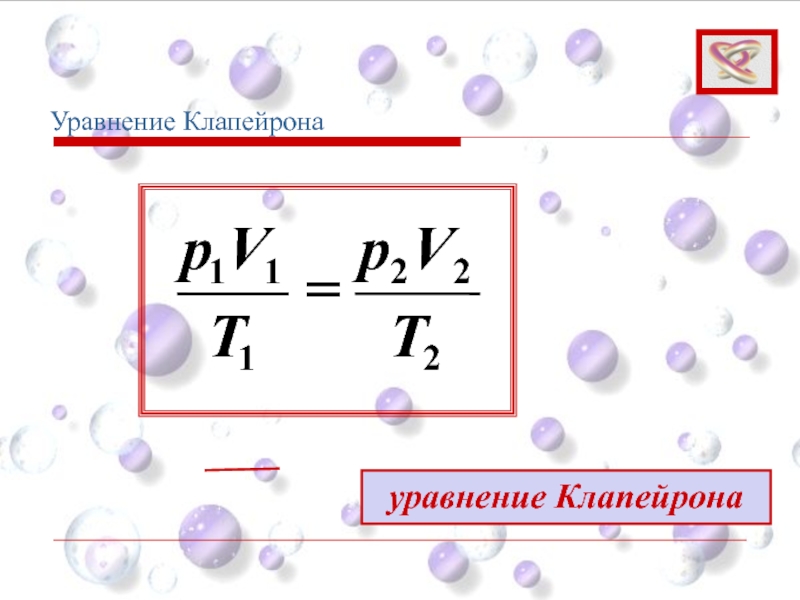
- 43. Уравнение Клапейрона (1)
- 44. Один моль любого газа при нормальных условиях
- 45. Уравнение Менделеева-Клапейрона
- 46. Уравнение Менделеева-Клапейрона (молярная газовая постоянная)
- 47. Тогда для 1 моль газа уравнение (1)
- 48. Тогда для любой массы газа m: Учтено,
- 49. Уравнение Менделеева-Клапейрона
- 50. Задача молекулярно-кинетической теории состоит в том, чтобы
- 51. Газ, состоящий из отдельных
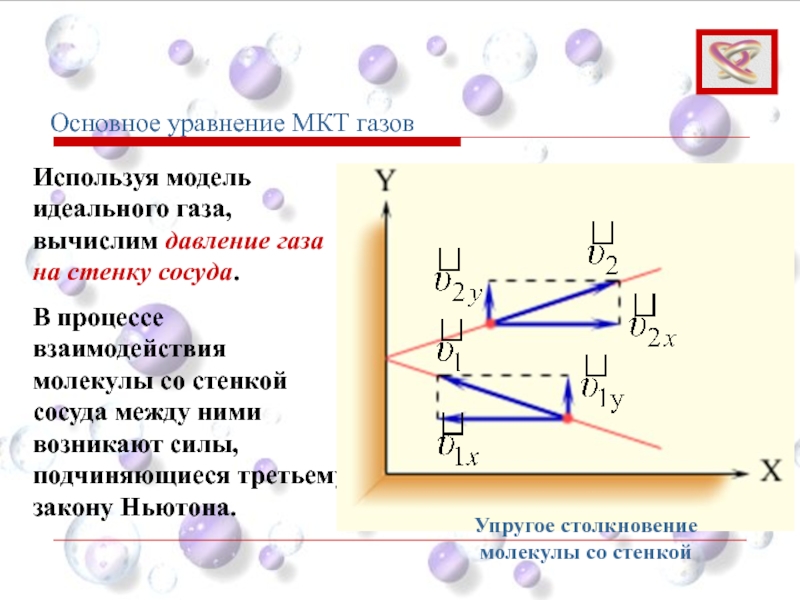
- 52. Используя модель идеального газа, вычислим давление газа
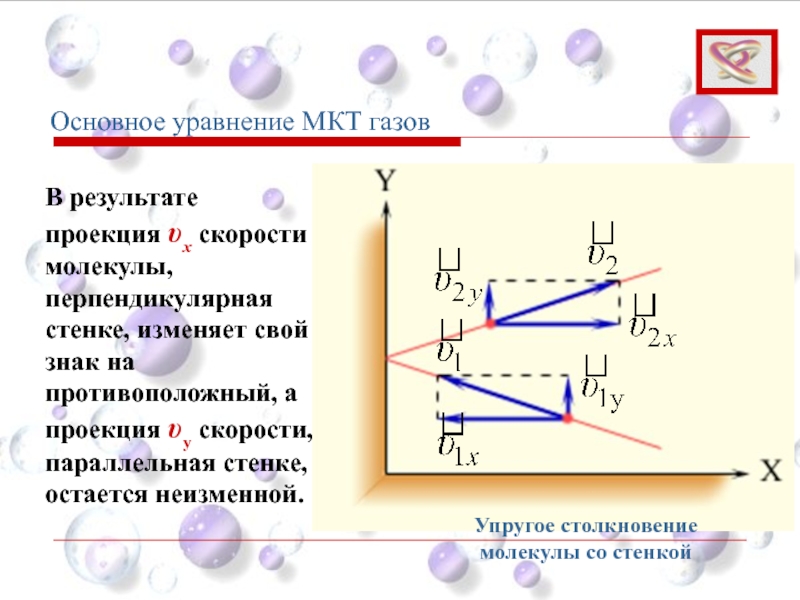
- 53. В результате проекция υx скорости молекулы, перпендикулярная
- 54. y x z 0 l l
- 55. y x z 0 l l
- 56. y x z 0 l l
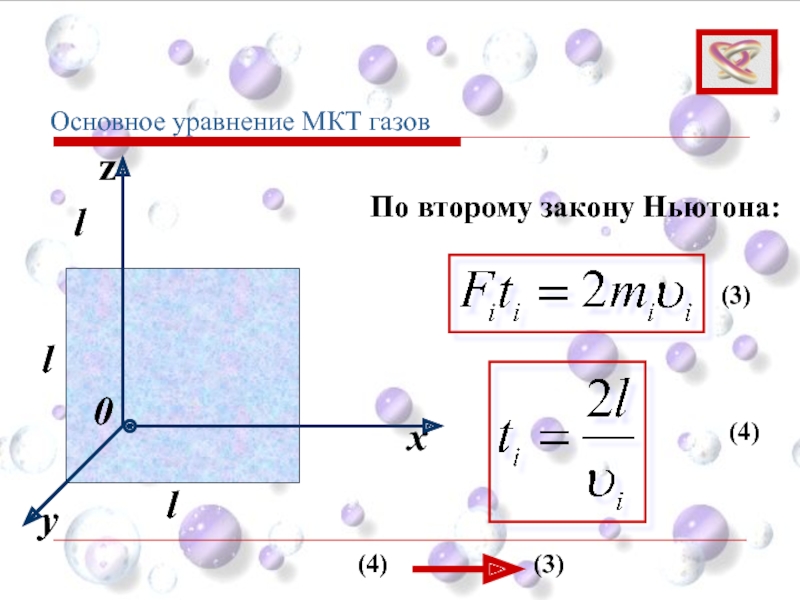
- 57. y x z 0 l l l Основное уравнение МКТ газов
- 58. y x z 0 l l
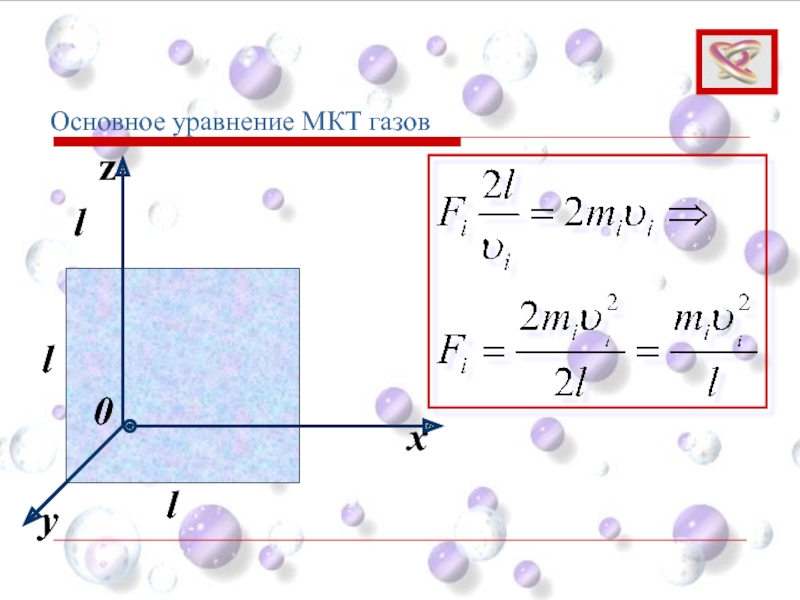
- 59. Суммарная сила ударов об одну грань: Основное уравнение МКТ газов
- 60. Основное уравнение МКТ газов Для идеального
- 61. Основное уравнение МКТ газов р
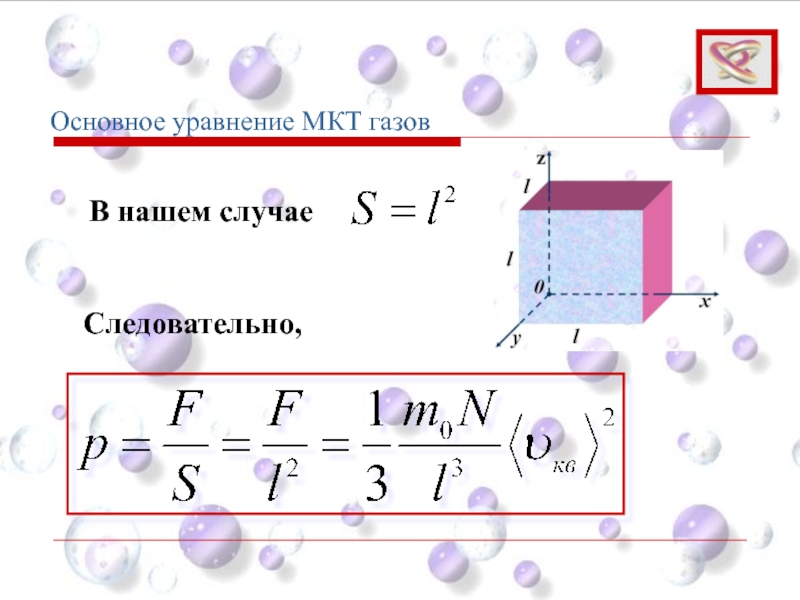
- 62. Основное уравнение МКТ газов В нашем случае Следовательно,
- 63. Или Основное уравнение МКТ (5) Основное уравнение МКТ газов ‒ концентрация молекул
- 64. Основное уравнение МКТ газов Средняя кинетическая энергия хаотического движения молекул газа Откуда (5)
- 65. Основное уравнение МКТ газов (6) Основное уравнение МКТ
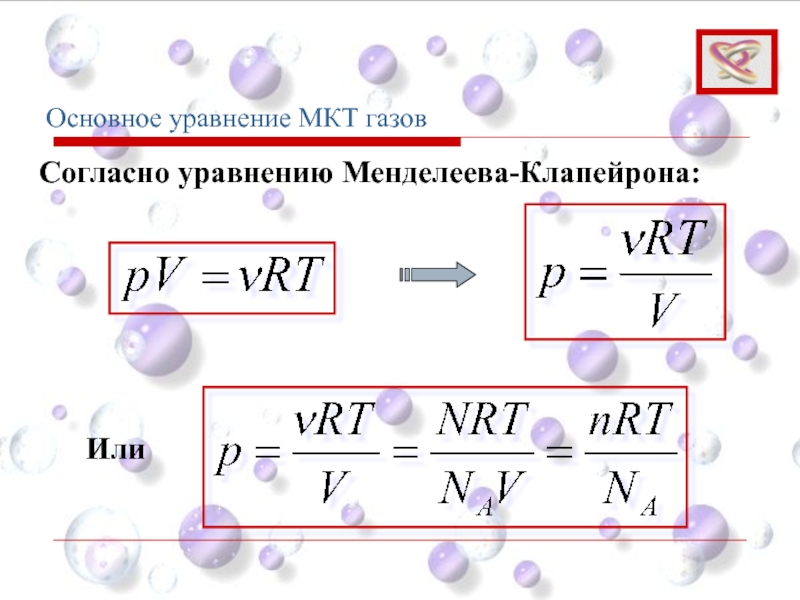
- 66. Основное уравнение МКТ газов Согласно уравнению Менделеева-Клапейрона: Или
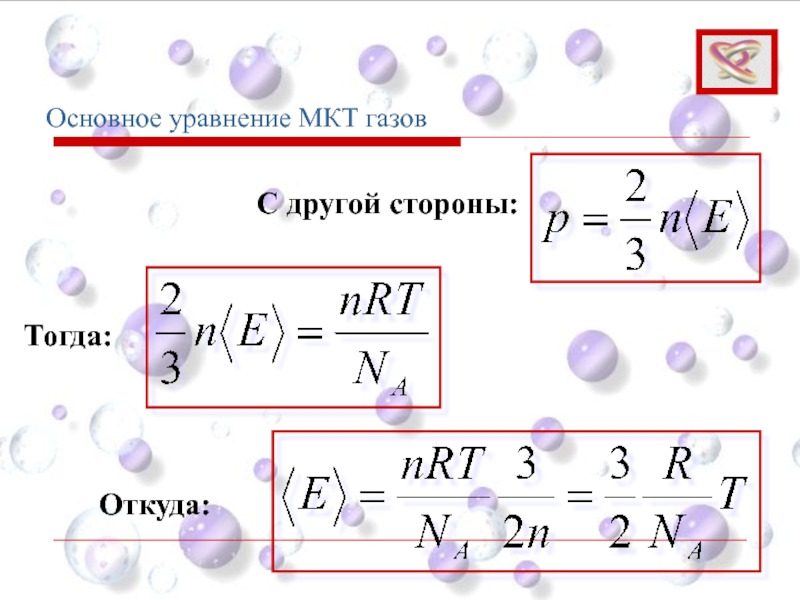
- 67. Основное уравнение МКТ газов Тогда: С другой стороны: Откуда:
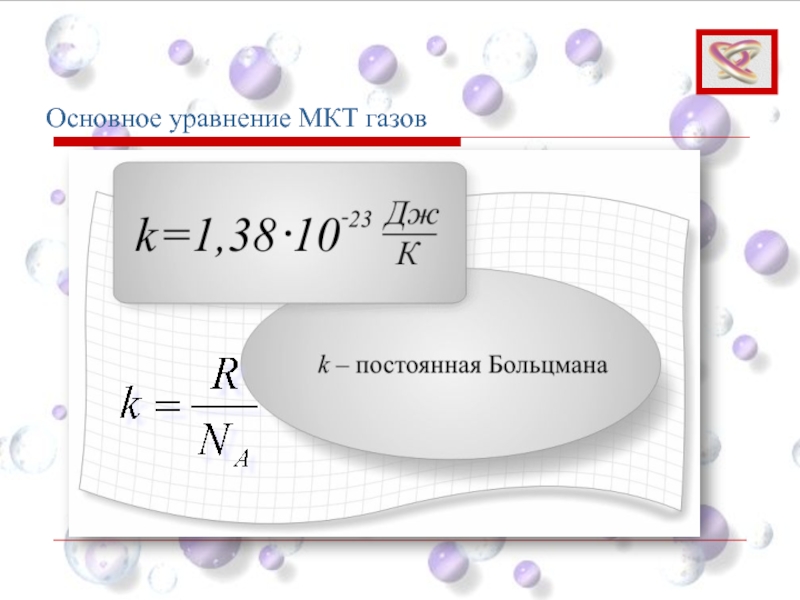
- 68. Основное уравнение МКТ газов
- 69. Основное уравнение МКТ газов Тогда: Средняя
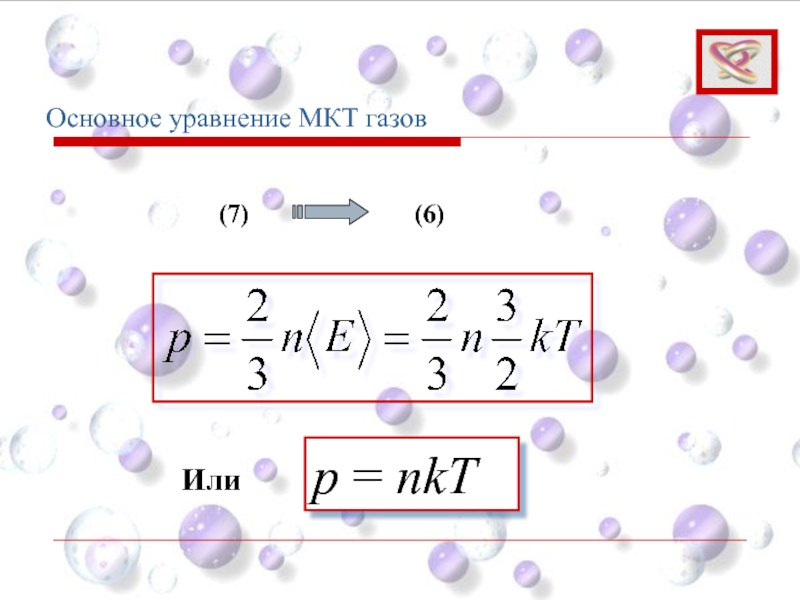
- 70. Основное уравнение МКТ газов p = nkT (7) (6) Или
- 71. Лекцию подготовили д.т.н., профессор Симдянкин А.А., к.п.н., доцент Симдянкина Е.Е.
Слайд 1Основы молекулярно- кинетической теории
Лекция
Составители: д.т.н., профессор Симдянкин А.А., к.п.н., доцент
Слайд 2Левкип и Демокрит – 400 лет до н.э.
М.В. Ломоносов – XVIII
Основы МКТ
Слайд 3 Молекулярно-кинетической теорией
называют учение о строении и
свойствах вещества на основе
представления о существовании
атомов и молекул как наименьших
частиц химического вещества.
Основы МКТ
Слайд 41. Все вещества – жидкие, твердые и газообразные – образованы
Основные положения МКТ
Слайд 63. Частицы взаимодействуют друг с другом силами, имеющими электрическую природу.
Гравитационное
Основные положения МКТ
-е
-е
-е
-е
-е
-е
е
2е
3е
H
He
Li
Слайд 71. Закон кратных отношений: при образовании из двух элементов различных веществ массы
N2O : N2O2 : N2O3 = 1 : 2 : 3
Опытные обоснования МКТ
Существование молекул
Слайд 87 г азота, соединяясь с 4 г кислорода, образуют 11 г
8 г » » » 15 г окиси азота NО,
12 г » » » 19 г азотистого ангидрида N2О3,
16 г » » » 23 г двуокиси азота NO2,
20 г » » » 27 г азотного ангидрида N2О5.
Массы кислорода, приходящиеся на одну и ту же массу азота (7 г), в этих соединениях относятся как
4 : 8 : 12 : 16 : 20 = 1 : 2 : 3 : 4 : 5.
Опытные обоснования МКТ
Существование молекул
Слайд 9 2. Молекулы наблюдаются с помощью ионного проектора, электронного микроскопа
Современный электронный
Опытные обоснования МКТ
Существование молекул
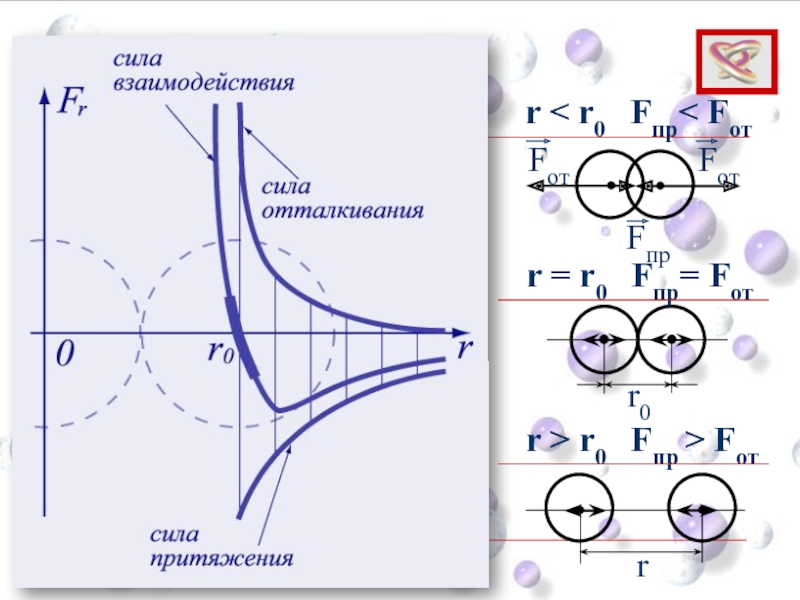
Слайд 10Опытные обоснования МКТ
Взаимодействие молекул
Силы притяжения и отталкивания действуют одновременно.
Силы электромагнитной природы.
Слайд 12Опытные обоснования МКТ
Хаотическое движение молекул
Наиболее ярким экспериментальным
подтверждением представлений
молекулярно-кинетической теории
о беспорядочном движении атомов и молекул является броуновское движение.
Слайд 14
1. Броуновское движение.
2. Диффузия.
3. Давление газа на стенки сосуда.
4. Стремление газа
Опытные обоснования МКТ
Хаотическое движение молекул
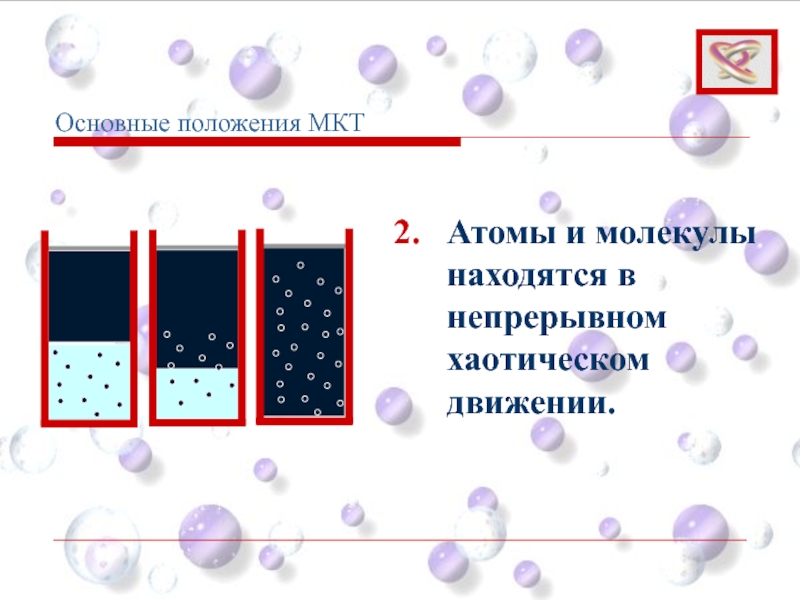
Слайд 15Беспорядочное хаотическое движение молекул называется тепловым движением.
Кинетическая энергия теплового движения
Основы МКТ
Внутренняя энергия — это сумма энергий молекулярных взаимодействий и энергии теплового движения молекул.
Понятие энергии относится всегда к системе тел.
Слайд 17В твердых телах молекулы совершают беспорядочные колебания около фиксированных центров (положений
Основы МКТ
Слайд 18В жидкостях молекулы имеют значительно большую свободу для теплового движения. Они
Основы МКТ
Слайд 19В газах расстояния между молекулами обычно значительно больше их размеров. Силы
Основы МКТ
Слайд 20Простейшей моделью молекулярно-кинетической теории является модель идеального газа.
В кинетической модели
Идеальный газ
Слайд 21Модель идеального газа достаточно хорошо описывает поведение реальных газов в широком
Суммарный объем всех молекул предполагается малым по сравнению с объемом сосуда, в котором находится газ.
Идеальный газ
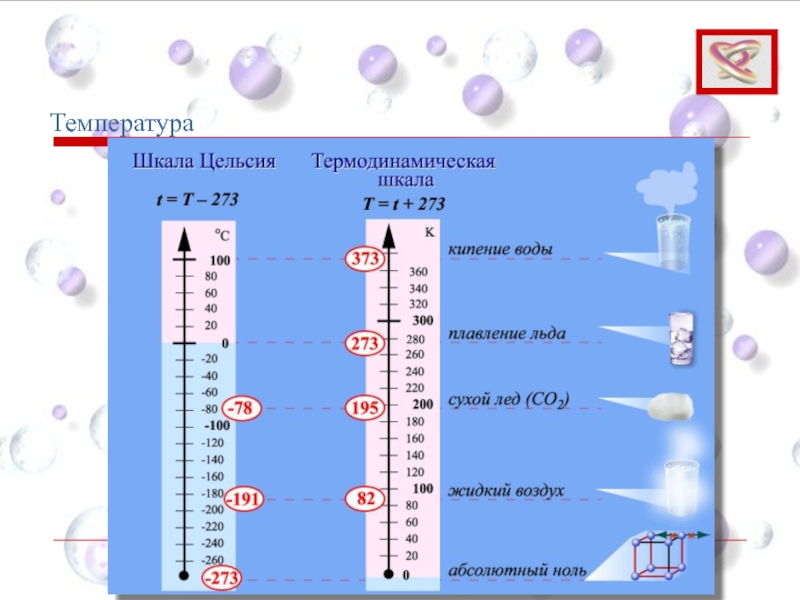
Слайд 22T = t + 273,15
Температурная шкала Кельвина называется абсолютной (термодинамической) шкалой температур.
В СИ
Комнатная температура TС = 20 °С по шкале Кельвина равна TК = 293,15 К.
Температура
Слайд 24Температура
Понятие температуры тесно связано с понятием теплового равновесия.
Тепловое равновесие –
Слайд 27ИЗОПРОЦЕССЫ В ГАЗАХ
(газовые законы)
Процессы, протекающие при неизменном значении одного из
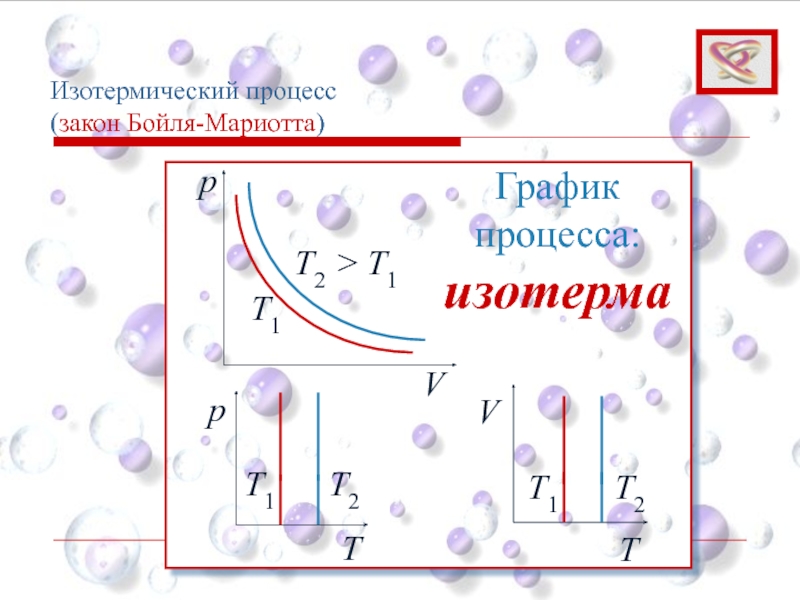
Слайд 28Изотермический процесс
(закон Бойля-Мариотта)
Для данной массы газа при постоянной температуре произведение
1662 г.
Бойль (англ.)
1676 г. Мариотт(фр.)
При T = const; m = const
pV =const
Слайд 29
p
V
T1
T2 > T1
График процесса: изотерма
p
Т
Т2
Т1
Т
V
Т1
Т2
Изотермический процесс
(закон Бойля-Мариотта)
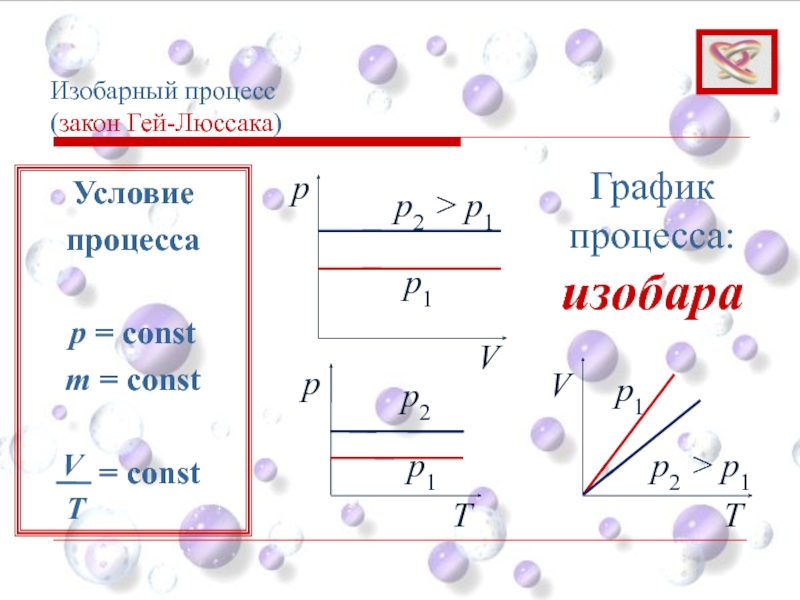
Слайд 31Изобарный процесс
(закон Гей-Люссака)
Изобарным процессом называют процесс, протекающий при неизменном давлении
Объем данной массы газа при постоянном давлении изменяется линейно с температурой:
При p = const; m = const
V = V0 (1 + αt)
Слайд 32где V0 – объем газа при температуре 0 °С. Коэффициент α равен
Его называют температурным коэффициентом объемного расширения газов.
Изобарный процесс
(закон Гей-Люссака)
2
1
2
1
T
T
V
V
=
В термодинамической форме:
V = V0 (1 + αt)
Слайд 33Изобарный процесс
(закон Гей-Люссака)
p
V
p1
p2 > p1
График процесса: изобара
p
Т
Т
V
p2
p1
p1
p2 > p1
Условие
процесса
p =
m = const
= const
T
V
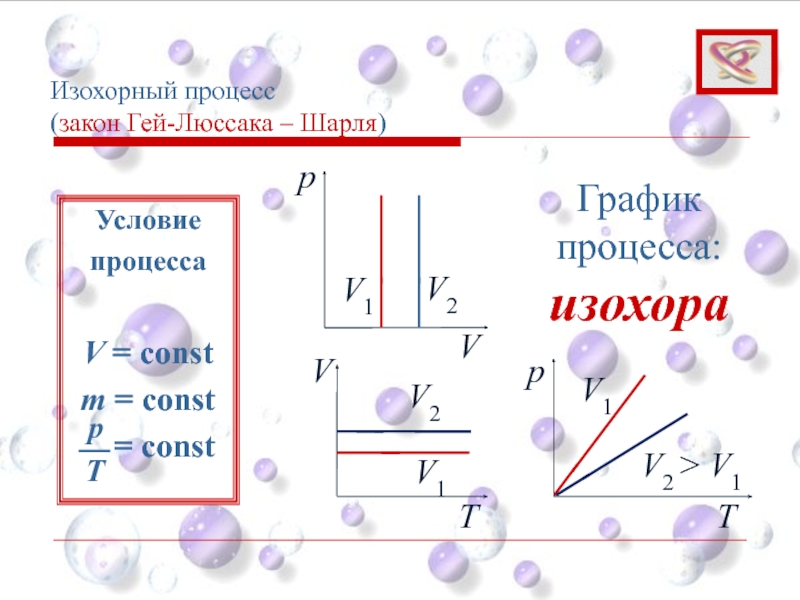
Слайд 35Изохорный процесс
(закон Гей-Люссака – Шарля)
Изохорный процесс – это процесс протекающий
Давление газа p изменяется прямо пропорционально его абсолютной температуре:
При V = const; m = const
p = p 0 (1 + αt)
Слайд 36Изохорный процесс
(закон Гей-Люссака – Шарля)
где p0 – давление газа при
Его называют температурным коэффициентом давления.
2
1
2
1
T
T
p
p
=
В термодинамической форме:
p = p 0 (1 + αt)
Слайд 37Изохорный процесс
(закон Гей-Люссака – Шарля)
p
V
V1
V2
График процесса: изохора
V
Т
Т
p
V2
V1
V1
V2 > V1
Условие
процесса
V
m = const
= const
T
p
Слайд 40p
V
0
1
1′
2
p1
p2
V1
V2
(p1, V1, T1)
(p2, V2, T2)
Клапейрон (фр.) вывел уравнение состояния идеального газа,
Уравнение Клапейрона
Слайд 44Один моль любого газа при нормальных условиях (Т = 273 К
Vm = 0,0224 м3/моль = 22,41 ∙ 10-3 м3/моль.
Согласно закону Авогадро:
Подставим эти данные в (1):
Менделеев объединил уравнение Клапейрона с законом Авогадро.
Уравнение Менделеева-Клапейрона
Слайд 47Тогда для 1 моль газа уравнение (1) можно записать в виде:
Уравнение
(2)
Уравнение Менделеева-Клапейрона
Слайд 48Тогда для любой массы газа m:
Учтено, что:
Уравнение Менделеева-Клапейрона
ν – (количество
Слайд 50Задача молекулярно-кинетической теории состоит в том, чтобы установить связь между микроскопическими
Основы МКТ
p V T
m ʋ Eк
?
Слайд 51 Газ, состоящий из отдельных атомов, а не молекул,
К одноатомным газам относят инертные газы — гелий, неон, аргон. В случае идеальных газов пренебрегают силами взаимодействия молекул, т. е. их потенциальная энергия полагается равной нулю, поэтому внутренняя энергия идеального газа представляет собой кинетическую энергию теплового движения молекул.
Слайд 52Используя модель идеального газа, вычислим давление газа на стенку сосуда.
В
Основное уравнение МКТ газов
Упругое столкновение молекулы со стенкой
Слайд 53В результате проекция υx скорости молекулы, перпендикулярная стенке, изменяет свой знак
Упругое столкновение молекулы со стенкой
Основное уравнение МКТ газов
Слайд 54
y
x
z
0
l
l
l
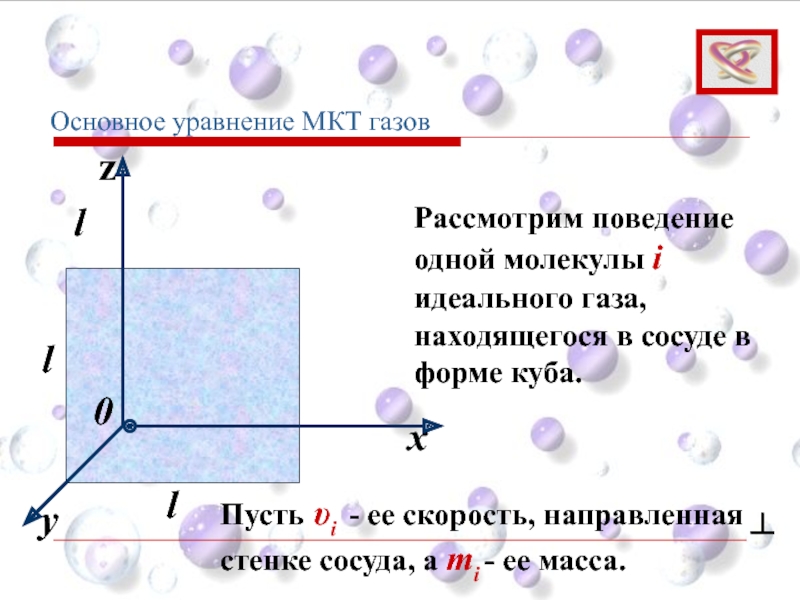
Рассмотрим поведение одной молекулы i идеального газа, находящегося в сосуде в
Пусть υi - ее скорость, направленная ┴ стенке сосуда, а mi - ее масса.
Основное уравнение МКТ газов
Слайд 55
y
x
z
0
l
l
l
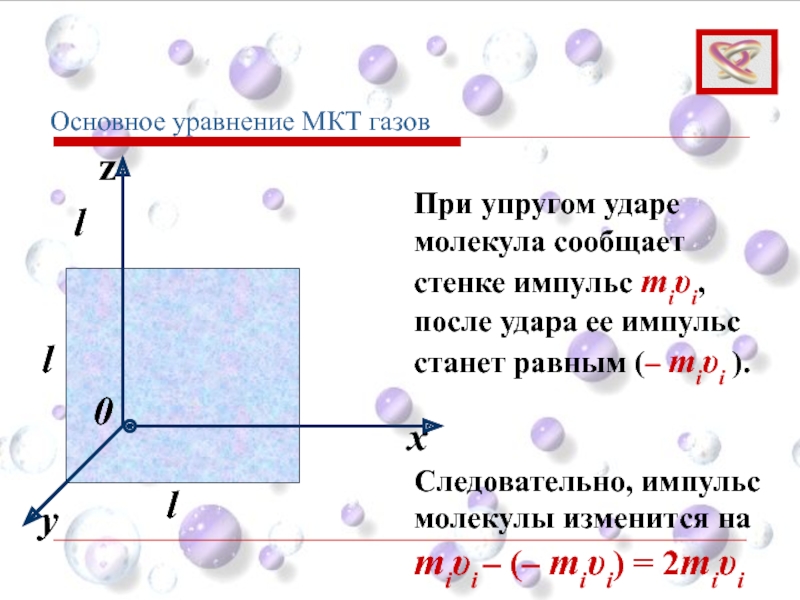
При упругом ударе молекула сообщает стенке импульс miυi, после удара ее
miυi – (– miυi) = 2miυi
Следовательно, импульс молекулы изменится на
Основное уравнение МКТ газов
Слайд 58
y
x
z
0
l
l
l
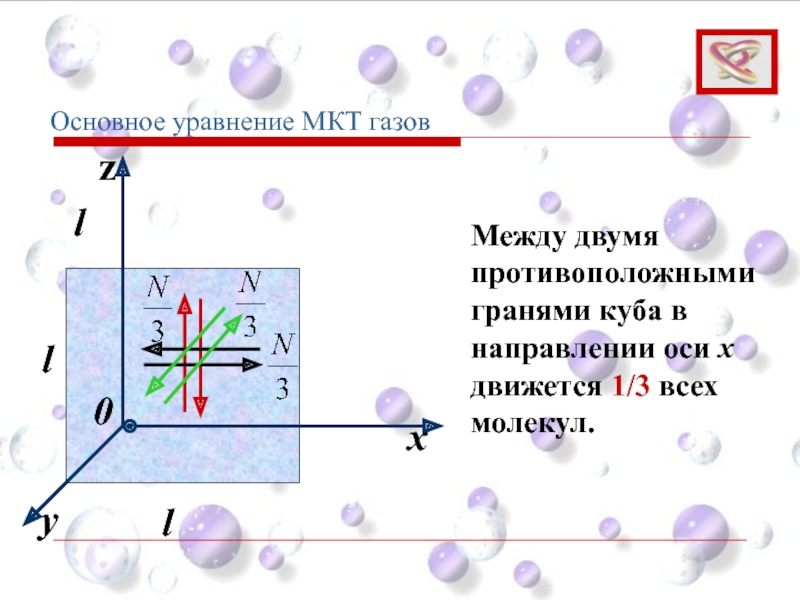
Основное уравнение МКТ газов
Между двумя противоположными гранями куба в направлении
Слайд 61Основное уравнение МКТ газов
р – давление газа на стенку сосуда.
С
Слайд 64Основное уравнение МКТ газов
Средняя кинетическая энергия хаотического движения молекул газа
Откуда
(5)
Слайд 69Основное уравнение МКТ газов
Тогда:
Средняя кинетическая энергия хаотического движения молекул газа
Температура есть мера средней кинетической энергии поступательного движения молекул.
(7)