- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Осадительное титрование. (Лекция 11) презентация
Содержание
- 1. Осадительное титрование. (Лекция 11)
- 2. План Требования к реакциям осадительного титрования Классификация
- 3. Классификация: аргентометрия (АgNO3); тиоцианатометрия (NH4SCN);
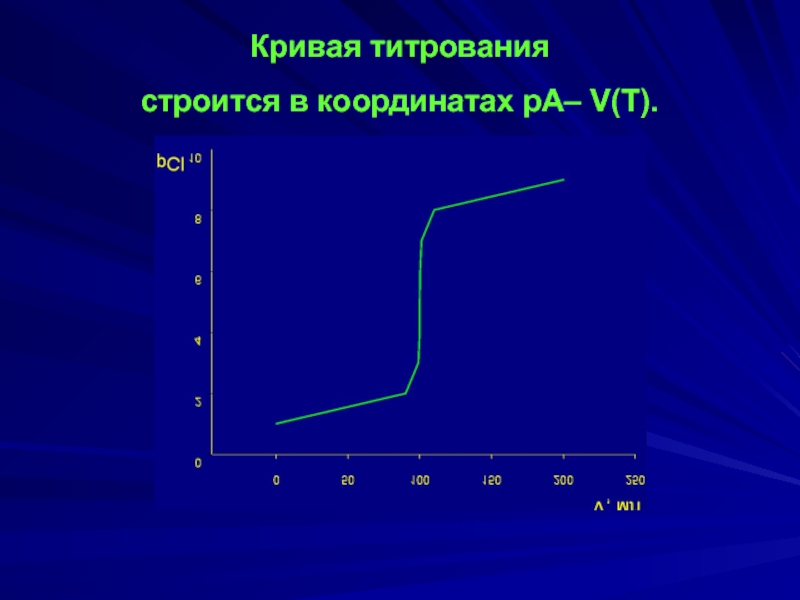
- 4. Кривая титрования строится в координатах рА– V(T).
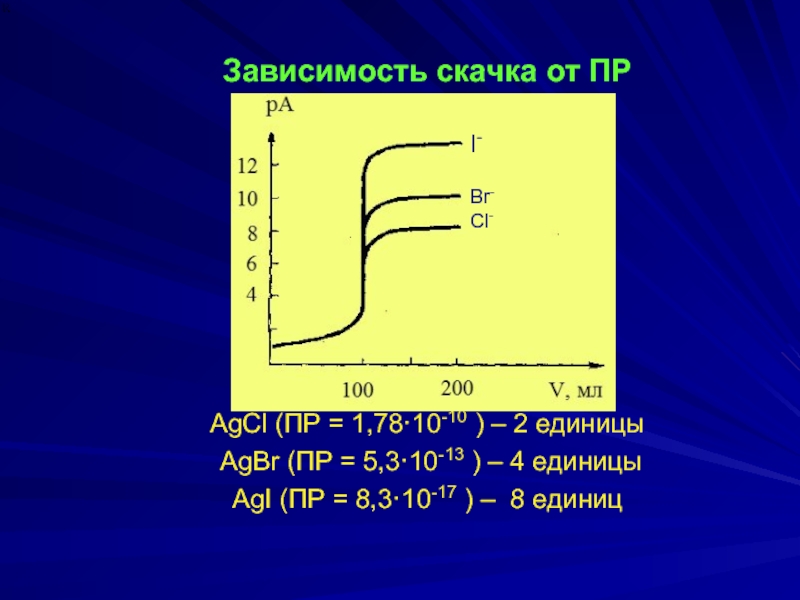
- 5. Зависимость скачка от ПР
- 6. Осадительные индикаторы Ag+ + Cl- ⇆ AgCl↓
- 7. Металлохромные индикаторы железоаммонийные квасцы FeNH4(SO4)2·12H2O Ag+ +
- 8. Адсорбционные индикаторы НInd ⇆ Н+ +
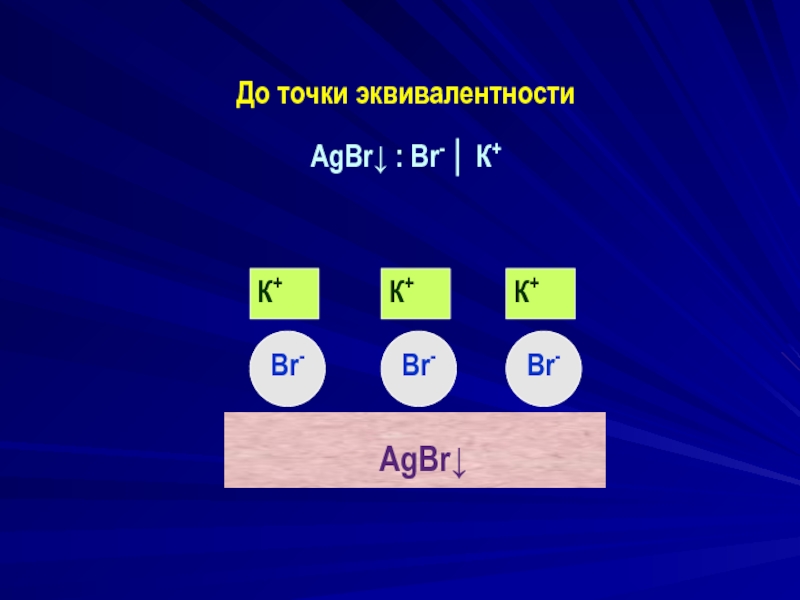
- 9. До точки эквивалентности AgBr↓ : Br-
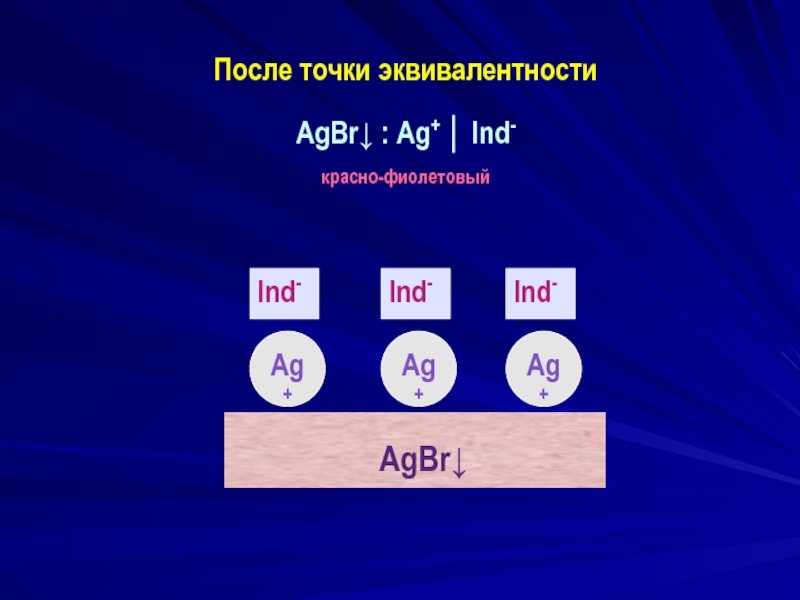
- 10. После точки эквивалентности AgBr↓ : Ag+
- 11. Аргентометрия Ag+ + Х- ⇆ AgХ↓,
- 12. МЕТОДЫ АРГЕНТОМЕТРИЧЕСКОГО ТИТРОВАНИЯ Метод Гей-Люссака
- 13. При определении хлоридов по методу Фольгарда
- 15. Тиоцианатометрия Ag+ + SCN- ⇄ AgSCN↓
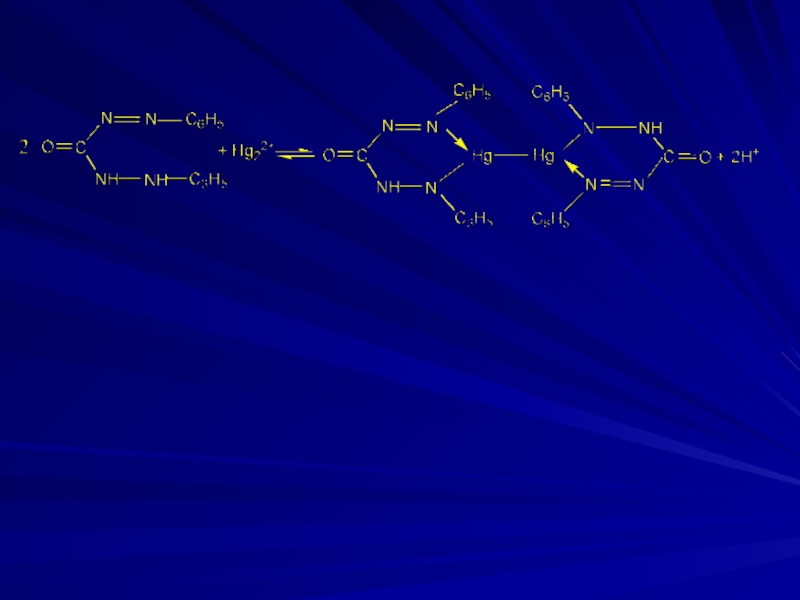
- 16. Меркурометрия Hg22+ + 2 Х- ⇄
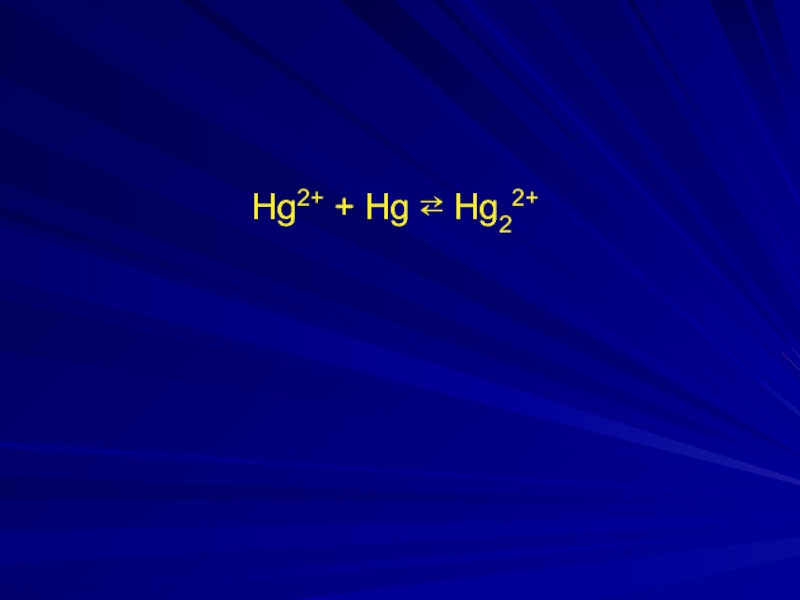
- 17. Hg2+ + Hg ⇄ Hg22+
- 18. Hg22+ +
Слайд 2План
Требования к реакциям осадительного титрования
Классификация методов осадительного титрования
Кривые осадительного титрования
Способы определения
КТТ
Аргентометрия
Тиоцианатометрия
Меркурометрия
Аргентометрия
Тиоцианатометрия
Меркурометрия
Слайд 3
Классификация:
аргентометрия (АgNO3);
тиоцианатометрия (NH4SCN);
меркурометрия (Hg2(NO3)2 или Hg2(ClO4)2);
гексацианоферратометрия (K4[Fe(CN)6]);
сульфатометрия (H2SO4);
бариометрия (BaCl2);
плюмбометрия (Pb(NO3)2 или
Pb(CH3COO)2).
Слайд 5Зависимость скачка от ПР
AgCl (ПР = 1,78·10-10 ) – 2 единицы
AgBr (ПР = 5,3·10-13 ) – 4 единицы
AgI (ПР = 8,3·10-17 ) – 8 единиц
AgI (ПР = 8,3·10-17 ) – 8 единиц
I-
Br-Cl-
Слайд 6Осадительные индикаторы
Ag+ + Cl- ⇆ AgCl↓
2 Ag+ + CrO42- ⇆ Ag2CrO4↓
Определение
проводят при рН = 6,5-10,3, т.к. в кислой среде (pH<6,5) осадок Ag2CrO4 растворяется с образованием дихромат-ионов:
2 Ag2CrO4 + 2 Н+ ⇆ 4 Ag+ + Cr2O72- + Н2О
В сильно щелочной среде (рН >10,3) образуется бурый осадок оксида серебра:
2 Ag+ + 2 ОН- → 2 AgОН↓ → Ag2O↓ + Н2О
2 Ag2CrO4 + 2 Н+ ⇆ 4 Ag+ + Cr2O72- + Н2О
В сильно щелочной среде (рН >10,3) образуется бурый осадок оксида серебра:
2 Ag+ + 2 ОН- → 2 AgОН↓ → Ag2O↓ + Н2О
Слайд 7Металлохромные индикаторы
железоаммонийные квасцы FeNH4(SO4)2·12H2O
Ag+ + SCN- → AgSCN↓
После ТЭ, когда все
катионы серебра оттитрованы, прибавление первой избыточной капли титранта приводит к образованию тиоцианатных комплексов железа(III) красного цвета:
Fe3+ + nSCN- → [Fe(SCN)n]3-n
Титрование проводят в кислой среде (pH=1) для подавления гидролиза железа(ІІІ), поскольку продукты гидролиза также окрашены.
[Fe(H2O)6]3+ + HOH ⇆ [Fe(H2O)5(OH)]2+ + H3O+
Fe(H2O)5(OH)]2+ + HOH ⇆ [Fe(H2O)4(OH)2]+ + H3O+
Fe3+ + nSCN- → [Fe(SCN)n]3-n
Титрование проводят в кислой среде (pH=1) для подавления гидролиза железа(ІІІ), поскольку продукты гидролиза также окрашены.
[Fe(H2O)6]3+ + HOH ⇆ [Fe(H2O)5(OH)]2+ + H3O+
Fe(H2O)5(OH)]2+ + HOH ⇆ [Fe(H2O)4(OH)2]+ + H3O+
Слайд 8 Адсорбционные индикаторы
НInd ⇆ Н+ + Ind-
Ag+ + Br - →
AgBr↓
До ТЭ: {m (AgBr)·n Br - (n-x) K+}x-...x K+
В ТЭ: {m (AgBr)}
После ТЭ: {m (AgBr)· n Ag+(n-x) Ind-}x+...x Ind-
До ТЭ: {m (AgBr)·n Br - (n-x) K+}x-...x K+
В ТЭ: {m (AgBr)}
После ТЭ: {m (AgBr)· n Ag+(n-x) Ind-}x+...x Ind-
Слайд 12МЕТОДЫ
АРГЕНТОМЕТРИЧЕСКОГО ТИТРОВАНИЯ
Метод Гей-Люссака
Метод Мора
Метод Фаянса-Фишера-Ходакова
Метод Фольгарда
Слайд 13
При определении хлоридов по методу Фольгарда
возможен перерасход титранта.
ПРAgCl =
1,78·10-10 > ПРAgSCN = 1,1·10-12
AgCl↓ + SCN- ⇆ AgSCN↓ + Cl-
[Fe(SCN)]2+ + AgCl ⇆ AgSCN↓ + Fe3+ + Cl-
Кр = =
AgCl↓ + SCN- ⇆ AgSCN↓ + Cl-
[Fe(SCN)]2+ + AgCl ⇆ AgSCN↓ + Fe3+ + Cl-
Кр = =
≈ 178
Слайд 14
При определении йодидов по методу Фольгарда
при несоблюдении порядка
прибавления реагентов возможна реакция:
2 I- + 2 Fe3+ ⇆ I2 + 2 Fe2+
Слайд 15Тиоцианатометрия
Ag+ + SCN- ⇄ AgSCN↓
Hg22+ + 2 SCN- ⇄ Hg2(SCN)2↓
После ТЭ
титруемый раствор окрашивается в красный цвет вследствие образования тиоцианатных комплексов железа(III):
Fe3+ + SCN- ⇄ [Fe(SCN)]2+
Fe3+ + SCN- ⇄ [Fe(SCN)]2+


![Классификация:аргентометрия (АgNO3);тиоцианатометрия (NH4SCN);меркурометрия (Hg2(NO3)2 или Hg2(ClO4)2);гексацианоферратометрия (K4[Fe(CN)6]);сульфатометрия (H2SO4);бариометрия (BaCl2);плюмбометрия (Pb(NO3)2 или Pb(CH3COO)2).](/img/tmb/2/183184/86bb7b929dfda5a53c85981a45942c8e-800x.jpg)









![Hg22+ + 2 Cl- ⇄ Hg2Cl2↓После ТЭHg22+ + 2 [Fe(SCN)]2+ ⇄ Hg2(SCN)2↓ + 2 Fe3+](/img/tmb/2/183184/5b0fe07e267b1010a74e6bf535c6747b-800x.jpg)