- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Молекулярная физика и термодинамика. Физические основы молекулярно-кинетической теории (МКТ) газов презентация
Содержание
- 1. Молекулярная физика и термодинамика. Физические основы молекулярно-кинетической теории (МКТ) газов
- 2. 1. Основные положения МКТ 1. Вещество
- 3. 2. Масса и размеры молекул Относительной
- 4. Оценим массу молекулы воды (m0)
- 5. 3. Состояние системы. Внутренняя энергия системы. Равновесным
- 6. 4. Основное уравнение МКТ Идеальный газ –
- 7. Число молекул, достигающих площадки ∆S: Молекула при
- 8. 5. Температура Температура – мера термодинамического равновесия
- 9. Из сравнения основного уравнения МКТ и уравнения Клайперона: - Постоянная Больцмана - кинетическая энергия
- 10. 6. Закон Авогадро. Закон Дальтона Закон Авогадро:
- 11. 7. Уравнение состояния идеального газа Соотношение, дающее
- 12. 2) Закон Гей-Люссака Изобарический процесс 3) Закон Шарля Изохорический процесс
- 13. Уравнение состояния идеального газа для случая, когда
- 14. 8. Средняя квадратичная скорость движения молекул -средняя
- 15. Распределение молекул по скоростям Экспериментальная проверка распределения
- 16. Распределение молекул по скоростям Закон Максвелла описывается
- 17. Относительное число молекул скорости которых лежат
- 18. Т.к. Найдем значение наиболее вероятной скорости
- 19. При повышении температуры площадь, ограниченная кривой, остаётся
- 20. Cреднее значение скорости Каждому интервалу
- 21. Средняя арифметическая скорость Средняя квадратичная скорость Наиболее вероятная скорость Скорости, характеризующие состояние газа:
- 22. 2. Экспериментальная проверка распределения Максвелла Немецкий физик
- 23. Молекулярный пучок ловушка Опыт Ламмерта (1929 г.)
- 24. 3. Барометрическая формула - давление на высоте
- 25. 4. Распределение Больцмана Заменив в барометрической формуле
- 26. 5. Опыты Перрена Перрен (1909 г.) –
- 27. 6. Средняя длина свободного пробега Между двумя
- 28. Явления переноса в термодинамически неравновесных системах
- 30. Согласно кинетической теории газов: - средняя длина
- 31. 2. Теплопроводность. Перенос энергии в форме
- 32. 3. Внутреннее трение (вязкость). Механизм возникновения внутреннего
- 33. Физические основы термодинамики Первое начало термодинамики. Работа
- 34. 1. Первое начало термодинамики Внутренняя энергия может
- 35. 2. Работа газа при изменении его объема
- 36. 3. Число степеней свободы молекулы Средняя энергия
- 37. y x z а) i=3 б) i=5
- 38. 4.Теплоемкость идеального газа Теплоемкостью тела называется величина,
- 39. Уравнение Майера молярная теплоемкость при постоянном давлении
- 40. 5. Адиабатический процесс Адиабатическим называется процесс, протекающий
- 41. интегрируем это уравнение Уравнение адиабаты. Уравнение Пуассона.
- 42. Политропическим называется такой процесс, при котором давление
- 43. 6. Работа, совершаемая идеальным газом при различных
- 44. Для изотермического процесса: n=1 Для адиабатического процесса:
- 45. Реальные газы Отклонение газов от идеальности Уравнение Ван-дер-Ваальса Экспериментальные изотермы
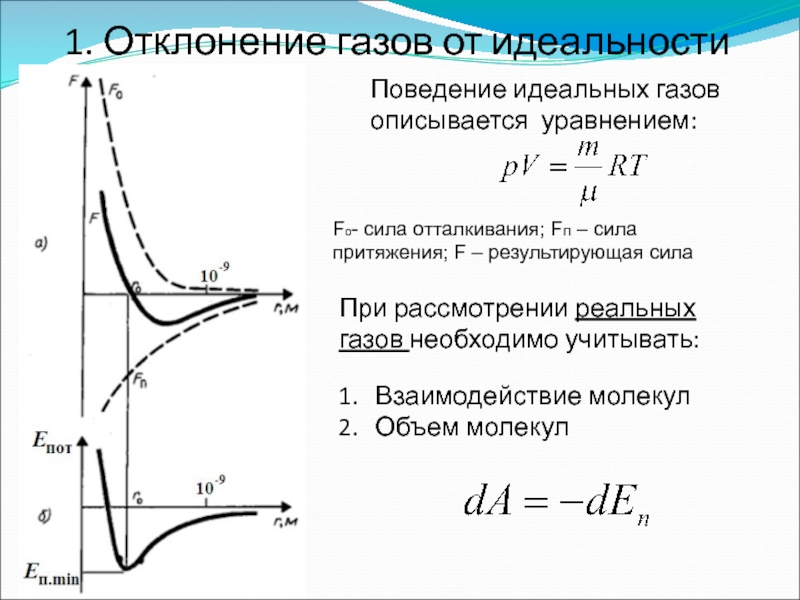
- 46. 1. Отклонение газов от идеальности Поведение идеальных
- 47. Критерием различных агрегатных состояний вещества является соотношение
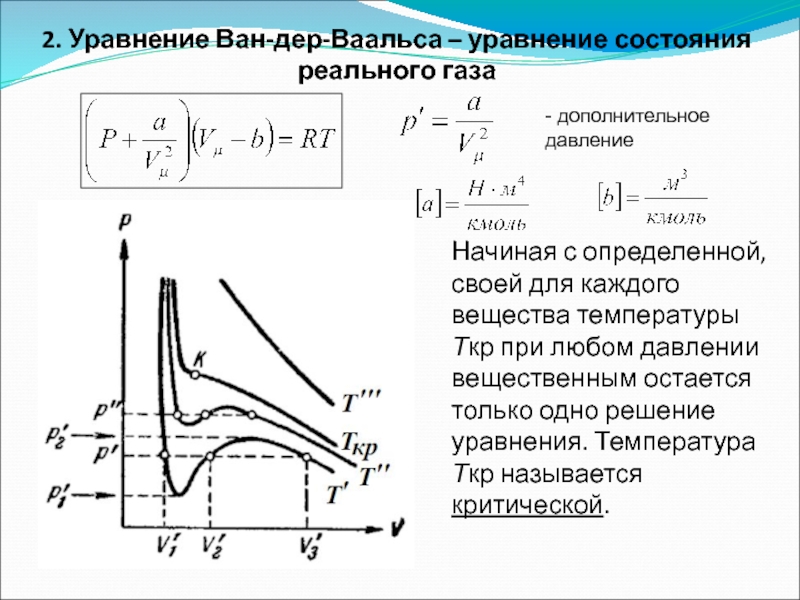
- 48. 2. Уравнение Ван-дер-Ваальса – уравнение состояния реального
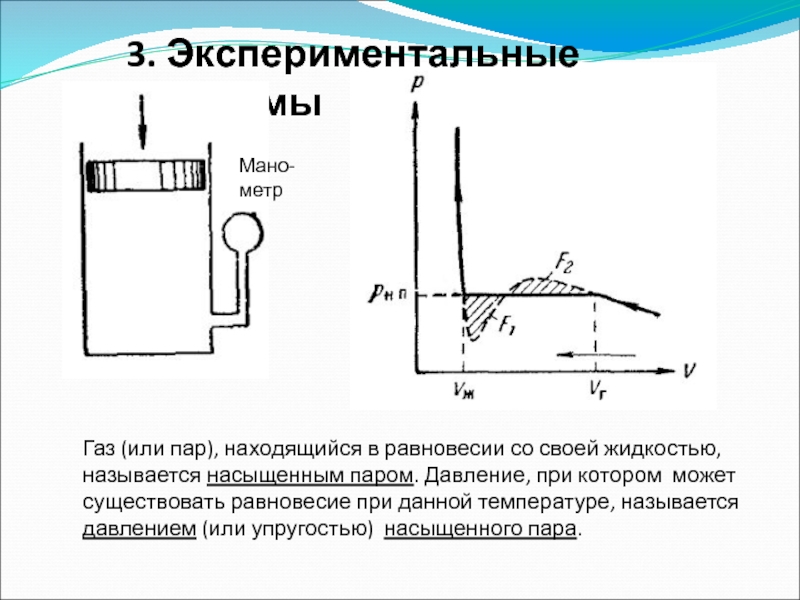
- 49. 3. Экспериментальные изотермы Мано-метр Газ (или пар),
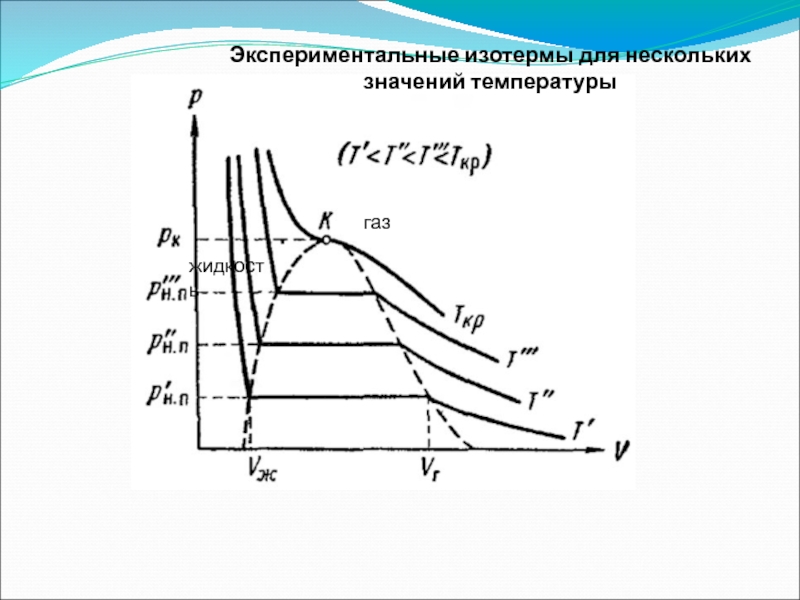
- 50. Экспериментальные изотермы для нескольких значений температуры газ жидкость
- 51. Внутренняя энергия реального газа Эффект Джоуля-Томсона Ожижение газов
- 52. 1. Внутренняя энергия реального газа Внутренняя энергия
- 53. 2. Эффект Джоуля-Томсона Пропуская газ по теплоизолированной
- 54. При адиабатическом расширении газа: U+pV
- 55. Расчет для моля газа Из уравнения Ван
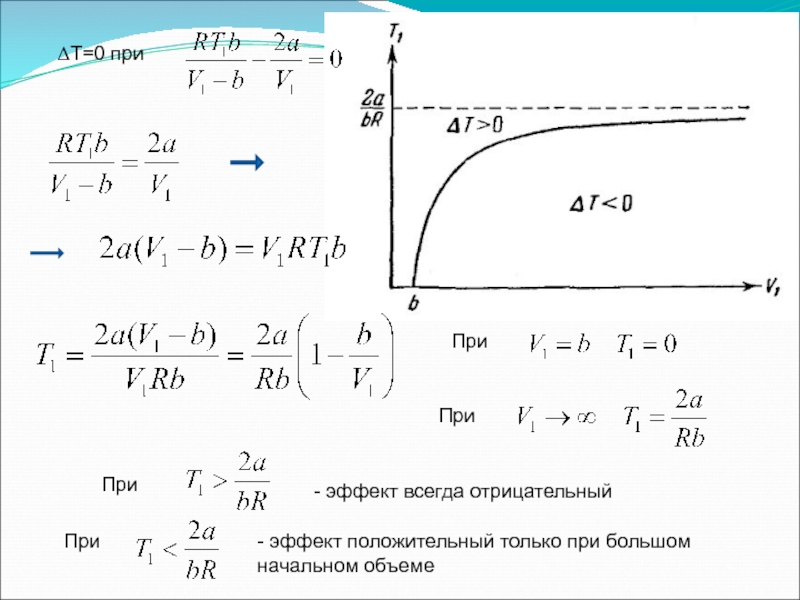
- 56. Преобразуем третье слагаемое: подставим Преобразуем: Знак ΔТ определяется знаком выражения в скобках
- 57. ΔТ=0 при При При
- 58. Знак ΔТ определяется знаком выражения в скобках
- 59. Обратимые и необратимые процессы. Коэффициент полезного действия
- 60. 1. Обратимые и необратимые процессы. Коэффициент полезного
- 61. 1) При расширении газ получает тепло 2)
Слайд 1Молекулярная физика и термодинамика
Физические основы молекулярно-кинетической теории (МКТ) газов
Основные положения МКТ
Масса и размеры молекул. Постоянная Авогадро
Состояние системы. Внутренняя энергия системы
Основное уравнение МКТ идеального газа
Понятие температуры
Закон Авогадро. Закон Дальтона
Уравнение состояния идеального газа
Средняя квадратичная скорость движения молекул
Слайд 21. Основные положения МКТ
1. Вещество имеет дискретную структуру, состоит из
2. Частицы находятся в непрерывном хаотическом движении.
3. Частицы взаимодействуют друг с другом. На дальних расстояниях преобладают силы притяжения, на близких – силы отталкивания.
Слайд 32. Масса и размеры молекул
Относительной молекулярной массой (μr) называется отношение
Моли различных веществ содержат одно и то же количество частиц, равное постоянной Авогадро NA = 6,02*1023 моль-1 .
Масса моля вещества носит название молярной массы (μ).
Слайд 53. Состояние системы. Внутренняя энергия системы.
Равновесным состоянием системы называется такое состояние,
Если в различных точках системы параметр имеет различное значение – тогда состояние системы называется неравновесным.
Процесс, состоящий из непрерывной последовательности равновесных состояний, называется равновесным.
Внутренняя энергия тела состоит из:
1) кинетической энергии хаотического движения молекул
2) потенциальной энергии взаимодействия между молекулами
3) внутримолекулярной энергии
Внутренняя энергия является функцией состояния системы.
Слайд 64. Основное уравнение МКТ
Идеальный газ – это достаточно разреженный газ, расстояния
будем полагать, что молекулы движутся только вдоль трех взаимно перпендикулярных направлений
все молекулы имеют одинаковую скорость
Слайд 7Число молекул, достигающих площадки ∆S:
Молекула при соударении со стенкой сообщает ей
Поскольку ударяется N молекул, то полный импульс будет равен:
- Основное уравнение МКТ
Средняя кинетическая энергия поступательного движения молекулы:
тогда
Слайд 85. Температура
Температура – мера термодинамического равновесия тел.
Температурная шкала Цельсия:
Температура – мера
- Универсальная газовая постоянная
- Уравнение Клайперона
Слайд 9Из сравнения основного уравнения МКТ и уравнения Клайперона:
- Постоянная Больцмана
- кинетическая
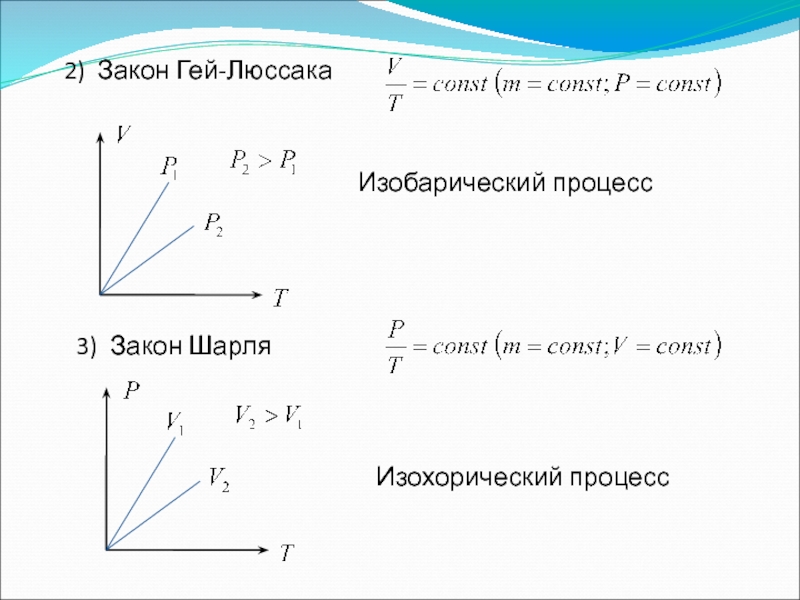
Слайд 106. Закон Авогадро. Закон Дальтона
Закон Авогадро: при одинаковых давлениях и температурах
Если имеется смесь нескольких газов:
- давление, которое было бы в сосуде, если бы в нем находились только молекулы i-го газа – парциальное давление.
Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений газов, образующих смесь.
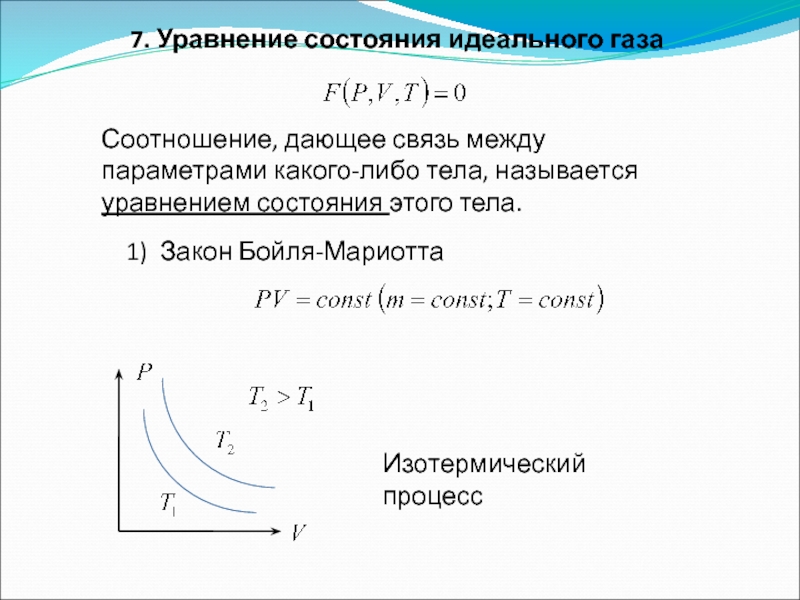
Слайд 117. Уравнение состояния идеального газа
Соотношение, дающее связь между параметрами какого-либо тела,
1) Закон Бойля-Мариотта
Изотермический процесс
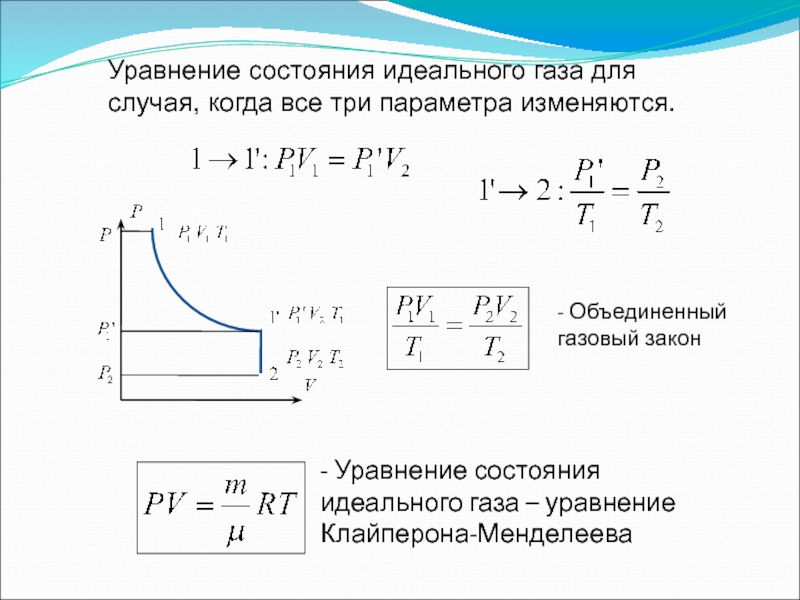
Слайд 13Уравнение состояния идеального газа для случая, когда все три параметра изменяются.
-
- Уравнение состояния идеального газа – уравнение Клайперона-Менделеева
Слайд 148. Средняя квадратичная скорость движения молекул
-средняя квадратичная скорость движения молекул
m –
Слайд 15Распределение молекул по скоростям
Экспериментальная проверка распределения Максвелла
Барометрическая формула
Распределение Больцмана
Опыты Перрена
Средняя длина
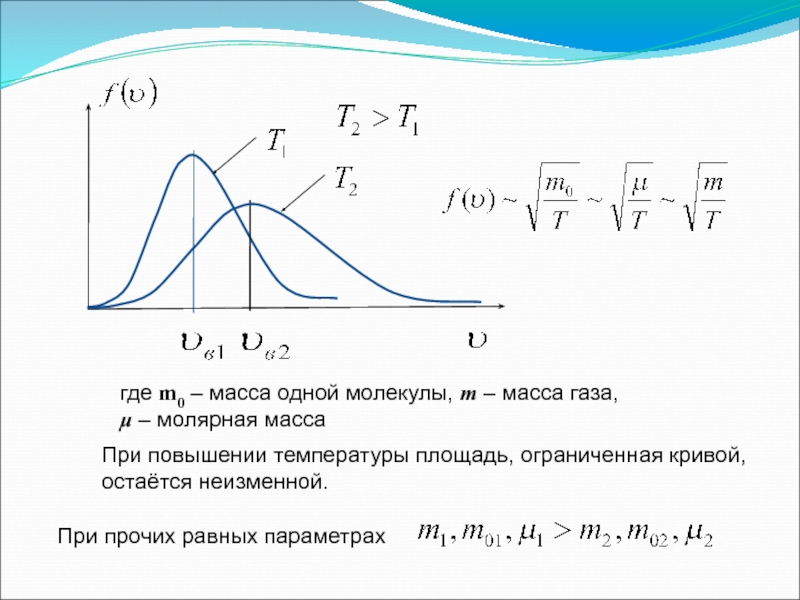
Слайд 16Распределение молекул по скоростям
Закон Максвелла описывается некоторой функцией f(υ), называемой функцией
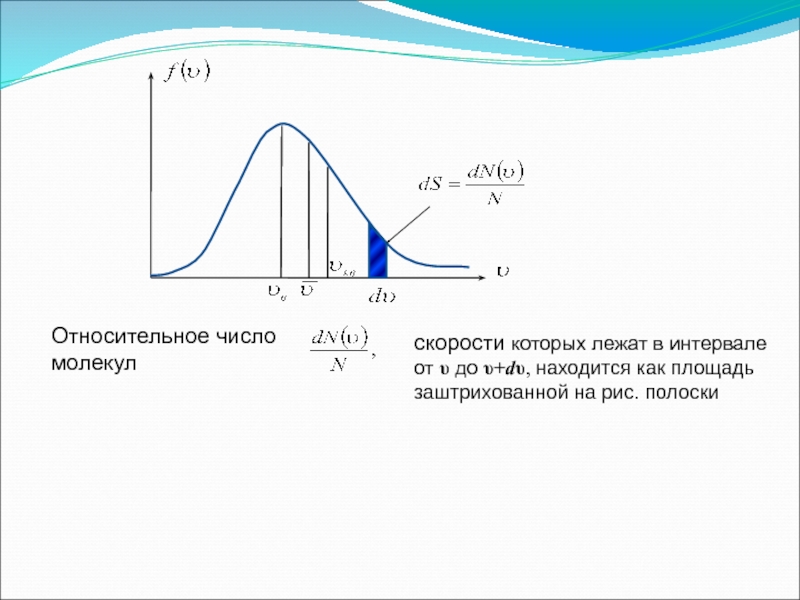
Функция f(υ) определяет относительное число молекул
скорости которых лежат в интервале от υ до υ+dυ, т.е.
где m0 – масса молекулы, k – постоянная Больцмана
-Закон распределения молекул идеального газа по скоростям (распределение Максвелла)
(1)
Слайд 17Относительное число молекул
скорости которых лежат в интервале от υ до
Слайд 18Т.к.
Найдем значение наиболее вероятной скорости υв , продифференцировав выражение (1) по
Слайд 19При повышении температуры площадь, ограниченная кривой, остаётся неизменной.
При прочих равных параметрах
где
μ – молярная масса
Слайд 20Cреднее значение скорости
Каждому интервалу соответствует
- сумма значений скоростей всех N молекул.
Средняя арифметическая скорость
Слайд 21Средняя арифметическая скорость
Средняя квадратичная скорость
Наиболее вероятная скорость
Скорости, характеризующие состояние газа:
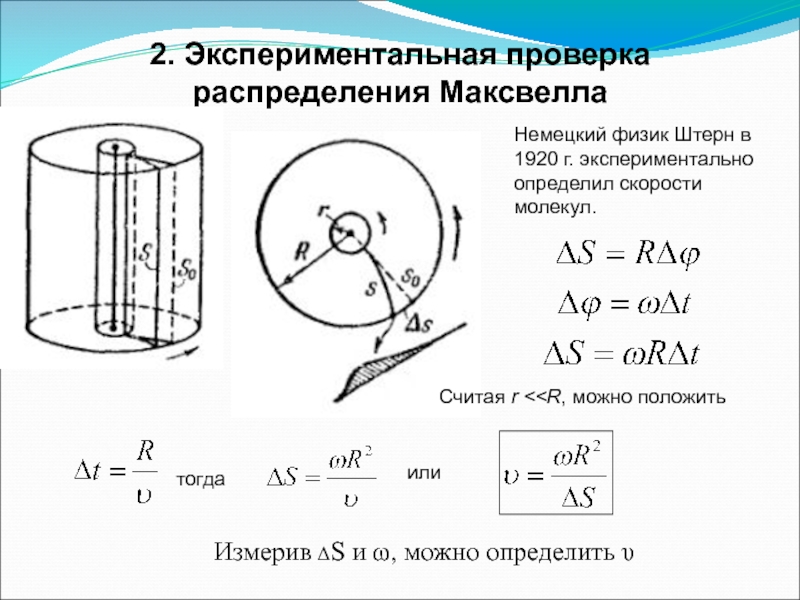
Слайд 222. Экспериментальная проверка распределения Максвелла
Немецкий физик Штерн в 1920 г. экспериментально
Считая r < тогда или Измерив ΔS и ω, можно определить υ
Слайд 23Молекулярный пучок
ловушка
Опыт Ламмерта (1929 г.)
t1 – время за которое молекулы пролетают
t1 должно совпадать со временем t2, за которое диски повернутся на угол φ
Слайд 243. Барометрическая формула
- давление на высоте h
- барометрическая формула
Предположения: 1) поле
2) температура постоянна;
3) масса всех молекул одинакова.
Слайд 254. Распределение Больцмана
Заменив в барометрической формуле
получим закон изменения числа молекул
Распределение Больцмана
Две тенденции распределения молекул по высоте: 1) притяжение молекул к Земле (чем больше m и меньше T); 2) тепловое движение стремится разбросать молекулы по высоте.
Слайд 265. Опыты Перрена
Перрен (1909 г.) – опыты по определению числа Авогадро.
Рассмотрим
Δh – толщина слоя.
Число частиц, попадающих в поле зрения микроскопа:
Распределение молекул по высоте
- вес броуновской частицы
Слайд 276. Средняя длина свободного пробега
Между двумя последовательными столкновениями молекулы проходят некоторый
Минимальное расстояние, на которое сближаются при столкновении центры двух молекул, называется эффективным диаметром молекул d.
- средняя скорость
- среднее число соударений за 1 с
Эффективное сечение молекул
Слайд 28Явления переноса в термодинамически неравновесных системах
Диффузия
Теплопроводность
Вязкость
К явлениям переноса относятся теплопроводность (обусловлена
Слайд 29
С макроскопической точки зрения перенос массы вещества подчиняется закону Фика: масса вещества ΔM, переносимая за время Δt через площадку ΔS, прямо пропорциональна градиенту плотности Δρ/Δx
D — коэффициент диффузии.
Знак минус показывает, что перенос массы происходит в направлении убывания плотности .
[D]=м2/с
1. Диффузия. Явление диффузии заключается в том, что происходит самопроизвольное проникновение и перемешивание частиц двух соприкасающихся газов, жидкостей и даже твердых тел; диффузия продолжается, пока существует градиент плотности.
Слайд 30Согласно кинетической теории газов:
- средняя длина свободного пробега
средняя скорость движения молекул,
d
n0 – концентрация молекул.
Слайд 312. Теплопроводность.
Перенос энергии в форме теплоты подчиняется закону Фурье:
Количество теплоты
χ — коэффициент теплопроводности
Знак минус показывает, что при теплопроводности энергия переносится в направлении убывания температуры
[q]= Дж/с
ρ - плотность газа, сV – удельная теплоемкость газа при постоянном объеме
Слайд 323. Внутреннее трение (вязкость). Механизм возникновения внутреннего трения между параллельными слоями
Сила внутреннего трения между двумя слоями газа (жидкости) подчиняется закону Ньютона:
где η — коэффициент вязкости, du/dz — градиент скорости, показывающий быстроту изменения скорости в направлении z, перпендикулярном направлению движения слоев, S — площадь, на которую действует сила f.
Коэффициент вязкости вычисляется по формуле:
Слайд 33Физические основы термодинамики
Первое начало термодинамики.
Работа газа при изменении его объема.
Число степеней
Теплоемкость идеального газа.
Адиабатический и политропический процессы.
Работа, совершаемая идеальным газом при различных процессах.
Слайд 341. Первое начало термодинамики
Внутренняя энергия может изменяться за счет двух различных
Совершения над телом работы А’
Сообщения телу количества теплоты Q путем теплопередачи
Изменение внутренней энергии
Первое начало термодинамики
Теплота, передаваемая системе, расходуется на увеличение ее внутренней энергии и на совершение системой работы против внешних сил.
Слайд 352. Работа газа при изменении его объема
Элементарная работа, совершаемая газом при
Элементарная работа
Полная работа А, совершаемая газом при изменении его объема от V1 до V2 находится путем интегрирования
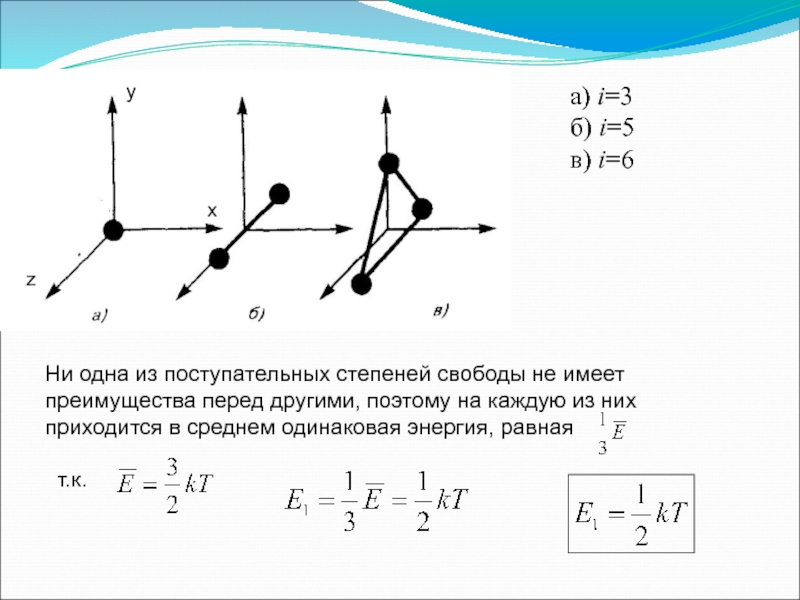
Слайд 363. Число степеней свободы молекулы
Средняя энергия поступательного движения молекулы:
Числом степеней свободы
Средняя кинетическая энергия молекулы:
Внутренняя энергия 1 моля идеального газа:
Внутренняя энергия произвольной массы газа:
Слайд 37y
x
z
а) i=3
б) i=5
в) i=6
Ни одна из поступательных степеней свободы не имеет
т.к.
Слайд 384.Теплоемкость идеального газа
Теплоемкостью тела называется величина, равная количеству тепла, которое нужно
Удельной теплоемкостью вещества называется величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 градус.
молярная теплоемкость вещества (теплоемкость одного моля)
молярная теплоемкость при постоянном объеме
Слайд 39Уравнение Майера
молярная теплоемкость при постоянном давлении
показатель адиабаты
При нагревании газа при постоянном
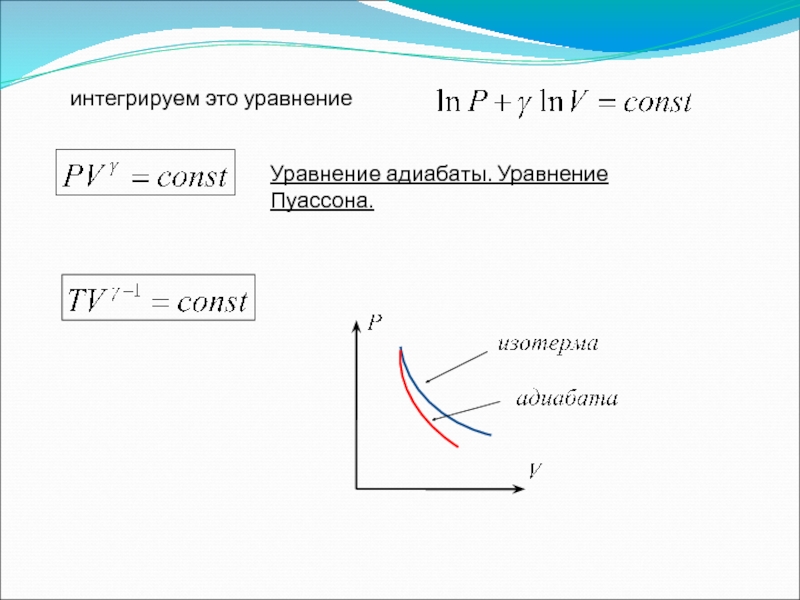
Слайд 405. Адиабатический процесс
Адиабатическим называется процесс, протекающий без теплообмена с внешней средой.
(1)
Подставляем
Слайд 42Политропическим называется такой процесс, при котором давление и объем идеального газа
Изобарический процесс
Изотермический процесс
Адиабатический процесс
Изохорический процесс
Слайд 436. Работа, совершаемая идеальным газом при различных процессах
Рассмотрим случай
Работа, совершаемая
Слайд 44Для изотермического процесса: n=1
Для адиабатического процесса:
Работа, совершаемая газом при изотермическом процессе
При
При изохорическом процессе:
Слайд 45Реальные газы
Отклонение газов от идеальности
Уравнение Ван-дер-Ваальса
Экспериментальные изотермы
Слайд 461. Отклонение газов от идеальности
Поведение идеальных газов описывается уравнением:
При рассмотрении реальных
Взаимодействие молекул
Объем молекул
Fо- сила отталкивания; Fп – сила притяжения; F – результирующая сила
Слайд 47Критерием различных агрегатных состояний вещества является соотношение величин En.min и kT
En.min
kT – определяет порядок средней кинетической энергии хаотического теплового движения молекул.
Если En.min << kT , то вещество находится в газообразном состоянии
Если En.min >> kT , то вещество находится в твердом состоянии
Если En.min ≈ kT , то вещество находится в жидком состоянии
Слайд 482. Уравнение Ван-дер-Ваальса – уравнение состояния реального газа
Начиная с определенной, своей
- дополнительное давление
Слайд 493. Экспериментальные изотермы
Мано-метр
Газ (или пар), находящийся в равновесии со своей жидкостью,
Слайд 521. Внутренняя энергия реального газа
Внутренняя энергия реального газа
- кинетическая энергия
- взаимная потенциальная энергия молекул
Кинетическая энергия молекул, содержащихся в моле газа равна:
Интегрируем:
- Внутренняя энергия реального газа
Работа против внутренних сил идет на увеличение потенциальной энергии системы
- внутреннее давление
Слайд 532. Эффект Джоуля-Томсона
Пропуская газ по теплоизолированной трубке с пористой перегородкой, Джоуль
Слайд 54При адиабатическом расширении газа:
U+pV - энтальпия – величина, которая
Работа совершаемая над порцией газа :
Слайд 55Расчет для моля газа
Из уравнения Ван дер Ваальса для газа до
Внутренняя энергия до расширения:
Подставив в (*) , получим:
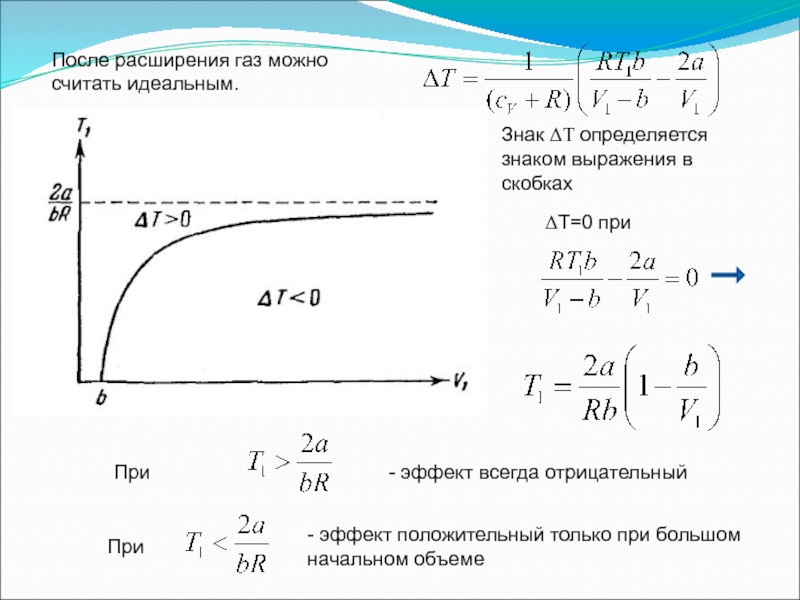
После расширения газ можно считать идеальным.
Слайд 56Преобразуем третье слагаемое:
подставим
Преобразуем:
Знак ΔТ определяется знаком выражения в скобках
Слайд 57ΔТ=0 при
При
При
При
- эффект всегда отрицательный
При
- эффект положительный
Слайд 58Знак ΔТ определяется знаком выражения в скобках
ΔТ=0 при
При
- эффект всегда
При
- эффект положительный только при большом начальном объеме
После расширения газ можно считать идеальным.
Слайд 59Обратимые и необратимые процессы. Коэффициент полезного действия тепловой машины.
Второе начало термодинамики.
Цикл
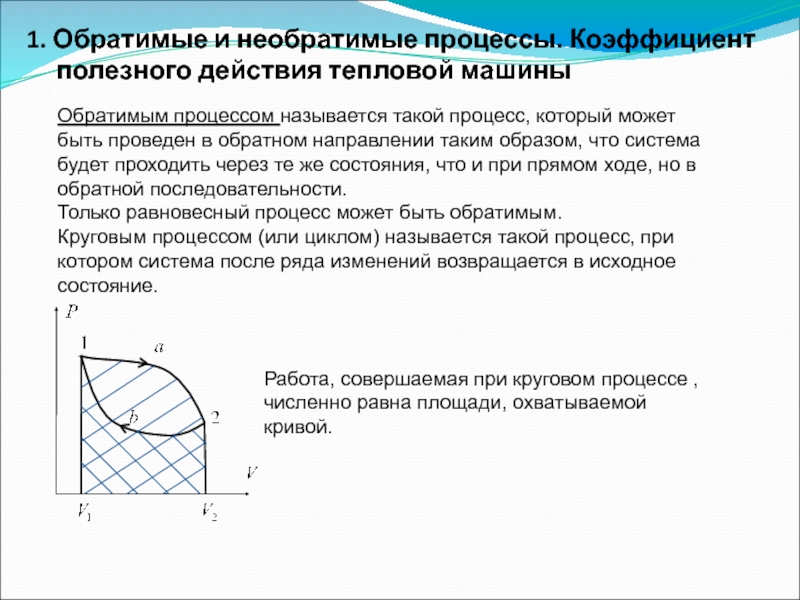
Слайд 601. Обратимые и необратимые процессы. Коэффициент полезного действия тепловой машины
Обратимым процессом
Только равновесный процесс может быть обратимым.
Круговым процессом (или циклом) называется такой процесс, при котором система после ряда изменений возвращается в исходное состояние.
Работа, совершаемая при круговом процессе , численно равна площади, охватываемой кривой.
Слайд 611) При расширении газ получает тепло
2) При сжатии от него отнимается
Складываем эти уравнения:
- полная работа, совершаемая за цикл
Тепловой машиной называется периодически действующий двигатель, совершающий работу за счет получаемого извне тепла.
I начало термодинамики: невозможен вечный двигатель первого рода, т.е. периодически действующий двигатель, совершающий работу в большем количестве, чем получаемая им извне энергия.
КПД определяется как отношение совершаемой за цикл работы к получаемому за цикл теплу