- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Лекция 42. Атомная физика презентация
Содержание
- 1. Лекция 42. Атомная физика
- 2.
- 3. Пусть частица ограничена тремя парами стенок во
- 4.
- 5.
- 6.
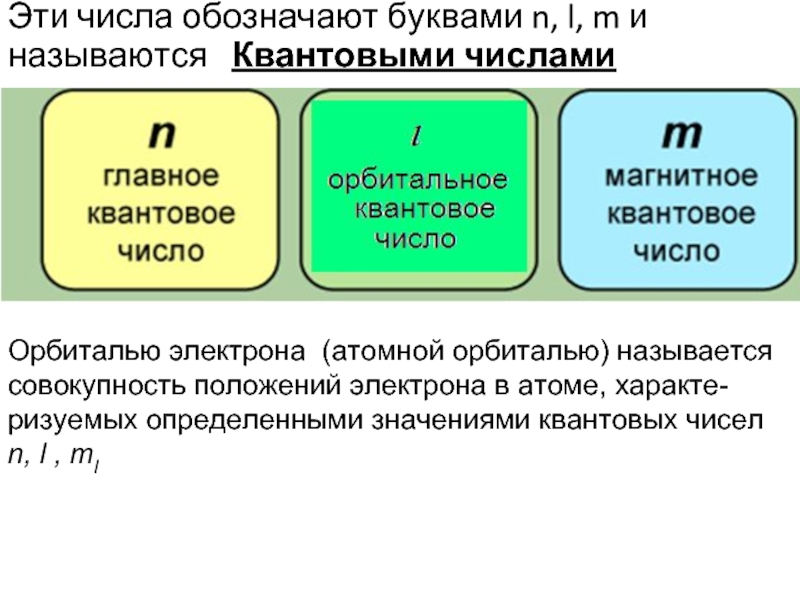
- 7. Эти числа обозначают буквами n, l, m
- 8. На рисунке показан график зависимости квадрата
- 9.
- 10. Орбитальное квантовое число (l) может
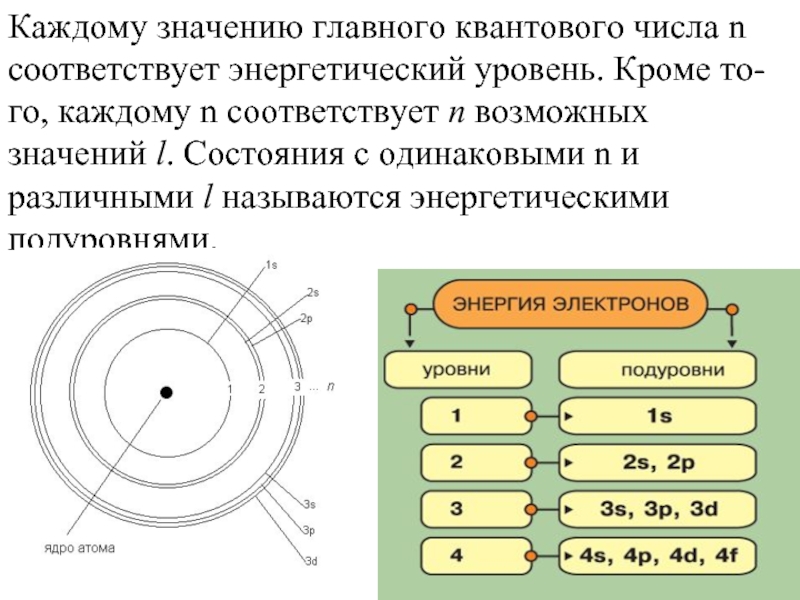
- 11. Каждому значению главного квантового числа n соответствует
- 12. Магнитное квантовое число (mℓ)
- 13. Для каждого значения l разрешено (2l +
- 14. Излучение и поглощение света атомами. Электрон,
- 15. Если фотон испускается в результате перехода между
- 16.
- 17. Стрелками показаны переходы атома водорода между различными
- 18. Переходы, показа-ны двунаправлен-ными стрелками: Сверху вниз – излу-чение, снизу верх – поглощение света.
- 19.
- 20. Пятиминутка: Рассчитать длины волн в спектре излучения
- 21. Фундаментальные природные закономерности: законы сохранения энергии, импульса,
- 22. Аналогичный сюрприз можно ожидать от враща-тельного движения
- 23. Значение спинового числа (s) определяется свойствами симметрии
- 24. С учетом спинового числа состояние электрона в
- 25. При́нцип Па́ули (принцип запрета) - один из фундаментальных принципов
- 26. Рассмотрим строение атомов, опираясь на таблицу Менделеева.
- 27. Первый период - n = 1. Имеет
- 29. Z=3 (литий). Третий электрон лития должен нахо-диться
- 30. n=1 n=2
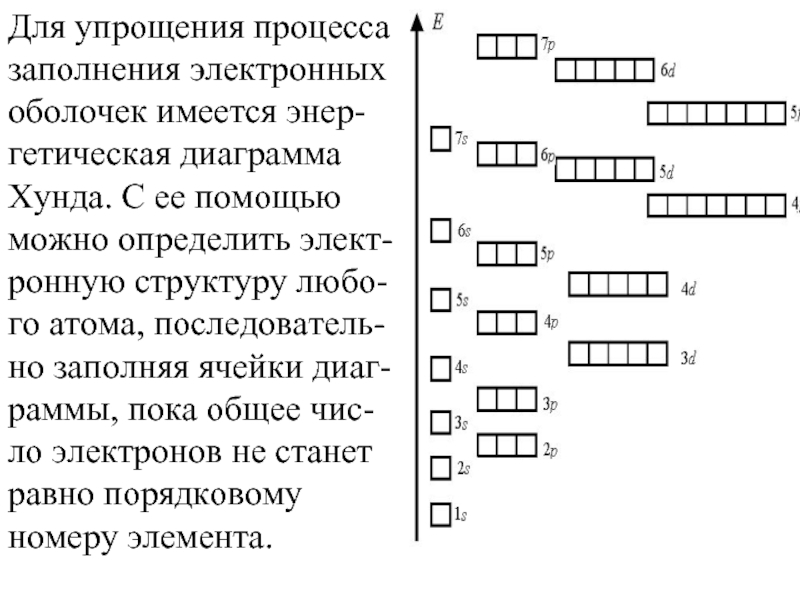
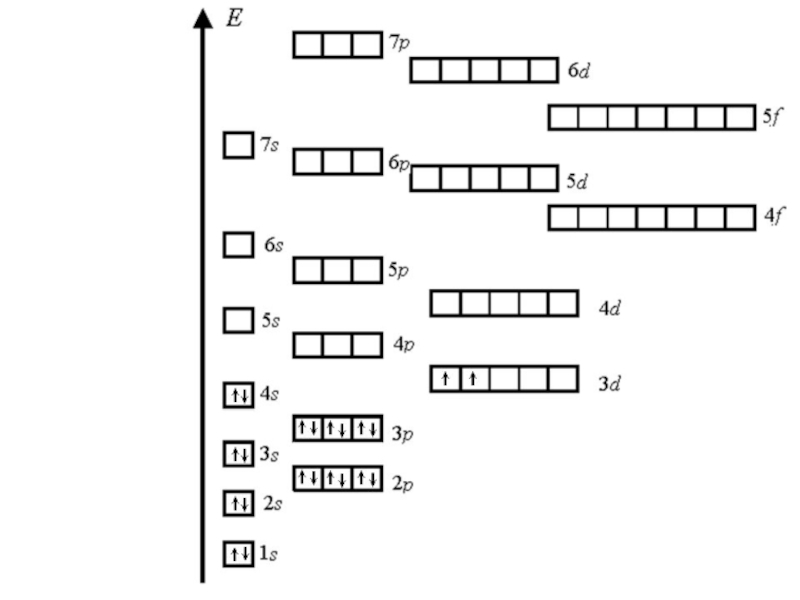
- 31. Для упрощения процесса заполнения электронных оболочек имеется
- 32. Спин электрона в атоме подчиняется правилу Хун-да:
- 34. Электронная структура атома Титана (Ti). Порядковый номер
- 35. I. Обозначения электронных оболочек - Энергетический
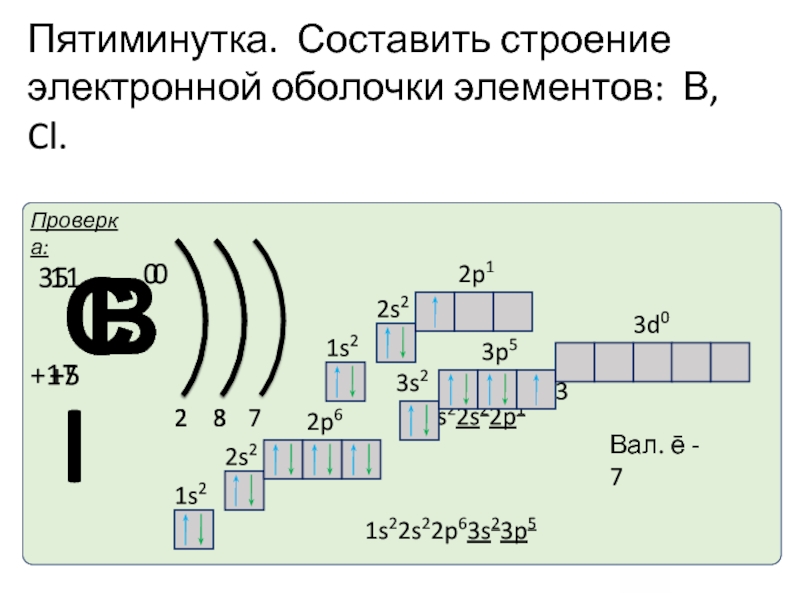
- 36. Пятиминутка. Составить строение электронной оболочки элементов: В, Cl.
Слайд 3Пусть частица ограничена тремя парами стенок во взаимно перпендикулярных направлениях, т.е.
Как и в классическом случае, движение
частицы можно разложить на три незави-
симых движения вдоль координатных осей.
Такое разложение справедливо потому что
при отражении частицы от стенки изменяется только одна проекция скорости, две другие остаются неизменными. Независимость движений вдоль координатных осей означает возможность представить волновую функцию в виде трех независимых компонент, каждая из которых зависит от одной координаты.
Слайд 7Эти числа обозначают буквами n, l, m и называются Квантовыми
Орбиталью электрона (атомной орбиталью) называется совокупность положений электрона в атоме, характе-ризуемых определенными значениями квантовых чисел n, l , ml
Слайд 8
На рисунке показан график зависимости квадрата модуля радиальной компоненты волновой функции
Слайд 10
Орбитальное квантовое число (l) может прини-мать целочисленные значения, меньшие главного квантового
Величина l опреде-ляет форму орбита-ли электрона.
Слайд 11Каждому значению главного квантового числа n соответствует энергетический уровень. Кроме то-го,
Слайд 12Магнитное квантовое число (mℓ)
характеризует пространственную ориентацию атомной орбитали одного подуровня по осям Х, У, Z или число неповторяющихся направлений движения электрона принимает значения: целых чисел от –l до +l , включая 0.
mℓ=1
mℓ=3
mℓ=5
mℓ=7
s
p
d
f -орбиталь
+1
0
-1
Слайд 13Для каждого значения l разрешено (2l + 1) значений m.
Например, l=4
-4, -3, -2, -1, 0, 1, 2, 3, 4
Получаем 9 возможных ориентаций орбитали f.
Все орбитали одного подуровня l при отсутствии внешнего магнитного поля обладают одинаковой энергией, но по разному ориентированы относительно друг друга
Слайд 14 Излучение и поглощение света атомами. Электрон, находящийся на энергетическом уровне
Слайд 15Если фотон испускается в результате перехода между уровнями с энергиями Еn1>
hν= Еn1- Еn2 (42.6)
Это соотношение определяет частоту колебаний или длину волны фотона.
Исследуя спектры излучения атомов, т.е. измеряя длины волн испускаемого света удается опреде-лить энергии их энергетических уровней.
Слайд 17Стрелками показаны переходы атома водорода между различными энергетическими уровнями и соответствующие
Слайд 18Переходы, показа-ны двунаправлен-ными стрелками: Сверху вниз – излу-чение, снизу верх –
Слайд 20Пятиминутка: Рассчитать длины волн в спектре излучения атома водорода, соответствующих переходам
Слайд 21Фундаментальные природные закономерности: законы сохранения энергии, импульса, момента импульса являются выражением
Ограничение субнаночастицы в пространстве, как мы видели, приводит к сюрпризу: квантовонности ее импульса (импульс изменяется только скачками и не может быть нулевым).
Слайд 22Аналогичный сюрприз можно ожидать от враща-тельного движения частицы. Ее момент импульса
L=ħs,
где коэффициент s –спиновое число частицы.
Проявление спина электрона было обнаружено в опыте экспериментально.
Слайд 23Значение спинового числа (s) определяется свойствами симметрии частицы. Если она абсолютно
Если для самосовмещения частицы ее достаточно повернуть на 180о (например, заточенный с двух сторон карандаш), то спиновое число равно 2. Если для самосовмещения требуется поворот на 360о (заточенный с одной стороны карандаш), то s=1. Такие частицы названы бозонами. Фотон–бозон.
Можно представить ситуацию в которой для самосовмещение необходим поворот на 720о. В этом случае s=1/2. Такие частицы называют фермионами. Электрон - фермион.
Слайд 24С учетом спинового числа состояние электрона в атоме характеризуется 4 квантовыми
n – натуральное число: 1, 2, 3…;
l=0, 1, ..n-1;
m=±l, ±(l-1), …0. Возможное состояние электрона называется орбиталью (по аналогии с орбитой планеты, можно условно считать, что строение атома аналогично строению планетной системы).
Для понимания строений атомов определяющее значение имеет т.н. принцип Паули.
Слайд 25При́нцип Па́ули (принцип запрета) - один из фундаментальных принципов законов природы. Два и
Если речь идет об атоме, то в нем не могут быть два или более электрона с одинаковой четверкой квантовых чисел. Поскольку электроны занимают орбитали с наименьшими энергиями, можно определить электронное строение любого атома в невозбужденном состоянии.
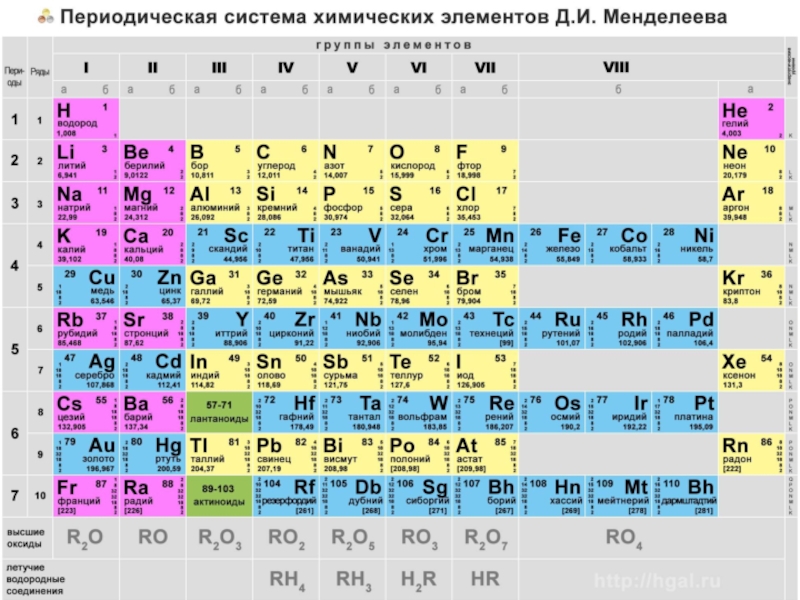
Слайд 26Рассмотрим строение атомов, опираясь на таблицу Менделеева. Из нее видно, что
Слайд 27Первый период - n = 1. Имеет единственную орбиталь l=0, m=0,
Второй период наряду с орбиталью n=1 имеет орбитали с n=2. Состоянию с n = 2 отвечают 4 орбитали: (n,l,m) = (2, 0, 0), (2, 1,1), (2, 1,0) или (2, 1, —1). Таким образом, в состоянии с n = 2 могут находиться 8 электронов.
Третий период соответствует главным квантовым числам 1, 2, 3. Количество возможных орбиталей для n=3 составляет 1+3+5=9, а возможное число электронов на них – 18, что соответствует 18 элементам.
Слайд 28
Можно сформулировать общие правила заполнения, эле-ктронных оболочек атомов которым следует
n=1
n=2
n=1
n=2
n=1
n=2
n=1
n=2
n=1
n=2
n=1
n=2
n=1
n=2
n=1
n=2
Слайд 29Z=3 (литий). Третий электрон лития должен нахо-диться на уровне n=2. Для
Слайд 30
n=1
n=2
n=3
1
n=1
n=2
n=3
2
n=1
n=2
n=3
3
n=1
n=2
n=3
4
n=1
n=2
n=3
5
n=1
n=2
n=3
6
n=1
n=2
n=3
7
n=1
n=2
n=3
8
Поскольку электронные волны, при n = 2, располо-жены очень близко к ядру (в данном случае Z, дос-тигает 10), то энергия ионизации оказывается весьма высокой (21,6 В). Эта величина недоступна для химических реакций. Неон – инертный газ.
Третий период:
Слайд 31Для упрощения процесса заполнения электронных оболочек имеется энер-гетическая диаграмма Хунда. С
Слайд 32Спин электрона в атоме подчиняется правилу Хун-да: Суммарное значение спинового квантового числа
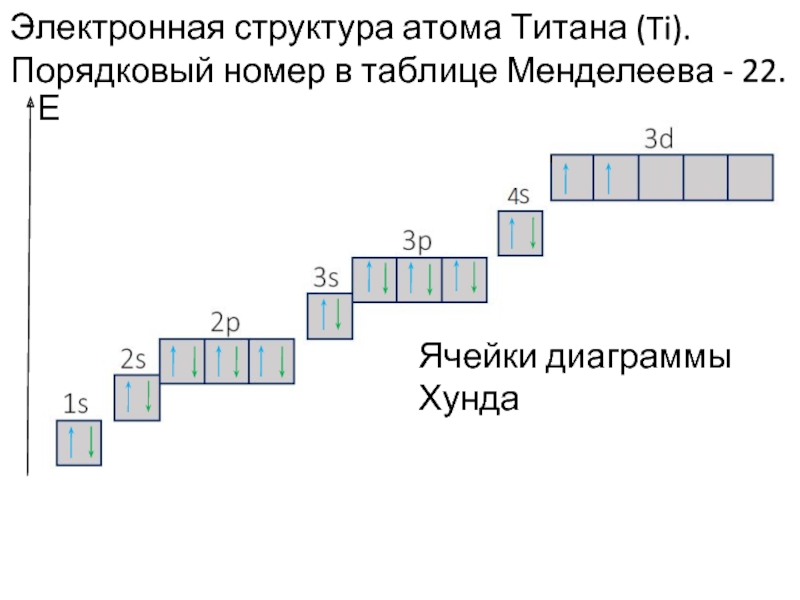
Слайд 34Электронная структура атома Титана (Ti). Порядковый номер в таблице Менделеева -
Е
Ячейки диаграммы Хунда
Слайд 35I. Обозначения электронных оболочек
- Энергетический уровень определяется главным квантовым числом n.
-
1s
2s
3s
2р
3р
3d