- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Квантовомеханическая модель атома водорода презентация
Содержание
- 1. Квантовомеханическая модель атома водорода
- 2. Лекция 7. Квантовомеханическая модель атома водорода
- 3. 7.1. Квантование энергии. Главное квантовое число
- 4. U r E1 E2 E3
- 5. Уравнение Шредингера для стационарных состояний имеет вид:
- 6. r x у z Сферическая система координат
- 7. Уравнение Шредингера в сферических координатах имеет сложный
- 8. При решении уравнения Шредингера в сферических координатах
- 9. Уравнение Шредингера имеет требуемые однозначные конечные и
- 10. Случай Е = 0 соответствует отрыву электрона
- 11. Однако в квантовой механике данные значения энергии
- 12. Главное квантовое число: - принимает целочисленные
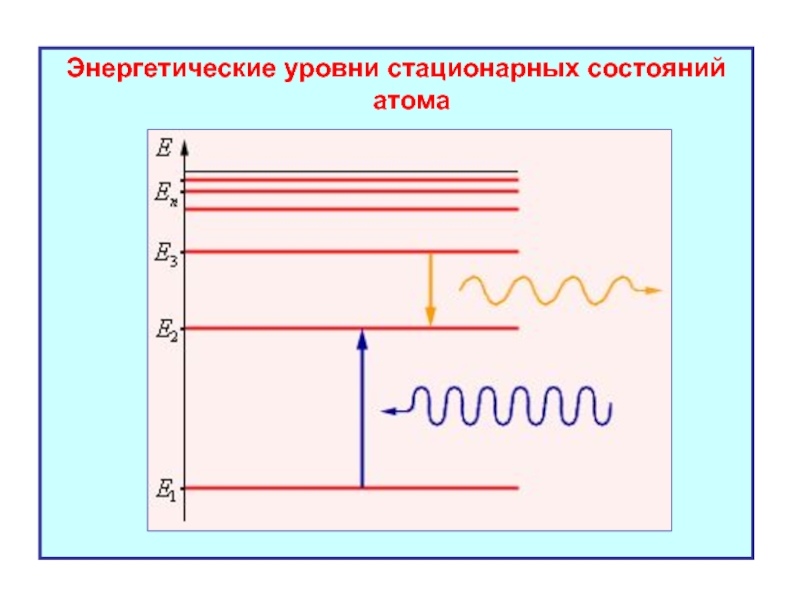
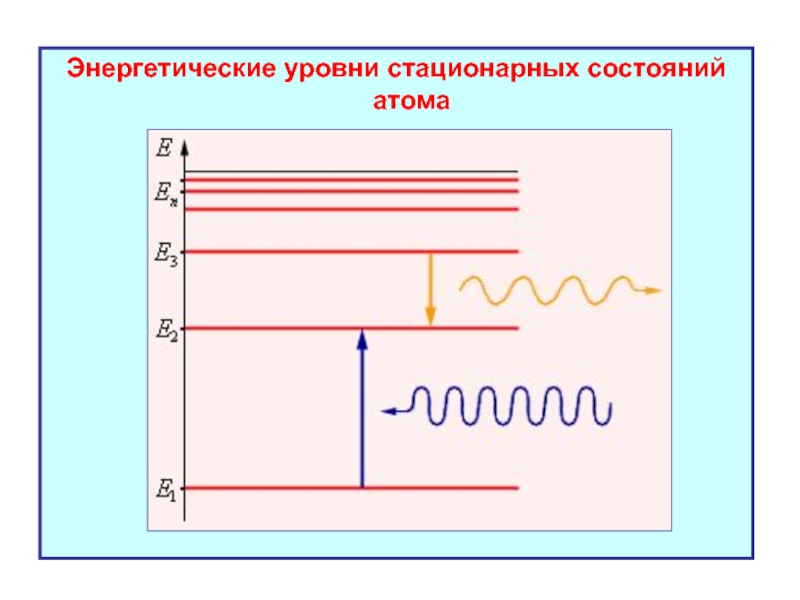
- 13. Энергетические уровни стационарных состояний атома
- 14. 7.2. Распределение электронного заряда в атоме.
- 15. Радиальная часть волновой функции:
- 16. Эта вероятность различна в разных частях объёма
- 17. Для стационарных состояний атома волновые функции также
- 18. Радиальная часть волновой функции (форма орбитали) зависят
- 19. При условии n = 1, 2, 3…
- 20. Сферическая форма электронного облака n = 1,
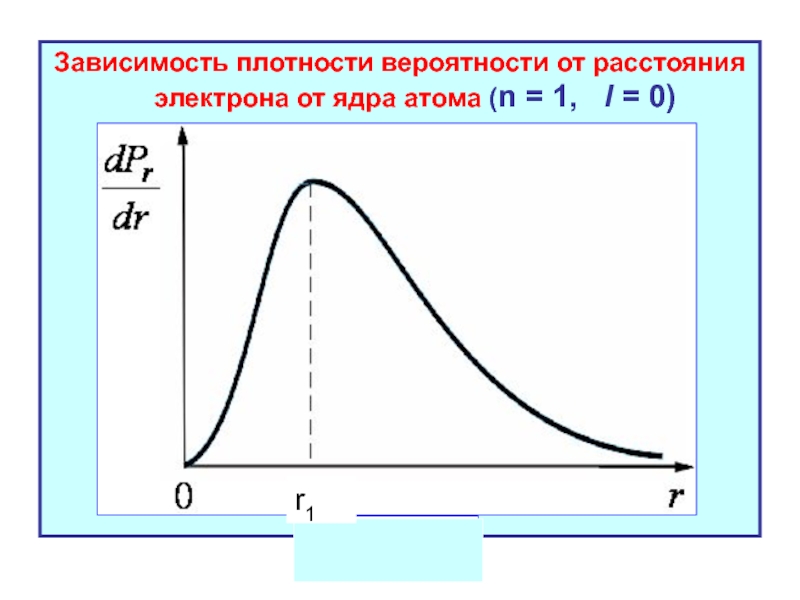
- 21. Зависимость плотности вероятности от расстояния электрона от
- 22. В состоянии с квантовыми числами n
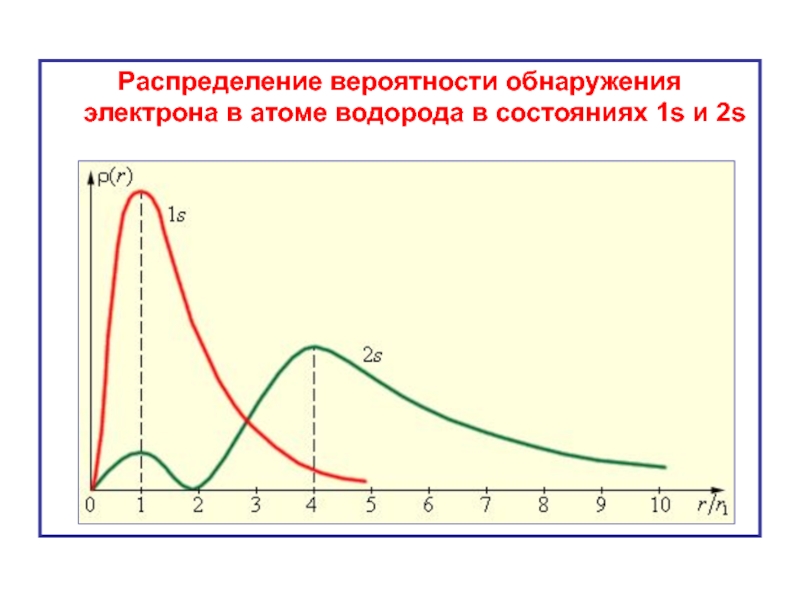
- 23. Распределение вероятности обнаружения электрона в атоме водорода в состояниях 1s и 2s
- 24. Для р -, d -, f -
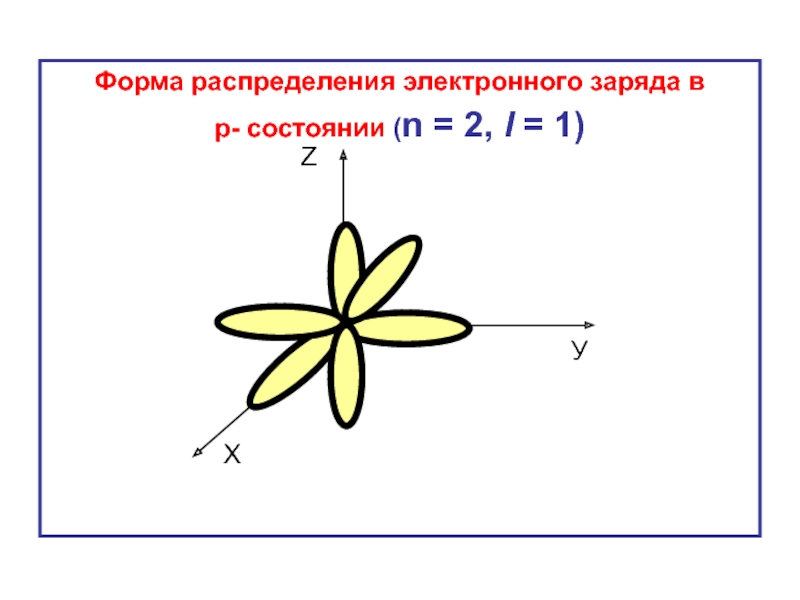
- 25. Форма распределения электронного заряда в р-
- 26. За радиус атома принято считать расстояние r,
- 27. Таким образом, волновой характер движения электрона приводит
- 28. Схема энергетических уровней атома водорода с
- 29. 7.3. Квантование орбитального момента импульса. Согласно первому
- 30. При больших значениях n (l ~n )
- 31. Единицей квантования орбитального механического момента импульса L
- 32. 7.4. Пространственное квантование. Магнитное квантовое число
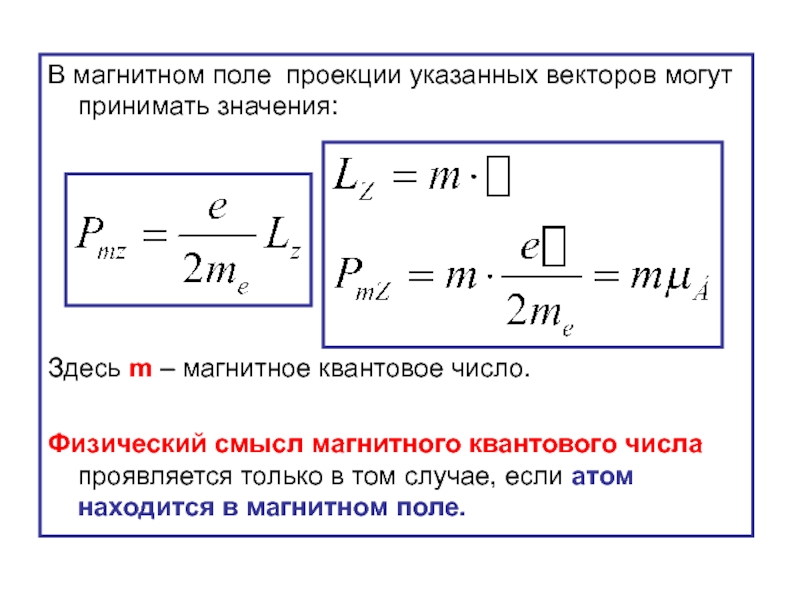
- 33. В магнитном поле проекции указанных векторов могут
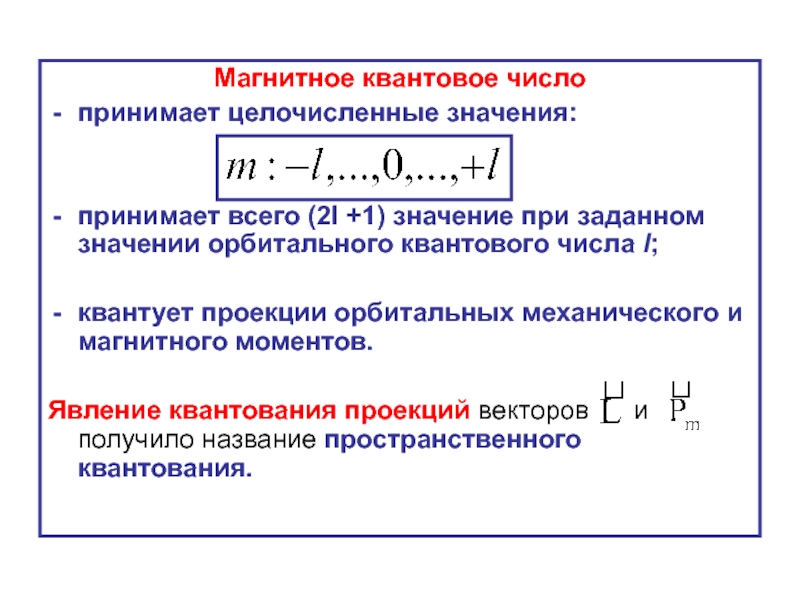
- 34. Магнитное квантовое число принимает целочисленные значения:
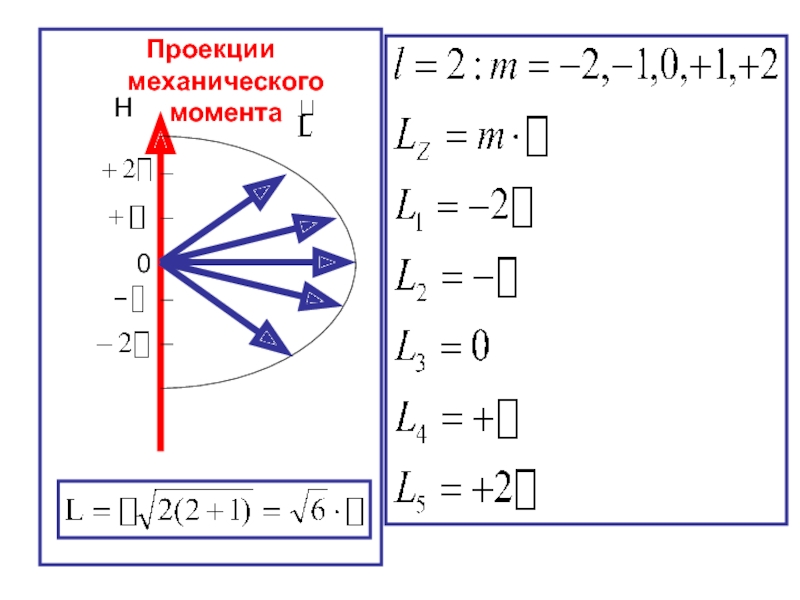
- 36. Проекции механического момента 0
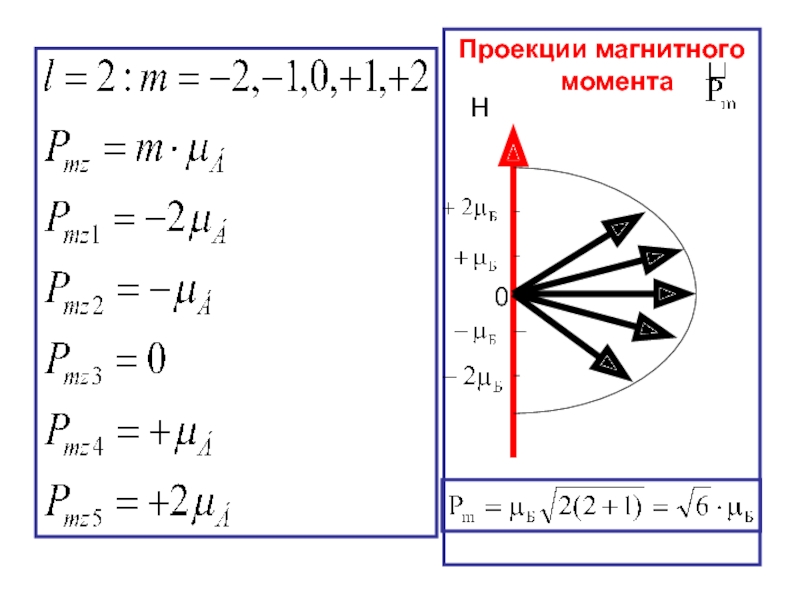
- 37. Проекции магнитного момента
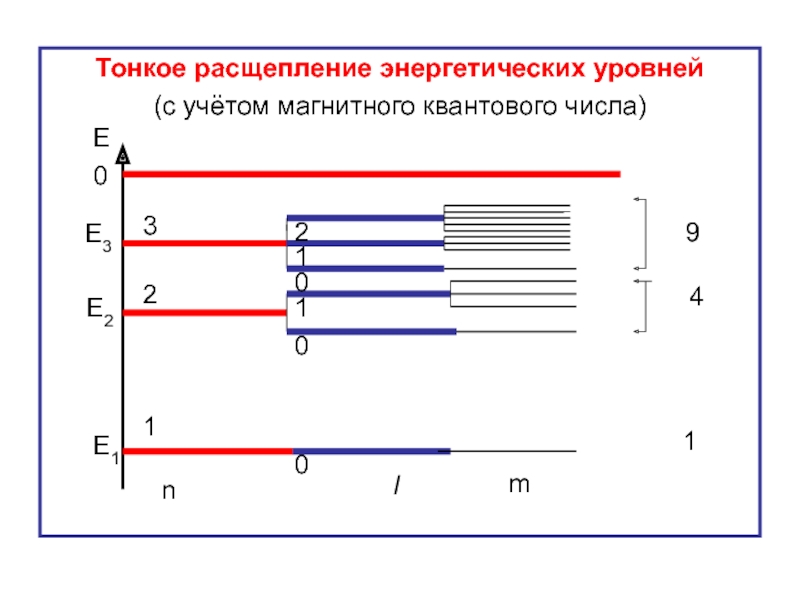
- 38. Тонкое расщепление энергетических уровней (с учётом магнитного
- 39. 7.5. Квантование собственного момента импульса. Спиновое
- 40. По современным представлениям всем элементарным частицам природы
- 41. Спин: собственный момент импульса частицы; -
- 42. К фермионам относятся микрочастицы с полуцелым спином:
- 43. Для электрона: Собственный механический
- 44. Собственные магнитный и механический моменты электрона связаны
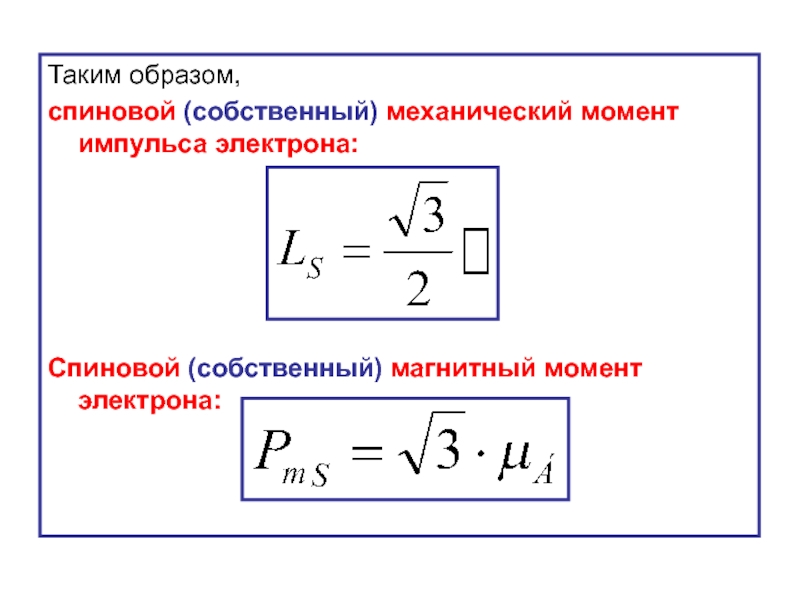
- 45. Таким образом, спиновой (собственный) механический момент импульса
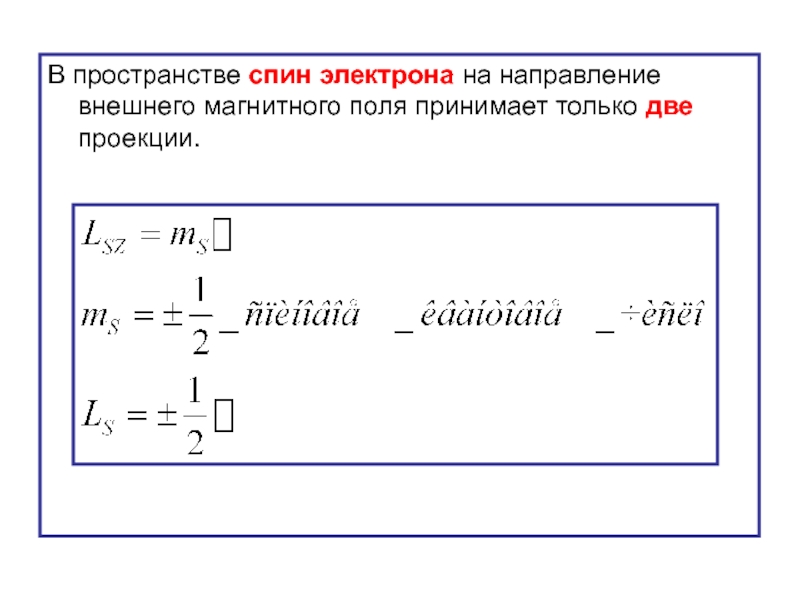
- 46. В пространстве спин электрона на направление внешнего
- 47. В пространстве спиновой магнитный момент электрона на
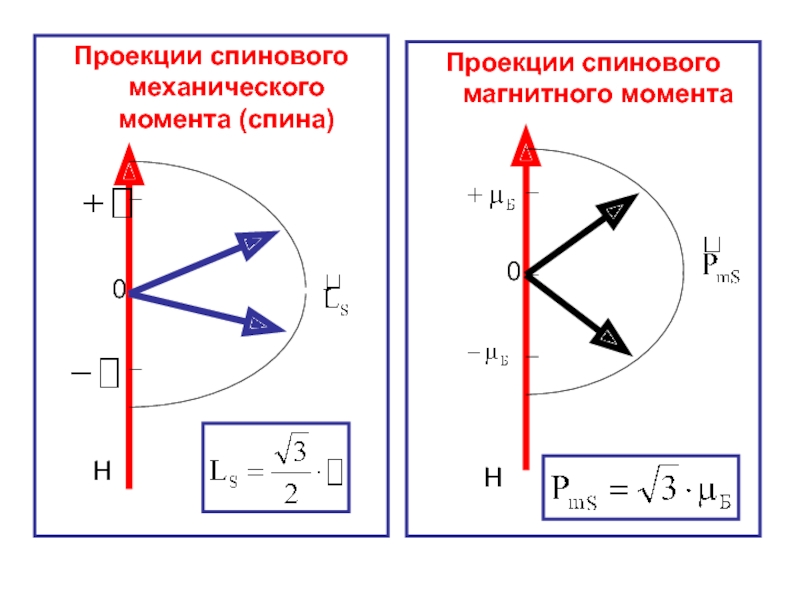
- 48. Н Проекции спинового механического момента
- 49. Сверхтонкое расщепление энергетических уровней (с учётом спинового
- 50. Число возможных энергетических состояний атома ( с
- 51. 7.6. Энергетический спектр атома водорода Значения полной
- 52. Главное квантовое число определяет энергию стационарных состояний:
- 53. Энергетические уровни стационарных состояний атома
- 54. Расщепление уровней по орбитальному квантовому числу
- 55. Расщепление энергетических уровней по магнитному квантовому числу
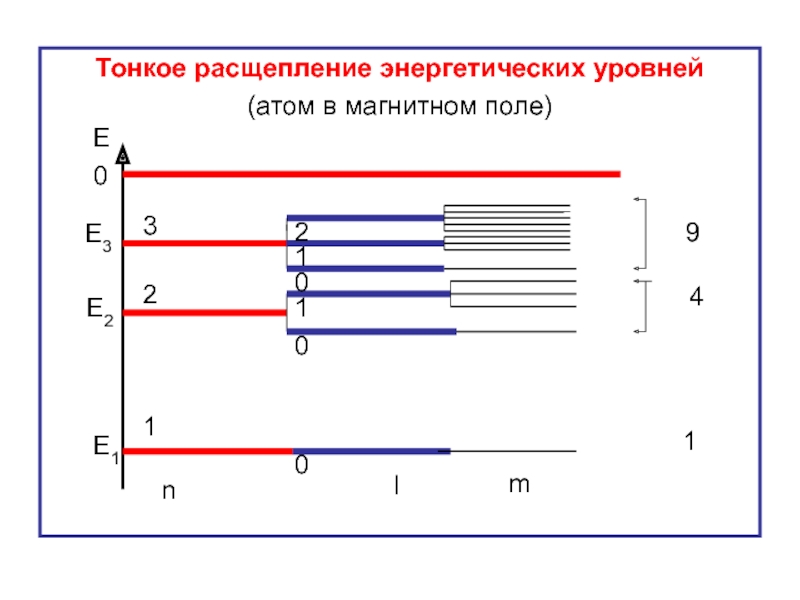
- 56. Тонкое расщепление энергетических уровней (атом в магнитном
- 57. С учётом трёх квантовых чисел уровень с
- 58. Кратность тонкого вырождения уровней: первого: n =
- 59. Сверхтонким называется расщепление энергетических уровней по спиновому
- 60. Сверхтонкое расщепление энергетических уровней (с учётом спинового
- 61. С учётом всех четырёх квантовых чисел число
- 62. Чтобы перевести атом из основного состояния в
Слайд 1Омский государственный технический университет
Кафедра физики
Калистратова Л.Ф.
Электронные лекции по разделам оптики,
9 лекций
(18 аудиторных часов)
Слайд 2Лекция 7.
Квантовомеханическая модель атома водорода
План лекции
7.1. Квантование энергии. Главное квантовое
7.2. Распределение электронного заряда в атоме. Орбитальное квантовое число.
7.3. Квантование орбитального момента импульса.
7.4. Пространственное квантование. Магнитное квантовое число.
7.5. Квантование собственного момента импульса. Спиновое квантовое число.
7.6. Энергетический спектр атома водорода.
Слайд 37.1. Квантование энергии.
Главное квантовое число
С точки зрения квантовой механики, электрон
Потенциальная энергия определяет взаимодействие электрона с положительно заряженным ядром:
r – расстояние электрона от ядра;
Ze – заряд ядра: Z = 1 для водорода;
e – заряд электрона.
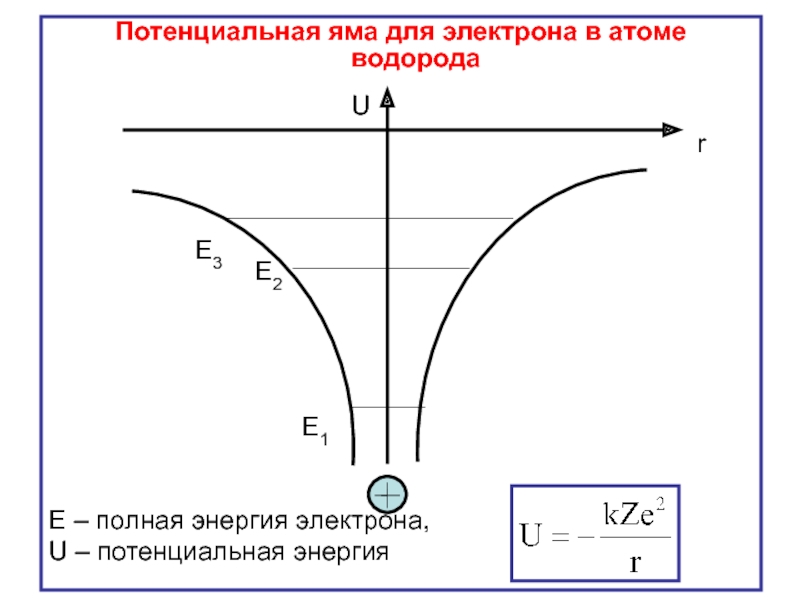
Слайд 4
U
r
E1
E2
E3
Потенциальная яма для электрона в атоме водорода
Е – полная энергия электрона,
U – потенциальная энергия
Слайд 5Уравнение Шредингера для стационарных состояний имеет вид:
Электрон находится в центральном, сферически
Слайд 7Уравнение Шредингера в сферических координатах имеет сложный вид, но более простое
Е – полная энергия электрона;
- волновая функция.
Слайд 8При решении уравнения Шредингера в сферических координатах получены следующие результаты:
собственные значения
Эти целые числа получили название:
n – главное квантовое число,
l – орбитальное квантовое число;
m – магнитное квантовое число.
Слайд 9Уравнение Шредингера имеет требуемые однозначные конечные и непрерывные решения в следующих
при любых положительных Е;
при дискретных отрицательных значениях энергии, определяемых формулой:
Слайд 10Случай Е = 0 соответствует отрыву электрона от атома.
2. Случай E
3. Случай E < 0 соответствует электрону, связанному с ядром атома.
Последнее выражение для полной энергии совпадает с формулой для энергии по теории Бора.
Слайд 11Однако в квантовой механике данные значения энергии получаются как следствие основных
Бору же для получения такого результата пришлось постулировать о наличии стационарных состояний атома.
Значения энергии
соответствуют энергиям стационарных состояний атома.
Число n называют главным квантовым числом.
Слайд 12Главное квантовое число:
- принимает целочисленные значения:
n = 1, 2, 3, …
определяет
- определяет значения полной энергии стационарных состояний атома.
Слайд 147.2. Распределение электронного заряда в атоме.
Орбитальное квантовое число
Рассмотрим собственные волновые
Волновые функции можно представить в виде произведения отдельных функций:
Слайд 15Радиальная часть волновой функции:
Угловые части волновой функции:
Квадрат модуля волновых функций определяет
Слайд 16Эта вероятность различна в разных частях объёма атома.
Заряд электрона «размазан»
Объёмная плотность электрического заряда атома
для стационарных состояний зависит только от расстояния r электрона от ядра:
С – некоторая постоянная величина, r1 = 0,0529 нм – радиус первой стационарной орбиты.
Слайд 17Для стационарных состояний атома волновые функции также зависят от расстояния r
Существует прямая зависимость между объёмной плотностью заряда атома и квадратом модуля радиальной волновой функции.
Орбиталь – форма распределения объёмной плотности электрического заряда в атоме.
Классическое понятие орбит пропадает.
Слайд 18Радиальная часть волновой функции (форма орбитали) зависят от двух квантовых чисел:
Орбитальное квантовое число
- принимает целочисленные значения:
l: 0, 1, 2, …, (n-1);
определяет форму распределения электронного заряда (форму орбитали);
определяет значения орбитального момента импульса электрона.
Слайд 19При условии n = 1, 2, 3… и l = 0
При этих условиях плотность вероятности нахождения электрона в тонком шаровом слое радиуса r и толщины dr определяется по формуле
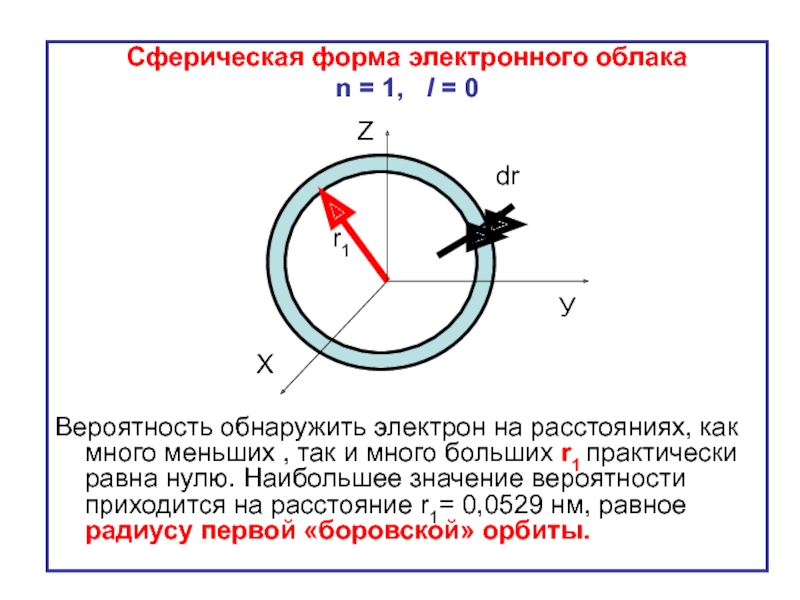
Величина оказывается максимальной на расстояниях от ядра, соответствующих радиусам «боровских» стационарных орбит: r1, r2 = 4r1, r3= 9r1,… и т.д.
Слайд 20Сферическая форма электронного облака
n = 1, l = 0
Вероятность обнаружить
r1
Z
X
У
dr
Слайд 22В состоянии с квантовыми числами
n = 2 и l
максимальная вероятность приходится на расстояние r2 = 4r1, которое соответствует радиусу второй стационарной орбиты.
Принято называть состояния атома, в которых:
l = 0 s - состоянием;
l = 1 p - состоянием;
l = 2 d – состоянием;
l = 3 f - состоянием и т д.
Слайд 24Для р -, d -, f - состояний плотность электронного облака
В таких состояниях форма распределения объёмного заряда имеет форму эллипса.
Чем больше орбитальное квантовое число , тем более вытянутым является эллипс.
Слайд 26За радиус атома принято считать расстояние r, на которое приходится 95
Самый маленький размер атом имеет в основном состоянии.
Если атом возбудить, то его размеры возрастают, атом как бы «разбухает».
Слайд 27Таким образом, волновой характер движения электрона приводит к тому, что понятие
Заряд электрона становится пространственно распределённым.
Можно говорить лишь об электронном облаке, имеющем различную форму в разных квантовых состояниях электрона в атоме.
Слайд 28Схема энергетических уровней атома водорода
с учётом орбитального квантового числа
Е
0
Е1
Е2
Е3
n
l
1
2
3
0
0
1
0
1
2
Слайд 297.3. Квантование орбитального момента импульса.
Согласно первому постулату Бора момент импульса электрона
где n – главное квантовое число.
Условием квантования момента импульса электрона согласно квантовой механики является формула, в которой участвует орбитальное квантовое число l.
Слайд 30При больших значениях n (l ~n ) обе формулы практически дают
Магнитный момент импульса Pm электрона и его механический момент импульса L связаны между собой соотношением:
.
Условие квантования для магнитного момента электрона:
Слайд 31Единицей квантования орбитального механического момента импульса L является перечёркнутая постоянная Планка.
Единицей
Слайд 327.4. Пространственное квантование.
Магнитное квантовое число
Рассмотрим атом, помещённый в магнитное поле.
Направления
Ориентация векторов и может быть только вполне определённой по отношению к направлению внешнего магнитного поля.
Слайд 33В магнитном поле проекции указанных векторов могут принимать значения:
Здесь m –
Физический смысл магнитного квантового числа проявляется только в том случае, если атом находится в магнитном поле.
Слайд 34Магнитное квантовое число
принимает целочисленные значения:
принимает всего (2l +1) значение при заданном
квантует проекции орбитальных механического и магнитного моментов.
Явление квантования проекций векторов и получило название пространственного квантования.
Слайд 35
Рассмотрим случай, когда l = 2. Магнитное число примет всего (2l
Значит векторы моментов импульсов на направление магнитного поля могут принять только 5 положений в пространстве.
Слайд 38Тонкое расщепление энергетических уровней
(с учётом магнитного квантового числа)
Е
0
Е1
Е2
Е3
n
l
1
2
3
0
0
1
0
1
2
1
4
9
m
Слайд 397.5. Квантование собственного момента импульса.
Спиновое квантовое число
В 1925 году американские
Предполагалось, что спиновое движение обусловлено как бы вращением электрона вокруг своей оси (электрон уподоблялся волчку).
Слайд 40По современным представлениям всем элементарным частицам природы (микрочастицам) приписывают наличие спина.
Спин:
следует считать внутренним свойством, присущим микрочастице подобно тому, как ей присущи заряд и масса;
является свойством одновременно квантовым и релятивистским.
Спином обладают многие элементарные частицы (электроны, протоны, нейтроны, фотоны), кроме мезонов.
Слайд 41Спин:
собственный момент импульса частицы;
- имеет одно единственное значение:
..
S – спиновое квантовое число.
По значению спинового квантового числа микрочастицы делятся на два класса: фермионы и бозоны.
Слайд 42К фермионам относятся микрочастицы с полуцелым спином:
К ним принадлежат электроны, протоны,
К бозонам относятся микрочастицы с нулевым или целым спином:
К ним принадлежат фотоны, фононы и другие элементарные частицы.
Слайд 43Для электрона:
Собственный механический момент импульса электрона имеет одно единственное значение:
Слайд 44Собственные магнитный и механический моменты электрона связаны соотношением:
Тогда для собственного магнитного
Слайд 45Таким образом,
спиновой (собственный) механический момент импульса электрона:
Спиновой (собственный) магнитный момент электрона:
Слайд 46В пространстве спин электрона на направление внешнего магнитного поля принимает только
Слайд 47В пространстве спиновой магнитный момент электрона на направление внешнего магнитного поля
Слайд 49Сверхтонкое расщепление энергетических уровней
(с учётом спинового квантового числа)
Е
0
Е1
Е2
Е3
n
l
1
2
3
0
0
1
0
1
2
2
8
18
m
Слайд 50Число возможных энергетических состояний атома
( с учётом всех четырёх квантовых чисел)
где n – главное квантовое число.
Слайд 517.6. Энергетический спектр атома водорода
Значения полной энергии электрона в атоме водорода
n – главное квантовое число: 1, 2, 3, ….
l - орбитальное квантовое число: 0, 1, 2, …, n -1
m – магнитное квантовое число: - l, …,0, …, + l
s – спиновое квантовое число: 1/2
Слайд 52Главное квантовое число определяет энергию стационарных состояний:
Принято говорить, что энергетические уровни с данным числом «n» расщепляются с учётом остальных квантовых чисел на подуровни.
Если:
n = 1, то l = 0 – данный уровень не расщепляется;
n = 2, то l = 0, 1 – данный уровень расщепляется на два подуровня;
n = 3, то l = 0, 1, 2 – данный уровень расщепляется на три подуровня и т.д.
Слайд 55Расщепление энергетических уровней по магнитному квантовому числу происходит в магнитном поле
Такое расщепление было обнаружено в 1896 году голландским учёным П. Зееманом.
Если:
l = 0, то m = 0 – уровень не расщепляется;
l = 1, то m = -1, 0, +1 – уровень расщепляется на три подуровня;
l = 2, то m = -2, -1, 0, +1, +2 – уровень расщепляется на пять подуровней.
Слайд 57С учётом трёх квантовых чисел уровень с заданным числом n расщепляется
Число возможных состояний определяется формулой:
Вырожденными называются состояния с одинаковой энергией.
Кратностью вырождения называется число различных состояний с одинаковым значением главного квантового числа.
Слайд 58Кратность тонкого вырождения уровней:
первого: n = 1 равна 1;
второго: n =
третьего: n = 3 равна 9;
четвёртого: n = 4 равна 16.
Тонкое вырождение снимается магнитным полем.
В зависимости от числа m ориентации векторов
в поле различны, поэтому и энергии, соответствующие квантовым состояниям с разными проекциями
на направление поля, оказываются различными.
Слайд 59Сверхтонким называется расщепление энергетических уровней по спиновому квантовому числу.
Оно было обнаружено
Поскольку спиновой магнитный момент электрона
принимает только две проекции, то каждый уровень в слабом магнитном поле расщепляется на два подуровня.
Слайд 60Сверхтонкое расщепление энергетических уровней
(с учётом спинового квантового числа)
Е
0
Е1
Е2
Е3
n
l
1
2
3
0
0
1
0
1
2
2
8
18
m
Слайд 61С учётом всех четырёх квантовых чисел число возможных энергетических состояний электрона
Состояние 1s (n = 1, l = 0) является основным состоянием атома водорода.
В этом состоянии атом может находиться бесконечно долго, обладая минимальной энергией.
Все остальные состояния называются возбуждёнными.
Слайд 62Чтобы перевести атом из основного состояния в возбужденное, ему необходимо сообщить
Это может быть осуществлено за счет:
теплового соударения атомов;
столкновения атома с быстрым электроном;
за счет поглощения атомом фотона.