- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Комплексиметрическое титрование. (Лекция 12) презентация
Содержание
- 1. Комплексиметрическое титрование. (Лекция 12)
- 2. План Сущность метода Требования, предъявляемые к реакциям
- 3. Требования, предъявляемые к реакциям Стехиометричность Полнота
- 4. Классификация Меркуриметрия Фторометрия
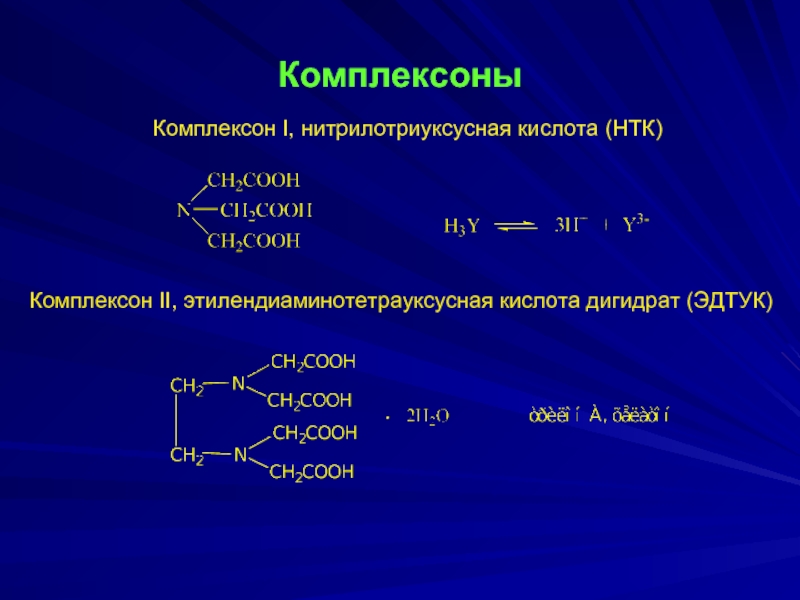
- 5. Комплексоны Комплексон I, нитрилотриуксусная кислота
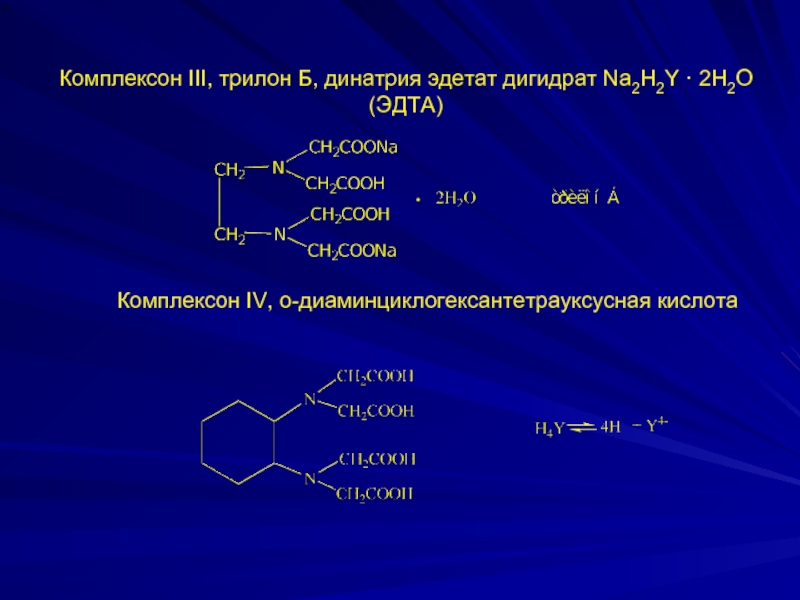
- 6. Комплексон III, трилон Б, динатрия эдетат дигидрат
- 7. ЭДТУК - слабая 4-х основная кислота
- 8. При рН 3 –
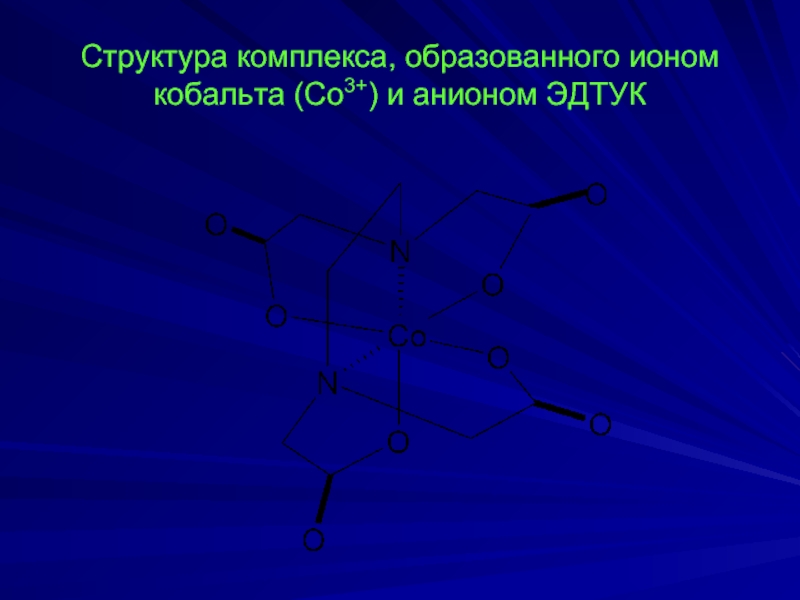
- 9. Структура комплекса, образованного ионом кобальта (Со3+) и анионом ЭДТУК
- 10. комплексы состава MY(n-4) В
- 11. Наиболее устойчивыми являются комплексы с ЭДТА:
- 12. Первичные стандарты: металлический цинк, алюминий, магний, ZnSO4∙7H2O, MgSO4∙7H2O.
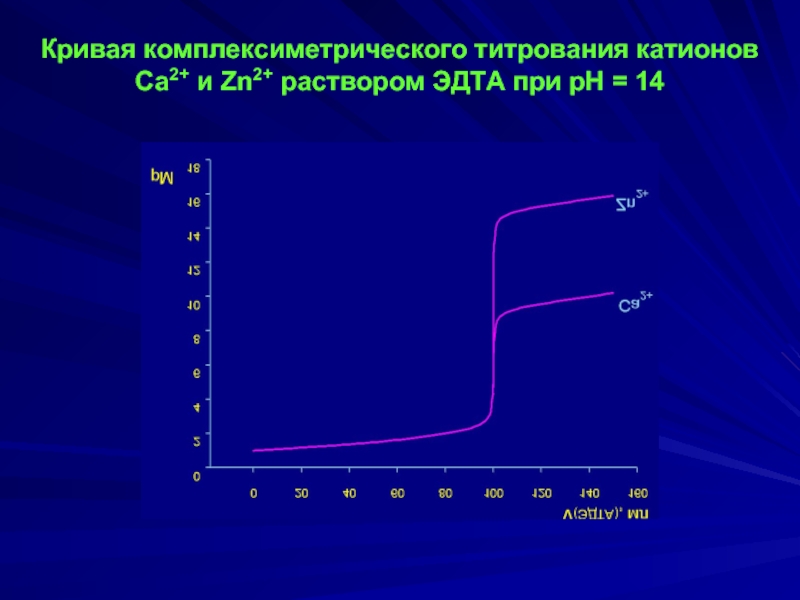
- 13. Кривая комплексиметрического титрования катионов Ca2+ и Zn2+ раствором ЭДТА при рН = 14
- 14. Принцип действия металлохромных индикаторов M2+
- 15. β[МInd] < β[MY]2-
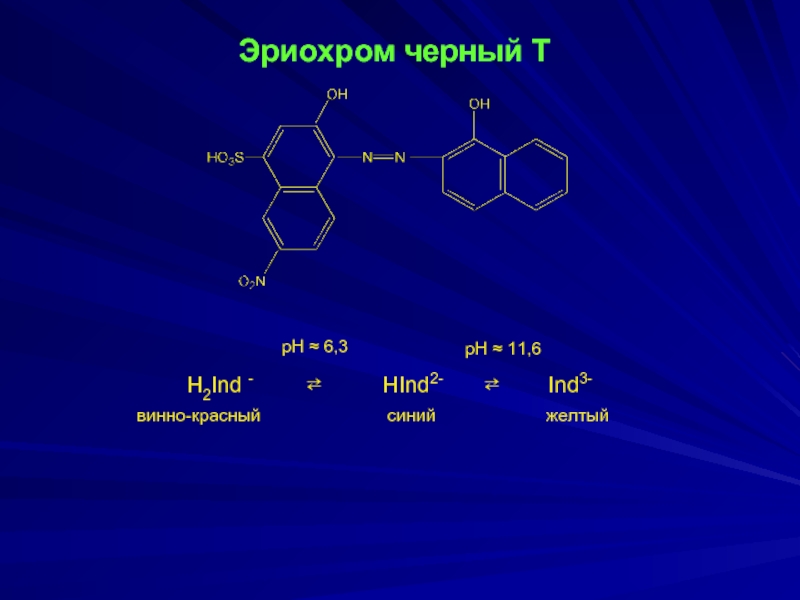
- 16. Эриохром черный Т H2Ind
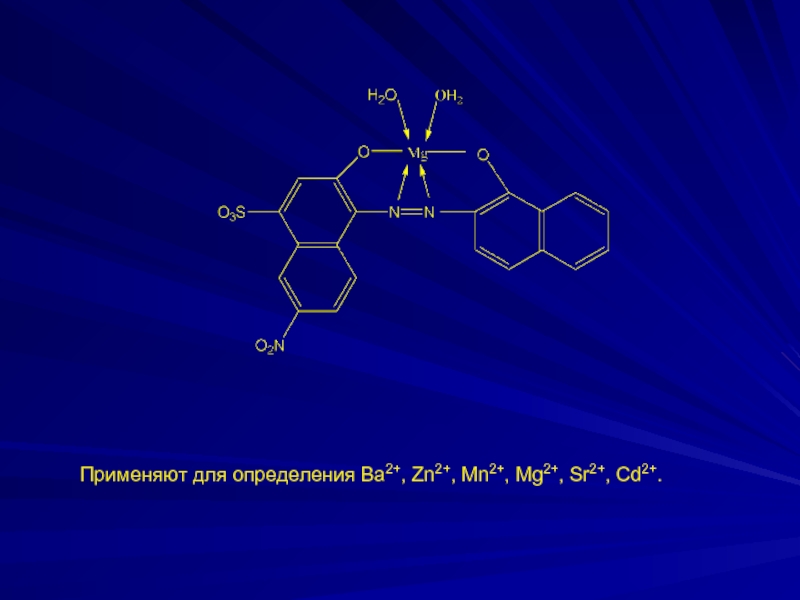
- 17. Применяют для определения Ва2+, Zn2+, Mn2+, Mg2+, Sr2+, Cd2+.
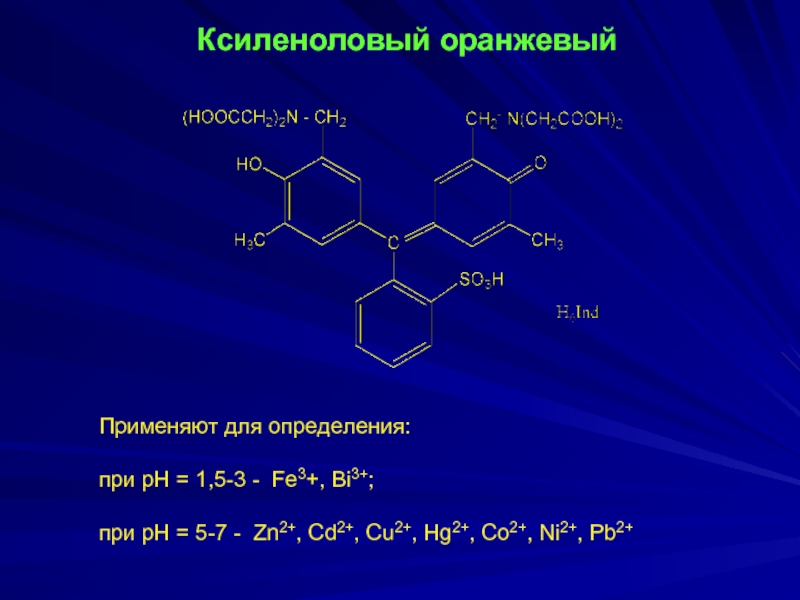
- 18. Ксиленоловый оранжевый
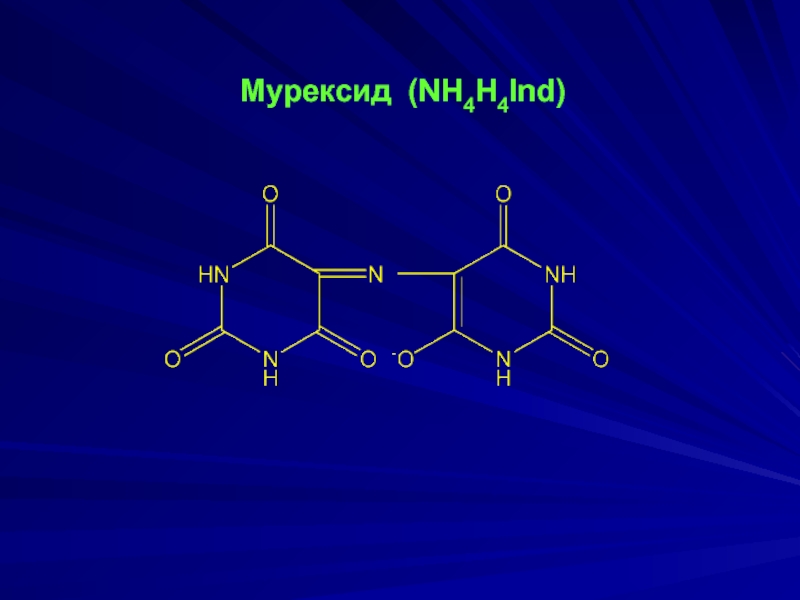
- 19. Мурексид (NH4H4Ind)
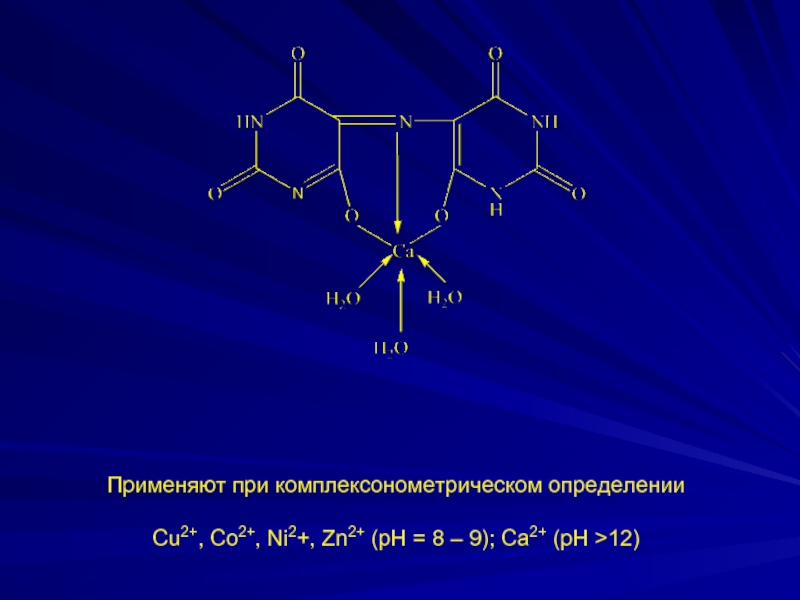
- 20. Применяют при комплексонометрическом определении Cu2+,
- 21. Меркуриметрия Для определения анионов Cl -,
- 22. Индикаторы Нитропруссид натрия: Hg2+ + [Fe(CN)5NO]2-
Слайд 2План
Сущность метода
Требования, предъявляемые к реакциям в комплексиметрии
Классификация методов комплексиметрии
Комплексонометрия
Комплексоны
Комплексы с ЭДТА
Титранты
метода
Кривые титрования
Индикаторы комплексонометрии.
Применение комплексонометрического титрования
Меркуриметрия
Кривые титрования
Индикаторы комплексонометрии.
Применение комплексонометрического титрования
Меркуриметрия
Слайд 3Требования, предъявляемые к реакциям
Стехиометричность
Полнота протекания реакции (β ≥ 108)
Реакции комплексообразования
должны протекать быстро
КТТ должна фиксироваться отчетливо
КТТ должна фиксироваться отчетливо
Слайд 5Комплексоны
Комплексон I, нитрилотриуксусная кислота (НТК)
Комплексон II, этилендиаминотетрауксусная кислота дигидрат (ЭДТУК)
Слайд 6Комплексон III, трилон Б, динатрия эдетат дигидрат Na2H2Y · 2H2O (ЭДТА)
Комплексон IV, о-диаминциклогексантетрауксусная кислота
Слайд 7
ЭДТУК - слабая 4-х основная кислота
H4Y ⇄ H+ +
H3Y- рКа1 = 2,0
H3Y- ⇄ H+ + H2Y2- рКа2 = 2,67
H2Y2- ⇄ H+ + HY3- рКа3 = 6,16
HY3- ⇄ H+ + Y4- рКа4 = 10,26
При рН<1,6 она протонируется: ионы водорода присоединяются к молекуле ЭДТУК, образуя ионы Н5Y+, Н6Y2+.
H3Y- ⇄ H+ + H2Y2- рКа2 = 2,67
H2Y2- ⇄ H+ + HY3- рКа3 = 6,16
HY3- ⇄ H+ + Y4- рКа4 = 10,26
При рН<1,6 она протонируется: ионы водорода присоединяются к молекуле ЭДТУК, образуя ионы Н5Y+, Н6Y2+.
Слайд 10комплексы состава MY(n-4)
В умеренно кислых растворах :
Mn+ + H2Y2- ⇄ [MY](n-4)
+ 2 H+
В нейтральных и умеренно щелочных растворах:
Mn+ + HY3- ⇄ [MY](n-4) + H+
В нейтральных и умеренно щелочных растворах:
Mn+ + HY3- ⇄ [MY](n-4) + H+
Слайд 11Наиболее устойчивыми являются комплексы с ЭДТА:
Bi3+ (lg β=27,9), Fe3+ (lg
β=25,1), Cr3+ (lg β=23,0),
т.е. lg β >20, их определяют в кислой среде.
Менее устойчивые комплексы с ЭДТА образуют ионы
S2 – элементов: Ba2+ (lg β=7,8), Mg2+ (lg β=8,7), Ca2+ (lg β=10,7),
т.е. lg β < 10. Их можно определять только в щелочной среде.
т.е. lg β >20, их определяют в кислой среде.
Менее устойчивые комплексы с ЭДТА образуют ионы
S2 – элементов: Ba2+ (lg β=7,8), Mg2+ (lg β=8,7), Ca2+ (lg β=10,7),
т.е. lg β < 10. Их можно определять только в щелочной среде.
Слайд 14Принцип действия металлохромных индикаторов
M2+ + H2Ind ⇄ [MInd] +
2 H+
цвет 1 цвет 2
M2+ + H2Y2- ⇄ [MY]2- + 2 H+
[MInd] + H2Y2- ⇄ [MY]2- + H2Ind
цвет 2 цвет 1
цвет 1 цвет 2
M2+ + H2Y2- ⇄ [MY]2- + 2 H+
[MInd] + H2Y2- ⇄ [MY]2- + H2Ind
цвет 2 цвет 1
Слайд 18
Ксиленоловый оранжевый
Применяют для определения:
при рН = 1,5-3 - Fe3+,
Bi3+;
при рН = 5-7 - Zn2+, Cd2+, Cu2+, Hg2+, Co2+, Ni2+, Pb2+
при рН = 5-7 - Zn2+, Cd2+, Cu2+, Hg2+, Co2+, Ni2+, Pb2+
Слайд 20Применяют при комплексонометрическом определении
Cu2+, Co2+, Ni2+, Zn2+ (рН = 8
– 9); Са2+ (рН >12)
Слайд 21Меркуриметрия
Для определения анионов Cl -, Br -, I -, CN
-, SCN -.
а) Hg2+ + 2 Cl - ⇄ HgCl2
б) Hg2+ + 4 I - ⇄ [HgI4]2-
В ТЭ появляется красный осадок
Hg2+ + [HgI4]2- ⇄ 2 HgI2↓
в) Hg2+ + 2 SCN - ⇄ Hg(SCN)2
а) Hg2+ + 2 Cl - ⇄ HgCl2
б) Hg2+ + 4 I - ⇄ [HgI4]2-
В ТЭ появляется красный осадок
Hg2+ + [HgI4]2- ⇄ 2 HgI2↓
в) Hg2+ + 2 SCN - ⇄ Hg(SCN)2
Слайд 22Индикаторы
Нитропруссид натрия:
Hg2+ + [Fe(CN)5NO]2- + 2 H2O ⇄ Hg[Fe(CN)5NO] ∙2 H2O↓
Дифенилкарбазон:






 + 2 H+ В нейтральных](/img/tmb/3/236760/c6801a39dc2f3cf3e11b0b56119bfb52-800x.jpg)


![Принцип действия металлохромных индикаторов M2+ + H2Ind ⇄ [MInd] + 2 H+](/img/tmb/3/236760/1a0eb810072dd6da08d15d691538cf43-800x.jpg)
![β[МInd] < β[MY]2-](/img/tmb/3/236760/e668d08f1484cee9e0d65ce294cdf6c5-800x.jpg)

![ИндикаторыНитропруссид натрия:Hg2+ + [Fe(CN)5NO]2- + 2 H2O ⇄ Hg[Fe(CN)5NO] ∙2 H2O↓ Дифенилкарбазон:](/img/tmb/3/236760/a109ed838d892f177610543d89d49734-800x.jpg)