- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Кинетика химических превращений. (Тема 4.3) презентация
Содержание
- 1. Кинетика химических превращений. (Тема 4.3)
- 2. Тема 4.3 Кинетика химических превращений: Схема
- 3. Схема превращения Пример: окисление аммиака Стехиометрически
- 4. Схема превращения Пример: окисление аммиака Действительные
- 5. Схема превращения Пример: окисление аммиака Схема
- 6. Скорость превращения и скорость реакции Скорость
- 7. Скорость превращения и скорость реакции Для
- 8. Скорость превращения и скорость реакции Истинная
- 9. Скорость превращения и скорость реакции Например,
- 10. Кинетическое уравнение реакции Зависимость скорости превращения
- 11. Скорость превращения и скорость реакции Параметры
- 12. Скорость превращения и скорость реакции Кинетическое
- 13. Скорость превращения и скорость реакции νАА
- 14. Скорость превращения и скорость реакции Порядок
- 15. Скорость превращения и скорость реакции
- 16. Скорость превращения и скорость реакции Энергия
- 17. Скорость превращения и скорость реакции а)
- 18. Скорость превращения и скорость реакции Для
- 19. Скорость превращения и скорость реакции Кинетическое
- 20. Скорость превращения и скорость реакции
- 21. Скорость превращения и скорость реакции Первая
Слайд 2Тема 4.3
Кинетика химических превращений:
Схема превращения;
Скорость превращения и скорость реакции;
Кинетическое уравнение
Слайд 3Схема превращения
Пример: окисление аммиака
Стехиометрически независимые уравнения
4NH3 + 5O2 = 4NO
4NH3 + 3O2 = 2N2 + 6H2O
Слайд 4Схема превращения
Пример: окисление аммиака
Действительные превращения
4NH3 + 5O2 = 4NO +
4NH3 + 3O2 = 2N2 + 6H2O
2NО = N2 + O2
6NО + 4NH3 = 5N2 + 6H2O
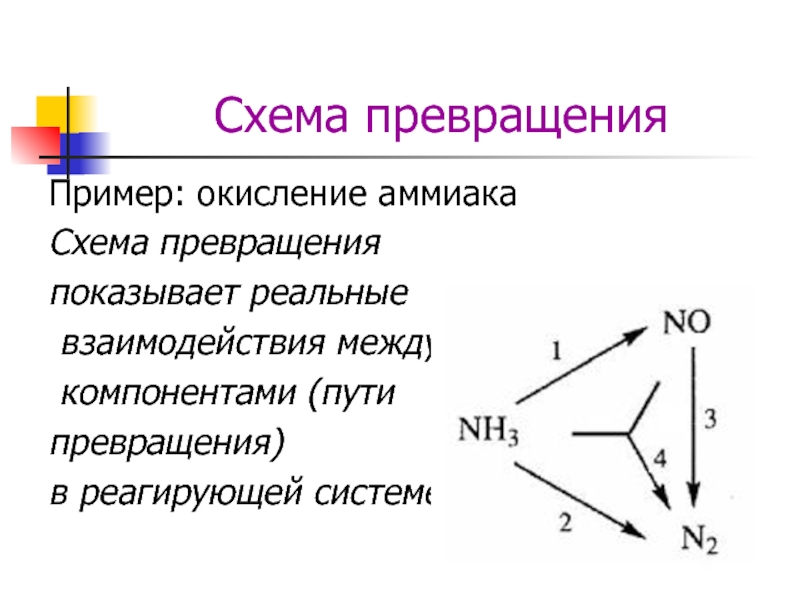
Слайд 5Схема превращения
Пример: окисление аммиака
Схема превращения
показывает реальные
взаимодействия между
компонентами
превращения)
в реагирующей системе
Слайд 6Скорость превращения и скорость реакции
Скорость превращения вещества — изменение количества
Слайд 7Скорость превращения и скорость реакции
Для скоростей превращения различных компонентов реакции
νАА + νВВ + …= νRR +νSS +…
справедливо следующее соотношение
Для сложнопараллельных реакций
Слайд 8Скорость превращения и скорость реакции
Истинная или мгновенная скорость реакции -
Суммарная или средняя скорость реакции - скорость протекания химической реакции за время Δτ, необходимое для достижения нужной степени превращения исходного вещества
Слайд 9Скорость превращения и скорость реакции
Например, реакция синтеза аммиака
N2 + 3H2
0,5N2 + 1,5H2 = NH3.
Слайд 10Кинетическое уравнение реакции
Зависимость скорости превращения или скорости реакции от условий
В составе кинетических уравнений различают параметры химической реакции и химического процесса.
Слайд 11Скорость превращения и скорость реакции
Параметры химической реакции – константы кинетического
Параметры химического процесса – внешние факторы, непосредственно не связанные со свойствами реагентов, определяющие условия протекания процесса и влияющие на скорость химического превращения
Слайд 12Скорость превращения и скорость реакции
Кинетическое уравнение в общем виде
Совокупность таких
Слайд 13Скорость превращения и скорость реакции
νАА + νВВ + …= νRR
Кинетическое уравнение простой необратимой реакции (или частной необратимой реакции в сложной схеме превращения)
Слайд 14Скорость превращения и скорость реакции
Порядок реакции по реагенту – параметр
Порядок реакции (общий) – это эмпирическая величина, равная сумме порядков реакции по компонентам (показателей степеней) , с которыми концентрации реагентов входят в выражение для скорости реакции.
Слайд 16Скорость превращения и скорость реакции
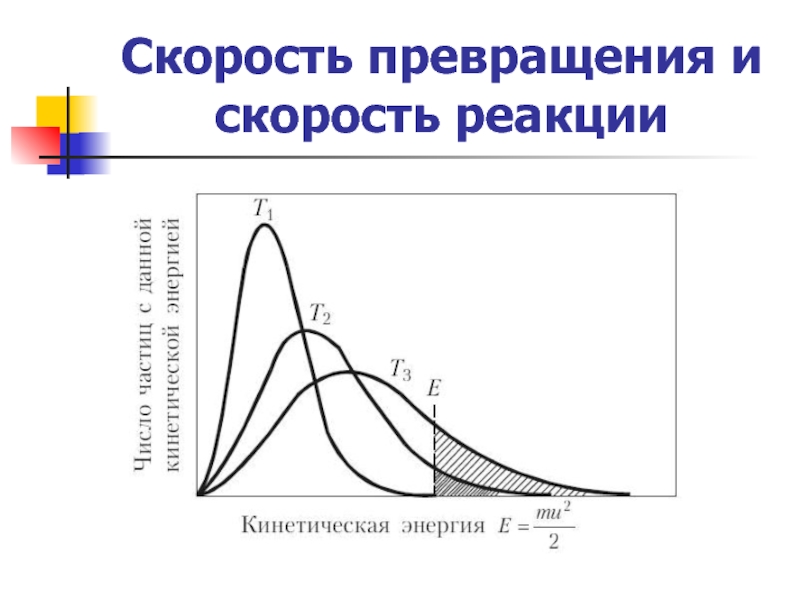
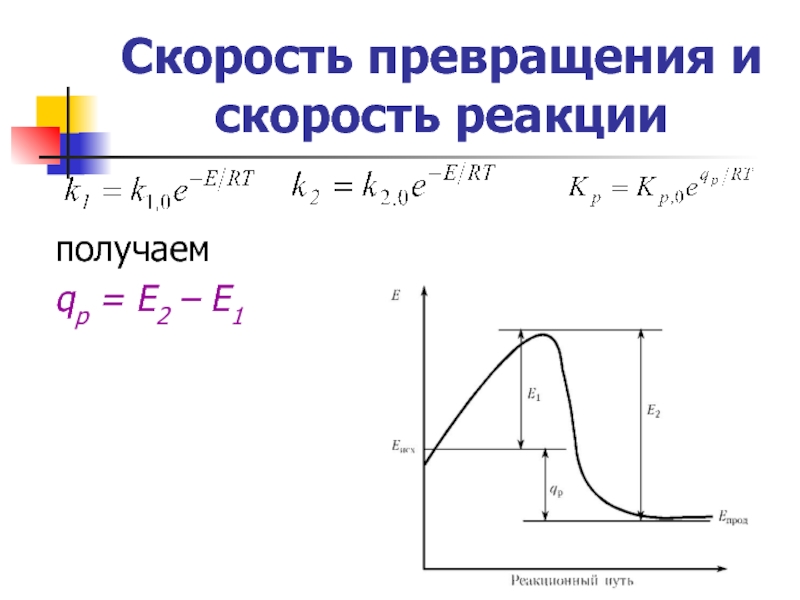
Энергия активации элементарной реакции Е –
Это энергетический барьер, который должны преодолеть молекулы при переходе из одного состояния реакционной системы в другое.
Слайд 17Скорость превращения и скорость реакции
а) чем выше энергия активации реакции
б) химические реакции более чувствительны к изменению температуры в области более низкой температуры.
Слайд 18Скорость превращения и скорость реакции
Для ориентировочной оценки влияния температуры на
Действует при температуре 10–400 °С и Е=60-120 КДж/моль
Слайд 21Скорость превращения и скорость реакции
Первая стадия реакции
k1СА(СК0 – САК)
Общая скорость реакции определяется скоростью второй стадии
r = k3САК
Кинетическая модель гомогенно-каталитической реакции