- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Избранные главы неорганического материаловедения. (Лекция 2) презентация
Содержание
- 1. Избранные главы неорганического материаловедения. (Лекция 2)
- 2. Материалы Равновесные Неравновесные
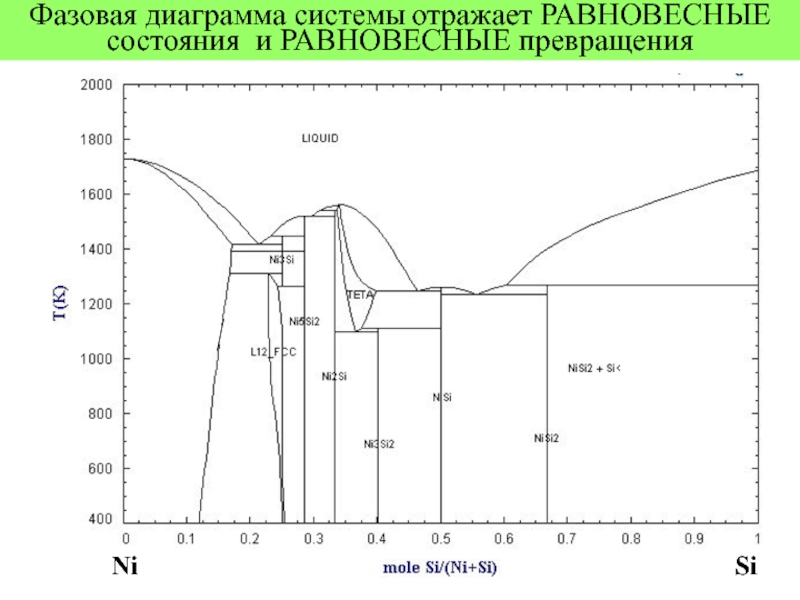
- 3. Фазовая диаграмма системы отражает РАВНОВЕСНЫЕ состояния и РАВНОВЕСНЫЕ превращения Ni Si
- 4. Правило Таммана: Диффузионные взаимодействия в твердофазных
- 5. Фазовая диаграмма физико-химической системы - ключ к
- 6. Физико-химическая система – совокупность выделенных из окружающей
- 7. Гетерогенная система – физико-химическая система, содержащая поверхности раздела, на которых происходит скачкообразное изменение какого-либо свойства.
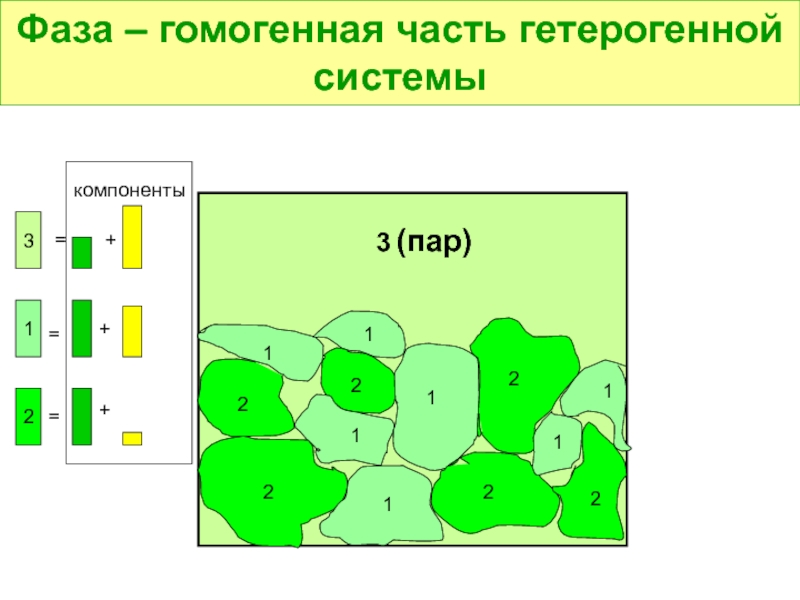
- 8. Фаза – гомогенная часть гетерогенной системы
- 9. Компоненты – индивидуальные вещества, составляющие систему.
- 10. Al 2-х
- 11. Определение химического потенциала компонента
- 12. Химическое равновесие гетерогенной системы достигается тогда,
- 13. μ11
- 14. μ11= μ12= μ13 =… …
- 15. μ11= μ12= μ13 =… …
- 16. Система уравнений имеет определенное решение, если
- 17. с11 ,с21 , с31 , ….. ,
- 18. Всего переменных: k(n-1)
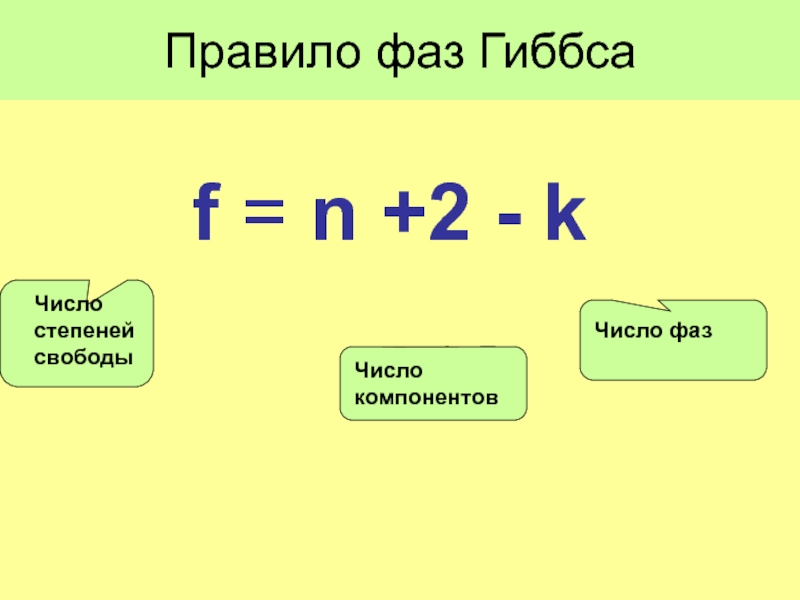
- 19. Правило фаз Гиббса f = n
- 20. Принцип соответствия Всякому комплексу фаз на диаграмме
- 21. Фазовые диаграммы однокомпонентных систем
- 22. Диаграмма состояния воды (однокомпонентная система) •
- 23. Сравнение диаграмм воды и серы dp/dT =
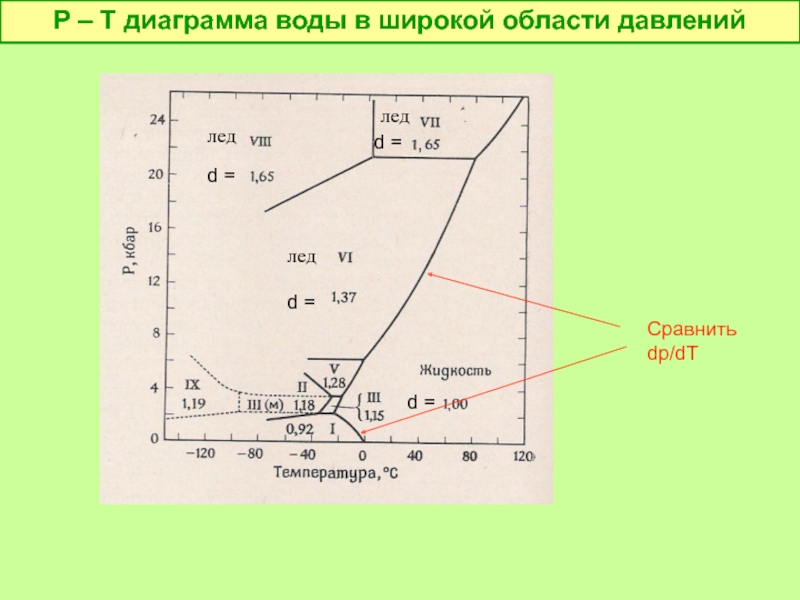
- 24. P – T диаграмма воды в широкой
- 25. dp/dT 0
- 26. Диаграмма состояния углерода Поле алмаза
- 27. Диаграмма состояния углерода Поле алмаза
- 28. Цех установок роста алмазов Установка роста алмазов
- 29. Искусственные алмазы ювелирного качества
- 30. Синтетические алмазы используются в бурении горных пород, металлообработке. Алмазные полировочные пасты
- 31. Разновидности графитовых материалов
- 32. Новые неравновесные высокодисперсные формы углерода Однослойная нанотрубка
- 33. Как и почему образуются нанотрубки? Углерод Графит(в
- 34. 1000 2000 3000 4000
- 35. Кубический нитрид бора –
- 36. Двухкомпонентные (бинарные) системы
- 37. Классификация равновесий в бинарных системах
- 38. Топологическая взаимосвязь диаграмм
- 39. А
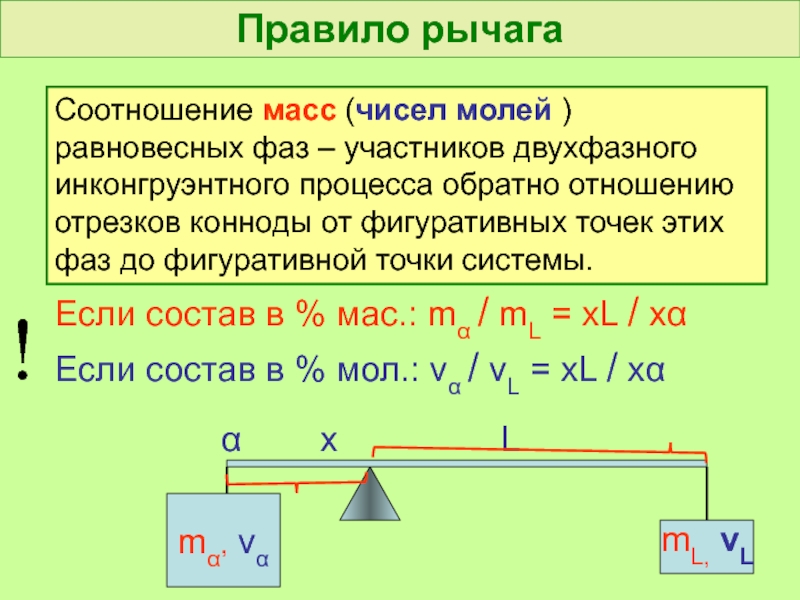
- 44. Правило рычага Соотношение масс (чисел молей )
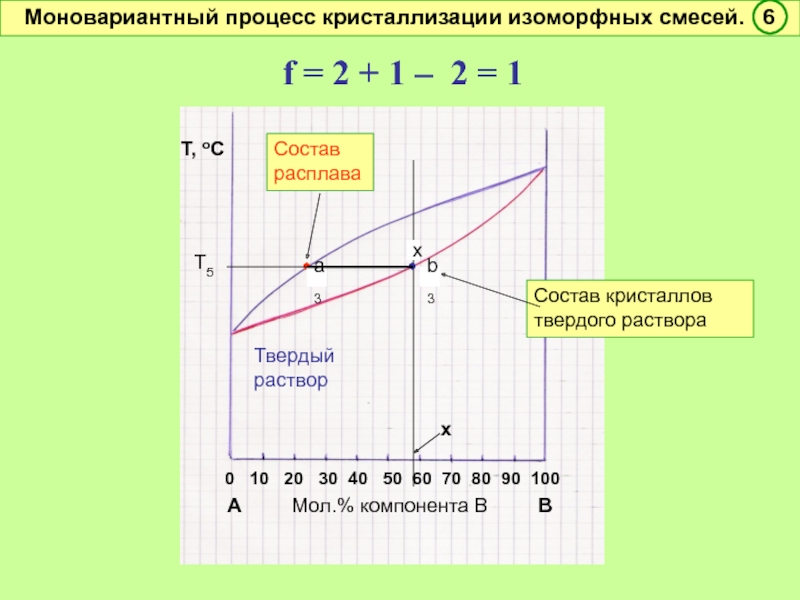
- 47. f = 2 + 1 – 2
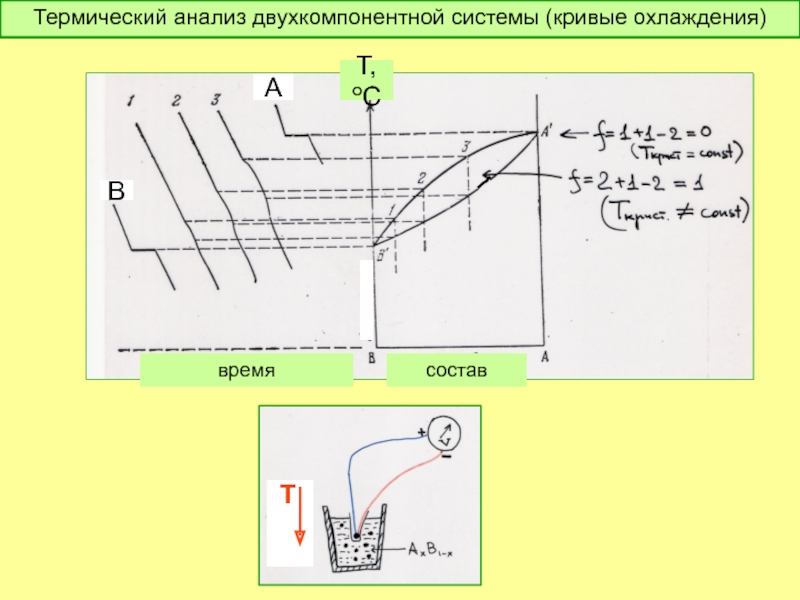
- 48. время В А состав Т,оС
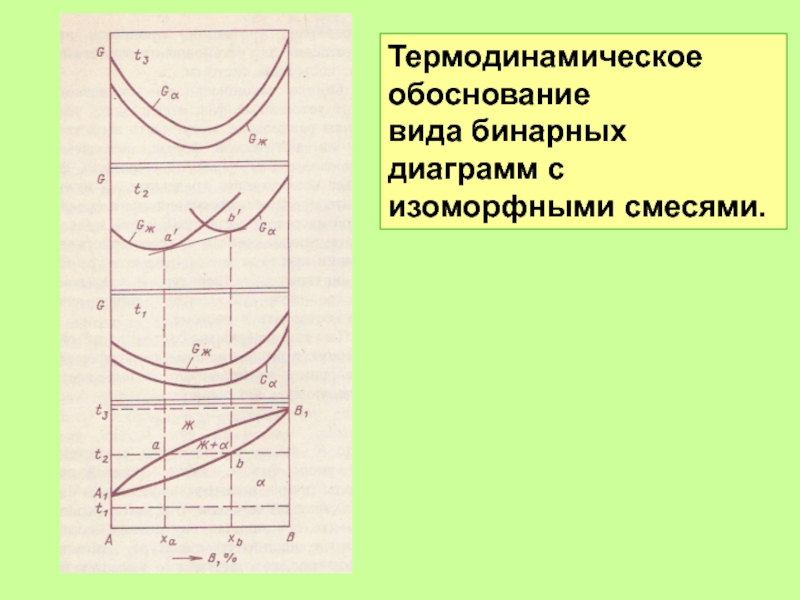
- 49. Термодинамическое обоснование вида бинарных диаграмм с изоморфными смесями.
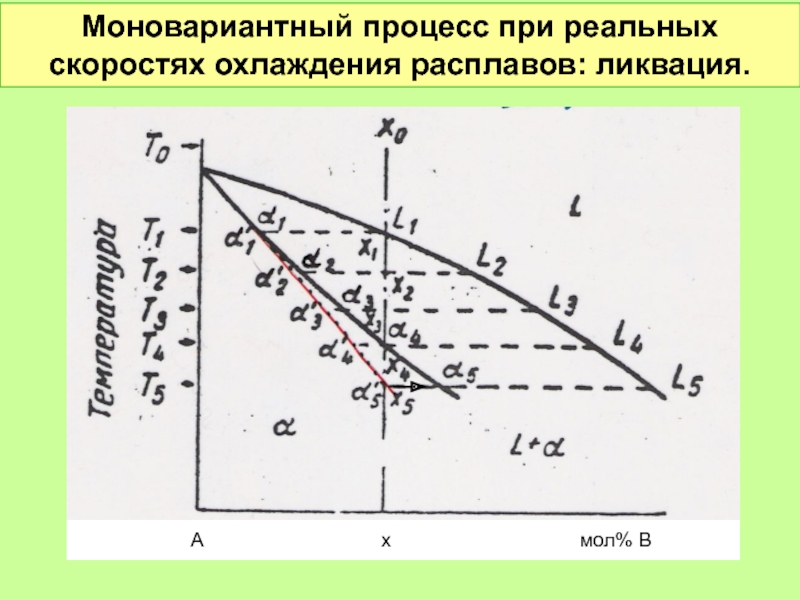
- 50. Моновариантный процесс при реальных скоростях охлаждения расплавов:
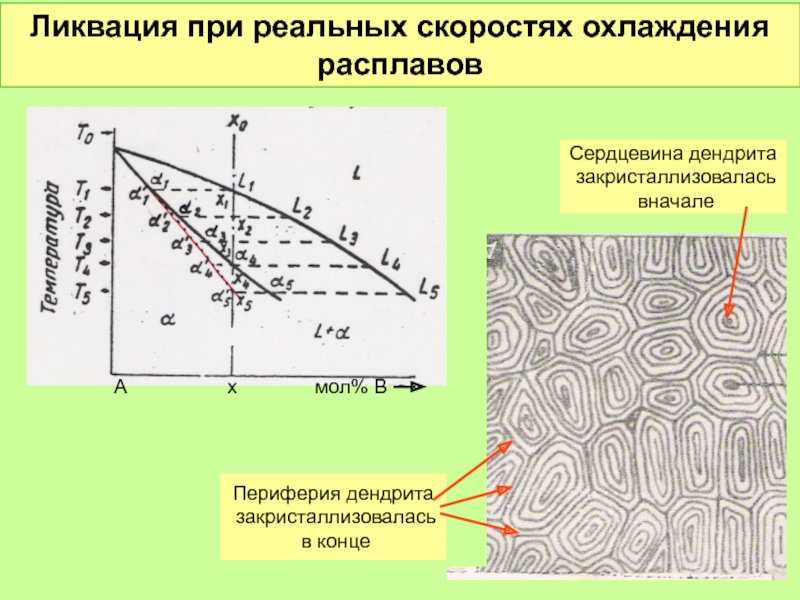
- 51. Ликвация при реальных скоростях охлаждения расплавов А
- 52. Диффузионный отжиг
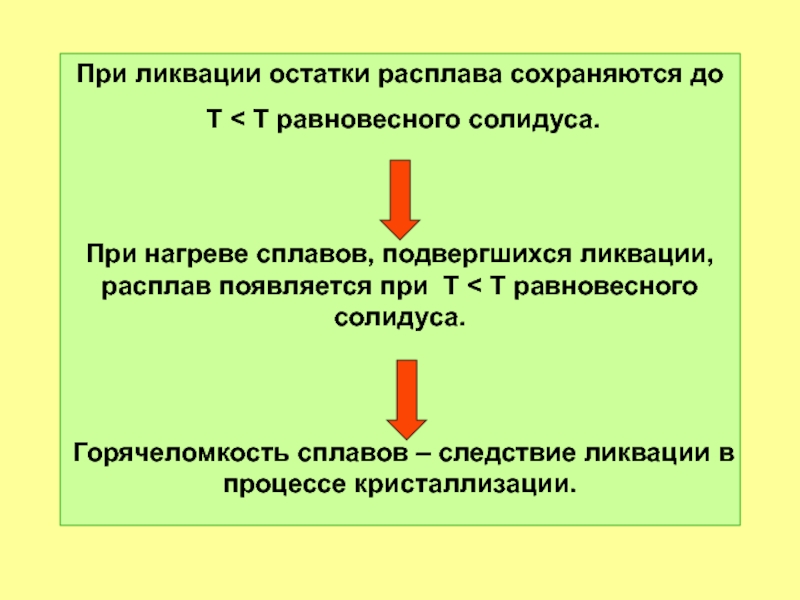
- 53. При ликвации остатки расплава сохраняются до
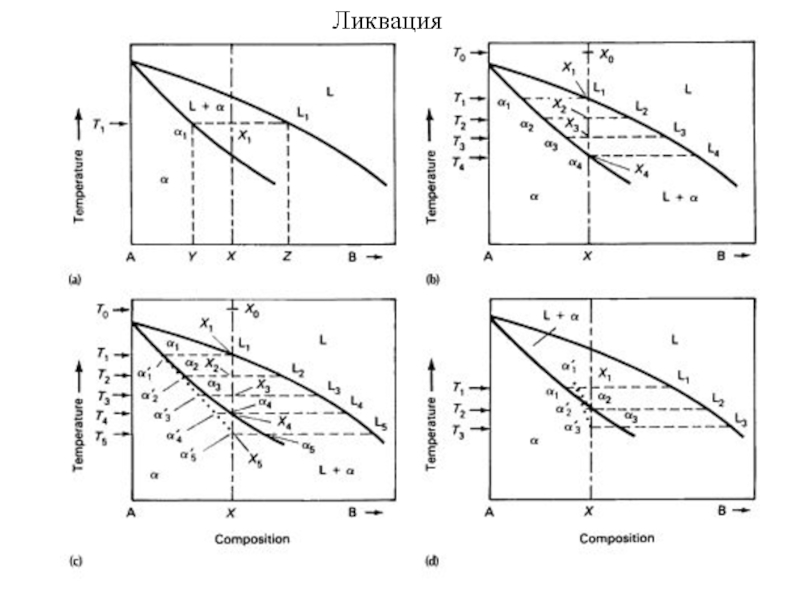
- 54. Ликвация
Слайд 1Избранные главы неорганического материаловедения
Лекция 2
Роль фазовых диаграмм в материаловедении
Определения: системы, фазы,
Химический потенциал
Правило фаз
5. Однокомпонентные системы
6. Двухкомпонентные системы
Классификация превращений в 2-х компонентных системах
Моновариантные процессы
Слайд 4Правило Таммана:
Диффузионные взаимодействия в твердофазных системах становятся возможными при Т ~>
Слайд 5Фазовая диаграмма физико-химической системы - ключ к пониманию особенностей материала и
3Al2O3•2SiO2
третичный муллит
расплав
расплав
SiO2 – Al2O3
муллит
Слайд 6Физико-химическая система – совокупность выделенных из окружающей среды материальных объектов, между
Слайд 7Гетерогенная система – физико-химическая система, содержащая поверхности раздела, на которых происходит
Слайд 9Компоненты – индивидуальные вещества, составляющие систему.
Число компонентов – минимальное число индивидуальных
Слайд 10
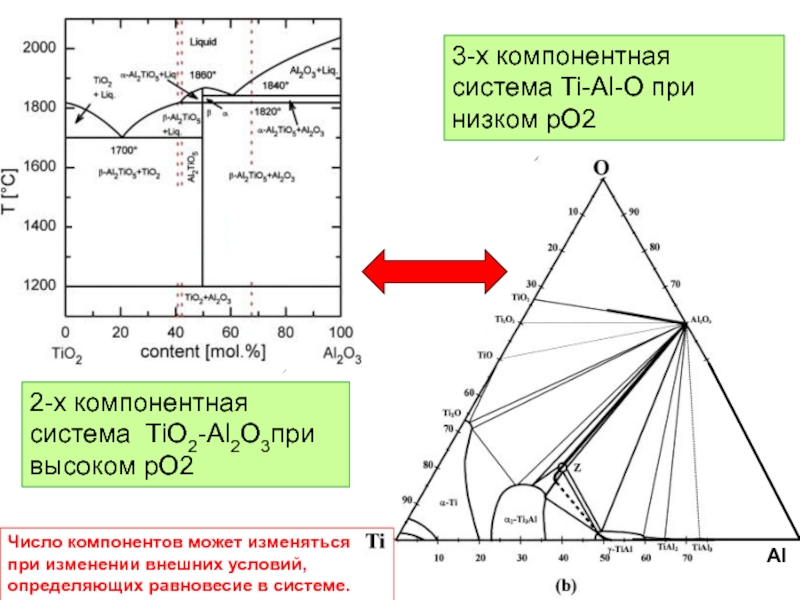
Al
2-х компонентная система TiO2-Al2O3при высоком рО2
3-х компонентная система Ti-Al-O при низком
Число компонентов может изменяться при изменении внешних условий, определяющих равновесие в системе.
Слайд 11
Определение химического потенциала компонента
μj = μjo + RTlnaj
aj = γjcj
Свободная
Число молей j -компонента
Слайд 12
Химическое равновесие гетерогенной системы достигается тогда, когда
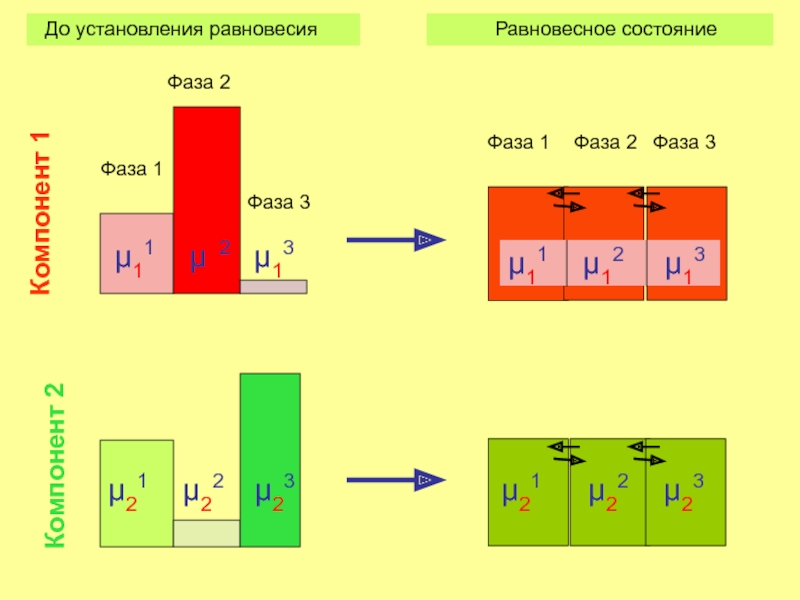
Слайд 13
μ11 μ12 μ13
μ11 μ12
Фаза 1
Фаза 2
Фаза 3
Фаза 1
Фаза 2
Фаза 3
До установления равновесия Равновесное состояние
μ21 μ22 μ23
μ21 μ22 μ23
μ21
μ23
μ21 μ22 μ23
Компонент 1
Компонент 2
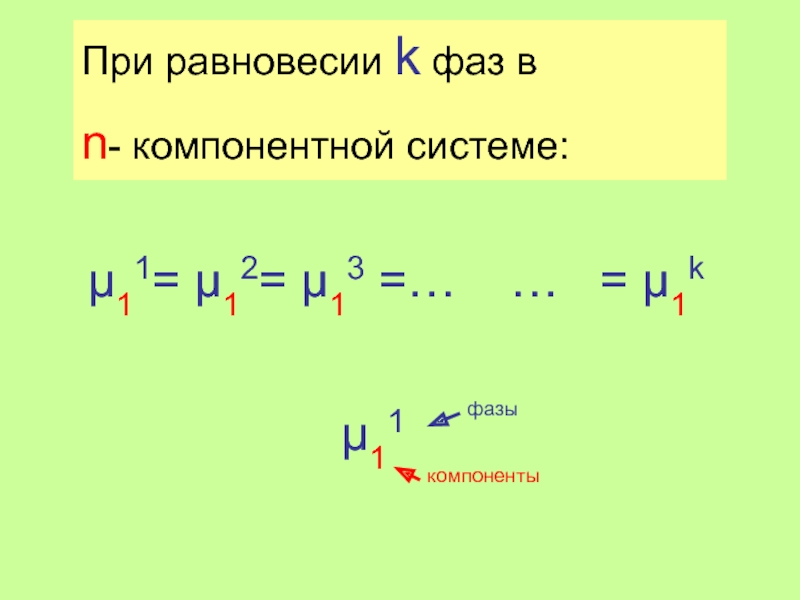
Слайд 15μ11= μ12= μ13 =… … = μ1k
μ21= μ22= μ23
μ31= μ32= μ33 =… … = μ3k
………………………………………………………………
μn1= μn2= μn3 =… … = μnk
n строк
k-1 равенств
Всего n(k-1) уравнений
Слайд 16Система уравнений имеет определенное решение, если
Переменные:
Состав равновесных фаз
Температура
Давление
Другие внешние потенциалы, влияющие на состояние системы (???)
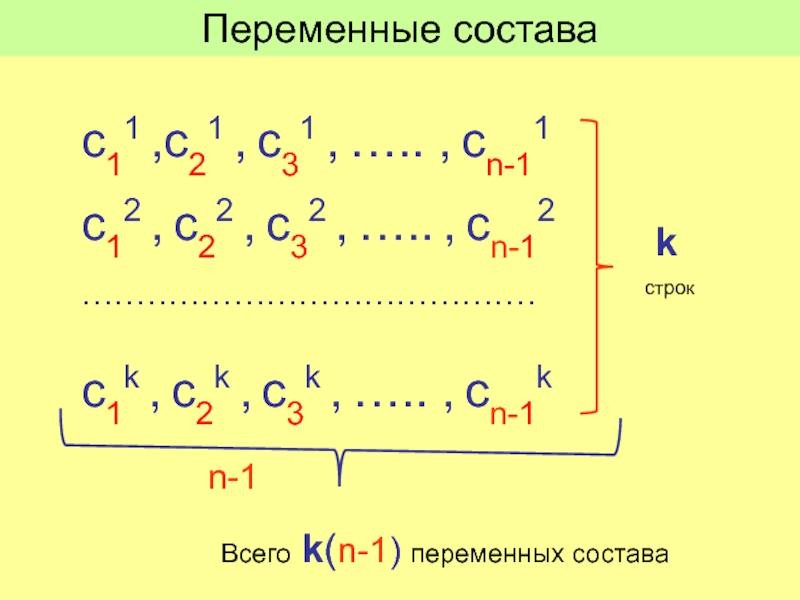
Слайд 17с11 ,с21 , с31 , ….. , cn-11
с12 , с22 ,
……………………………………
с1k , с2k , с3k , ….. , сn-1k
Переменные состава
k
строк
n-1
Всего k(n-1) переменных состава
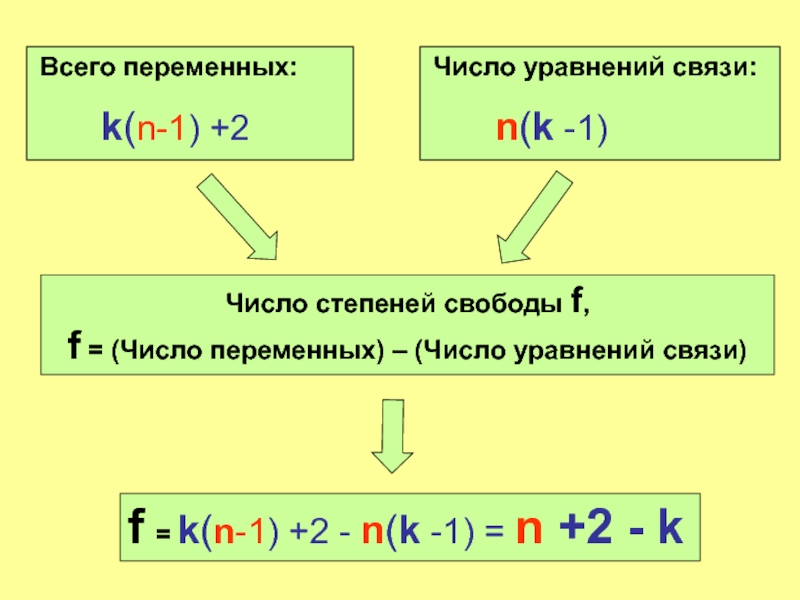
Слайд 18 Всего переменных:
k(n-1) +2
Число уравнений связи:
Число степеней свободы f, f = (Число переменных) – (Число уравнений связи)
f = k(n-1) +2 - n(k -1) = n +2 - k
Слайд 20Принцип соответствия
Всякому комплексу фаз на диаграмме состояния соответствует свой геометрический образ,
Вариантность ≡ число степеней свободы
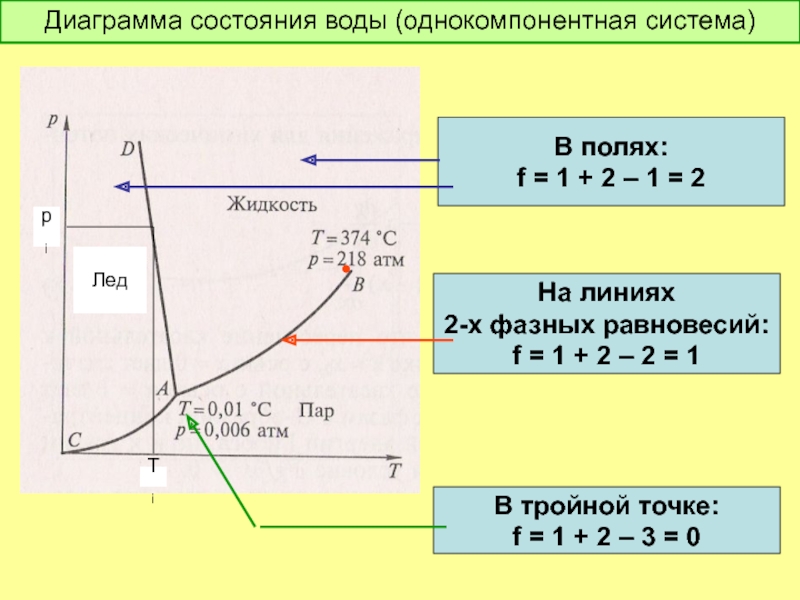
Слайд 22Диаграмма состояния воды (однокомпонентная система)
•
Лед
pi
Ti
В полях:
f = 1 + 2
На линиях
2-х фазных равновесий:
f = 1 + 2 – 2 = 1
В тройной точке:
f = 1 + 2 – 3 = 0
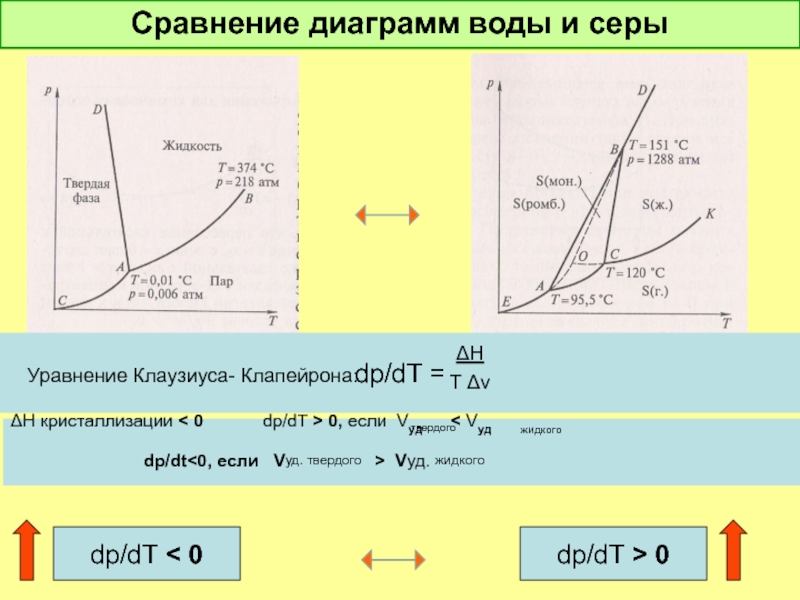
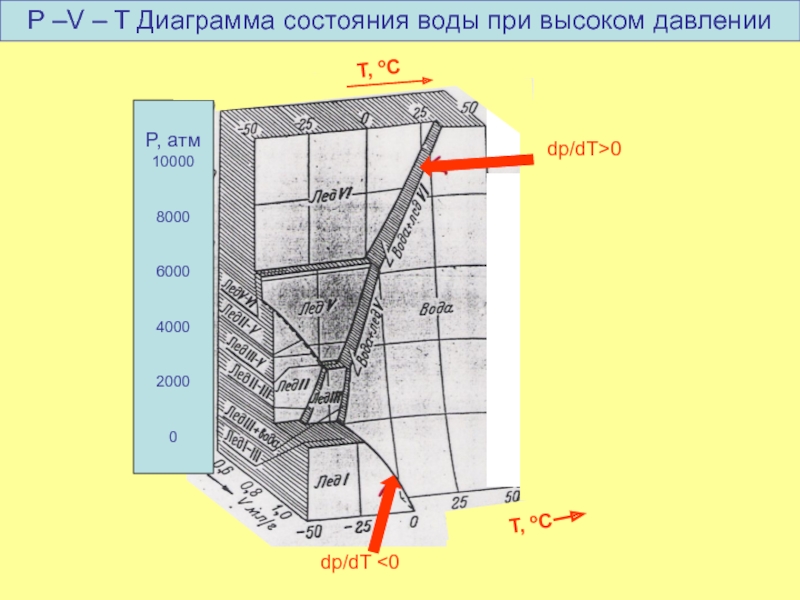
Слайд 23Сравнение диаграмм воды и серы
dp/dT =
Уравнение Клаузиуса- Клапейрона:
ΔH
T Δv
ΔH кристаллизации
dp/dt<0, если Vуд. твердого > Vуд. жидкого
dp/dT < 0
dp/dT > 0
твердого
жидкого
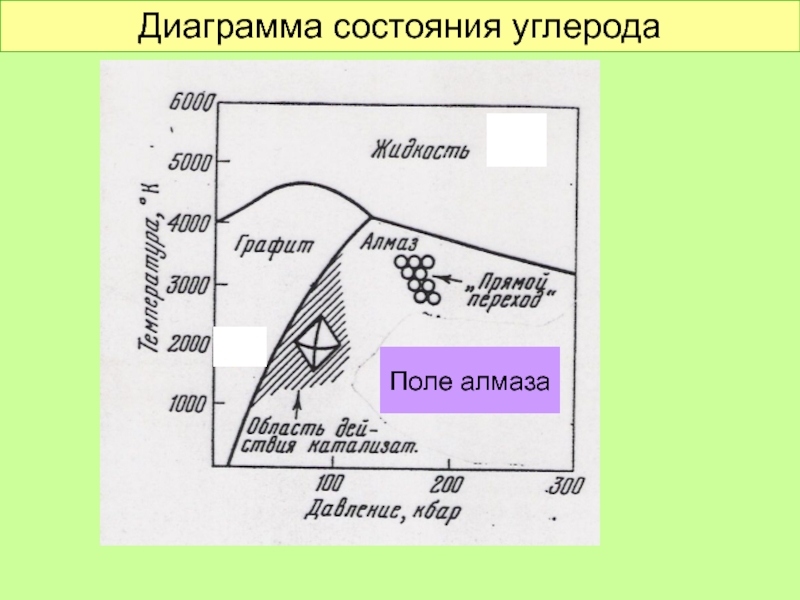
Слайд 27Диаграмма состояния углерода
Поле алмаза
Т, К
1000
6000
Р,
кбар
300
200
100
Алмаз более устойчив, чем графит при
P
Уравнение Лейпунского (1939 г.)
Алмаз
Графит
Расплав
Слайд 30Синтетические алмазы используются в бурении горных пород, металлообработке.
Алмазные полировочные пасты
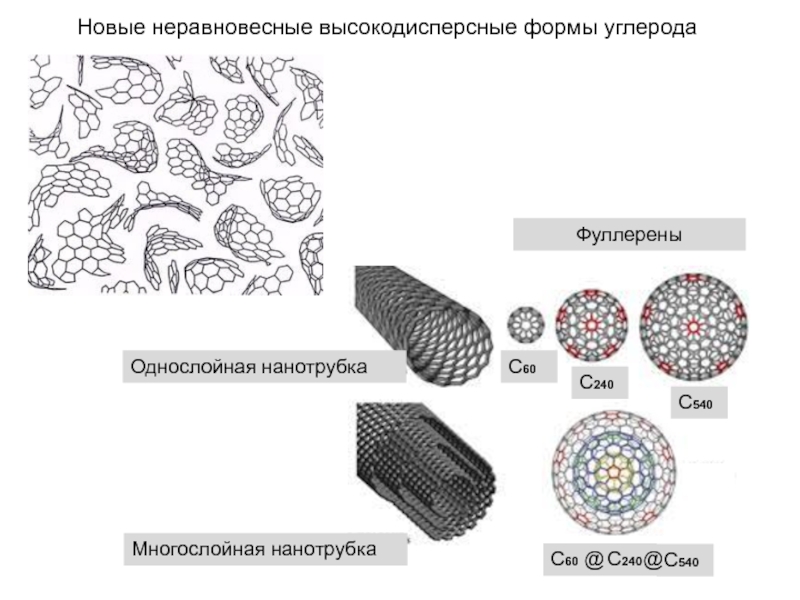
Слайд 32Новые неравновесные высокодисперсные формы углерода
Однослойная нанотрубка
Многослойная нанотрубка
Фуллерены
С60
С240
С540
С60
С240
С540
@
@
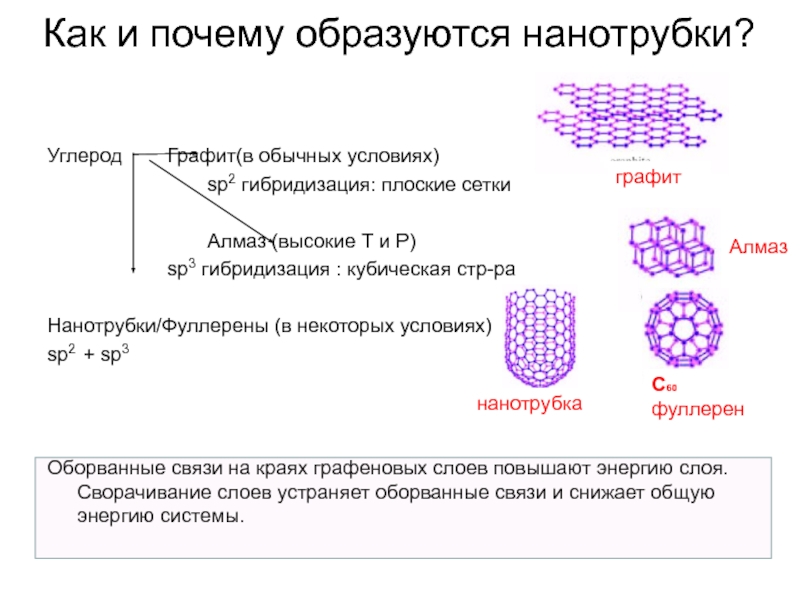
Слайд 33Как и почему образуются нанотрубки?
Углерод Графит(в обычных условиях)
sp2 гибридизация: плоские сетки
Алмаз (высокие
sp3 гибридизация : кубическая стр-ра
Нанотрубки/Фуллерены (в некоторых условиях)
sp2 + sp3
Оборванные связи на краях графеновых слоев повышают энергию слоя. Сворачивание слоев устраняет оборванные связи и снижает общую энергию системы.
графит
Алмаз
С60 фуллерен
нанотрубка
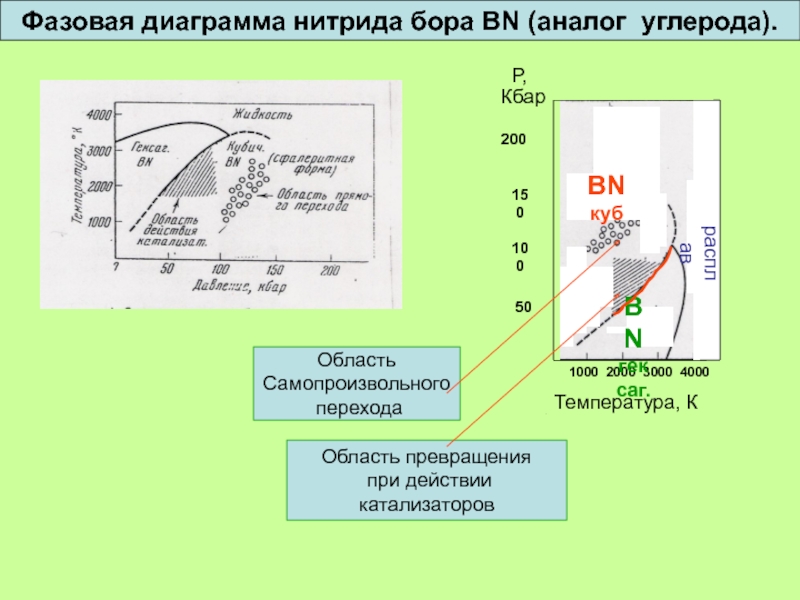
Слайд 34
1000 2000 3000 4000
Температура, К
Р,
Кбар
200
150
100
50
BN
куб
BN
гексаг.
расплав
Область
при действии катализаторов
Область
Самопроизвольного
перехода
Фазовая диаграмма нитрида бора BN (аналог углерода).
Слайд 35
Кубический нитрид бора – высокотвердый материал для режущих инструментов
BN, в отличие
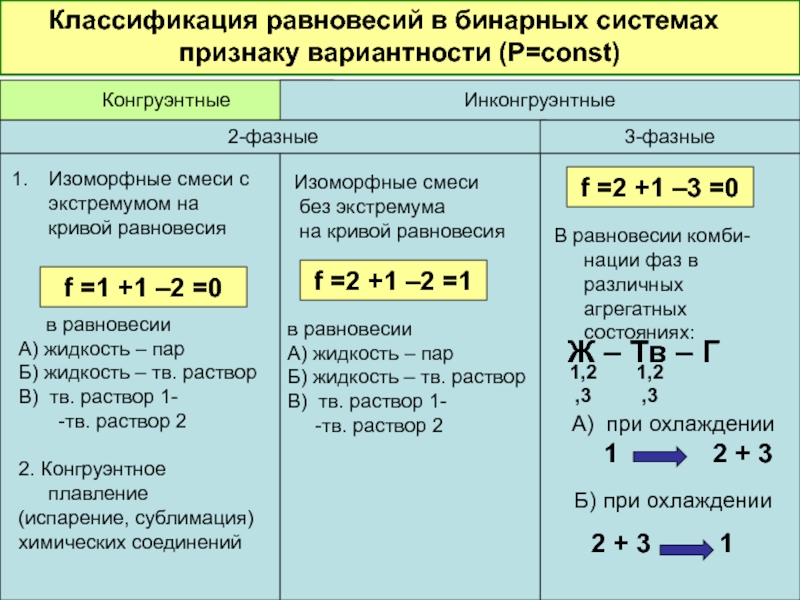
Слайд 37Классификация равновесий в бинарных системах по
Конгруэнтные
Инконгруэнтные
2-фазные
3-фазные
в равновесии
А) жидкость – пар
Б) жидкость – тв. раствор
В) тв. раствор 1-
-тв. раствор 2
Изоморфные смеси с экстремумом на кривой равновесия
в равновесии
А) жидкость – пар
Б) жидкость – тв. раствор
В) тв. раствор 1-
-тв. раствор 2
2. Конгруэнтное плавление
(испарение, сублимация)
химических соединений
f =1 +1 –2 =0
Изоморфные смеси
без экстремума
на кривой равновесия
f =2 +1 –2 =1
f =2 +1 –3 =0
В равновесии комби-нации фаз в различных агрегатных состояниях:
А) при охлаждении 1 2 + 3
Б) при охлаждении
2 + 3 1
1,2,3
Ж – Тв – Г
1,2,3
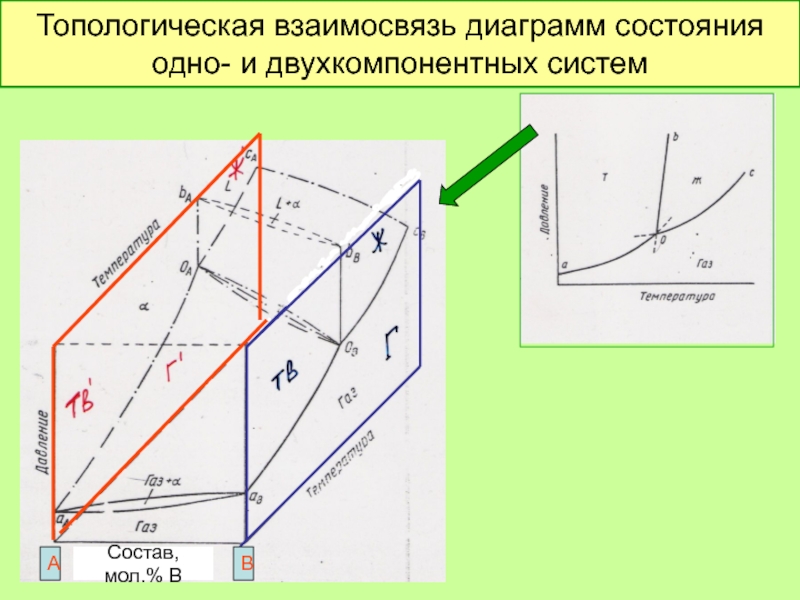
Слайд 38
Топологическая взаимосвязь диаграмм состояния
одно- и двухкомпонентных систем
Состав, мол.% В
А
В
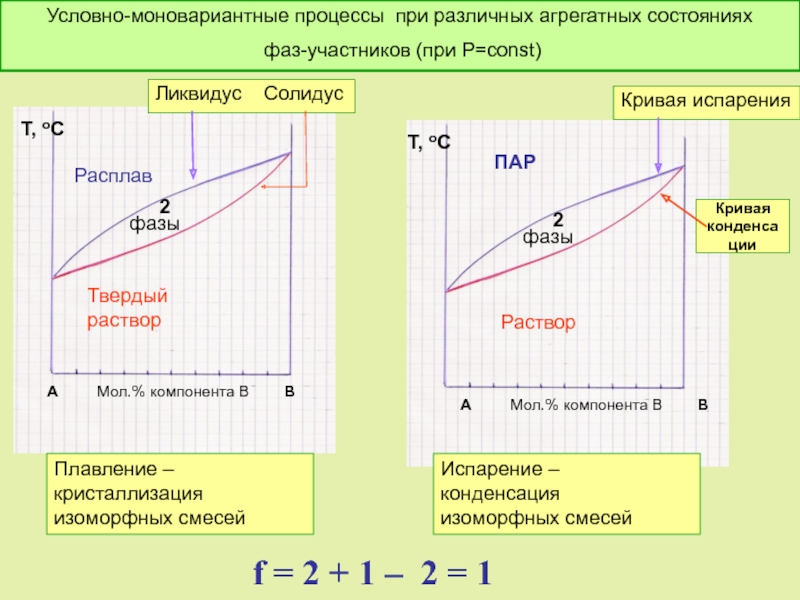
Слайд 39 А Мол.% компонента
Т, оС
Расплав
Твердый раствор
А Мол.% компонента В В
Т, оС
А Мол.% компонента В В
ПАР
Раствор
Плавление – кристаллизация изоморфных смесей
Испарение – конденсация изоморфных смесей
Условно-моновариантные процессы при различных агрегатных состояниях
фаз-участников (при Р=const)
Ликвидус Солидус
Кривая испарения
Кривая
конденсации
2
фазы
2
фазы
f = 2 + 1 – 2 = 1
Слайд 40 0 10
А Мол.% компонента В В
Т, оС
Расплав
Твердый раствор
•
х
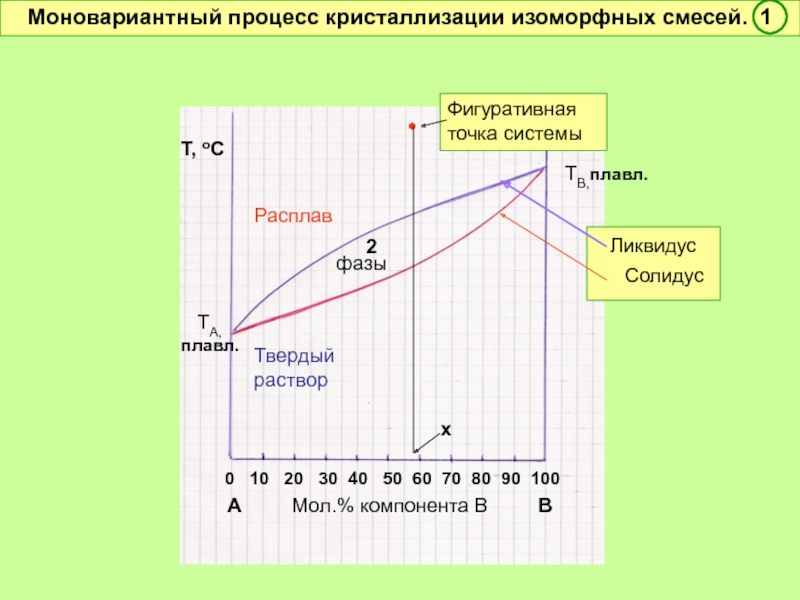
Фигуративная точка системы
Моновариантный процесс кристаллизации изоморфных смесей. 1
Ликвидус
Солидус
2
фазы
ТА, плавл.
ТВ,плавл.
Слайд 41 0 10
А Мол.% компонента В В
Т, оС
Состав расплава
Твердый раствор
•
х
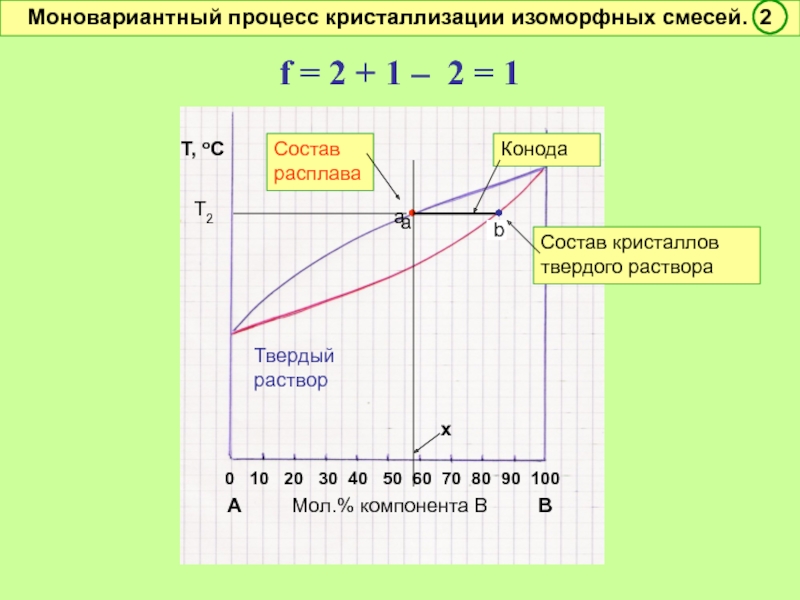
Моновариантный процесс кристаллизации изоморфных смесей. 2
•
Конода
Состав кристаллов твердого раствора
Т2
а
a
b
f = 2 + 1 – 2 = 1
Слайд 42 0 10
А Мол.% компонента В В
Т, оС
Состав расплава
Твердый раствор
•
х
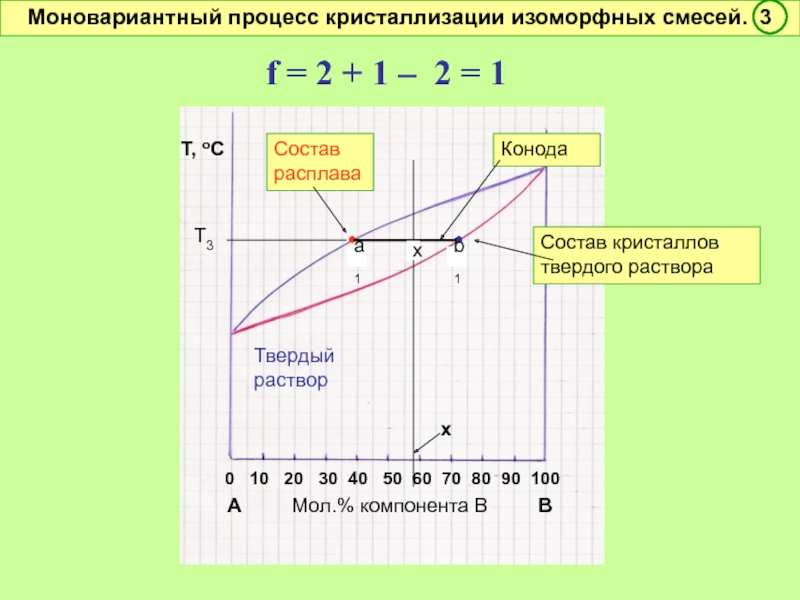
Моновариантный процесс кристаллизации изоморфных смесей. 3
•
Конода
Состав кристаллов твердого раствора
Т3
a1
b1
x
f = 2 + 1 – 2 = 1
Слайд 43 0 10
А Мол.% компонента В В
Т, оС
Состав расплава
Твердый раствор
•
х
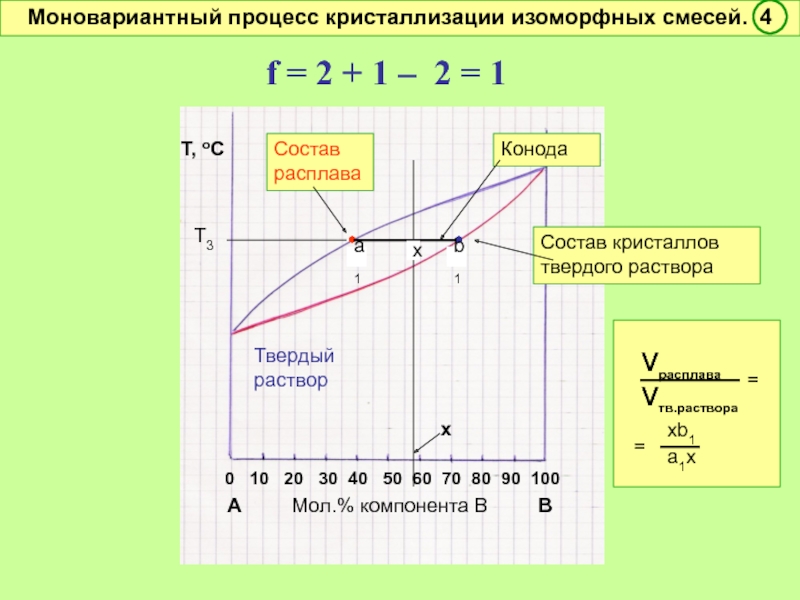
Моновариантный процесс кристаллизации изоморфных смесей. 4
•
Конода
Состав кристаллов твердого раствора
Т3
a1
b1
x
νрасплава
νтв.раствора
=
=
xb1
a1x
f = 2 + 1 – 2 = 1
Слайд 44Правило рычага
Соотношение масс (чисел молей ) равновесных фаз – участников двухфазного
Если состав в % мас.: mα / mL = xL / xα
Если состав в % мол.: να / νL = xL / xα
mα, να
mL, νL
α х L
!
Слайд 45 0 10
А Мол.% компонента В В
Т, оС
Состав расплава
Твердый раствор
•
х
Моновариантный процесс кристаллизации изоморфных смесей. 5
•
Состав кристаллов твердого раствора
Т4
a2
b2
x
f = 2 + 1 – 2 = 1
Слайд 46 0 10
А Мол.% компонента В В
Т, оС
Состав расплава
Твердый раствор
•
х
Моновариантный процесс кристаллизации изоморфных смесей. 6
•
Состав кристаллов твердого раствора
Т5
a3
b3
x
f = 2 + 1 – 2 = 1
Слайд 47f = 2 + 1 – 2 = 1
Условно моновариантное превращение.
Смысл
1. Состав обеих равновесных фаз однозначно определяется температурой. Для определения состава фаз надо провести конноду при выбранной температуре.
2. Данный состав фазы может быть реализован только при вполне определенной температуре. Этому составу равновесна вторая фаза также вполне определенного состава.
Инконгруэнтные превращения в изоморфных смесях
Слайд 51Ликвация при реальных скоростях охлаждения расплавов
А
Сердцевина дендрита
закристаллизовалась
вначале
Периферия дендрита
закристаллизовалась
в конце
Слайд 52
Диффузионный отжиг ликвидирует последствия ликвации
Микроструктура сплава Ni0,7Cu0,3 . Увеличение 100
До
После отжига
Обогащено
Cu
Обогащено
Ni
Слайд 53При ликвации остатки расплава сохраняются до
T < T равновесного солидуса.
При
Горячеломкость сплавов – следствие ликвации в процессе кристаллизации.