- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Идеальный газ презентация
Содержание
- 1. Идеальный газ
- 2. Размеры молекул малы по сравнению с расстояниями
- 3. Реальный газ можно считать идеальным, если он сильно разрежен и хорошо нагрет
- 4. Скорости движения молекул При одной и той
- 5. Микропараметры (характеризуют одну молекулу) Макропараметры (можно измерить приборами)
- 6. В модели «идеальный газ» все молекулы движутся
- 7. Давление газа создается ударами молекул
- 8. Основное уравнение МКТ -связывает микро и макро параметры
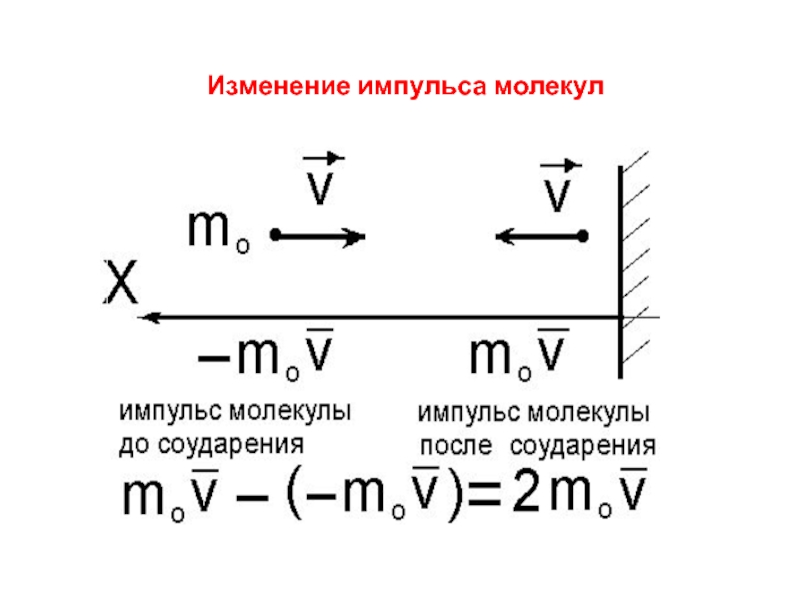
- 9. Изменение импульса молекул
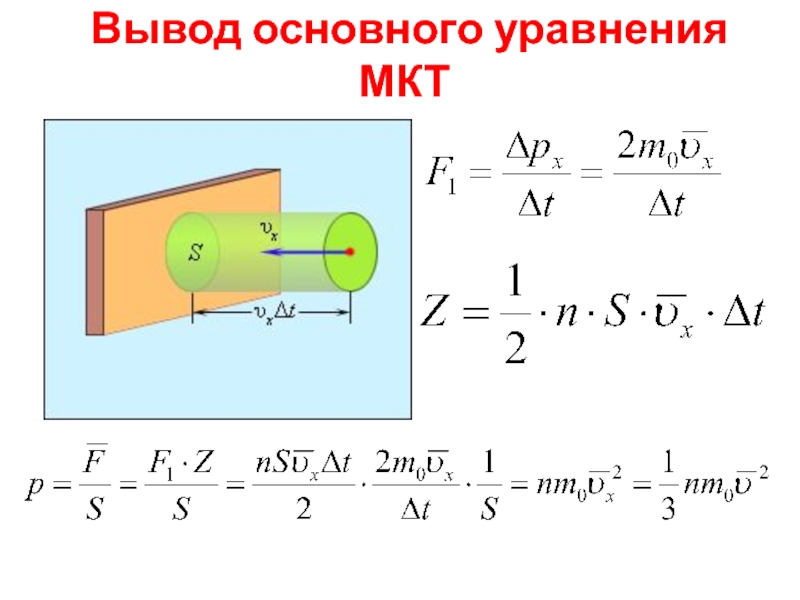
- 11. Вывод основного уравнения МКТ
- 12. Основное уравнение МКТ
- 14. Тепловым равновесием называют такое состояние, при котором
- 15. Можно предположить, что при тепловом равновесии
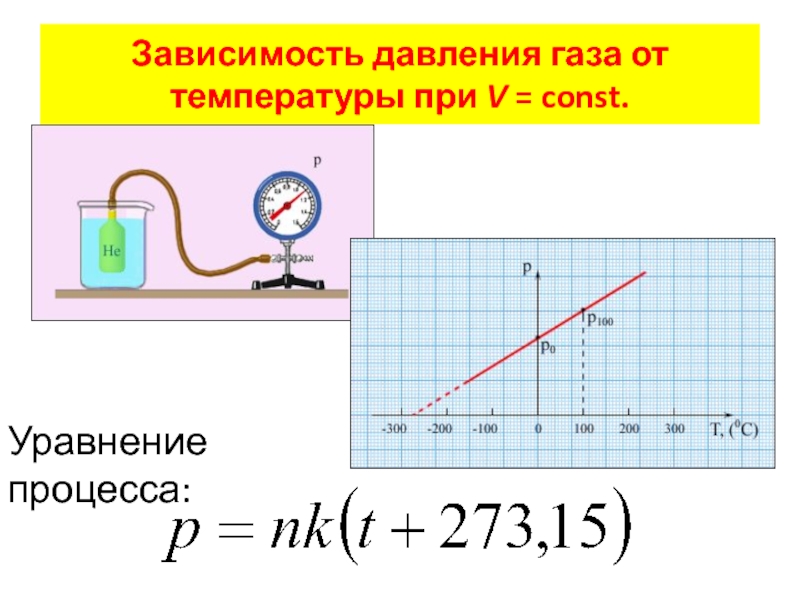
- 16. Зависимость давления газа от температуры при V = const. Уравнение процесса:
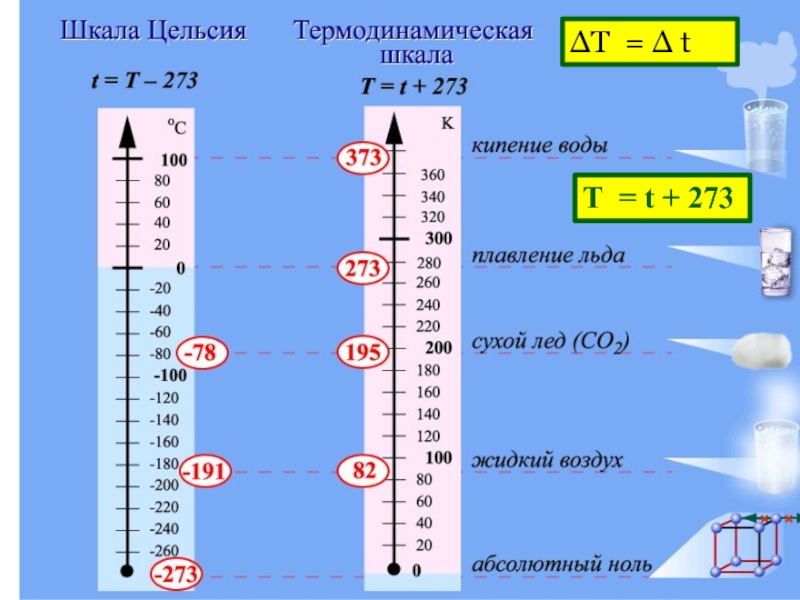
- 17. ШКАЛА КЕЛЬВИНА Английский физик У. Кельвин в
- 19. Температура – мера средней кинетической энергии молекул
- 20. ΔТ = Δ t Т = t + 273
- 21. - температура в энергетических единицах Т -
- 22. При одной и той же температуре средние кинетические энергии движения молекул всех газов равны
- 23. Универсальная газовая постоянная
- 24. Нормальные условия р0 = 100 кПа = 105 Па Т0 = 273 К
- 25. 1. При одинаковых давлениях и температурах концентрация
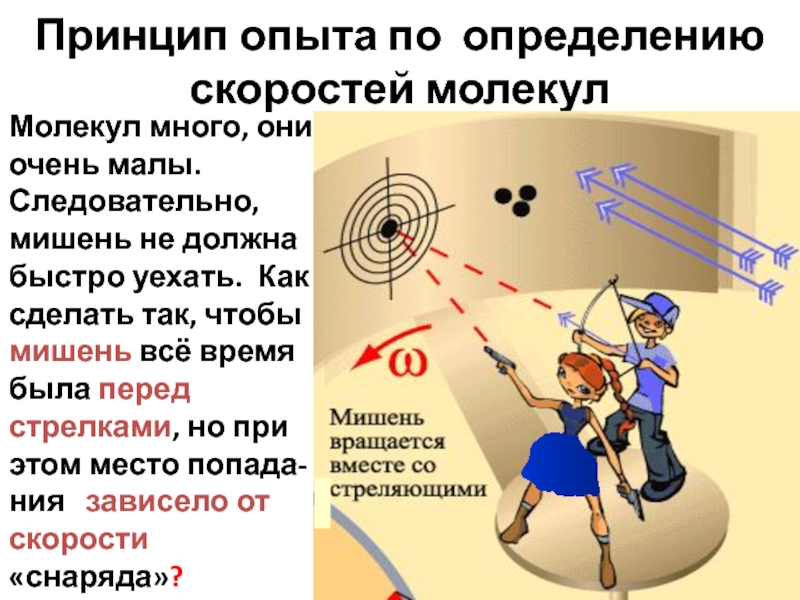
- 26. Принцип опыта по определению скоростей молекул
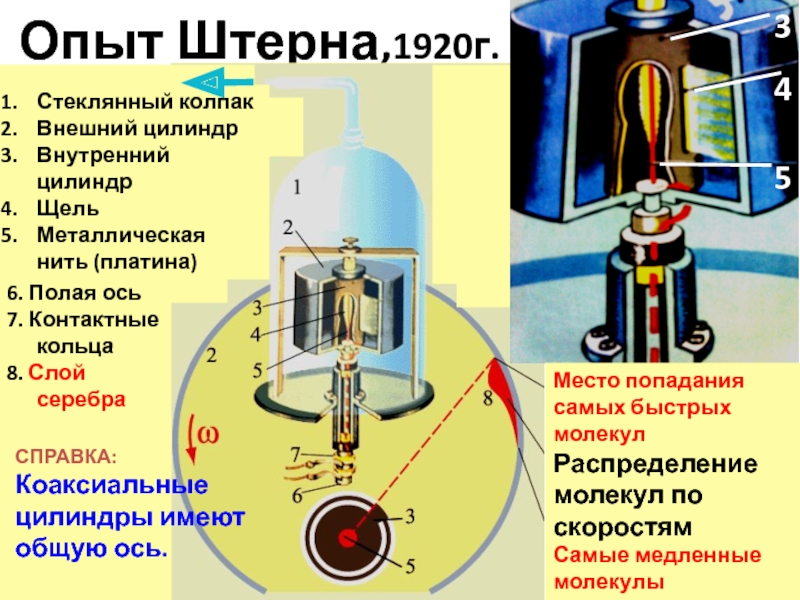
- 27. Опыт Штерна,1920г.
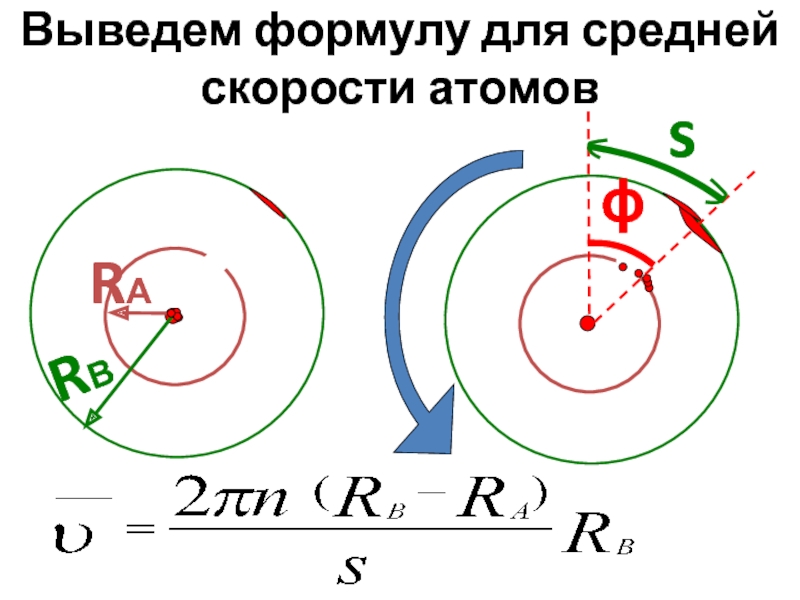
- 28. Выведем формулу для средней скорости атомов
- 29. Объясните, а как действует эта установка?
Слайд 1Идеальный газ – это модель в которой
Молекулы принимают за материальные точки
Между
Столкновения частиц между собой и со стенками сосуда абсолютно упругие
Слайд 2Размеры молекул малы по сравнению с расстояниями между ними
Силы взаимодействия проявляются
Молекулы распределены по всему объему равномерно
Молекулы газа движутся хаотично, то есть в любом направлении движется одинаковое число молекул
Скорости молекул могут принимать любые значения
Число молекул очень велико
Для отдельно взятой молекулы справедливы законы Ньютона
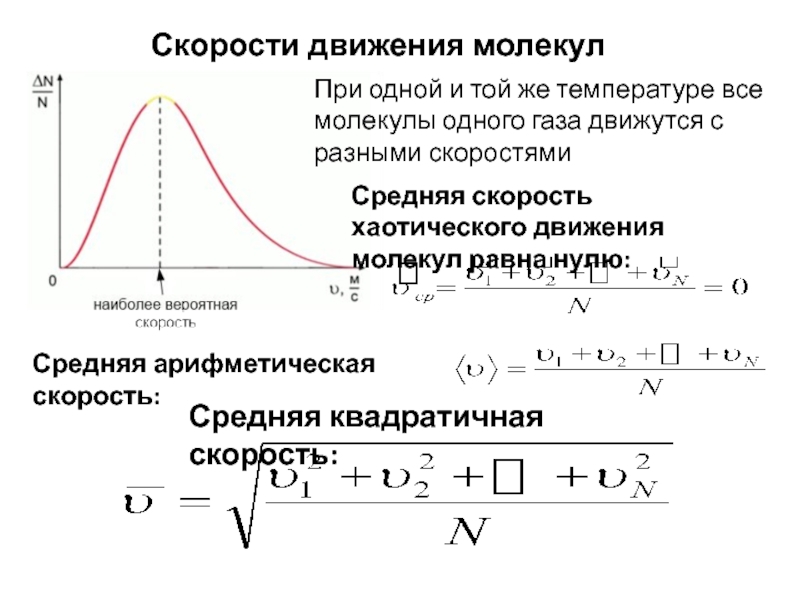
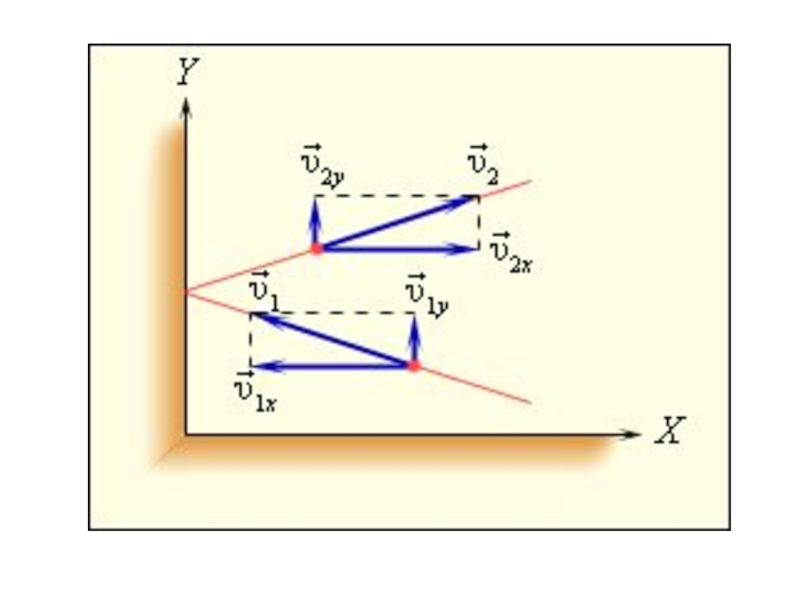
Слайд 4Скорости движения молекул
При одной и той же температуре все молекулы одного
Средняя арифметическая скорость:
Средняя скорость хаотического движения молекул равна нулю:
Средняя квадратичная скорость:
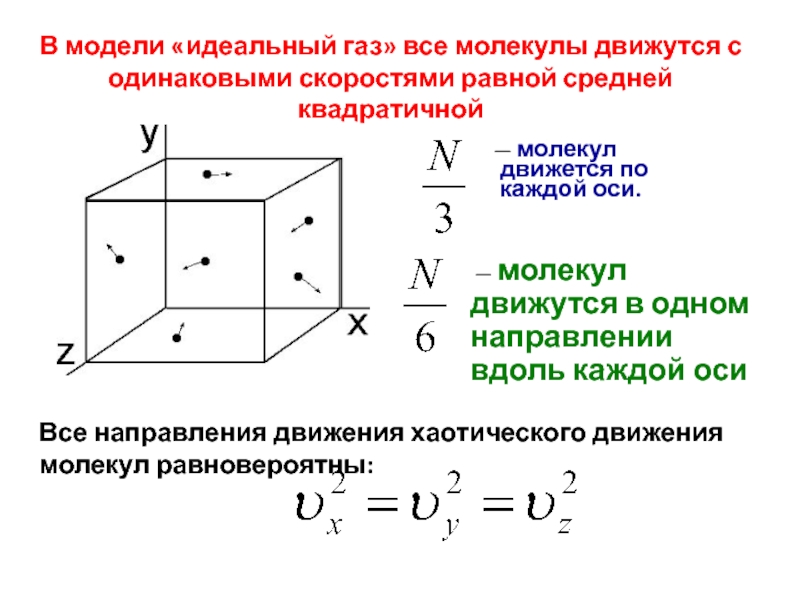
Слайд 6В модели «идеальный газ» все молекулы движутся с одинаковыми скоростями равной
— молекул движется по каждой оси.
— молекул движутся в одном направлении вдоль каждой оси
Все направления движения хаотического движения молекул равновероятны:
Слайд 7 Давление газа
создается ударами молекул
малые силы отдельных ударов складываются
Слайд 14Тепловым равновесием называют такое состояние, при котором все макроскопические параметры сколь
Температура характеризует состояние теплового равновесия системы тел: все тела системы, находящиеся друг с другом в тепловом равновесии, имеют одну и ту же температуру.
Температура характеризуют степень нагретости тел (холодное, теплое, горячее).
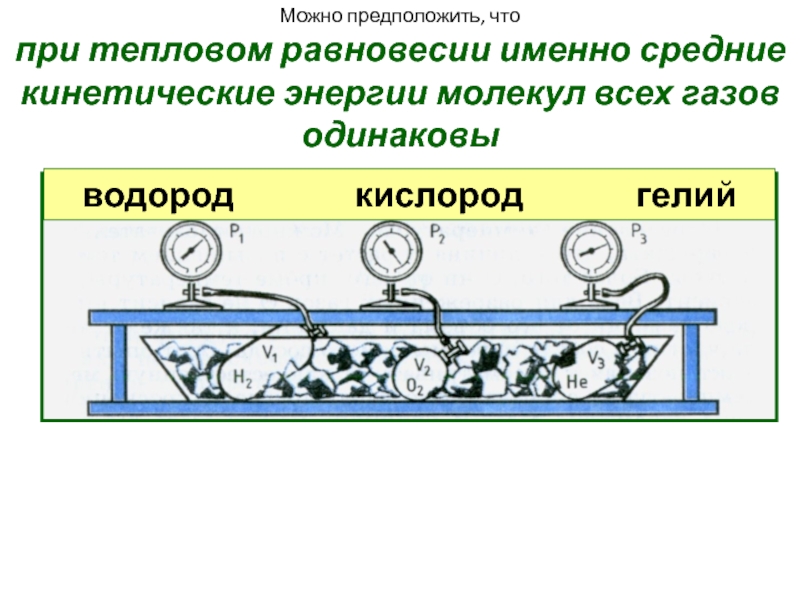
Слайд 15Можно предположить, что
при тепловом равновесии именно средние кинетические энергии молекул
водород кислород гелий
Слайд 17ШКАЛА КЕЛЬВИНА
Английский физик У. Кельвин в 1848 г. предложил использовать точку нулевого
T = t + 273 [K]
Слайд 19Температура – мера средней кинетической энергии молекул
За абсолютный ноль принимают температуру
Слайд 21- температура в энергетических единицах
Т - абсолютная температура [K]
k - постоянная
Слайд 22При одной и той же температуре средние кинетические энергии движения молекул
Слайд 251. При одинаковых давлениях и температурах концентрация молекул у всех газов
2. Для смеси газов давление равно сумме парциальных давлений – закон Дальтона
Следствия:
Слайд 26Принцип опыта по определению скоростей молекул
Молекул много, они очень малы. Следовательно,
Слайд 27Опыт Штерна,1920г.
Место попадания самых быстрых молекул
Распределение молекул по скоростям
Самые медленные молекулы
Стеклянный
Внешний цилиндр
Внутренний цилиндр
Щель
Металлическая нить (платина)
6. Полая ось
7. Контактные кольца
8. Слой серебра
5
4
3
СПРАВКА:
Коаксиальные цилиндры имеют общую ось.
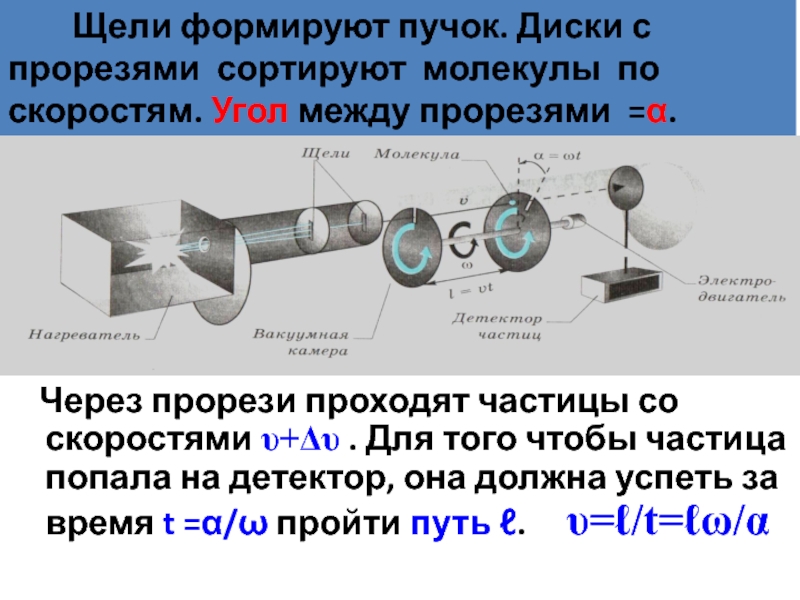
Слайд 29Объясните, а как действует эта установка?
Через прорези проходят частицы
Щели формируют пучок. Диски с прорезями сортируют молекулы по скоростям. Угол между прорезями =α.










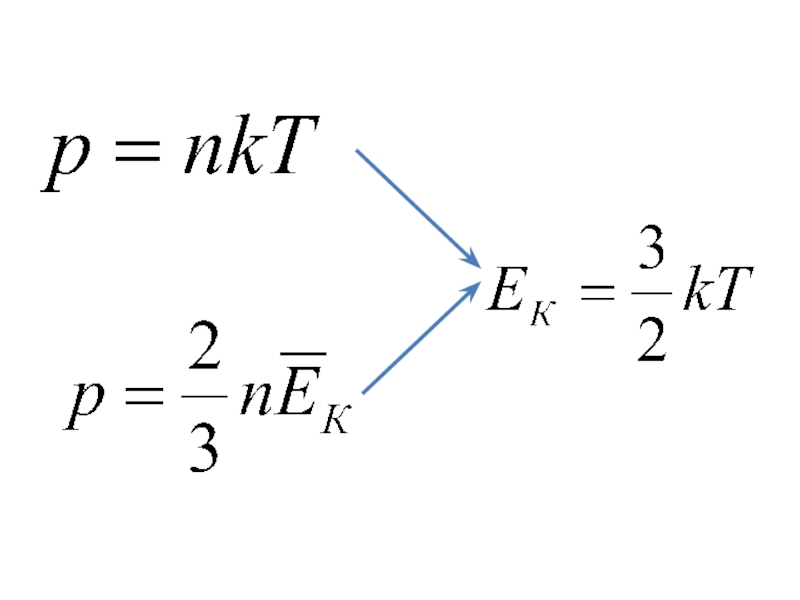

![- температура в энергетических единицахТ - абсолютная температура [K]k - постоянная Больцмана, связывает температуру в](/img/tmb/5/448419/c9886e53a249b66a895b4dc0ef353ee0-800x.jpg)