- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Методы молекулярно-абсорбционной спектроскопии в УФ- и видимой областях презентация
Содержание
- 1. Методы молекулярно-абсорбционной спектроскопии в УФ- и видимой областях
- 2. Основы методов Молекулярно-абсорбционная спектроскопия в УФ-
- 3. Типы электронных переходов
- 4. Типы электронных переходов σ→σ*-переходы - связаны с
- 6. Переходы с переносом заряда Различают: а)
- 7. Переходы с переносом заряда
- 8. Фотоэлектроколориметрия
- 9. Основы метода Фотоэлектроколориметрия основана на избирательном поглощении
- 10. Схема фотоэлектроколориметра (с однолучевой системой освещения)
- 11. Условия проведения фотоэлектроколориметрического анализа Проведение
- 12. Требования к фотометрическим реакциям Чувствительность- реакция считается
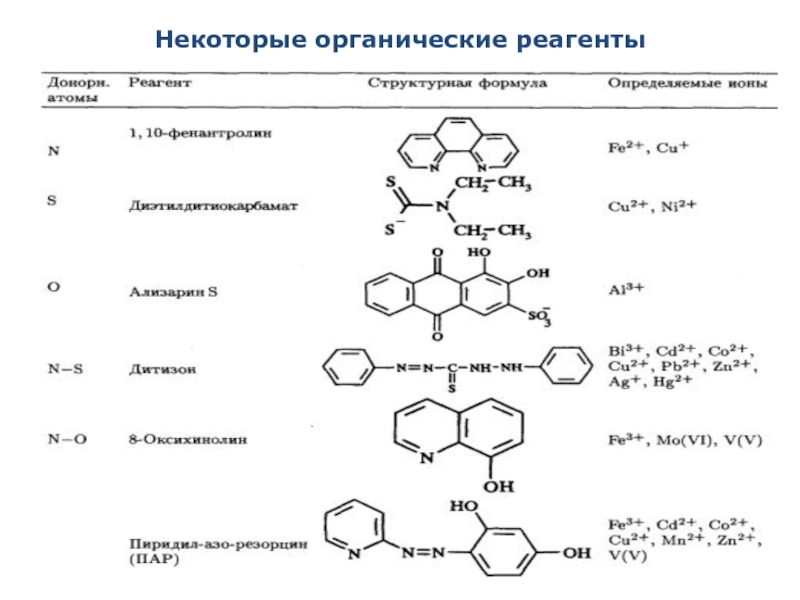
- 13. Некоторые органические реагенты
- 14. Фотометрические реакции Экстракционная фотометрия – гибридный метод
- 15. Условия проведения фотоэлектроколориметрического анализа 2. Выбор аналитической
- 16. Условия проведения фотоэлектроколориметрического анализа 3. Диапазон концентраций
- 17. Методы количественного фотоэлектроколориметрического анализа Немонохроматичность применяемого
- 18. Методы количественного фотоэлектроколориметрического анализа 2. Метод градуировочного
- 19. Методы количественного фотоэлектроколориметрического анализа 3. Метод добавок
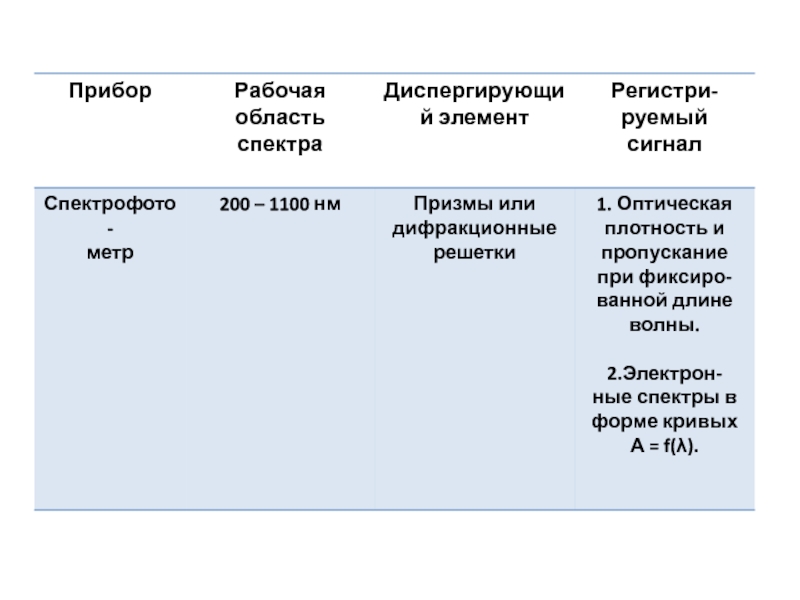
- 20. УФ – СПЕКТРОСКОПИЯ (СПЕКТРОФОТОМЕТРИЯ В УФ – И ВИДИМОЙ ОБЛАСТИ)
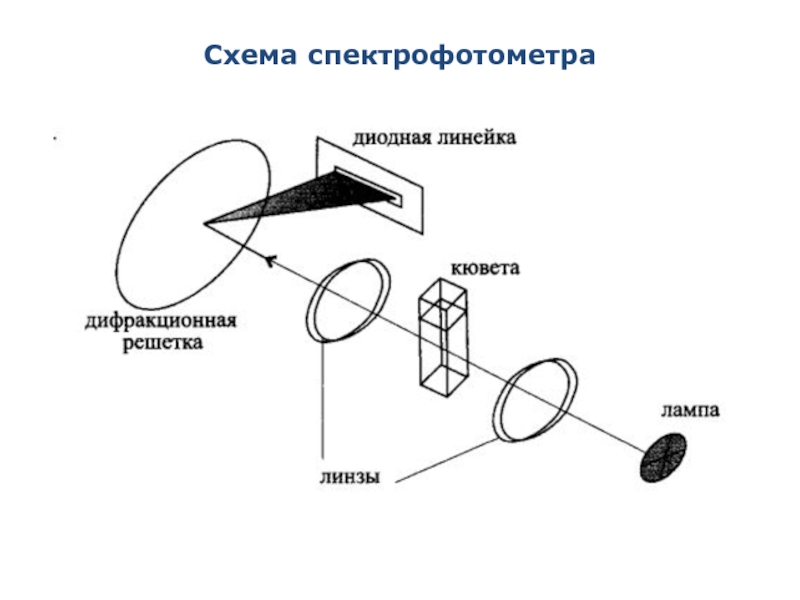
- 22. Схема спектрофотометра
- 23. Спектофотометрические определения Определения содержания веществ можно проводить
- 24. Методы количественного спектрофотометрического анализа Метод сравнения.
- 25. Дифференциальная фотометрия Метод отношения пропусканий В качестве
- 26. Дифференциальная фотометрия 2. Метод анализа следов Используют
- 27. Многоволновая спектрофотометрия (метод Фирордта) Метод применяют для
- 28. Производная спектрофотометрия Аналитическим сигналом является производная оптической
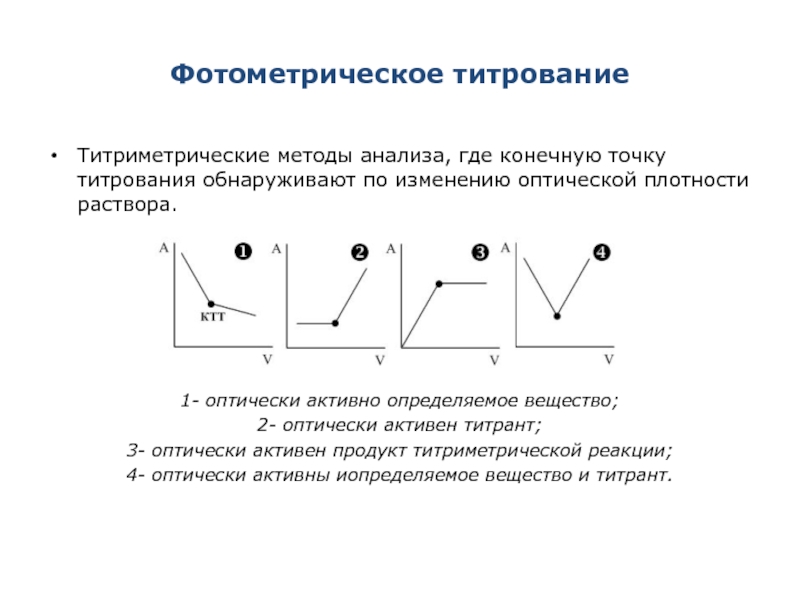
- 29. Фотометрическое титрование Титриметрические методы анализа, где конечную
- 30. Применение спектроскопии в УФ- и видимой областях
- 31. Применение спектроскопии в УФ- и видимой областях
- 32. Связь УФ – спектров со строением органических
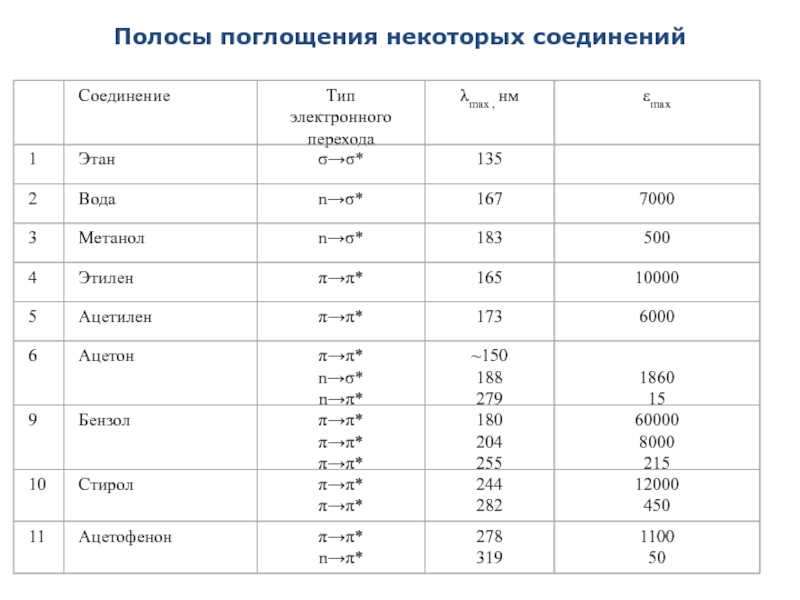
- 33. Полосы поглощения некоторых соединений
- 34. Основные понятия Ауксохромы - электронодонорные заместители,
- 35. Качественный анализ на основе электронных спектров 1.
- 36. Качественный анализ на основе электронных спектров 2.
- 37. Качественный анализ на основе электронных спектров В
- 38. Качественный анализ на основе электронных спектров 3.
- 39. Качественный анализ на основе электронных спектров 4.
- 40. Электронные спектры поглощения отдельных классов органических соединений
- 41. АЛКЕНЫ Изолированные двойные углерод-углеродные связи имеют
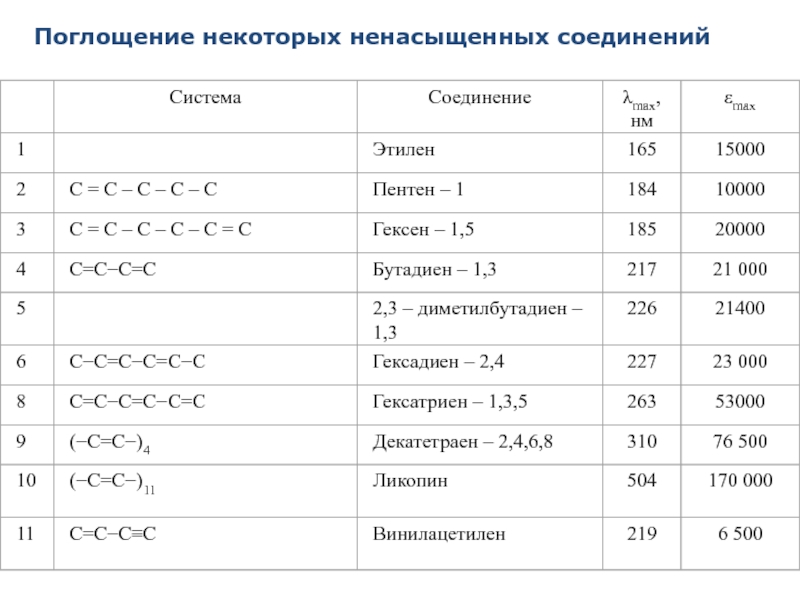
- 42. Поглощение некоторых ненасыщенных соединений
- 43. АЛКИНЫ Для ацетиленовых углеводородов с изолированной
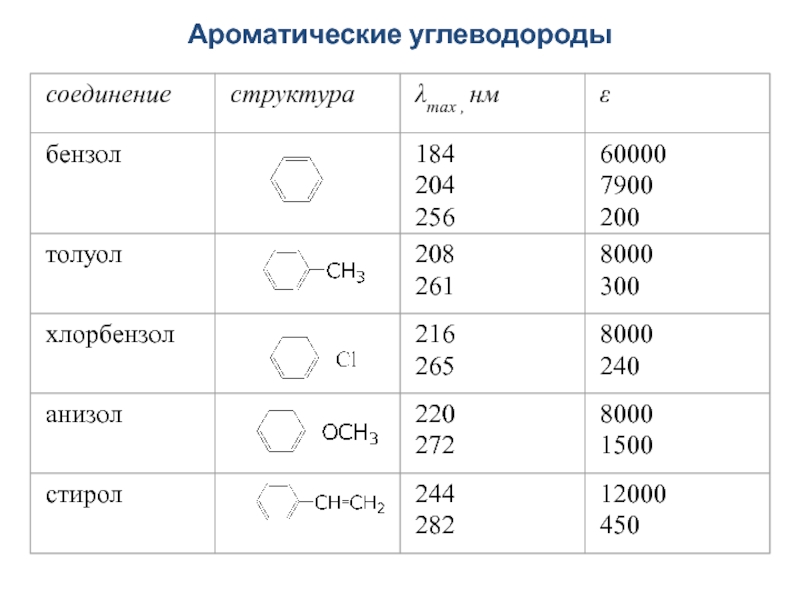
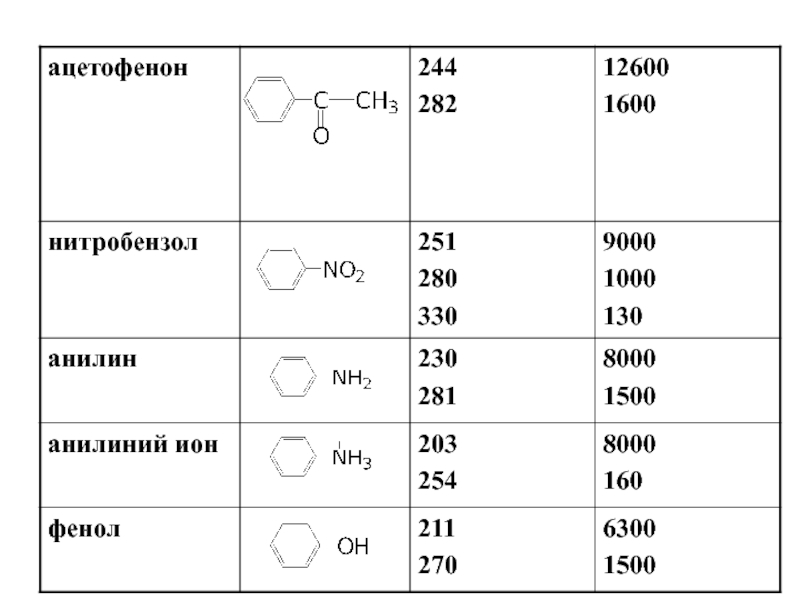
- 44. Ароматические углеводороды
- 47. Альдегиды, кетоны Насыщенные и несопряжённые альдегиды и
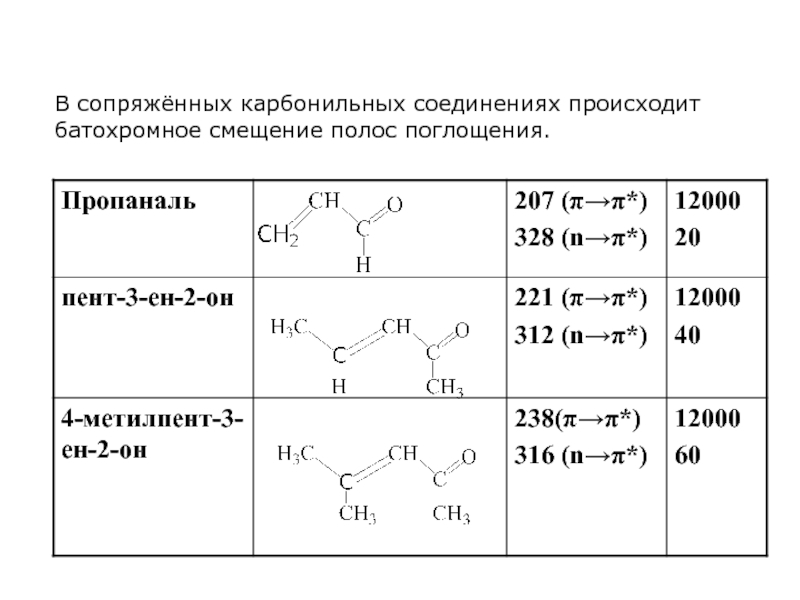
- 48. В сопряжённых
- 49. Карбоновые кислоты Алифатические карбоновые кислоты
- 50. Заключение Методы молекулярно-абсорбционной спектроскопии являются одними из
Слайд 1
Методы молекулярно-абсорбционной спектроскопии в УФ- и видимой областях
канд.хим.наук, доцент Л.А. Дрыгунова
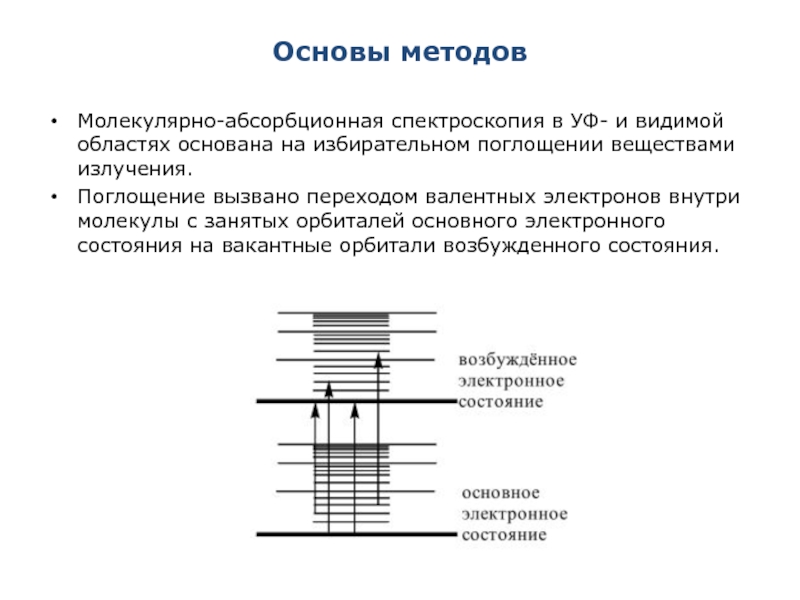
Слайд 2Основы методов
Молекулярно-абсорбционная спектроскопия в УФ- и видимой областях основана на
Поглощение вызвано переходом валентных электронов внутри молекулы с занятых орбиталей основного электронного состояния на вакантные орбитали возбужденного состояния.
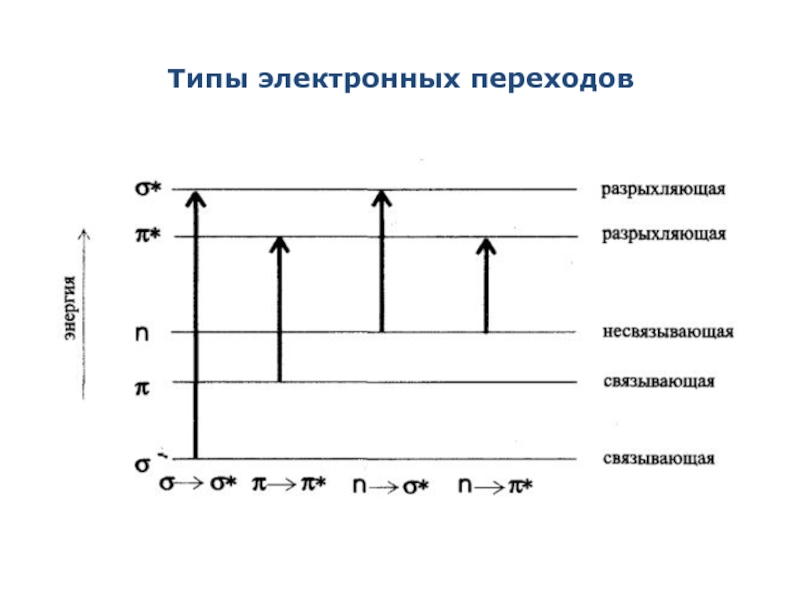
Слайд 4Типы электронных переходов
σ→σ*-переходы - связаны с самыми большими изменениями энергии. Наблюдаются
n→σ*-переходы – связаны уже с меньшими затратами энергии. Характерны для соединений, содержащих гетероатомы (N, O, S). Полосы поглощения, вызванные этими переходами, наблюдаются в УФ – области до 300 нм. Значение длины волны в максимуме поглощения зависит от электроотрицательности гетероатома.
CH3Cl λmax = 173 нм
CH3OH λmax = 184 нм
Слайд 5
π → π * - переходы - требуют еще меньшей
n→ π* - переходы - полосы поглощения, соответствующие этим переходам, находятся в наиболее длинноволновой области и имеют меньшую интенсивность. Характерны для молекул, содержащих кратные связи и гетероатом. π → π* - переходы и n→π* - переходы имеют наибольшее аналитическое значение
Типы электронных переходов
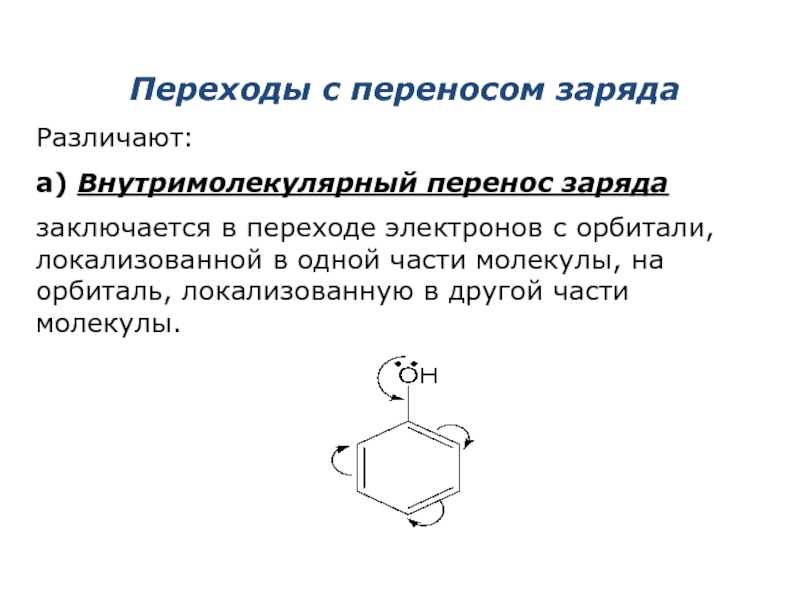
Слайд 6Переходы с переносом заряда
Различают:
а) Внутримолекулярный перенос заряда
заключается в переходе
Слайд 7
Переходы с переносом заряда
б) Комплекс с переносом заряда
Две частицы (молекулы
Слайд 9Основы метода
Фотоэлектроколориметрия основана на избирательном поглощении немонохроматического излучения в видимой области
Слайд 11 Условия проведения фотоэлектроколориметрического анализа
Проведение фотометрической реакции.
В видимой области поглощают
Фотометрическая реакция – перевод неокрашенных и слабоокрашенных соединений действием специальных реагентов в окрашенные соединения для увеличения интенсивности поглощения.
Чаще в качестве фотометрических реакций используют реакции комплексообразования, а также окислительно-восстановительные, с различными органическими реагентами и др.
Cu2+ + 4 NH3 = [ Cu(NH3)4 ] 2+
Слайд 12Требования к фотометрическим реакциям
Чувствительность- реакция считается чувствительной, если величина молярного коэффициента
Избирательность – в реакцию должно вступать только определяемое вещество.
Устойчивость образующегося комплекса.
Полнота связывания определяемого компонента в комплекс.
Интенсивная окраска образующегося комплекса.
Хорошая растворимость комплекса в растворителе.
Разность между длинами волн, соответствующих максимумам поглощения реагента и продукта реакции (оптимально, если ∆λ=80 нм).
Слайд 14Фотометрические реакции
Экстракционная фотометрия – гибридный метод анализа, в котором после проведения
Экстракционную фотометрию чаще используют в случаях, когда продукт фотометрической реакции плохо растворим в воде, либо в растворе присутствуют соединения, мешающие определению.
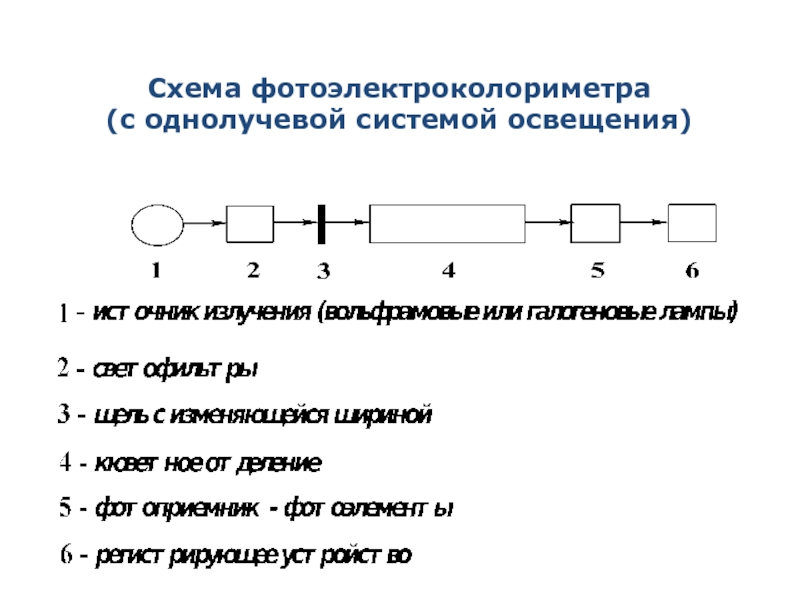
Слайд 15Условия проведения фотоэлектроколориметрического анализа
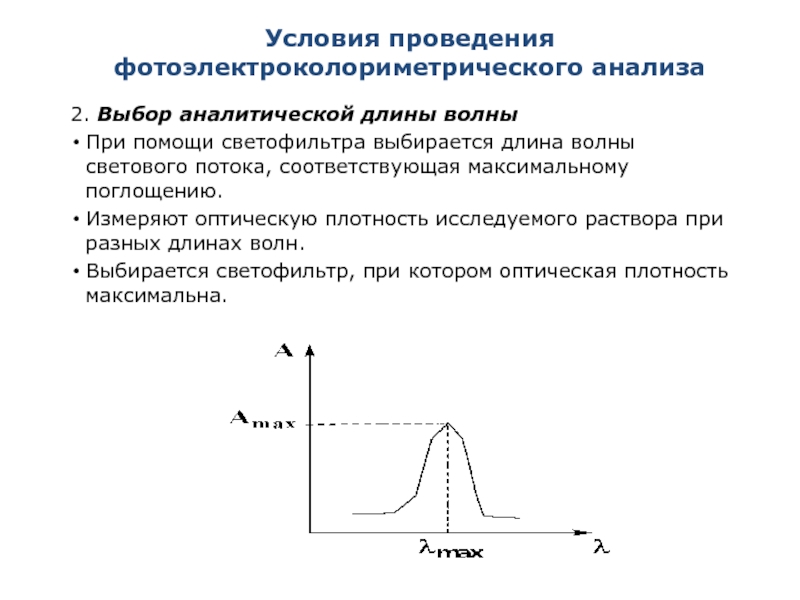
2. Выбор аналитической длины волны
При помощи светофильтра выбирается
Измеряют оптическую плотность исследуемого раствора при разных длинах волн.
Выбирается светофильтр, при котором оптическая плотность максимальна.
Слайд 16Условия проведения фотоэлектроколориметрического анализа
3. Диапазон концентраций анализируемых растворов
Оптимальный диапазон оптических плотностей
А = ε · l · C
Подбирают концентрацию и толщину кюветы таким образом, чтобы обеспечить оптимальный диапазон оптических плотностей, обычно C < 0.01моль/л.
4. Наличие раствора сравнения
При анализе однокомпонентных растворов раствором сравнения является растворитель или это может быть раствор, содержащий все компоненты анализируемого раствора, кроме определяемого вещества.
Слайд 17Методы количественного фотоэлектроколориметрического анализа
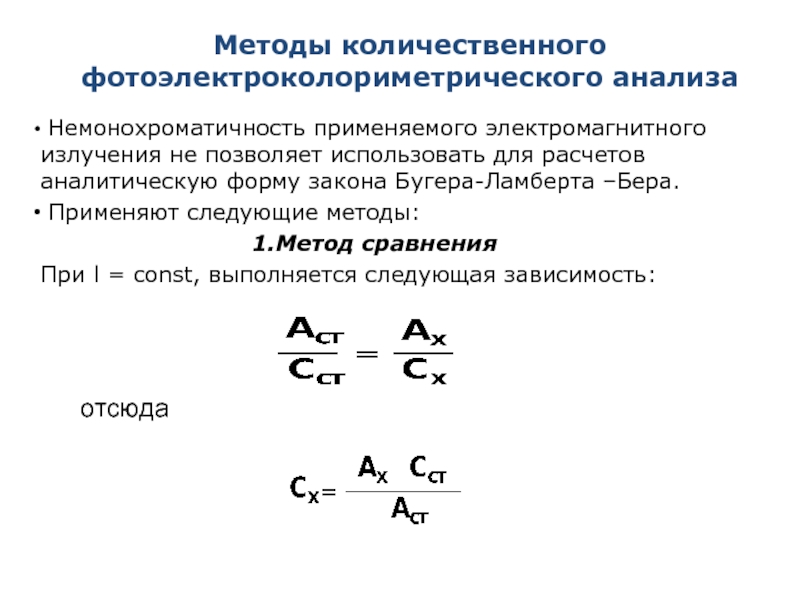
Немонохроматичность применяемого электромагнитного излучения не позволяет использовать
Применяют следующие методы:
Метод сравнения
При l = const, выполняется следующая зависимость:
отсюда
Слайд 18Методы количественного фотоэлектроколориметрического анализа
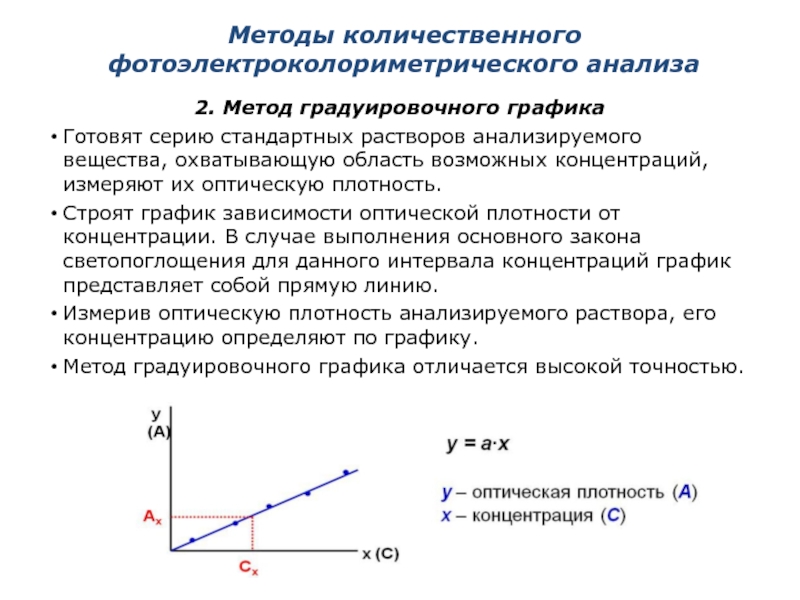
2. Метод градуировочного графика
Готовят серию стандартных растворов анализируемого
Строят график зависимости оптической плотности от концентрации. В случае выполнения основного закона светопоглощения для данного интервала концентраций график представляет собой прямую линию.
Измерив оптическую плотность анализируемого раствора, его концентрацию определяют по графику.
Метод градуировочного графика отличается высокой точностью.
Слайд 19Методы количественного фотоэлектроколориметрического анализа
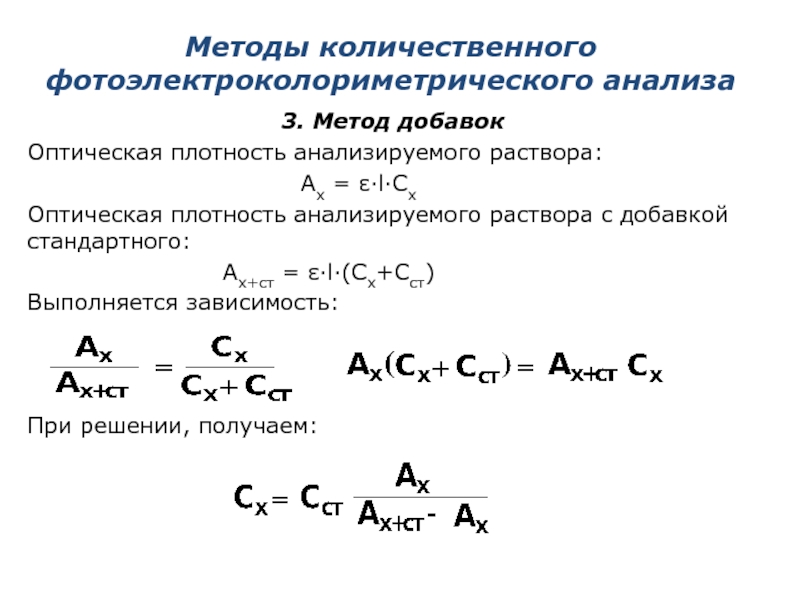
3. Метод добавок
Оптическая плотность анализируемого раствора:
Оптическая плотность анализируемого раствора c добавкой стандартного:
Ax+ст = ε·l·(Cx+Сст)
Выполняется зависимость:
При решении, получаем:
Слайд 23Спектофотометрические определения
Определения содержания веществ можно проводить непосредственно, а также с использованием
Определения без реагентов
В УФ-области можно определять многие органические соединения, имеющие полосы поглощения π→π* и n→π*- переходов в УФ-области, например, ароматические углеводороды и т.д.
В видимой области можно определять окрашенные органические соединения, имеющих полосы π→π* и n→π*- переходов в видимой области, а также окрашенные неорганические соединения, поглощение которых, как правило, вызвано совершением d→d*- переходов, например, MnO4--, Cr2O72—ионы.
Определения с помощью реагентов
Для проведения анализа проводят фотометрическую реакцию.
Слайд 24Методы количественного
спектрофотометрического анализа
Метод сравнения.
Метод градуировочного графика.
Метод добавок.
Метод
Обязательное условие применения метода-
подчинение анализируемой системы закону Бугера-Ламберта-Бера.
Если коэффициент поглощения анализируемого вещества неизвестен, его определяют экспериментально.
Готовят серию стандартных растворов анализируемого вещества, измеряют оптическую плотность, для каждого рассчитывают коэффициент поглощения, получают среднее значение.
Измерив оптическую плотность анализируемого раствора и зная коэффици
Слайд 25Дифференциальная фотометрия
Метод отношения пропусканий
В качестве раствора сравнения используют раствор известной концентрации
Слайд 26Дифференциальная фотометрия
2. Метод анализа следов
Используют при анализе растворов с низкой оптической
Метод предельной точности
Границы оптической плотности устанавливаются по двум растворам известной концентрации С1 и С2 (С1< Сх< С2). Расчет концентрации проводят методом градуировочного графика.
Слайд 27Многоволновая спектрофотометрия
(метод Фирордта)
Метод применяют для анализа растворов, содержащих несколько светопоглощающих частиц.
Для раствора, содержащего два вида светопоглощающих частиц:
Решение системы уравнений позволит рассчитать концентрации С1 и С2.
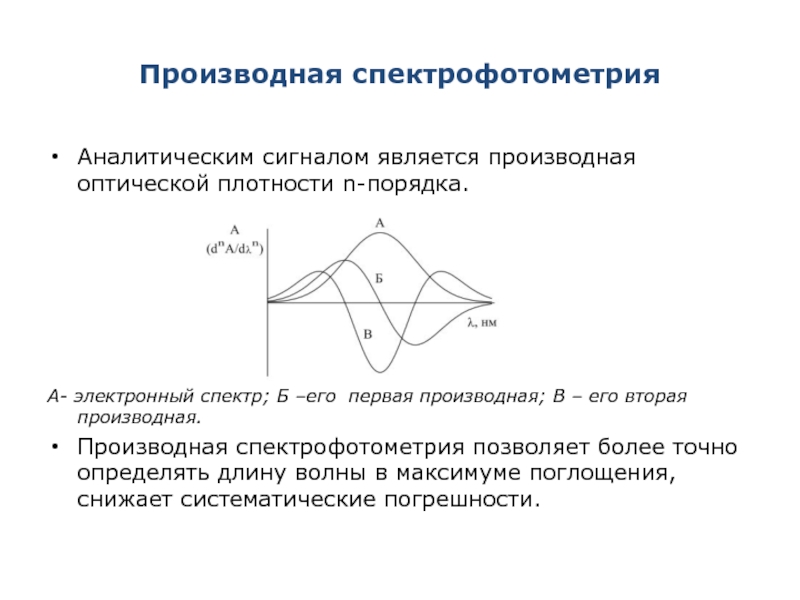
Слайд 28Производная спектрофотометрия
Аналитическим сигналом является производная оптической плотности n-порядка.
А- электронный спектр; Б
Производная спектрофотометрия позволяет более точно определять длину волны в максимуме поглощения, снижает систематические погрешности.
Слайд 29Фотометрическое титрование
Титриметрические методы анализа, где конечную точку титрования обнаруживают по изменению
1- оптически активно определяемое вещество;
2- оптически активен титрант;
3- оптически активен продукт титриметрической реакции;
4- оптически активны иопределяемое вещество и титрант.
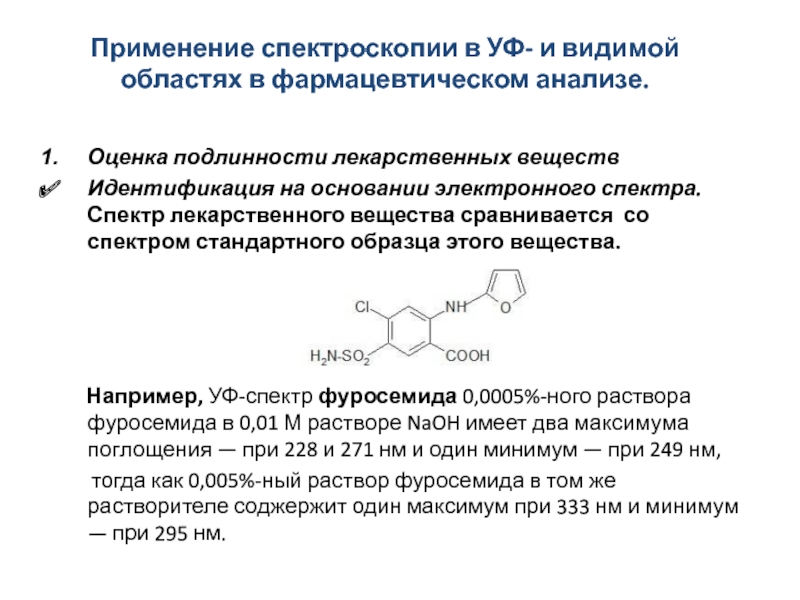
Слайд 30Применение спектроскопии в УФ- и видимой областях в фармацевтическом анализе.
Оценка подлинности
Идентификация на основании электронного спектра. Спектр лекарственного вещества сравнивается со спектром стандартного образца этого вещества.
Например, УФ-спектр фуросемида 0,0005%-ного раствора фуросемида в 0,01 М растворе NaOH имеет два максимума поглощения — при 228 и 271 нм и один минимум — при 249 нм,
тогда как 0,005%-ный раствор фуросемида в том же растворителе соджержит один максимум при 333 нм и минимум — при 295 нм.
Слайд 31Применение спектроскопии в УФ- и видимой областях в фармацевтическом анализе.
Идентификация на
Например, коэффициент поглощения парацетомола в 0,1М растворе HCl при 240 нм равен 880 л/моль см.
Оценка чистоты лекарственного вещества.
Готовят раствор лекарственного вещества определенной концентрации и измеряют величину оптической плотности при определенной длине волны. Например, оптическая плотность 16%-ного раствора анальгина при 400 нм не должна превышать 0.1.
обнаружение специфических примесей по появлению дополнительных полос поглощения в электронном спектре. Например, максимум поглощения адреналина находится при 278 нм, а его специфической примеси – адреналона, при 310 нм.
3. Определение количественного содержания лекарственных веществ.
Слайд 32Связь УФ – спектров со строением органических соединений
Хромофоры – это структурные
Слайд 34Основные понятия
Ауксохромы - электронодонорные заместители, (−ОН, −ОR, −NН2 -NHR, галогены).
Батохромный
Гипсохромный сдвиг (или синий сдвиг) – сдвиг полосы поглощения в сторону меньших длин волн.
Гиперхромный эффект - повышение интенсивности поглощения.
Гипохромный эффект – понижение интенсивности поглощения.
Слайд 35Качественный анализ на основе электронных спектров
1. Идентификация органических соединений
Осуществляется сравнением
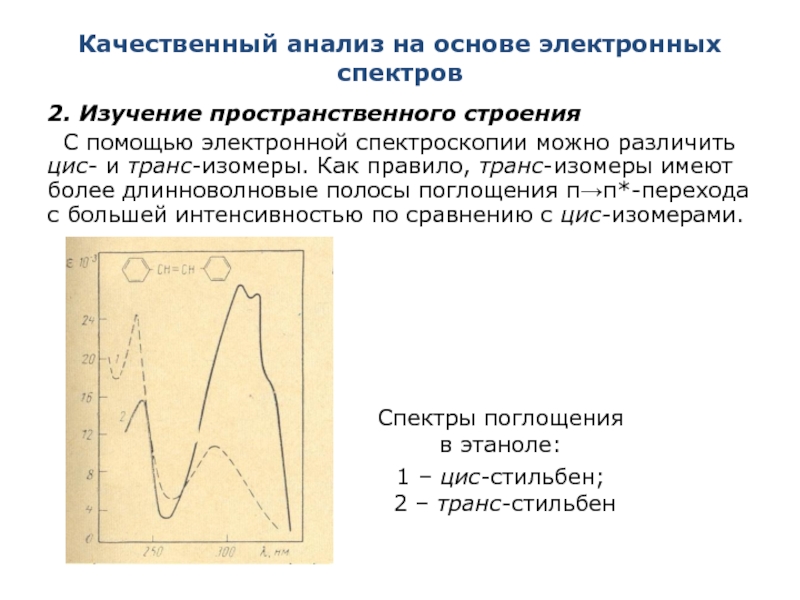
Слайд 36Качественный анализ на основе электронных спектров
2. Изучение пространственного строения
С помощью
Слайд 37Качественный анализ на основе электронных спектров
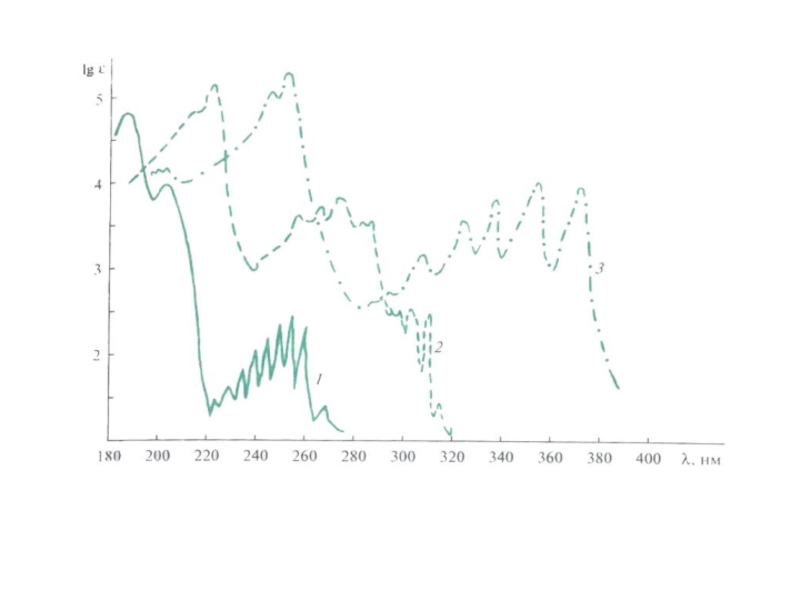
В сопряжённых системах, содержащих объёмные заместители,
1 – дифенил;
2 – 2 – метилдифенил;
3 – 2,6 – диметилдифенил;
4 – 2,2’- диметилдифенил;
5 – 2,2’,6,6’- тетраметилдифенил
Слайд 38Качественный анализ на основе электронных спектров
3. Изучение кинетики и контроль за
Осуществляется в процессе синтеза органических соединений. В этих случаях спектры записывают для выбранных аналитических длин волн исходного соединения и (или) продукта реакции. Регистрируется изменение оптической плотности от начала до конца реакции как функция времени.
Слайд 39Качественный анализ на основе электронных спектров
4. Исследование равновесий в растворах
Используется
Слайд 40Электронные спектры поглощения отдельных классов органических соединений
АЛКАНЫ
Слайд 41АЛКЕНЫ
Изолированные двойные углерод-углеродные связи имеют интенсивную полосу поглощения, обусловленную π→π* переходом,
Алкильные заместители у этиленовых углеродных атомов приводят к небольшому батохромному сдвигу, и соответствующее поглощение наблюдается при 175–200 нм. Циклические непредельные углеводороды имеют спектры, аналогичные спектрам алкенов.
При сопряжении кратных связей наблюдают батохромный и гиперхромный эффекты полос поглощения.
Слайд 43АЛКИНЫ
Для ацетиленовых углеводородов с изолированной С≡С связью наблюдается полоса поглощения π→π*
Ацетилен λmax = 173 нм
алкилацетилены λmax= 187 нм
диалкилацетилены λmax 190 нм.
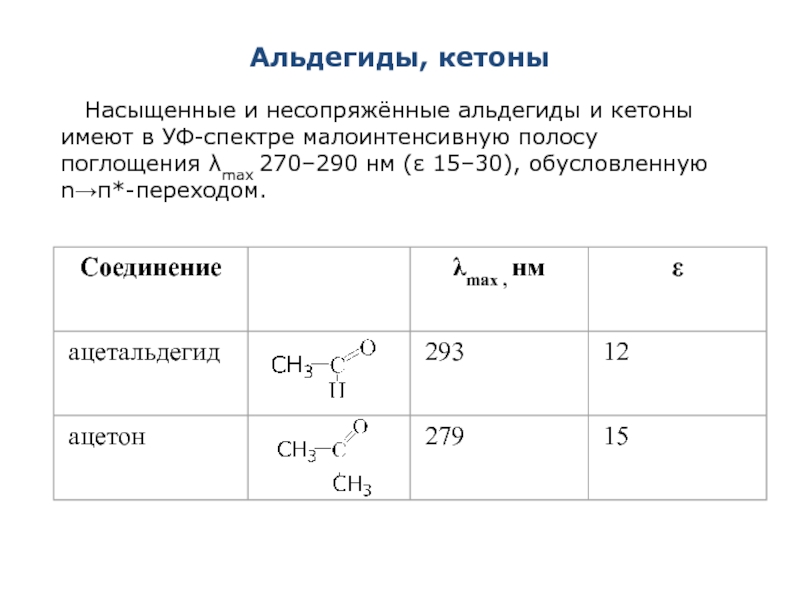
Слайд 47Альдегиды, кетоны
Насыщенные и несопряжённые альдегиды и кетоны имеют в УФ-спектре малоинтенсивную