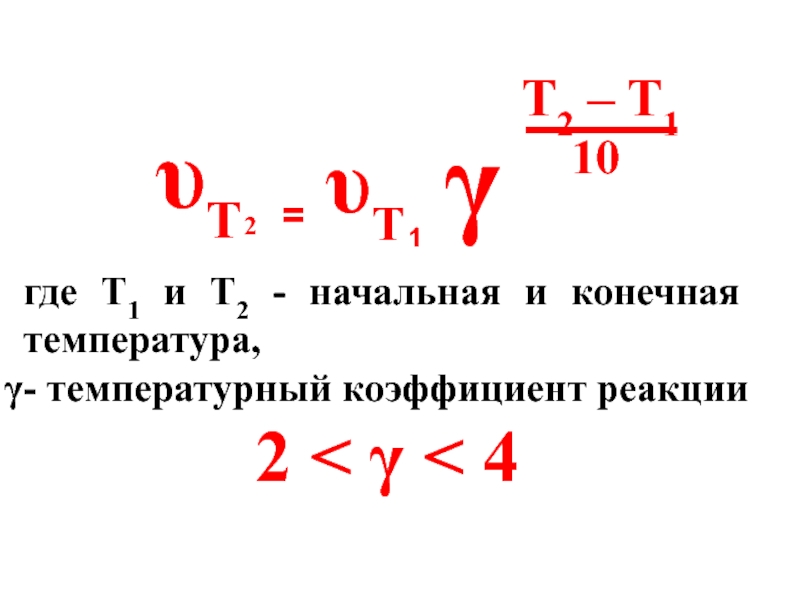- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Химическая кинетика. Лекция 9 презентация
Содержание
- 1. Химическая кинетика. Лекция 9
- 2. Химическая кинетика - то раздел химии, изучающий скорость и механизм химических реакций.
- 3. Кинетический метод исследования, наряду с термодинамическим и квантово-механическим, широко применяется в современном естествознании.
- 4. 9.1 Понятие о скорости и механизме химических
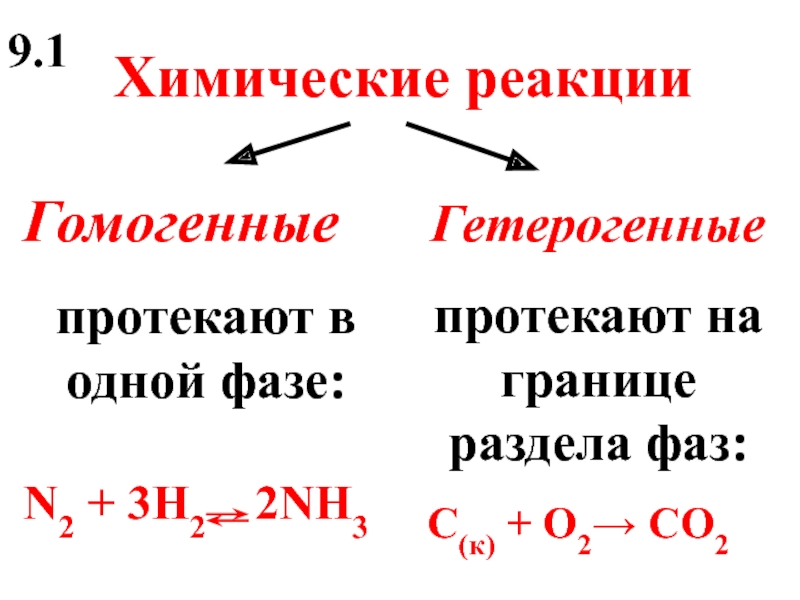
- 5. Химические реакции Гомогенные протекают в одной
- 6. Средняя скорость гомогенной реакции (υ) равна изменению
- 7. [A]0_ и [A] – исходная и
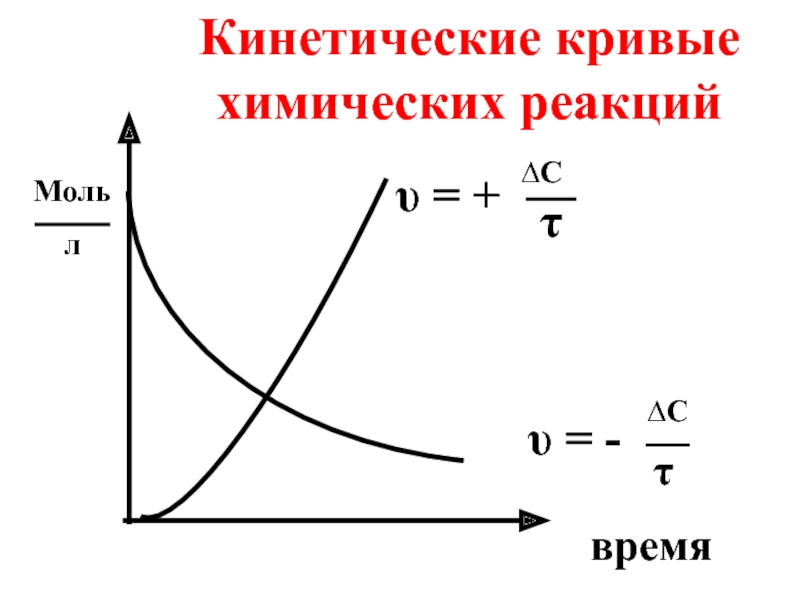
- 8. Кинетические кривые химических реакций время
- 9. Скорость гетерогенной реакции равна изменению количества вещества
- 10. где ν0 и ν – количество вещества
- 11. Большинство биохимических реакций являются гомо- генными. Они
- 12. Полное обновление костной ткани осуществляется за 4-7
- 13. На скорость химических реакций влияет: а) природа реагирующих веществ, б) их агрегатное состояние,
- 14. в) природа растворителя (если реакция протекает в
- 15. д) концентрация реагирующих веществ, е) давление (для газофазных реакций), ж) температура, з) катализатор.
- 16. Чтобы произошла химическая реакция, необходимо взаимодействие между
- 18. Во всем многообразии столкновений выделяют элементарные стадии процесса.
- 20. Элементарная стадия – это столкновение молекул реагирующих веществ, приводящее к образованию молекул продуктов.
- 21. Механизм химической реакции – это число и последовательность элементарных стадий процесса.
- 22. Характеристикой механизма является молекулярность элементарных стадий. Молекулярность – это число частиц, участвующих в элементарном превращении.
- 23. Различают: а) мономолекулярные превра-щения:
- 24. Молекулярность не может быть больше трех, т.к. вероятность столкновения четырех и более частиц ничтожно мала.
- 25. Химическая реакция является простой, если представляет собой
- 26. Если химическая реакция протекает в несколько стадий,
- 27. Радикал – это атом или группа атомов,
- 28. H2 + Br2 → 2HBr Механизм:
- 29. 2) рост цепи (бимолекулярная стадия): Br
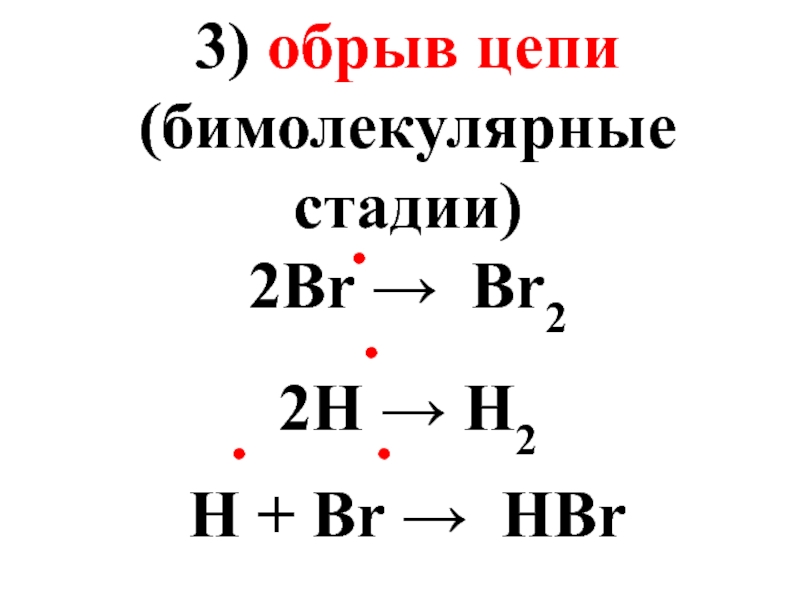
- 30. 3) обрыв цепи (бимолекулярные стадии) 2Br →
- 31. Радикальные реакции протекают in vivo под
- 32. Ученые считают, что накопление радикалов во внутриклеточных жидкостях – одна из причин старения.
- 33. Реакция пероксидного окисления липидов, скорость которой резко
- 34. Для снижения скорости пероксидного окисления используется антиоксиданты: витамины А, Е, С, соединения селена.
- 35. 9.2 Уравнения, описывающие влияние концентрации реагирующих веществ на скорость химических реакций, называются кинетическими уравнениями.
- 36. Кинетические уравнения составляют на основе закона действующих
- 37. Математическое выражение ЗДМ для реакции: аА +
- 38. k зависит от температуры и природы веществ
- 39. Порядок реакции определяется только экспериментально. Он является
- 40. Для радикальной реакции H2 + Br2 → 2HBr кинетическое уравнение υ = k[H2][Br2]1/2
- 41. Только для простых реакций порядок и молекулярность
- 42. Кинетическое описание простых реакций. Реакции нулевого порядка
- 43. Условное уравнение: Константа скорости
- 44. [A] Кинетическая кривая реакций нулевого порядка υ
- 45. Время полуреакции (τ ½) –это время, необходимое
- 46. Реакции первого порядка (n=1) Примеры: каталитические и
- 47. Условное уравнение: Константа скорости
- 48. Кинетическая кривая реакции первого порядка [A] υ
- 49. Время полуреакции: τ ½ = ℓn 2 k
- 50. Период полураспада некоторых радионуклидов I131
- 51. Реакции второго порядка (n=2) Примеры: гидролиз белков, жиров, углеводов и других биологически активных соединений.
- 52. Условные уравнения: 2 А → Р А
- 53. Константа скорости: k = 1 τ [A]0
- 54. Кинетика сложных реакций 1) обратимые реакции
- 55. A B C k1 k2 KClO3
- 56. Скорость реакции равна скорости ее лимитирующей
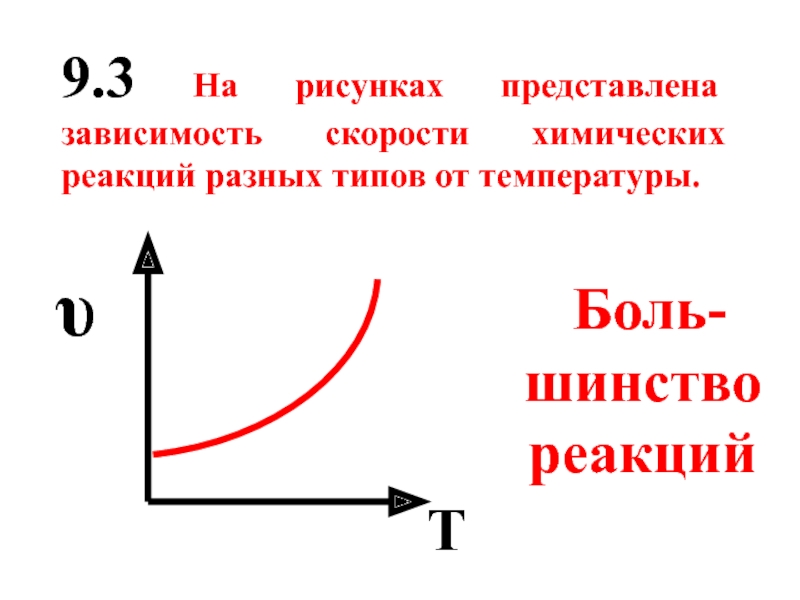
- 57. 9.3 На рисунках представлена зависимость скорости химических
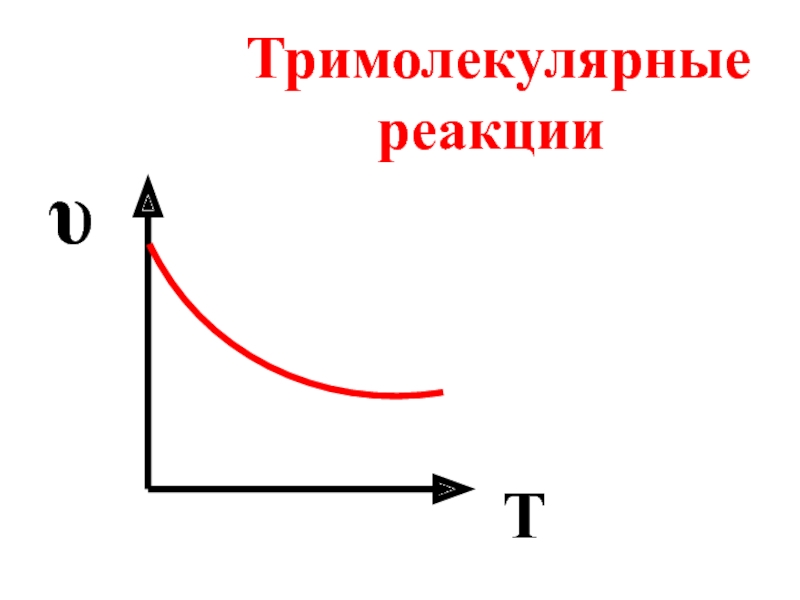
- 58. υ T Тримолекулярные реакции
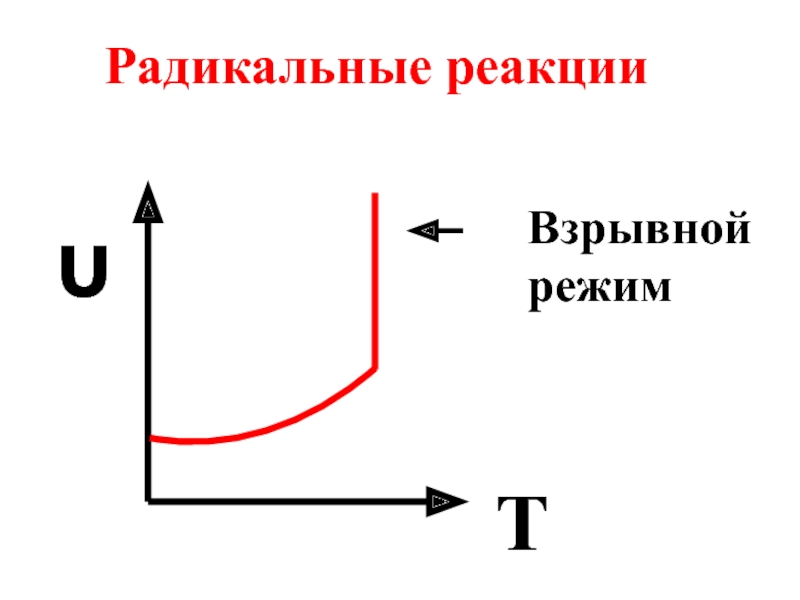
- 59. υ T Взрывной режим Радикальные реакции
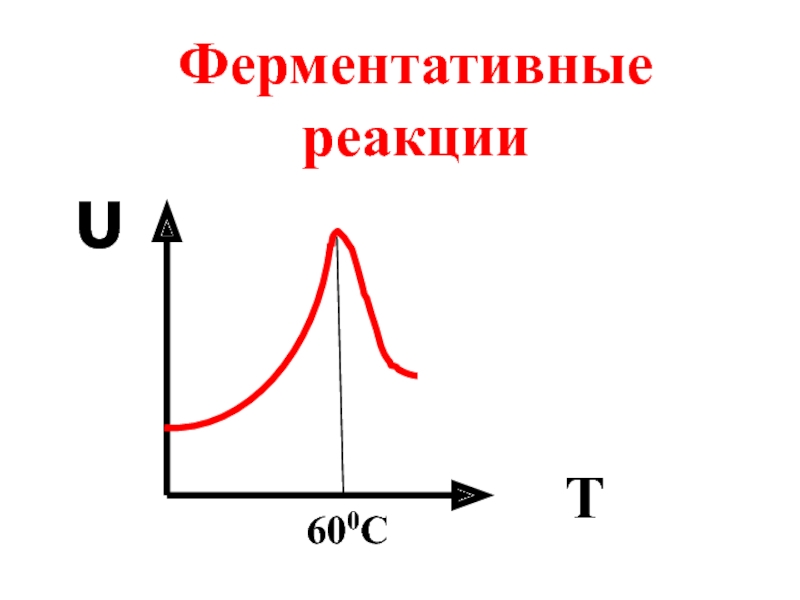
- 60. Ферментативные реакции υ T 600C
- 61. Для большинства химических реакций выполняется правило Вант-Гоффа:
- 62. υT 2 = υT 1 γ
- 63. Для биохимических реакций 1,5 < γ
- 64. Значительно точнее зависимость скорости и температуры описывается
- 65. где υ0 и k0 - коэффициенты пропорциональности,
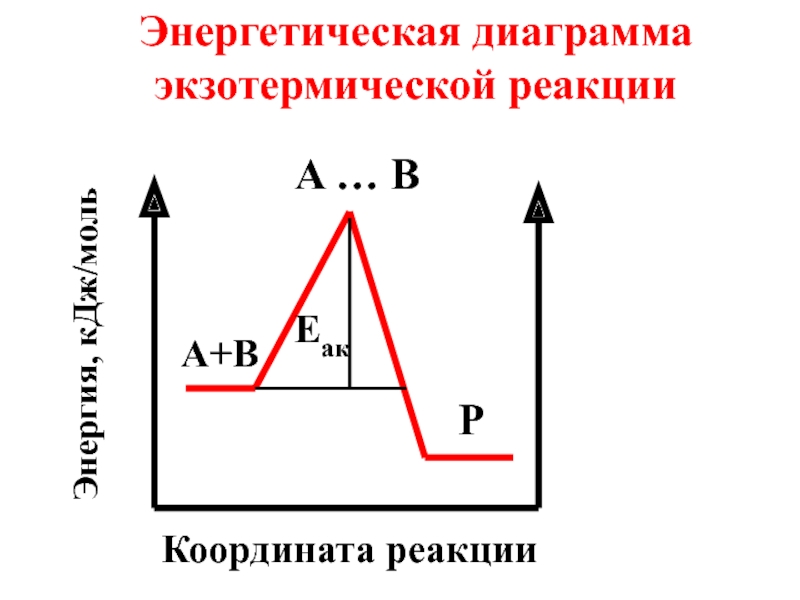
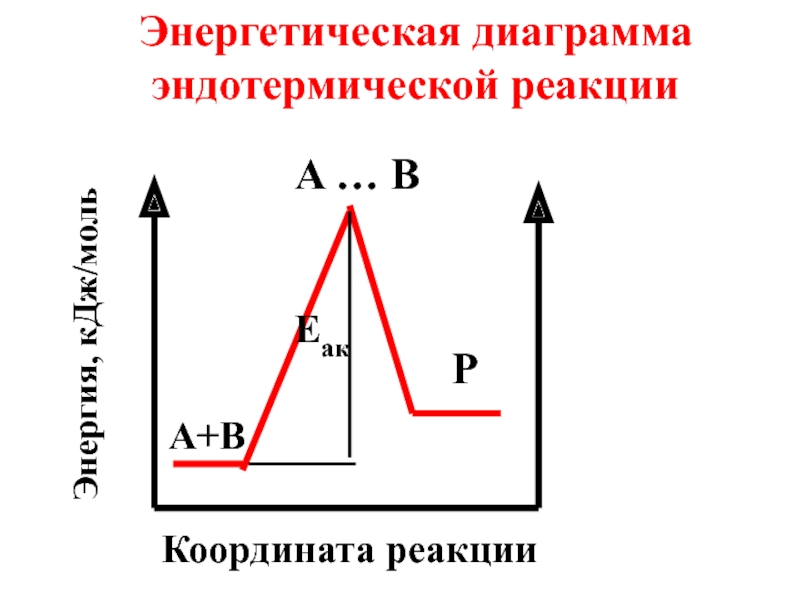
- 66. С точки зрения теории активного комплекса, энергия
- 67. Энергия активации иначе называется энергетическим барьером химической реакции.
- 68. Активный комплекс - промежуточная частица, в которой
- 69. Схема химической реакции : А + В
- 71. Энергетическая диаграмма экзотермической реакции A … B P A+B Eaк Координата реакции Энергия, кДж/моль
- 72. Энергетическая диаграмма эндотермической реакции A … B P A+B Eaк Координата реакции Энергия, кДж/моль
- 73. Энергия активации (Еак) зависит от природы реагирующих веществ и не зависит от температуры.
- 74. С повышением температуры в реакционной смеси возрастает
- 75. Кроме термических, существуют нетермические способы активации молекул: фотохимические, электрические и радиационные.
- 76. Благодарим за внимание !!!
Слайд 3Кинетический метод исследования, наряду с термодинамическим и квантово-механическим, широко применяется в
Слайд 49.1 Понятие о скорости и механизме химических реакций.
9.2 Влияние концентрации реагирующих
9.3 Влияние температуры на скорость химических реакций.
План
Слайд 5Химические реакции
Гомогенные
протекают в одной фазе:
N2 + 3H2 2NH3
Гетерогенные
протекают на границе
С(к) + O2→ CO2
9.1
Слайд 6Средняя скорость гомогенной реакции (υ) равна изменению концентрации вещества в единицу
υ =
[A] - [A]0
τ
Слайд 7 [A]0_ и [A] – исходная и конечная концентрация вещества, моль/л
τ
(+) – вещество образуется,
(–) – вещество расходуется.
Слайд 9Скорость гетерогенной реакции равна изменению количества вещества в единицу времени на
υ =
ν - ν0
S ×τ
Слайд 10где ν0 и ν – количество вещества в начальный и конечный
S – площадь поверхности раздела фаз, м2
Слайд 11Большинство биохимических реакций являются гомо- генными. Они протекают с различной скоростью.
Слайд 12Полное обновление костной ткани осуществляется за 4-7 лет. Время обновления белков
Слайд 13На скорость химических реакций влияет:
а) природа реагирующих веществ,
б) их агрегатное состояние,
Слайд 14в) природа растворителя (если реакция протекает в растворе),
г) площадь поверхности реагирующих
Слайд 15д) концентрация реагирующих веществ,
е) давление (для газофазных реакций),
ж) температура,
з) катализатор.
Слайд 16Чтобы произошла химическая реакция, необходимо взаимодействие между молекулами реагирующих веществ.
Слайд 20Элементарная стадия – это столкновение молекул реагирующих веществ, приводящее к образованию
Слайд 22Характеристикой механизма является молекулярность элементарных стадий.
Молекулярность – это число частиц, участвующих
Слайд 23Различают:
а) мономолекулярные превра-щения: I2 → 2I
б) бимолекулярные
в) тримолекулярные превра-щения: 2NO + O2 → 2NO2
Слайд 24Молекулярность не может быть больше трех, т.к. вероятность столкновения четырех и
Слайд 25Химическая реакция является простой, если представляет собой многократное чередование одной элементарной
H2 + I2 → 2HI
Слайд 26Если химическая реакция протекает в несколько стадий, то она является сложной.
Слайд 27Радикал – это атом или группа атомов, имеющие неспаренный электрон. Радикалы
Слайд 32Ученые считают, что накопление радикалов во внутриклеточных жидкостях – одна из
Слайд 33Реакция пероксидного окисления липидов, скорость которой резко возрастает даже под воздействием
Слайд 34Для снижения скорости пероксидного окисления используется антиоксиданты: витамины А, Е, С,
Слайд 359.2 Уравнения, описывающие влияние концентрации реагирующих веществ на скорость химических реакций,
Слайд 36Кинетические уравнения составляют на основе закона действующих масс (Гульдберг и Вааге,1867):
Слайд 37Математическое выражение ЗДМ для реакции:
аА + bВ + cС → Р
υ
где k – константа скорости, являющаяся фундаментальной кинетической характеристикой реакций.
Слайд 38k зависит от температуры и природы веществ и не зависти от
[A], [B], [C] – концентрации реагирующих веществ, моль/л;
x, y и z – порядок реакции по веществам.
Общий порядок реакции (n) равен: n = x + y + z
Слайд 39Порядок реакции определяется только экспериментально. Он является величиной формальной и может
Слайд 42Кинетическое описание простых реакций.
Реакции нулевого порядка (n=0)
Примеры: фотохимические, каталитические и ферментативные
Слайд 43Условное уравнение:
Константа
скорости
[A]0
k =
τ
А → Р
Кинетическое уравнение:
υ = k [A]0= k
Слайд 45Время полуреакции (τ ½) –это время, необходимое для уменьшения концентрации исходного
[A]0
τ ½ =
2k
Слайд 46Реакции первого порядка (n=1)
Примеры: каталитические и ферментативные реакции (при низкой концентрации
Слайд 51Реакции второго порядка (n=2)
Примеры: гидролиз белков, жиров, углеводов и других биологически
Слайд 54Кинетика сложных реакций
1) обратимые реакции
A B
k1
k2
Кинетическое уравнение:
υ = k1[A] – k2[B]
Слайд 55
A
B
C
k1
k2
KClO3
2) Параллельные реакции
KCl + O2
KCl + KClO4
Кинетическое уравнение:
υ = k1 ([A]0
Слайд 56
Скорость реакции равна скорости ее лимитирующей стадии: υ = k2
3) Последовательные реакции
A B C
k1
k2
быстрая
медленная
(лимитирующая)
Слайд 579.3 На рисунках представлена зависимость скорости химических реакций разных типов от
Боль-шинство реакций
T
υ
Слайд 61Для большинства химических реакций выполняется правило Вант-Гоффа: при повышении температуры на
Слайд 62
υT
2
=
υT
1
γ
T2 – T1
10
где Т1 и Т2 - начальная и конечная температура,
-
2 < γ < 4
Слайд 63Для биохимических реакций
1,5 < γ < 3,
поэтому при повышении
Слайд 64Значительно точнее зависимость скорости и температуры описывается уравнением Аррениуса:
-Еак/RT
υ =
k = k0e
-Еак/RT




![Средняя скорость гомогенной реакции (υ) равна изменению концентрации вещества в единицу времени: υ =[A] - [A]0](/img/tmb/3/274328/246374b8320883dbaa69855e739e71c9-800x.jpg)
![[A]0_ и [A] – исходная и конечная концентрация вещества, моль/лτ - время реакции, с.,](/img/tmb/3/274328/7038ae7e0e19469ddf5f466f04ef78c6-800x.jpg)

























![Математическое выражение ЗДМ для реакции:аА + bВ + cС → Рυ = k [A]x [B]y](/img/tmb/3/274328/7c0ee4fbbcad95229a38bfc726e7acd1-800x.jpg)
![k зависит от температуры и природы веществ и не зависти от их концентрации;[A], [B], [C]](/img/tmb/3/274328/c24f86c03e6e9863607f87b7401224e3-800x.jpg)

![Для радикальной реакции H2 + Br2 → 2HBr кинетическое уравнение υ = k[H2][Br2]1/2](/img/tmb/3/274328/a0fb5356e0a9d979094860d8a1e3c9e9-800x.jpg)
![Только для простых реакций порядок и молекулярность совпадают:H2 + I2 → 2HIυ = k [H2][I2]](/img/tmb/3/274328/47e39844f9ac034c73cf25ed0fc06f52-800x.jpg)

![Условное уравнение:Константаскорости [A]0 - [A]k =](/img/tmb/3/274328/5734b8107f5a9f149692ca9354e2c1c4-800x.jpg)
![[A]Кинетическая кривая реакций нулевого порядкаυ](/img/tmb/3/274328/5d182482e1a0c90105dc836aa337ab53-800x.jpg)


![Условное уравнение:Константаскорости k = 1τ[A]0 [A]ℓnА → РКинетическое](/img/tmb/3/274328/eac5a6283d71d1d387410954305e11cb-800x.jpg)
![Кинетическая кривая реакции первого порядка[A]υ](/img/tmb/3/274328/cb7eec564390f54ce2d43dc0fe669afc-800x.jpg)
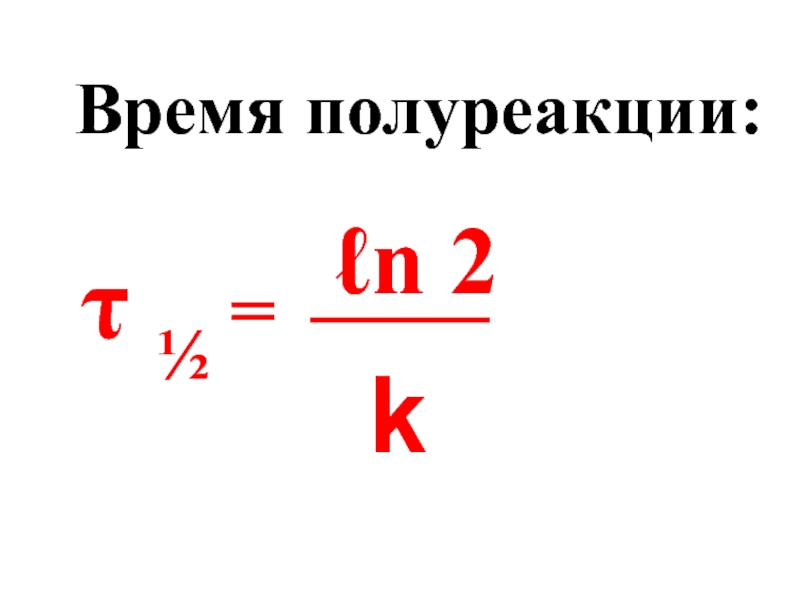


![Условные уравнения:2 А → РА + В → РКинетические уравнения:υ = k [A]2 υ =](/img/tmb/3/274328/f728b2cd0c9c0b25706bdbef848abf52-800x.jpg)
![Константа скорости:k =1τ[A]0 -[A]× [A][A]0τ ½=τ ½=11k[A]0k[B]0](/img/tmb/3/274328/a9b3e19a690efec3d8b98e3536319383-800x.jpg)
![Кинетика сложных реакций1) обратимые реакцииA B k1k2Кинетическое уравнение: υ = k1[A] – k2[B]](/img/tmb/3/274328/807296763ccad5bc85ced30fc5fc03df-800x.jpg)
![ABCk1k2KClO32) Параллельные реакцииKCl + O2KCl + KClO4Кинетическое уравнение:υ = k1 ([A]0 – [B]) + k2](/img/tmb/3/274328/6ecb561b5b6980364d10f8955c7ed75d-800x.jpg)
![Скорость реакции равна скорости ее лимитирующей стадии: υ = k2 [B]3) Последовательные реакцииA B](/img/tmb/3/274328/03cceedbcafde091ae502611eb7fb319-800x.jpg)