- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Энтропия. Второе и третье начала термодинамики презентация
Содержание
- 1. Энтропия. Второе и третье начала термодинамики
- 2. МОЛЕКУЛЯРНАЯ ФИЗИКА ТЕРМОДИНАМИКА Т П У
- 3. Тема 6. ЭНТРОПИЯ. ВТОРОЕ И ТРЕТЬЕ НАЧАЛА
- 4. 6.1. Приведенная теплота. Энтропия Из
- 5. Отношение теплоты Q в
- 7. Суммируя приведенную теплоту на всех участках процесса,
- 8. Этот результат справедлив для любого обратимого
- 9. Это позволяет ввести новую функцию состояния S:
- 10. Понятие энтропии было впервые введено Рудольфом Клаузиусом
- 12. В 1850 г. получил общие соотношения между
- 13. 6.2. Изменение энтропии в изопроцессах
- 14. Таким образом, по этой формуле можно
- 15. Так как, а
- 16. т.е. изменение энтропии ΔS1→2 идеального газа при
- 17. изобарический:
- 18. Изменение энтропии в изопроцессах:
- 19. 6.3. Поведение энтропии в процессах изменения агрегатного
- 20. 1. Переход вещества из твердого состояния (фазы)
- 21. 4. Закон плавления: количество тепла ∂Q, которое
- 22. Этот закон справедлив и для кристаллизации, правда,
- 23. Изменение энтропии в процессе этого фазового перехода
- 24. Тогда можно использовать термодинамический смысл энтропии: с
- 25. или
- 26. Так как температура системы в данном фазовом
- 27. Из этой формулы следует, что при плавлении
- 28. Поэтому при равной температуре энтропия твердого тела
- 29. Фазовый переход «жидкость – газ»
- 30. 2: при испарении система поглощает тепло, при
- 31. В процессе фазового перехода «жидкость – газ»
- 32. Коэффициент пропорции r в этом выражении, есть
- 33. Изменение энтропии в этом процессе можно найти
- 34. Из формулы следует, что при испарении энтропия возрастает, а при конденсации уменьшается.
- 35. Физический смысл этого результата состоит в
- 36. занятой жидкостью, но не имеет возможности «оторваться
- 37. Молекулы газа ведут себя иначе. У них
- 38. Поэтому при равных температурах фазовая область молекул
- 39. 6.4. Изменения энтропии при обратимых и необратимых
- 40. Обратимый цикл Карно Из
- 41. Изменение энтропии нагревателя:
- 42. то
- 43. Необратимый цикл Мы знаем, что
- 44. Таким образом
- 45. Тогда
- 46. 6.5. Второе начало термодинамики
- 47. Исторически второе начало термодинамики возникло из
- 49. Чтобы термический коэффициент полезного действия теплового
- 50. 1. Невозможен процесс, единственным
- 51. Математической формулировкой второго начала является
- 52. При обратимомном процессе
- 53. Первое и второе начала термодинамики в объединенной
- 54. 6.6. Свободная и связанная энергии Как
- 55. Обозначим,
- 56. следовательно свободная энергия есть та работа,
- 57. Связанная энергия – та часть
- 58. В термодинамике есть еще понятие – энергетическая
- 59. При любом необратимом
- 60. 6.7. Статистический смысл энтропии Посмотрим на энтропию с другой стороны.
- 61. Макросостояние – это
- 62. Термодинамической вероятностью или
- 63. В состоянии равновесия в термодинамике и вероятность
- 64. А вероятность сложного события, есть произведение вероятностей
- 65. Больцман предложил, что
- 66. Связь между S и
- 67. Энтропия – вероятностная статистическая величина.
- 68. Российские физики Я.Б. Зельдович и
- 69. 6.8. Третье начало термодинамики
- 71. Согласно Нернсту, изменение энтропии ΔS стремится к
- 72. Как первое и второе начала термодинамики, теорема
- 73. Отсюда следует, что при T → 0
- 74. При T = 0, внутренняя энергия и
- 75. Согласно классическим представлениям при абсолютном нуле,
- 76. Третье начало термодинамики иногда формулируют следующим образом:
- 77. Принцип Нернста бал развит
- 78. Следствием Третьего начала является то что,
Слайд 2МОЛЕКУЛЯРНАЯ
ФИЗИКА
ТЕРМОДИНАМИКА
Т П У
Доцент кафедры
Общей физики
Кузнецов Сергей Иванович
Сегодня *
Слайд 3Тема 6. ЭНТРОПИЯ. ВТОРОЕ И ТРЕТЬЕ НАЧАЛА ТЕРМОДИНАМИКИ
6.1. Приведенная теплота. Энтропия
6.2.
6.3. Поведение энтропии в процессах изменения агрегатного состояния
6.4. Изменение энтропии в обратимых и необратимых процессах
6.5. Второе начало термодинамики
6.6. Свободная и связанная энергии
6.7. Статистический смысл энтропии
6.8. Третье начало термодинамики
Слайд 46.1. Приведенная теплота. Энтропия
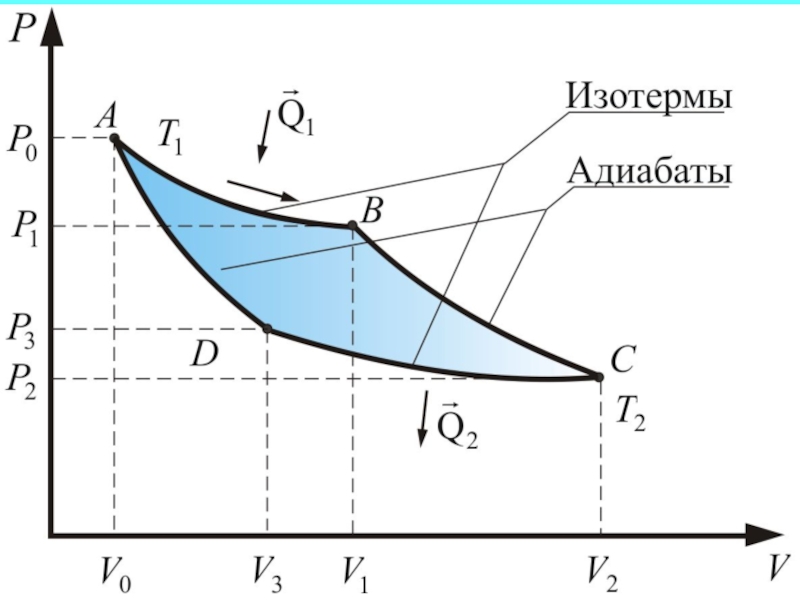
Из рассмотренного цикла Карно (п. 5.4)
Слайд 5 Отношение теплоты Q в изотермическом процессе к температуре,
Слайд 7 Суммируя приведенную теплоту на всех участках процесса, получим: Тогда в обратимом цикле
Слайд 8 Этот результат справедлив для любого обратимого процесса. Таким образом, для процесса,
Слайд 9 Это позволяет ввести новую функцию состояния S:
Слайд 10 Понятие энтропии было впервые введено Рудольфом Клаузиусом в 1865 г. Для обратимых
Слайд 11 Клаузиус
Слайд 12 В 1850 г. получил общие соотношения между теплотой и механической работой
Слайд 136.2. Изменение энтропии в изопроцессах
Энтропия системы является
Если система совершает равновесный переход из состояния 1 в состояние 2, то изменение энтропии:
(6.2.1)
Слайд 14 Таким образом, по этой формуле можно определить энтропию лишь с точностью
Слайд 16т.е. изменение энтропии ΔS1→2 идеального газа при переходе его из состояния
Слайд 17изобарический:
Слайд 196.3. Поведение энтропии в процессах изменения агрегатного состояния
Рассмотрим три агрегатных
Фазовый переход «твердое тело – жидкость»
Из школьного курса физики хорошо известны четыре факта об этом переходе.
Слайд 201. Переход вещества из твердого состояния (фазы) в жидкое называется плавлением,
Слайд 214. Закон плавления: количество тепла ∂Q, которое необходимо для плавления вещества
Слайд 22 Этот закон справедлив и для кристаллизации, правда, с одним отличием: ∂Q
Слайд 23 Изменение энтропии в процессе этого фазового перехода можно найти просто, если
Слайд 24 Тогда можно использовать термодинамический смысл энтропии: с точки зрения термодинамики энтропия
Слайд 26 Так как температура системы в данном фазовом переходе не меняется и
Слайд 27 Из этой формулы следует, что при плавлении энтропия возрастает, а при
Слайд 28 Поэтому при равной температуре энтропия твердого тела меньше энтропии жидкости. Это означает,
Слайд 29Фазовый переход «жидкость – газ»
Этот переход обладает всеми свойствами
Существует четыре факта также знакомые из школьного курса физики.
1: переход вещества из жидкости в газовую фазу называется испарением, а обратный переход – конденсацией.
Слайд 30 2: при испарении система поглощает тепло, при конденсации – теряет. 3: процессы
Слайд 31 В процессе фазового перехода «жидкость – газ» температура остается постоянной и
Слайд 32 Коэффициент пропорции r в этом выражении, есть константа, зависящая от вещества
Слайд 33 Изменение энтропии в этом процессе можно найти просто, считая процесс равновесным.
Слайд 35 Физический смысл этого результата состоит в различии фазовой области молекулы
Слайд 36занятой жидкостью, но не имеет возможности «оторваться от коллектива» остальных молекул:
Слайд 37 Молекулы газа ведут себя иначе. У них гораздо больше свободы, среднее
Слайд 38 Поэтому при равных температурах фазовая область молекул газа значительно больше фазовой
Слайд 396.4. Изменения энтропии при обратимых и необратимых процессах
Итак,
Энтропия – величина аддитивная, т.е. она равна сумме энтропий всех тел входящих в систему:
Слайд 40Обратимый цикл Карно
Из п. 5.2 мы знаем, что,
Изменение энтропии газа
так как газ возвращается в исходное состояние.
Слайд 44Таким образом или
Слайд 45 Тогда для замкнутой системы
Таким образом, для произвольного процесса,
(6.4.6)
где, знак равенства – для обратимого процесса; знак больше − для необратимого.
Слайд 466.5. Второе начало термодинамики
Термодинамика, это
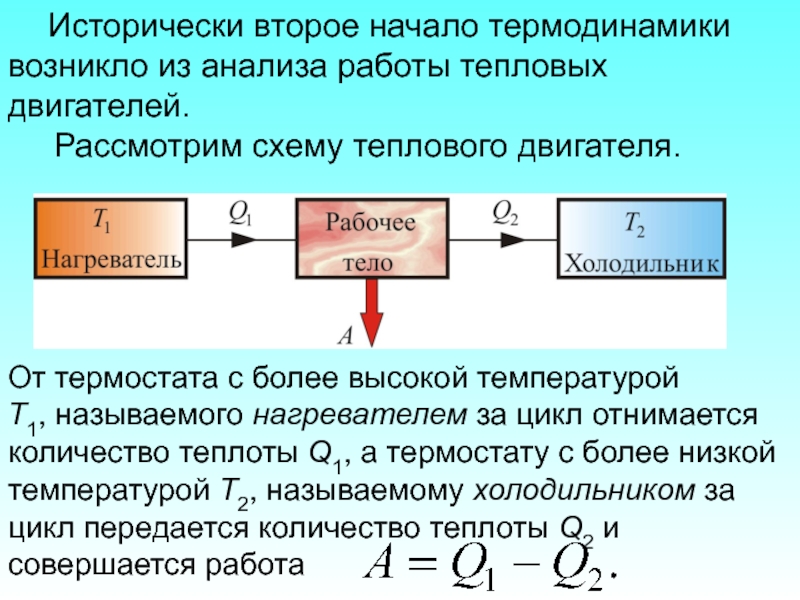
Слайд 47 Исторически второе начало термодинамики возникло из анализа работы тепловых двигателей.
Слайд 49 Чтобы термический коэффициент полезного действия теплового двигателя был
Слайд 50 1. Невозможен процесс, единственным результатом которого является превращение
Слайд 51 Математической формулировкой второго начала является выражение Энтропия замкнутой системы
Слайд 52 При обратимомном процессе
Слайд 546.6. Свободная и связанная энергии
Как следует из первого и второго
Это равенство можно переписать в виде
.
Слайд 55 Обозначим,
Слайд 56 следовательно свободная энергия есть та работа, которую могло бы совершить
Слайд 57 Связанная энергия – та часть внутренней энергии, которая не
Внутренняя энергия системы U равна сумме свободной (F) и связанной энергии (TS):
Слайд 59 При любом необратимом процессе энтропия увеличивается до
Слайд 61 Макросостояние – это состояние вещества, характеризуемое его
Слайд 62 Термодинамической вероятностью или статистическим весом макросостояния W
Слайд 63 В состоянии равновесия в термодинамике и вероятность максимальна и энтропия максимальна.
Слайд 64 А вероятность сложного события, есть произведение вероятностей
Слайд 65 Больцман предложил, что
Слайд 66 Связь между S и W позволяет несколько иначе сформулировать
Слайд 67 Энтропия – вероятностная статистическая величина.
Слайд 68 Российские физики Я.Б. Зельдович и И.Д. Новиков, так же
Слайд 696.8. Третье начало термодинамики
Недостатки первого и второго начал
На основании обобщения экспериментальных исследований свойств различных веществ при сверхнизких температурах был установлен закон, устранивший указанный недостаток. Сформулировал его в 1906 г. Нернст и называется он третьим началом термодинамики, или теоремой Нернста.
Слайд 70 Нернст Вальтер
Слайд 71 Согласно Нернсту, изменение энтропии ΔS стремится к нулю при любых обратимых
Слайд 72 Как первое и второе начала термодинамики, теорема Нернста может рассматриваться как
Слайд 73Отсюда следует, что при T → 0 интеграл
Слайд 74 При T = 0, внутренняя энергия и тепловая функция системы прекращают
Слайд 75 Согласно классическим представлениям при абсолютном нуле, возможно непрерывное множество микросостояний
Слайд 76 Третье начало термодинамики иногда формулируют следующим образом: при абсолютном нуле температуры
Слайд 77 Принцип Нернста бал развит Планком, предположившим, что при